2.2: Mageuzi ya Nadharia ya Atomiki
- Page ID
- 182466
- Eleza hatua muhimu katika maendeleo ya nadharia ya kisasa ya atomiki
- Kufupisha na kutafsiri matokeo ya majaribio ya Thomson, Millikan, na Rutherford
- Eleza chembe tatu subatomic kwamba kutunga atomi
- Kuanzisha neno isotopu
Katika karne mbili tangu Dalton kuendeleza mawazo yake, wanasayansi wamefanya maendeleo makubwa katika kuendeleza uelewa wetu wa nadharia ya atomiki. Sehemu kubwa ya hii ilitokana na matokeo ya majaribio kadhaa ya semina yaliyofunua maelezo ya muundo wa ndani wa atomi. Hapa, tutajadili baadhi ya maendeleo hayo muhimu, kwa msisitizo juu ya matumizi ya njia ya kisayansi, pamoja na kuelewa jinsi ushahidi wa majaribio ulivyochambuliwa. Wakati watu wa kihistoria na tarehe nyuma ya majaribio haya yanaweza kuvutia kabisa, ni muhimu kuelewa dhana zinazosababishwa na kazi zao.
Nadharia ya Atomiki baada ya karne ya kumi
Ikiwa jambo lilikuwa linajumuisha atomi, atomi zilijumuisha nini? Walikuwa chembe ndogo, au kulikuwa na kitu kidogo? Mwishoni mwa miaka ya 1800, wanasayansi kadhaa waliovutiwa na maswali kama haya walichunguza kuruhusiwa kwa umeme ambayo inaweza kuzalishwa katika gesi za shinikizo la chini, huku ugunduzi muhimu zaidi uliofanywa na mwanafizikia wa Kiingereza J. J. Thomson kwa kutumia tube ya ray ya cathode. Vifaa hivi vilikuwa na tube ya kioo iliyotiwa muhuri ambayo karibu hewa yote ilikuwa imeondolewa; tube ilikuwa na electrodes mbili za chuma. Wakati voltage ya juu ilitumiwa kwenye electrodes, boriti inayoonekana inayoitwa ray ya cathode ilionekana kati yao. Boriti hii ilikuwa imefutwa kuelekea malipo mazuri na mbali na malipo mabaya, na ilizalishwa kwa njia ile ile na mali zinazofanana wakati metali tofauti zilitumiwa kwa electrodes. Katika majaribio kama hayo, ray ilikuwa wakati huo huo deflected na shamba magnetic kutumika, na vipimo vya kiwango cha deflection na nguvu magnetic shamba kuruhusiwa Thomson kufanya mahesabu ya malipo kwa wingi uwiano wa chembe cathode ray. Matokeo ya vipimo hivi yalionyesha kuwa chembe hizi zilikuwa nyepesi zaidi kuliko atomi (Kielelezo\(\PageIndex{1}\)).
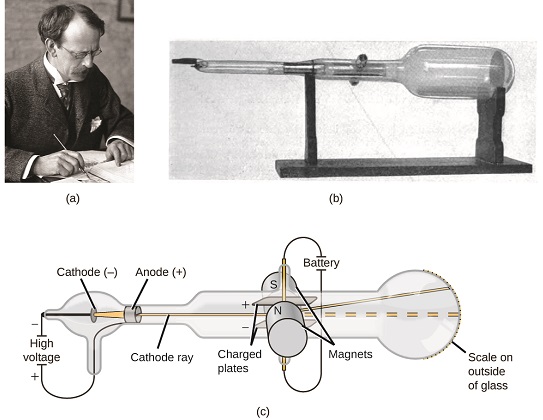
Kulingana na uchunguzi wake, hapa ni nini Thomson alipendekeza na kwa nini: chembe ni kuvutia na chanya (+) mashtaka na kuchukizwa na hasi (-) mashtaka, hivyo ni lazima kushtakiwa vibaya (kama mashtaka kurudisha na tofauti na mashtaka kuvutia); wao ni chini kubwa kuliko atomi na kutofautishwa, bila kujali chanzo nyenzo, hivyo ni lazima msingi, subatomic wapiga kura wa atomi wote. Ingawa utata wakati huo, wazo la Thomson lilikubaliwa hatua kwa hatua, na chembe yake ya ray ya cathode ni kile tunachokiita sasa elektroni, chembe ya chaji vibaya, subatomiki yenye masi zaidi ya mara elfu moja chini ya ile ya atomu. Neno “elektroni” liliundwa mwaka 1891 na mwanafizikia wa Ireland George Stoney, kutoka “elector ic i on.”
Mwaka 1909, habari zaidi kuhusu elektroni ilifunuliwa na mwanafizikia wa Marekani Robert A. Millikan kupitia majaribio yake ya “kushuka kwa mafuta”. Millikan aliunda matone ya mafuta microscopic, ambayo yanaweza kushtakiwa kwa umeme kwa msuguano walipounda au kwa kutumia eksirei. Matone haya awali yalianguka kutokana na mvuto, lakini maendeleo yao ya kushuka yanaweza kupunguzwa au hata kuachwa na uwanja wa umeme chini katika vifaa. Kwa kurekebisha nguvu za shamba la umeme na kufanya vipimo vya makini na mahesabu sahihi, Millikan aliweza kuamua malipo kwenye matone ya mtu binafsi (Kielelezo\(\PageIndex{2}\)).
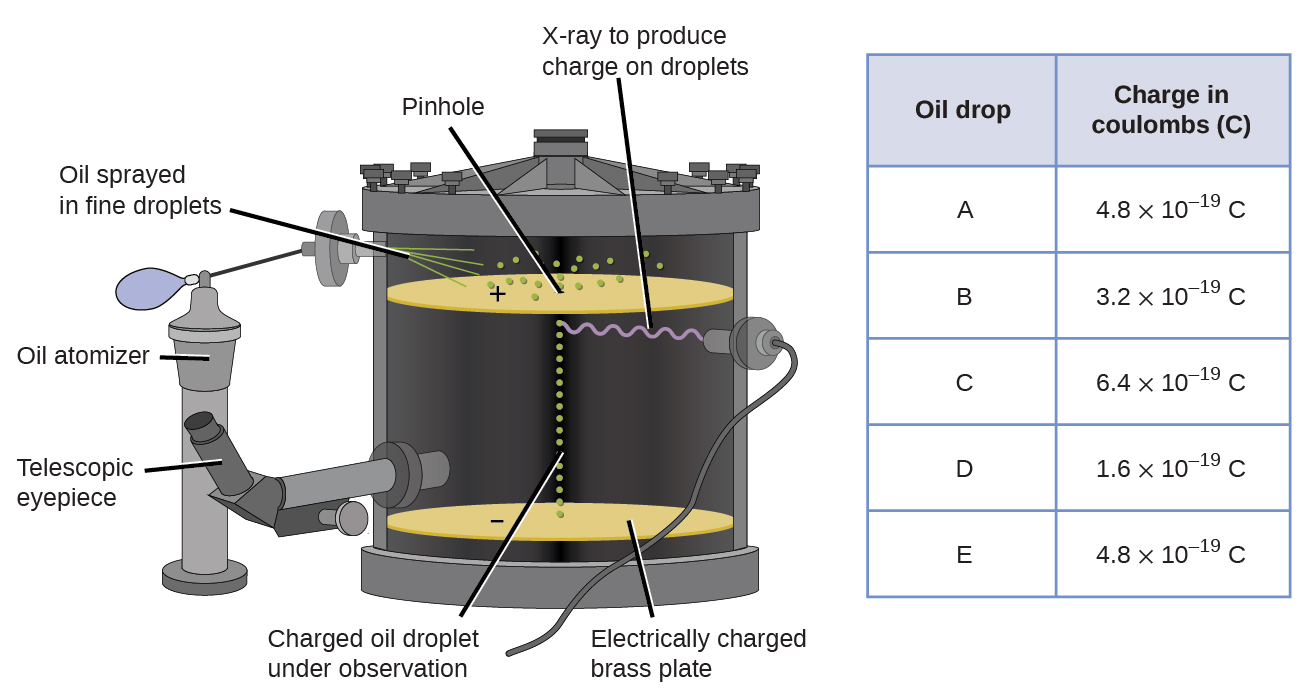
Kuangalia data ya malipo ambayo Millikan alikusanya, huenda umetambua kuwa malipo ya droplet ya mafuta ni mara nyingi ya malipo maalum, 1.6\(\times\) 10 -19 C. Milikan alihitimisha kuwa thamani hii lazima iwe malipo ya msingi-malipo ya elektroni-na kipimo chake mashtaka kutokana na ziada ya elektroni moja (mara 1 1.6\(\times\) 10 -19 C), elektroni mbili (mara 2 1.6\(\times\) 10 -19 C), elektroni tatu (mara 3 1.6\(\times\) 10 -19 C), na kadhalika, kwenye droplet iliyotolewa ya mafuta. Kwa kuwa chaji ya elektroni ilijulikana sasa kutokana na utafiti wa Milikan, na uwiano wa malipo hadi molekuli ulikuwa umejulikana tayari kutokana na utafiti wa Thomson (1.759\(\times\) 10 11 C/kg), ilihitaji tu hesabu rahisi ili kuamua masi ya elektroni pia.
\[\mathrm{Mass\: of\: electron=1.602\times 10^{-19}\:\cancel{C}\times \dfrac{1\: kg}{1.759\times 10^{11}\:\cancel{C}}=9.107\times 10^{-31}\:kg} \tag{2.3.1} \]
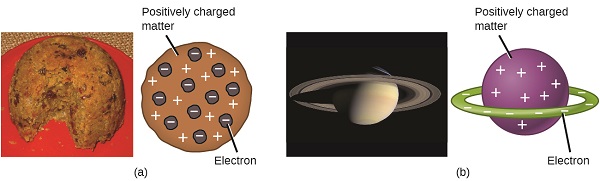
Wanasayansi sasa walikuwa wameanzisha ya kwamba atomu haikugawanyika kama Dalton alivyoamini, na kutokana na kazi ya Thomson, Millikan, na wengineo, chaji na wingi wa chembe hasi, subatomiki- elektroni-zilijulikana. Hata hivyo, sehemu ya chaji chanya ya atomu bado haijaeleweka vizuri. Mwaka 1904, Thomson alipendekeza mfano wa “plum pudding” ya atomi, ambayo ilielezea molekuli yenye kushtakiwa vyema na kiasi sawa cha malipo hasi kwa namna ya elektroni iliyoingia ndani yake, kwani atomi zote hazipatikani umeme. Mfano wa ushindani ulikuwa umependekezwa mwaka 1903 na Hantaro Nagaoka, ambaye alidai atomi kama Saturn, yenye nyanja yenye chaji chanya iliyozungukwa na halo ya elektroni (Kielelezo\(\PageIndex{3}\)).
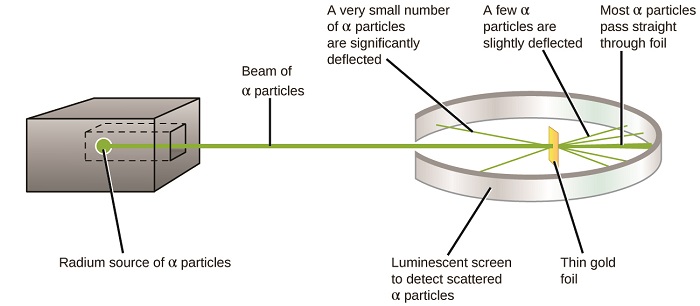
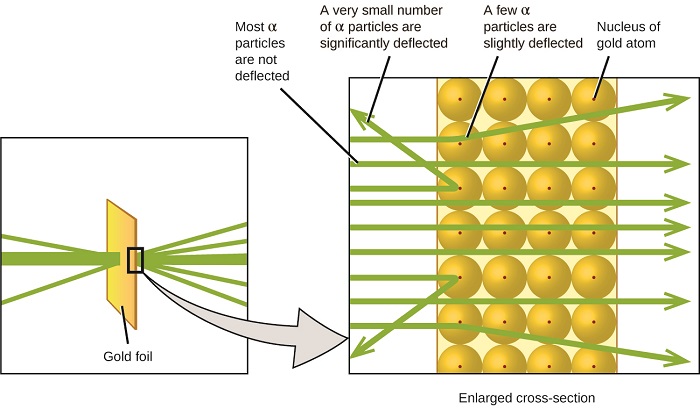
Maendeleo makubwa yaliyofuata katika kuelewa atomu yalitoka Ernest Rutherford, mwanafizikia kutoka New Zealand ambaye kwa kiasi kikubwa alitumia kazi yake ya kisayansi nchini Kanada na Uingereza. Alifanya mfululizo wa majaribio kwa kutumia boriti ya chembe za alpha za kasi, zenye chaji chanya (α chembe) zilizotengenezwa na kuoza kwa mionzi ya radiamu; chembe α zinajumuisha protoni mbili na nyutroni mbili (utajifunza zaidi kuhusu kuoza kwa mionzi katika sura ya nyuklia kemia). Rutherford na wenzake Hans Geiger (baadaye maarufu kwa counter Geiger) na Ernest Marsden walilenga boriti ya chembe α, chanzo cha ambayo iliingizwa katika kizuizi cha risasi ili kunyonya zaidi ya mionzi, kwenye kipande nyembamba sana cha foil ya dhahabu na kuchunguza kueneza matokeo ya chembe α kwa kutumia skrini ya luminescent ambayo iliwaka kwa ufupi ambapo imepigwa na chembe α.
Waligundua nini? Chembe nyingi zilipita kwa njia ya foil bila kufutwa kabisa. Hata hivyo, baadhi walikuwa diverted kidogo, na idadi ndogo sana walikuwa deflected karibu moja kwa moja nyuma kuelekea chanzo (Kielelezo\(\PageIndex{4}\)). Rutherford alielezea kutafuta matokeo haya: “Ilikuwa tukio la ajabu sana ambalo limewahi kutokea kwangu katika maisha yangu. Ilikuwa karibu kama ajabu kama wewe fired shell 15-inch katika kipande cha karatasi tishu na akarudi na kugonga wewe” 1 (uk. 68).
Hapa ndivyo Rutherford alivyotokana: Kwa sababu wengi wa chembe α zinazohamia haraka zilipita kupitia atomi za dhahabu zisizofanywa, lazima zimesafiri kupitia nafasi tupu ndani ya atomu. Chembe za Alpha zinashtakiwa vyema, hivyo uharibifu uliondoka wakati walikutana na malipo mengine mazuri (kama mashtaka yanapindana). Kwa kuwa kama mashtaka yanarudiana, chembe chache za α zilizochajiwa vyema ambazo zimebadilika njia kwa ghafla lazima zimegonga, au karibu zikaribia, mwili mwingine ambao pia ulikuwa na chaji yenye kujilimbikizia, chanya. Kwa kuwa uharibifu ulifanyika sehemu ndogo ya wakati huo, malipo haya yalichukua kiasi kidogo cha nafasi katika foil ya dhahabu. Kuchambua mfululizo wa majaribio hayo kwa undani, Rutherford alifanya hitimisho mbili:
- Kiasi kinachotumiwa na atomi lazima iwe na kiasi kikubwa cha nafasi tupu.
- Mwili mdogo, nzito, wenye kushtakiwa vyema, kiini, lazima uwe katikati ya kila atomi.
Uchunguzi huu ulisababisha Rutherford kupendekeza mfano ambao atomu ina ndogo sana, chanya kushtakiwa kiini, ambapo wengi wa wingi wa atomi ni kujilimbikizia, kuzungukwa na elektroni hasi kushtakiwa, ili atomi ni umeme upande wowote (Kielelezo\(\PageIndex{5}\)).
Baada ya majaribio mengi zaidi, Rutherford aligundua pia kwamba viini vya elementi vingine vina kiini cha hidrojeni kama “kizuizi cha ujenzi,” na aliita jina hili la msingi zaidi chembe protoni, chembe ya chaji chanya, subatomiki inayopatikana katika kiini. Kwa kuongeza moja, ambayo utajifunza ijayo, mfano huu wa nyuklia wa atomi, uliopendekezwa zaidi ya karne iliyopita, bado unatumiwa leo.
Utafutaji mwingine muhimu ulikuwa ugunduzi wa isotopi. Katika miaka ya 1900 mapema, wanasayansi walitambua vitu kadhaa ambavyo vimeonekana kuwa vipengele vipya, kuwatenga kutoka kwa ores za mionzi. Kwa mfano, “kipengele kipya” kilichozalishwa na kuoza kwa mionzi ya thorium kilipewa awali jina la mesothorium. Hata hivyo, uchambuzi wa kina zaidi ulionyesha kuwa mesothorium ilikuwa sawa na kemikali na radiamu (bidhaa nyingine ya kuoza), licha ya kuwa na molekuli atomia tofauti. Matokeo haya, pamoja na matokeo yanayofanana kwa elementi nyingine, yalisababisha mwanakemia wa Kiingereza Frederick Soddy kutambua kwamba elementi inaweza kuwa na aina za atomi zilizo na raia tofauti ambazo hazijulikani kemikali. Aina hizi tofauti huitwa isotopi —atomi za elementi hiyohiyo zinazotofautiana kwa wingi. Soddy alitunukiwa Tuzo ya Nobel ya Kemia mwaka wa 1921 kwa ugunduzi huu.
Puzzle moja ilibaki: Kiini kilijulikana kuwa na karibu wote wa wingi wa atomu, na idadi ya protoni kutoa nusu tu, au chini, ya molekuli hiyo. Mapendekezo tofauti yalifanywa ili kuelezea kile kilichosababisha molekuli iliyobaki, ikiwa ni pamoja na kuwepo kwa chembe zisizo na upande wowote katika kiini. Kama unavyoweza kutarajia, kuchunguza chembe zisizo na chaji ni changamoto kubwa sana, na haikuwa mpaka 1932 ambapo James Chadwick alipata ushahidi wa nyutroni, ambazo hazipatikani, chembe za subatomiki zilizo na masi takribani sawa na ile ya protoni. Kuwepo kwa nyutroni pia kunaelezea isotopi: Zinatofautiana kwa wingi kwa sababu zina idadi tofauti za nyutroni, lakini zinafanana kikemia kwa sababu zina idadi sawa ya protoni. Hii itaelezwa kwa undani zaidi baadaye katika sura hii.
Muhtasari
Ingawa hakuna mtu aliyeona ndani ya atomu, majaribio yameonyesha mengi kuhusu muundo wa atomia. Bomba la ray ya cathode la Thomson lilionyesha kuwa atomi zina chembe ndogo, zenye chaji vibaya zinazoitwa elektroni. Millikan aligundua kwamba kuna malipo ya kimsingi ya umeme—malipo ya elektroni. Jaribio la foil la dhahabu la Rutherford lilionyesha kuwa atomi zina kiini kidogo, kikubwa, chenye chaji chanya; chembe zenye kushtakiwa vyema ndani ya kiini huitwa protoni. Chadwick aligundua ya kwamba kiini pia kina chembe zisizo na upande zinazoitwa neutroni. Soddy alionyesha ya kwamba atomi za elementi moja zinaweza kutofautiana kwa wingi; hizi huitwa isotopi.
maelezo ya chini
- Ernest Rutherford, “Maendeleo ya Nadharia ya Muundo wa Atomiki,” ed. Ratcliffe, katika Background ya Sayansi ya Kisasa, eds. Joseph Needham na Walter Pagel, (Cambridge, Uingereza: Cambridge University Press, 1938), 61—74. Ilifikia Septemba 22, 2014, https://ia600508.us.archive.org/3/it...e032734mbp.pdf.
faharasa
- alpha chembe (α chembe)
- chanya kushtakiwa chembe yenye protoni mbili na nyutroni mbili
- elektroni
- vibaya kushtakiwa, subatomic chembe ya molekuli ya chini iko nje ya kiini
- isotopu
- atomi ambazo zina idadi sawa ya protoni lakini idadi tofauti ya nyutroni
- neutroni
- uncharged, subatomic chembe iko katika kiini
- protoni
- chanya kushtakiwa, subatomic chembe iko katika kiini
- kiini
- mkubwa, chanya kushtakiwa katikati ya chembe linaloundwa na protoni na neutrons


