2.1: Mawazo mapema katika Nadharia ya Atomiki
- Page ID
- 182473
Ujuzi wa Kuendeleza
Mwishoni mwa sehemu hii, utaweza:
- Hali postulates ya nadharia ya atomiki ya Dalton
- Tumia postulates ya nadharia ya atomiki ya Dalton kuelezea sheria za idadi ya uhakika na nyingi
Lugha inayotumiwa katika kemia inaonekana na kusikika katika taaluma nyingi, kuanzia dawa hadi uhandisi hadi sanaa. Lugha ya kemia inajumuisha msamiati wake mwenyewe pamoja na aina yake ya kifupi. Alama za kemikali hutumiwa kuwakilisha atomi na elementi. Fomu za kemikali zinaonyesha molekuli pamoja na muundo wa misombo. Ulinganisho wa kemikali hutoa taarifa kuhusu ubora na wingi wa mabadiliko yanayohusiana na athari za kemikali.
Sura hii itaweka msingi wa utafiti wetu wa lugha ya kemia. Dhana za msingi huu ni pamoja na nadharia ya atomiki, muundo na wingi wa atomi, tofauti ya muundo wa isotopu, malezi ya ion, vifungo vya kemikali katika misombo ya ionic na covalent, aina ya athari za kemikali, na kumtaja misombo. Tutaanzisha pia mojawapo ya zana zenye nguvu zaidi za kuandaa ujuzi wa kemikali: meza ya mara kwa mara.
Nadharia ya Atomiki kupitia Karne ya kumi
Majadiliano ya kwanza ya kumbukumbu ya muundo wa msingi wa suala hutoka kwa wanafalsafa wa kale wa Kigiriki, wanasayansi wa siku zao. Katika karne ya tano KK, Leucippus na Democritus walidai kuwa jambo lote liliundwa na chembe ndogo, za mwisho ambazo waliziita atomos, neno linalotokana na neno la Kigiriki kwa ajili ya “zisizogawanyika.” Walifikiria atomi kama chembe zinazohamia zilizotofautiana kwa umbo na ukubwa, na ambazo zinaweza kujiunga pamoja. Baadaye, Aristotle na wengine walifikia hitimisho kwamba jambo lilikuwa na mchanganyiko mbalimbali wa “elementi” nne —moto, ardhi, hewa, na maji-na inaweza kugawanywa kwa kiasi kikubwa. Kushangaza, wanafalsafa hawa walidhani kuhusu atomi na “elementi” kama dhana za falsafa, lakini inaonekana kamwe hawakufikiria kufanya majaribio ya kupima mawazo yao.
Mtazamo wa Aristoteli kuhusu utungaji wa jambo ulishikilia kwa zaidi ya miaka elfu mbili, hadi mwalimu wa shule ya Kiingereza John Dalton alisaidia kuleta mapinduzi ya kemia kwa nadharia yake ya kwamba tabia ya jambo inaweza kuelezewa kwa kutumia nadharia ya atomia. Kwanza iliyochapishwa mwaka wa 1807, mawazo mengi ya Dalton kuhusu vipengele vya microscopic ya suala bado halali katika nadharia ya kisasa ya atomiki. Hapa ni postulates ya nadharia atomiki ya Dalton.
- Matter inaundwa na chembe ndogo mno zinazoitwa atomi. Atomu ni kitengo kidogo cha elementi kinachoweza kushiriki katika mabadiliko ya kemikali.
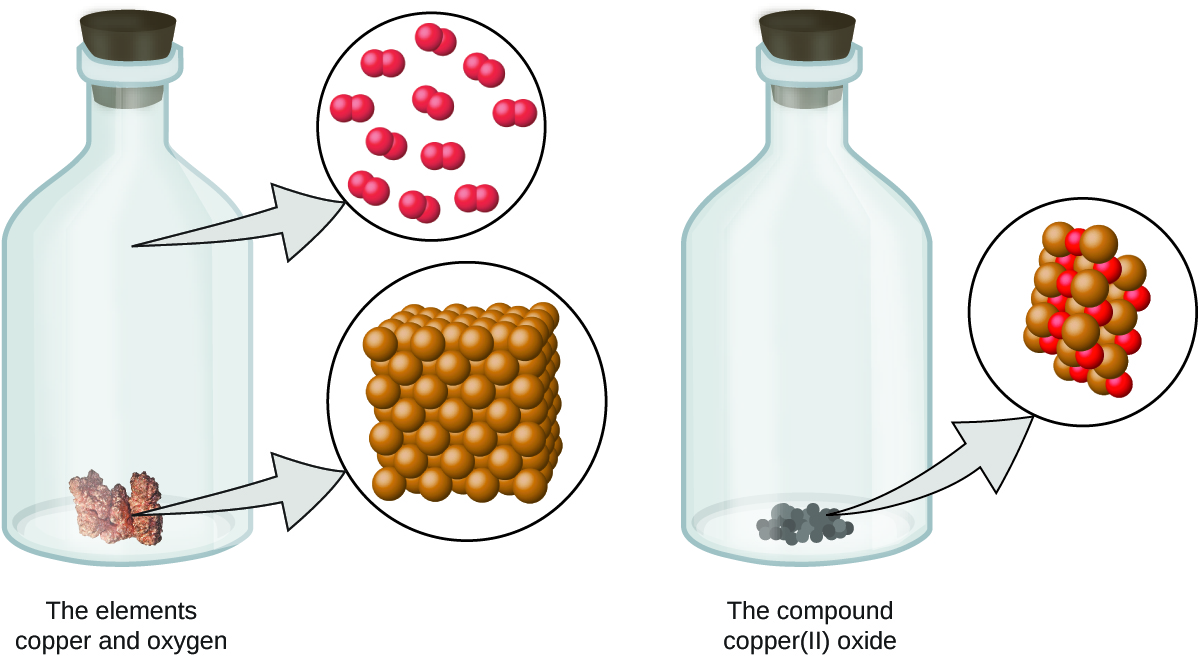
- Elementi ina aina moja tu ya atomu, ambayo ina masi ambayo ni tabia ya elementi na ni sawa kwa atomi zote za elementi hiyo (Kielelezo\(\PageIndex{1}\)). Sampuli ya macroscopic ya kipengele ina idadi kubwa ya atomi, ambayo yote yana mali ya kemikali inayofanana.

- Atomi za elementi moja hutofautiana katika mali kutoka atomi za elementi nyingine zote.
- Kiwanja kina atomi za elementi mbili au zaidi zilizounganishwa katika uwiano mdogo, nzima-namba. Katika kiwanja kilichopewa, idadi ya atomi za kila moja ya vipengele vyake daima hupo katika uwiano sawa (Kielelezo\(\PageIndex{2}\)).

- Atomi ni wala kuundwa wala kuharibiwa wakati wa mabadiliko ya kemikali, lakini badala yake upya na mavuno dutu kwamba ni tofauti na wale waliopo kabla ya mabadiliko (Kielelezo\(\PageIndex{3}\)).
Dalton ya nadharia atomiki hutoa maelezo microscopic ya mali nyingi macroscopic ya jambo kwamba umejifunza kuhusu. Kwa mfano, kama elementi kama vile shaba ina aina moja tu ya atomu, basi haiwezi kuvunjwa kuwa dutu rahisi, yaani kuwa dutu linajumuisha aina chache za atomi. Na kama atomi hazijatengenezwa wala kuharibiwa wakati wa mabadiliko ya kemikali, basi wingi wa suala la sasa wakati suala linabadilika kutoka kwa aina moja hadi nyingine litabaki mara kwa mara (sheria ya uhifadhi wa suala).
Mfano\(\PageIndex{1}\): Kupima Theory ya Atomiki ya Dalton
Katika kuchora zifuatazo, nyanja za kijani zinawakilisha atomi za kipengele fulani. Sehemu za zambarau zinawakilisha atomi za elementi nyingine. Ikiwa nyanja zinagusa, ni sehemu ya kitengo kimoja cha kiwanja. Je, mabadiliko ya kemikali yafuatayo yanayowakilishwa na alama hizi yanakiuka mawazo yoyote ya nadharia ya atomiki ya Dalton? Ikiwa ndivyo, ni moja?
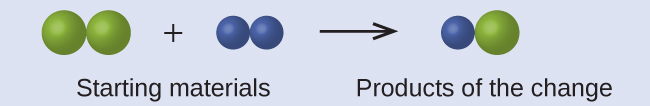
Suluhisho Vifaa vya kuanzia vinajumuisha nyanja mbili za kijani na nyanja mbili za zambarau. Bidhaa hizo zinajumuisha nyanja moja tu ya kijani na nyanja moja ya zambarau. Hii inakiuka postulate Dalton ya kwamba atomi si kuundwa wala kuharibiwa wakati wa mabadiliko ya kemikali, lakini ni tu kusambazwa tena. (Katika kesi hii, atomi zinaonekana kuwa zimeharibiwa.)
Zoezi\(\PageIndex{1}\)
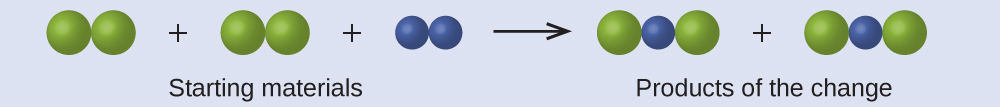
Katika kuchora zifuatazo, nyanja za kijani zinawakilisha atomi za kipengele fulani. Sehemu za zambarau zinawakilisha atomi za elementi nyingine. Ikiwa nyanja zinagusa, ni sehemu ya kitengo kimoja cha kiwanja. Je, mabadiliko ya kemikali yafuatayo yanayowakilishwa na alama hizi yanakiuka mawazo yoyote ya nadharia ya atomiki ya Dalton? Kama ni hivyo, ambayo moja
Jibu:
Vifaa vya kuanzia vinajumuisha nyanja nne za kijani na nyanja mbili za zambarau. Bidhaa hizo zinajumuisha nyanja nne za kijani na nyanja mbili za zambarau. Hii haina kukiuka yoyote ya postulates Dalton: Atomi si kuundwa wala kuharibiwa, lakini ni redistributed katika ndogo, uwiano nzima-idadi.
Dalton alijua majaribio ya mwanakemia wa Kifaransa Joseph Proust, ambaye alionyesha kwamba sampuli zote za kiwanja safi zina vyenye vipengele sawa katika uwiano sawa na wingi. Taarifa hii inajulikana kama sheria ya uwiano wa uhakika au sheria ya utungaji wa mara kwa mara. Pendekezo kwamba idadi ya atomi za elementi katika kiwanja kilichopewa daima zipo katika uwiano sawa ni sawa na uchunguzi huu. Kwa mfano, wakati sampuli tofauti za isooctane (sehemu ya petroli na moja ya viwango vinavyotumiwa katika mfumo wa rating octane) zinaonekana kuwa na uwiano wa wingi wa kaboni-kwa-hidrojeni wa 5. 33:1, kama inavyoonekana katika Jedwali\(\PageIndex{1}\).
| Sampuli | Carbon | Hidrojeni | Uwiano wa Misa |
|---|---|---|---|
| A | 14.82 g | 2.78 g | \(\mathrm{\dfrac{14.82\: g\: carbon}{2.78\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| B | 22.33 g | 4.19 g | \(\mathrm{\dfrac{22.33\: g\: carbon}{4.19\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| C | 19.40 g | 3.64 g | \(\mathrm{\dfrac{19.40\: g\: carbon}{3.63\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
Ni muhimu kutambua kwamba ingawa sampuli zote za kiwanja fulani zina uwiano sawa wa wingi, kuzungumza si kweli kwa ujumla. Hiyo ni, sampuli zilizo na uwiano sawa wa wingi sio lazima dutu sawa. Kwa mfano, kuna misombo mingi isipokuwa isooctane ambayo pia ina uwiano wa wingi wa kaboni-kwa-hidrojeni wa 5. 33:1 .00.
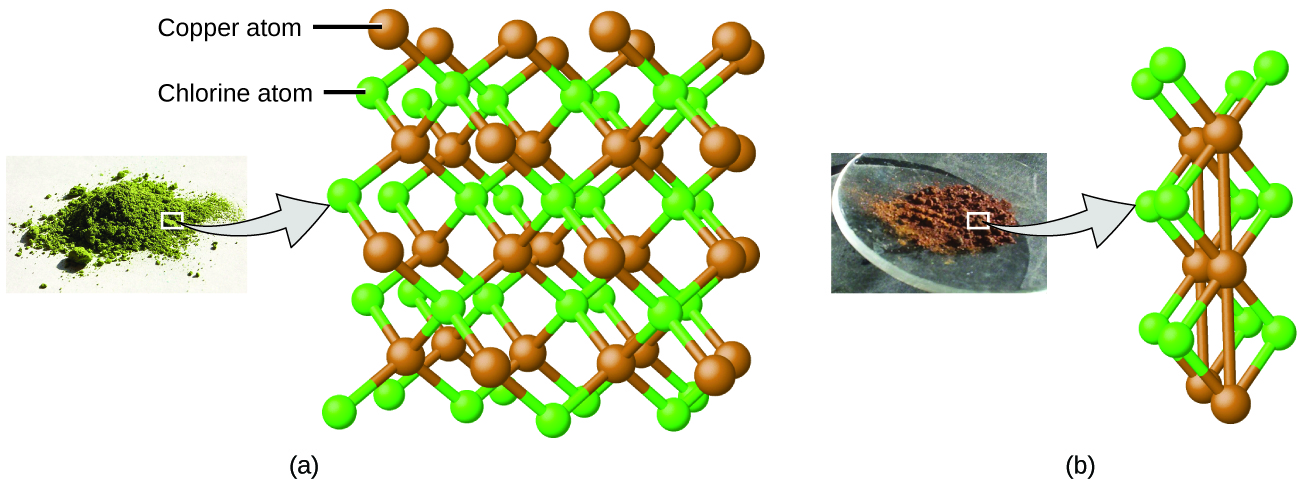
Dalton pia alitumia data kutoka Proust, pamoja na matokeo kutoka kwa majaribio yake mwenyewe, kuunda sheria nyingine ya kuvutia. Sheria ya idadi nyingi inasema kwamba wakati vipengele viwili vinavyoitikia kuunda kiwanja zaidi ya moja, umati wa kudumu wa kipengele kimoja utaitikia na raia wa kipengele kingine kwa uwiano wa idadi ndogo, nzima. Kwa mfano, shaba na klorini inaweza kuunda kijani, fuwele imara na uwiano wa wingi wa 0.558 g klorini kwa 1 g shaba, pamoja na kahawia fuwele imara na uwiano wa wingi wa 1.116 g klorini kwa 1 g shaba. Uwiano huu peke yao hauwezi kuonekana kuvutia au taarifa; hata hivyo, ikiwa tunachukua uwiano wa uwiano huu, tunapata matokeo muhimu na ya kushangaza: uwiano mdogo, nzima-namba.
\[\mathrm{\dfrac{\dfrac{1.116\: g\: Cl}{1\: g\: Cu}}{\dfrac{0.558\: g\: Cl}{1\: g\: Cu}}=\dfrac{2}{1}}\]
Uwiano huu wa 2-kwa-1 unamaanisha kuwa kiwanja cha kahawia kina mara mbili kiasi cha klorini kwa kiasi cha shaba kama kiwanja cha kijani.
Hii inaweza kuelezewa na nadharia atomia kama uwiano wa shaba hadi klorini katika kiwanja cha kahawia ni atomi 1 ya shaba hadi atomi 2 za klorini, na uwiano katika kiwanja kijani ni atomi 1 ya shaba hadi atomi 1 ya klorini. Uwiano wa atomi za klorini (na hivyo uwiano wa raia wao) ni 2 hadi 1 (Kielelezo\(\PageIndex{4}\)).
Mfano \(\PageIndex{2}\): Sheria za Uwiano wa Uhakika na Multiple
Sampuli ya kiwanja A (gesi wazi, isiyo na rangi) inachambuliwa na kupatikana kuwa na 4.27 g kaboni na 5.69 g oksijeni. Sampuli ya kiwanja B (pia gesi iliyo wazi, isiyo na rangi) inachambuliwa na kupatikana kuwa na 5.19 g kaboni na 13.84 g oksijeni. Je, data hizi ni mfano wa sheria ya idadi ya uhakika, sheria ya idadi nyingi, au wala? Data hizi zinakuambia nini kuhusu vitu A na B?
Suluhisho
Katika kiwanja A, uwiano wa wingi wa kaboni na oksijeni ni:
\[\mathrm{\dfrac{1.33\: g\: O}{1\: g\: C}}\]
Katika kiwanja B, uwiano wa wingi wa kaboni na oksijeni ni:
\[\mathrm{\dfrac{2.67\: g\: O}{1\: g\: C}}\]
Uwiano wa uwiano huu ni:
\[\mathrm{\dfrac{\dfrac{1.33\: g\: O}{1\: g\: C}}{\dfrac{2.67\: g\: O}{1\: g\: C}}=\dfrac{1}{2}}\]
Hii inasaidia sheria ya idadi nyingi. Hii ina maana kwamba A na B ni misombo tofauti, na A kuwa na nusu kama kaboni kiasi kwa kiasi cha oksijeni (au mara mbili ya oksijeni kwa kiasi cha kaboni) kama B. jozi iwezekanavyo ya misombo ambayo inafaa uhusiano huu itakuwa A = CO 2 na B = CO.
Zoezi\(\PageIndex{2}\)
Sampuli ya kiwanja X (kioevu wazi, isiyo na rangi, inayowaka na harufu inayoonekana) inachambuliwa na kupatikana kuwa na 14.13 g kaboni na 2.96 g ya hidrojeni. Sampuli ya kiwanja Y (kioevu wazi, isiyo na rangi, inayowaka na harufu inayoonekana ambayo ni tofauti kidogo na harufu ya X) inachambuliwa na kupatikana kuwa na 19.91 g kaboni na 3.34 g hidrojeni. Je, data hizi ni mfano wa sheria ya idadi ya uhakika, sheria ya idadi nyingi, au wala? Data hizi zinakuambia nini kuhusu vitu X na Y?
Jibu:
Katika kiwanja X, uwiano wa wingi wa kaboni hadi hidrojeni ni\(\mathrm{\dfrac{14.13\: g\: C}{2.96\: g\: H}}\). Katika kiwanja Y, uwiano wa wingi wa kaboni na oksijeni ni\(\mathrm{\dfrac{19.91\: g\: C}{3.34\: g\: H}}\). Uwiano wa uwiano huu ni\(\mathrm{\dfrac{\dfrac{14.13\: g\: C}{2.96\: g\: H}}{\dfrac{19.91\: g\: C}{3.34\: g\: H}}=\dfrac{4.77\: g\: C/g\: H}{5.96\: g\: C/g\: H}=0.800=\dfrac{4}{5}}\). Uwiano huu mdogo, nzima-nambari huunga mkono sheria ya idadi nyingi. Hii ina maana kwamba X na Y ni misombo tofauti.
Muhtasari
Wagiriki wa Kale walipendekeza jambo hilo lina chembe ndogo sana zinazoitwa atomi. Dalton alidai kwamba kila kipengele kina aina ya tabia ya atomi ambayo inatofautiana katika mali kutoka kwa atomi za vipengele vingine vyote, na kwamba atomi za vipengele tofauti zinaweza kuchanganya katika uwiano wa kudumu, ndogo, nzima-namba ili kuunda misombo. Sampuli za kiwanja fulani zote zina idadi sawa ya msingi kwa wingi. Wakati vipengele viwili vinaunda misombo tofauti, umati uliopewa wa kipengele kimoja utachanganya na raia wa kipengele kingine katika uwiano mdogo, nzima-nambari. Wakati wa mabadiliko yoyote ya kemikali, atomi hazijatengenezwa wala kuharibiwa.
Glossary
- Dalton’s atomic theory
- set of postulates that established the fundamental properties of atoms
- law of constant composition
- (also, law of definite proportions) all samples of a pure compound contain the same elements in the same proportions by mass
- law of definite proportions
- (also, law of constant composition) all samples of a pure compound contain the same elements in the same proportions by mass
- law of multiple proportions
- when two elements react to form more than one compound, a fixed mass of one element will react with masses of the other element in a ratio of small whole numbers


