18.11: Matukio, Maandalizi, na Mali ya Halogens
- Page ID
- 176313
- Eleza maandalizi, mali, na matumizi ya halojeni
- Eleza mali, maandalizi, na matumizi ya misombo ya halogen
Mambo katika kikundi 17 ni halojeni. Hizi ni mambo ya fluorine, klorini, bromini, iodini, na astatine. Mambo haya ni tendaji sana kutokea kwa uhuru katika asili, lakini misombo yao inasambazwa sana. Chloridi ni nyingi zaidi; ingawa fluoridi, bromidi, na iodidi hazipatikani sana, zinapatikana kwa sababu. Katika sehemu hii, tutachunguza tukio, maandalizi, na mali ya halojeni. Kisha, tutachunguza misombo ya halogen na metali ya mwakilishi ikifuatiwa na uchunguzi wa interhalogens. Sehemu hii itahitimisha na baadhi ya matumizi ya halojeni.
Matukio na Maandalizi
Halojeni zote hutokea katika maji ya bahari kama ioni halide. Mkusanyiko wa ioni ya kloridi ni 0.54 M; ile ya halidi nyingine ni chini ya 10 -4 M. Fluoridi pia hutokea katika madini kama vile CaF 2, Ca (PO 4) 3 F, na Na 3 alF 6. Kloridi pia hutokea katika Ziwa Kuu ya Chumvi na Bahari ya Chumvi, na katika vitanda vingi vya chumvi ambavyo vina NaCl, KCl, au MgCl 2. Sehemu ya klorini katika mwili wako iko kama asidi hidrokloric, ambayo ni sehemu ya asidi ya tumbo. Misombo ya bromini hutokea Bahari ya Chumvi na brines chini ya ardhi. Misombo ya iodini hupatikana kwa kiasi kidogo katika chumvi ya Chile, brines chini ya ardhi, na kelp ya bahari. Iodini ni muhimu kwa kazi ya tezi ya tezi.
Vyanzo bora vya halojeni (isipokuwa iodini) ni chumvi za halide. Inawezekana kuimarisha ions za halide kwa molekuli za halogen za diatomic bure kwa njia mbalimbali, kulingana na urahisi wa oxidation ya ion halide. Fluoride ni vigumu sana kuimarisha, wakati iodidi ni rahisi.
Njia kuu ya kuandaa fluorine ni oxidation electrolytic. Utaratibu wa kawaida wa electrolysis ni kutumia mchanganyiko wa kuyeyuka ya fluoride ya hidrojeni ya potasiamu, KHF 2, na fluoride ya hidrojeni isiyo na maji. Electrolysis husababisha HF kuoza, kutengeneza gesi ya fluorini kwenye anode na hidrojeni kwenye cathode. Ni muhimu kuweka gesi hizo mbili zikitenganishwa ili kuzuia recombination yao ya kulipuka ili kurekebisha fluoride ya hidrojeni.
Klorini nyingi za kibiashara hutoka kwa electrolysis ya ioni ya kloridi katika ufumbuzi wa maji ya kloridi ya sodiamu; hii ni mchakato wa klori-alkali uliojadiliwa hapo awali Klorini pia ni bidhaa ya uzalishaji electrolytic ya metali kama vile sodiamu, kalsiamu, na magnesiamu kutoka kloridi zao fused. Pia inawezekana kuandaa klorini na oxidation ya kemikali ya ioni ya kloridi katika ufumbuzi wa asidi na mawakala wenye nguvu za oksidi kama vile dioksidi ya manganese (\(\ce{MnO2}\)) au dichromate ya sodiamu (\(\ce{Na2Cr2O7}\)). Majibu na dioksidi ya manganese ni:
\[\ce{MnO}_{2(s)}+\ce{2Cl^-}_{(aq)}+\ce{4H_3O^+}_{(aq)}⟶\ce{Mn}^{2+}_{(aq)}+\ce{Cl}_{2(g)}+\ce{6H_2O}_{(l)}\nonumber \]
Maandalizi ya kibiashara ya bromini yanahusisha oxidation ya ion ya bromidi na klorini:
\[\ce{2Br^-}_{(aq)}+\ce{Cl}_{2(g)}⟶\ce{Br}_{2(l)}+\ce{2Cl^-}_{(aq)} \nonumber \]
Klorini ni wakala wenye nguvu zaidi kuliko bromini. Njia hii ni muhimu kwa ajili ya uzalishaji wa bromini yote ya ndani.
Baadhi ya iodini hutoka kwa oxidation ya kloridi iodini\(\ce{ICl}\),, au asidi iodic,\(\ce{HlO_3}\). Maandalizi ya kibiashara ya iodini hutumia kupunguza iodate ya sodiamu\(\ce{NaIO_3}\), uchafu katika amana za chumvi ya Chile, na sulfite ya hidrojeni ya sodiamu:
\[\ce{2IO^-}_{3(aq)}+\ce{5HSO^-}_{3(aq)}⟶\ce{3HSO^-}_{4(aq)}+\ce{2SO^{2-}}_{4(aq)}+\ce{H_2O}_{(l)}+\ce{I}_{2(s)} \nonumber \]
Mali ya Halogens
Fluorine ni gesi ya njano ya rangi ya njano, klorini ni gesi ya kijani-njano, bromini ni kioevu kirefu cha rangi nyekundu, na iodini ni imara ya fuwele ya kijivu-nyeusi. Bromini ya maji machafu ina shinikizo la mvuke, na mvuke nyekundu inaonekana kwa urahisi katika Kielelezo\(\PageIndex{1}\). Fuwele za iodini zina shinikizo la mvuke inayoonekana. Wakati wa upole mkali, fuwele hizi hupendeza na huunda mvuke mzuri wa violet.

Bromini ni kidogo tu mumunyifu katika maji, lakini ni miscible katika idadi yote katika chini polar (au nonpolar) vimumunyisho kama vile klorofomu, tetrakloridi kaboni, na disulfidi kaboni, kutengeneza ufumbuzi kwamba kutofautiana kutoka njano na nyekundu-kahawia, kulingana na mkusanyiko.
Iodini ni mumunyifu katika chloroform, tetrakloridi kaboni, disulfidi kaboni, na hidrokaboni nyingi, kutoa ufumbuzi wa violet wa molekuli ya I 2. Iodini hupasuka kidogo tu katika maji, na kutoa ufumbuzi wa kahawia. Ni mumunyifu kabisa katika ufumbuzi wa maji ya iodidi, ambayo huunda ufumbuzi wa kahawia. Ufumbuzi huu wa kahawia husababisha kwa sababu molekuli za iodini zina mizunguko ya valence d tupu na inaweza kutenda kama asidi dhaifu ya Lewis kuelekea ioni iodidi. Equation kwa mmenyuko wa kubadilishwa wa iodini (asidi Lewis) na ioni ya iodidi (Lewis msingi) ili kuunda ion ya triodidi\(\ce{I3-}\),, ni:
\[\ce{I}_{2(s)}+\ce{I^-}_{(aq)}⟶\ce{I^-}_{3(aq)} \label{4} \]
Rahisi ni kuimarisha ion ya halide, ni vigumu zaidi kwa halogen kutenda kama wakala wa oxidizing. Fluorine ujumla oxidizes kipengele kwa hali yake ya juu oxidation, wakati halojeni nzito haiwezi. Kwa mfano, wakati fluorine ya ziada inachukua na sulfuri,\(\ce{SF_6}\) fomu. Klorini inatoa\(\ce{SCl_2}\) na bromini,\(\ce{S_2Br_2}\). Iodini haina kuguswa na sulfuri.
Fluorine ni wakala mwenye nguvu zaidi wa oxidizing wa vipengele vinavyojulikana. Inapunguza kwa urahisi vipengele vingine vingi; kwa hiyo, mmenyuko wa reverse, oxidation ya fluorides, ni vigumu sana kukamilisha. Fluorini humenyuka moja kwa moja na huunda fluoridi za binary na vipengele vyote isipokuwa gesi nyepesi vyeo (Yeye, Ne, na Ar). Fluorine ni wakala mwenye nguvu ya oksidi ambayo vitu vingi huwasha moto juu ya kuwasiliana nayo. Matone ya maji yanawaka katika fluorine na fomu\(\ce{O_2}\)\(\ce{OF_2}\),\(\ce{H_2O_2}\),,\(\ce{O_3}\), na\(\ce{HF}\). Mbao na asbestosi huwaka na kuchoma katika gesi ya fluorini. Wengi metali moto kuchoma kwa nguvu katika fluorine. Hata hivyo, inawezekana kushughulikia fluorini katika vyombo vya shaba, chuma, au nickel kwa sababu filamu inayoambatana ya chumvi ya fluoride hupunguza nyuso zao. Fluorine ni kipengele pekee ambacho humenyuka moja kwa moja na xenon yenye heshima ya gesi.
Ingawa ni wakala wa oxidizing wenye nguvu, klorini haitumiki zaidi kuliko fluorine. Kuchanganya klorini na hidrojeni katika giza hufanya mmenyuko kati yao kuwa polepole. Mfiduo wa mchanganyiko kwa mwanga husababisha mbili kuguswa kwa kulipuka. Klorini pia haina kazi kidogo kuelekea metali kuliko fluorini, na athari za oksidi kawaida zinahitaji joto la juu. Sodiamu iliyosafishwa inawaka katika klorini. Klorini inashambulia nonmetali nyingi (C, N2, na O2 ni tofauti tofauti), na kutengeneza misombo ya Masi ya covalent. Klorini kwa ujumla humenyuka na misombo ambayo yana kaboni na hidrojeni tu (hidrokaboni) kwa kuongeza vifungo vingi au kwa kubadilisha.
Katika maji baridi, klorini inakabiliwa na mmenyuko wa kutofautiana:
\[\ce{Cl}_{2(aq)}+\ce{2H_2O}_{(l)}⟶\ce{HOCl}_{(aq)}+\ce{H_3O^+}_{(aq)}+\ce{Cl^-}_{(aq)} \nonumber \]
Nusu ya atomi za klorini huongeza oxidation kwa hali ya 1+ya oxidation (asidi ya hypochlorous), na nusu nyingine hupunguza hali ya 1 ya oxidation (ion kloridi). Ukosefu huu haujakamilika, hivyo maji ya klorini ni mchanganyiko wa usawa wa molekuli za klorini, molekuli ya asidi ya hypochlorous, ioni za hidronium, na ioni za kloridi. Unapoonekana kwa mwanga, suluhisho hili linakabiliwa na utengano wa photochemical:
\[\ce{2HOCl}_{(aq)}+\ce{2H_2O}_{(l)}\xrightarrow{\ce{sunlight}} \ce{2H_3O^+}_{(aq)}+\ce{2Cl^-}_{(aq)}+\ce{O}_{2(g)} \nonumber \]
Klorini isiyo ya metali ni electronegative zaidi kuliko elementi nyingine yoyote isipokuwa fluorini, oksijeni, na nitrojeni. Kwa ujumla, vipengele vya electronegative sana ni mawakala mzuri wa oksidi; kwa hiyo, tunatarajia klorini ya msingi ili kuimarisha vipengele vingine vyote isipokuwa kwa hizi tatu (na gesi zisizo za ufanisi). Mali yake ya oxidizing, kwa kweli, ni wajibu wa matumizi yake kuu. Kwa mfano, fosforasi (V) kloridi, kati muhimu katika maandalizi ya wadudu na silaha za kemikali, hutengenezwa na oxidizing phosphorus na klorini:
\[\ce{P}_{4(s)}+\ce{10Cl}_{2(g)}⟶\ce{4PCl}_{5(l)} \nonumber \]
Kiasi kikubwa cha klorini pia hutumiwa kuimarisha, na hivyo kuharibu, vifaa vya kikaboni au kibaiolojia katika utakaso wa maji na katika blekning.
Mali ya kemikali ya bromini ni sawa na yale ya klorini, ingawa bromini ni wakala wa oksidi dhaifu na reactivity yake ni chini ya ile ya klorini.
Iodini ni athari ndogo ya halojeni. Ni wakala dhaifu zaidi wa oksidi, na ioni ya iodidi ni ioni ya halide iliyosababishwa kwa urahisi zaidi. Iodini humenyuka na metali, lakini inapokanzwa mara nyingi inahitajika. Haina oxidize ions nyingine za halide.
Ikilinganishwa na halojeni nyingine, iodini humenyuka kidogo tu na maji. Mwelekeo wa iodini katika maji huguswa na mchanganyiko wa wanga na iodidi ion, na kutengeneza rangi ya bluu ya kina. Tabia hii ni mtihani nyeti sana kwa uwepo wa iodini katika maji.
Halides ya Metals Mwakilishi
Maelfu ya chumvi ya metali ya mwakilishi yameandaliwa. Halides ya binary ni sehemu muhimu ya chumvi. Chumvi ni kiwanja cha ioniki kilichoundwa na cations na anions, isipokuwa ioni hidroksidi au oksidi. Kwa ujumla, inawezekana kuandaa chumvi hizi kutoka kwa metali au kutoka kwa oksidi, hidroksidi, au kabonati. Tutaonyesha aina ya jumla ya athari za kuandaa chumvi kupitia athari zinazotumiwa kuandaa halidi za binary.
Misombo ya binary ya chuma na halojeni ni halides. Halidi nyingi za binary ni ionic. Hata hivyo, zebaki, vipengele vya kikundi 13 na majimbo ya oxidation ya 3+, bati (IV), na risasi (IV) huunda halidi za binary covalent. Mmenyuko wa moja kwa moja wa chuma na halogen huzalisha halide ya chuma. Mifano ya athari hizi za kupunguza oxidation ni pamoja na:
\[\ce{Cd}_{(s)}+\ce{Cl}_{2(g)}⟶\ce{CdCl}_{2(s)} \nonumber \]
\[\ce{2Ga}_{(l)}+\ce{3Br}_{2(l)}⟶\ce{2GaBr}_{3(s)} \nonumber \]
Video\(\PageIndex{1}\): Majibu ya metali ya alkali na halojeni za msingi ni exothermic sana na mara nyingi vurugu. Chini ya hali ya kudhibitiwa, hutoa maandamano ya kusisimua kwa wanafunzi wa budding wa kemia. Unaweza kuona inapokanzwa ya awali ya sodiamu ambayo huondoa mipako ya hidroksidi ya sodiamu, peroxide ya sodiamu, na mafuta ya madini ya mabaki ili kufungua uso wa tendaji. Majibu na gesi ya klorini huendelea vizuri sana.
Ikiwa chuma kinaweza kuonyesha majimbo mawili ya oxidation, inaweza kuwa muhimu kudhibiti stoichiometry ili kupata halide na hali ya chini ya oxidation. Kwa mfano, maandalizi ya kloridi ya bati (II) inahitaji uwiano wa 1:1 wa Sn hadi\(\ce{Cl_2}\), wakati maandalizi ya kloridi ya bati (IV) inahitaji uwiano wa 1:2:
\[\ce{Sn}_{(s)}+\ce{Cl}_{2(g)}⟶\ce{SnCl}_{2(s)} \nonumber \]
\[\ce{Sn}_{(s)}+\ce{2Cl}_{2(g)}⟶\ce{SnCl}_{4(l)}\nonumber \]
Mwakilishi wa mwakilishi wa kazi - wale ambao ni rahisi kuimarisha kuliko hidrojeni-kuguswa na halidi za hidrojeni za gesi ili kuzalisha halidi za chuma na hidrojeni. Majibu ya zinki na fluoride ya hidrojeni ni:
\[\ce{Zn}_{(s)}+\ce{2HF}_{(g)}⟶\ce{ZnF}_{2(s)}+\ce{H}_{2(g)} \nonumber \]
Mwakilishi wa metali pia huguswa na ufumbuzi wa halidi za hidrojeni ili kuunda hidrojeni na ufumbuzi wa halides zinazofanana. Mifano ya athari hizo ni pamoja na:
\[\ce{Cd}_{(s)}+\ce{2HBr}_{(aq)}⟶\ce{CdBr}_{2(aq)}+\ce{H}_{2(g)} \nonumber \]
\[\ce{Sn}_{(s)}+\ce{2HI}_{(aq)}⟶\ce{SnI}_{2(aq)}+\ce{H}_{2(g)} \nonumber \]
Hydroxides, carbonates, na baadhi ya oksidi huguswa na ufumbuzi wa halidi za hidrojeni ili kuunda ufumbuzi wa chumvi za halide. Inawezekana kuandaa chumvi za ziada kwa majibu ya hidroksidi hizi, kabonati, na oksidi na suluhisho la maji ya asidi nyingine:
\[\ce{CaCo}_{3(s)}+\ce{2HCl}_{(aq)}⟶\ce{CaCl}_{2(aq)}+\ce{CO}_{2(g)}+\ce{H_2O}_{(l)} \nonumber \]
\[\ce{TlOH}_{(aq)}+\ce{HF}_{(aq)}⟶\ce{TlF}_{(aq)}+\ce{H_2O}_{(l)} \nonumber \]
Halides chache na chumvi nyingine nyingi za metali za mwakilishi hazipatikani. Inawezekana kuandaa chumvi hizi za mumunyifu kwa athari za metathesis zinazotokea wakati ufumbuzi wa chumvi za mumunyifu huchanganywa (Kielelezo\(\PageIndex{2}\)). Athari za metathesis zinachunguzwa katika sura juu ya stoichiometry ya athari za kemikali.

Halides kadhaa hutokea kwa kiasi kikubwa katika asili. Bahari na mabichi ya chini ya ardhi yana halidi nyingi. Kwa mfano, kloridi ya magnesiamu katika bahari ni chanzo cha ions magnesiamu kutumika katika uzalishaji wa magnesiamu. Kubwa chini ya ardhi amana ya kloridi sodiamu, kama mgodi chumvi inavyoonekana katika Kielelezo\(\PageIndex{3}\), kutokea katika maeneo mengi ya dunia. Amana hizi hutumika kama chanzo cha sodiamu na klorini karibu na misombo mingine yote iliyo na vipengele hivi. Mchakato wa klori-alkali ni mfano mmoja.

Interhalogens
Misombo inayotokana na halojeni mbili au zaidi tofauti ni interhalogens. Molekuli za Interhalogen zinajumuisha atomi moja ya halogen nzito iliyofungwa na vifungo moja kwa idadi isiyo ya kawaida ya atomi za halogen nyepesi. Miundo ya IF 3, IF 5, na IF 7 ni mfano katika Kielelezo\(\PageIndex{4}\) Formula kwa interhalogens nyingine, ambayo kila mmoja hutoka kwa majibu ya halojeni husika, ni katika Jedwali\(\PageIndex{1}\).
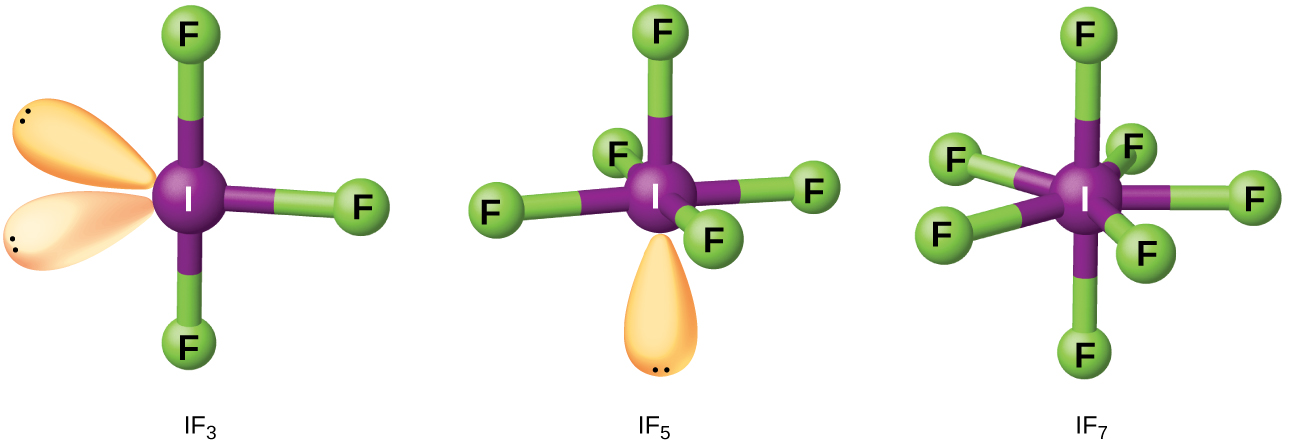
Kumbuka kutoka Jedwali\(\PageIndex{1}\) kwamba fluorini ina uwezo wa oxidize iodini kwa hali yake ya juu ya oxidation, 7+, ambapo bromini na klorini, ambazo ni vigumu zaidi kuzalisha, kufikia tu hali ya 5+-oxidation. Hali ya 7+-oxidation ni kikomo cha halojeni. Kwa sababu halojeni ndogo zinajumuishwa kuhusu moja kubwa, idadi kubwa ya atomi ndogo iwezekanavyo huongezeka kadiri radius ya atomu kubwa inavyoongezeka. Wengi wa misombo hii ni imara, na wengi ni tendaji sana. Interhalogens huguswa kama halidi zao za sehemu; fluoridi za halogen, kwa mfano, ni mawakala wenye nguvu zaidi kuliko kloridi za halogen.
| YX | YX 3 | YX 5 | YX 7 |
|---|---|---|---|
| BrCl (g) | |||
| BrF (g) | BrF (3 l) | BrF (5 l) | |
| ClF (g) | ClF (3 g) | ClF (5 g) | |
| Bir (s) | |||
| Cil (l) | Cil (3 s) | ||
| IF (s) | IF 3 (s) | IF 5 (l) | IF 7 (g) |
Polyhalides ionic ya metali alkali, kama vile KI 3, kiCl 2, KiCl 4, CsiBr 2, na CSbrCl 2, ambayo yana anioni linajumuisha angalau atomi tatu halogen, ni karibu kuhusiana na interhalojeni. Kama ilivyoonekana hapo awali, malezi ya anion ya polyhalide\(\ce{I_3^-}\) ni wajibu wa umumunyifu wa iodini katika ufumbuzi wa maji yenye iodidi ioni.
Maombi
Ioni ya fluoride na misombo ya fluorini ina matumizi mengi muhimu. Misombo ya kaboni, hidrojeni, na fluorini hubadilisha Freons (misombo ya kaboni, klorini, na fluorine) kama refrigerants. Teflon ni polymer linajumuisha —CF 2 CF 2 — vitengo. Ioni ya fluoride huongezwa kwa vifaa vya maji na kwa dawa za meno kama SNF 2 au NaF kupambana na kuoza kwa jino. Fluoride sehemu inabadilisha meno kutoka Ca 5 (PO 4) 3 (OH) katika Ca 5 (PO 4) 3 F.
Chlorini ni muhimu kwa bleach massa kuni na nguo pamba. Klorini humenyuka na maji ili kuunda asidi ya hypochlorous, ambayo huchanganya vitu vya rangi kwa rangi isiyo rangi. Kiasi kikubwa cha klorini ni muhimu katika hidrokaboni za klorini (kuchukua nafasi ya hidrojeni na klorini) kuzalisha misombo kama vile tetrakloridi (cCl 4), klorofomu (ChCl 3), na kloridi ya ethyl (C 2 H 5 Cl), na katika uzalishaji wa kloridi ya polyvinyl (PVC) na polima nyingine. Klorini ni muhimu pia kuua bakteria katika usambazaji wa maji ya jamii.
Bromini ni muhimu katika uzalishaji wa rangi fulani, na bromidi za sodiamu na potasiamu hutumiwa kama sedatives. Wakati mmoja, bromidi ya fedha nyeti ilikuwa sehemu ya filamu ya picha.
Iodini katika ufumbuzi wa pombe na iodidi ya potasiamu ni antiseptic (tincture ya iodini). Chumvi za iodidi ni muhimu kwa utendaji mzuri wa tezi ya tezi; upungufu wa iodini unaweza kusababisha maendeleo ya goiter. Chumvi ya meza ya iodized ina 0.023% iodidi ya potasiamu. Iodidi ya fedha ni muhimu katika mbegu za mawingu ili kushawishi mvua; ilikuwa muhimu katika uzalishaji wa filamu ya picha na iodoform, CHI 3, ni antiseptic.
Muhtasari
Halogens huunda halidi na vipengele vya chini vya electronegative. Halides ya metali hutofautiana kutoka ionic hadi covalent; halides ya nonmetals ni covalent. Interhalogens huunda kwa mchanganyiko wa halojeni mbili au zaidi tofauti. Wote wa metali mwakilishi huguswa moja kwa moja na halojeni za msingi au kwa ufumbuzi wa asidi hidrohali (HF, HCl, HbR, na HI) ili kuzalisha halidi za mwakilishi wa chuma. Maandalizi mengine ya maabara yanahusisha kuongezewa kwa asidi hidrohali yenye maji kwa misombo ambayo yana anioni za msingi kama vile hidroksidi, oksidi, au kabonati.


