18.9: Matukio, Maandalizi, na Misombo ya Oksijeni
- Page ID
- 176416
- Eleza mali, maandalizi, na misombo ya oksijeni
- Eleza maandalizi, mali, na matumizi ya oksidi za chuma za mwakilishi, peroxides, na hidroksidi
Oksijeni ni elementi nyingi zaidi juu ya ukonde wa dunia. Uso wa dunia unajumuisha ukanda, anga, na hydrosphere. Kuhusu asilimia 50 ya ukubwa wa ukubwa wa dunia ina oksijeni (pamoja na mambo mengine, hasa silicon). Oksijeni hutokea kama molekuli O 2 na, kwa kiwango kidogo, kama molekuli O 3 (ozoni) katika hewa. Inaunda asilimia 20 ya wingi wa hewa. Kuhusu 89% ya maji kwa wingi ina oksijeni pamoja. Pamoja na kaboni, hidrojeni, na nitrojeni, oksijeni ni sehemu kubwa ya mimea na wanyama.
Oksijeni ni gesi isiyo na rangi, isiyo na harufu, na isiyoharibika kwa joto la kawaida. Ni denser kidogo kuliko hewa. Ingawa ni kidogo tu mumunyifu katika maji (49 ml ya gesi dissolves katika 1 L katika STP), umumunyifu wa oksijeni ni muhimu sana kwa maisha ya majini.
Zaidi ya oksijeni iliyotengwa kibiashara inatokana na hewa na salio kutokana na electrolysis ya maji. Kutenganishwa kwa oksijeni kutoka hewa huanza na baridi na kuimarisha hewa mpaka itapunguza. Kama hewa ya kioevu inapunguza, oksijeni na kiwango chake cha juu cha kuchemsha (90 K) hutenganisha na nitrojeni, ambayo ina kiwango cha chini cha kuchemsha (77 K). Inawezekana kutenganisha vipengele vingine vya hewa kwa wakati mmoja kulingana na tofauti katika pointi zao za kuchemsha.
Oksijeni ni muhimu katika michakato ya mwako kama vile kuchomwa kwa nishati. Mimea na wanyama hutumia oksijeni kutoka hewa kwa kupumua. Usimamizi wa hewa yenye utajiri wa oksijeni ni mazoezi muhimu ya matibabu wakati mgonjwa anapata ugavi usiofaa wa oksijeni kwa sababu ya mshtuko, pneumonia, au ugonjwa mwingine.
Sekta ya kemikali inaajiri oksijeni kwa oksidi vitu vingi. Kiasi kikubwa cha oksijeni zinazozalishwa kibiashara ni muhimu katika kuondolewa kwa kaboni kutoka chuma wakati wa uzalishaji wa chuma. Kiasi kikubwa cha oksijeni safi ni muhimu pia katika utengenezaji wa chuma na katika kukata na kulehemu kwa metali yenye mienge ya oksihidrojeni na oksiasetilini.
Oxyjeni ya maji ni muhimu kwa sekta ya nafasi. Ni wakala oxidizing katika inji za roketi. Pia ni chanzo cha oksijeni ya gesi kwa msaada wa maisha katika nafasi.
Kama tunavyojua, oksijeni ni muhimu sana kwa maisha. Nishati zinazohitajika kwa ajili ya matengenezo ya kazi za kawaida za mwili kwa binadamu na katika viumbe vingine hutoka kwa oksidi ya polepole ya misombo ya kemikali. Oksijeni ni wakala wa mwisho wa oxidizing katika athari hizi. Kwa binadamu, oksijeni hupita kutoka kwenye mapafu ndani ya damu, ambako inachanganya na hemoglobin, huzalisha oksijemoglobin. Kwa fomu hii, damu husafirisha oksijeni kwa tishu, ambako huhamishiwa kwenye tishu. Bidhaa za mwisho ni dioksidi kaboni na maji. Damu hubeba dioksidi kaboni kupitia mishipa hadi mapafu, ambapo damu hutoa dioksidi kaboni na kukusanya ugavi mwingine wa oksijeni. Digestion na kuimarisha chakula hurejesha vifaa vinavyotumiwa na oxidation katika mwili; nishati iliyokombolewa ni sawa na kama chakula kinachomwa nje ya mwili.
Mimea ya kijani inaendelea kujaza oksijeni katika angahewa kwa mchakato unaoitwa photosynthesis. Bidhaa za photosynthesis zinaweza kutofautiana, lakini, kwa ujumla, mchakato hubadilisha dioksidi kaboni na maji katika glucose (sukari) na oksijeni kwa kutumia nishati ya mwanga:
\ [kuanza {alignat} {3}
&\ ce {6CO2} (g)\ :+\: &\ ce {6H2O} (l)
\:\ mathrm {\ underset {mwanga} {\ strarrow {chlorophyll}}}\:
&\ ce {C6H12O6} (aq)\ :+\: &\ ce {6O2} (g)\\
&\ mathrm {carbon\\ dioksidi} &\ ce {maji} &\ ce { glucose} &\ ce {oksijeni}
\ mwisho {alignat}\ nonumber\]
Hivyo, oksijeni iliyokuwa dioksidi kaboni na maji kwa michakato ya kimetaboliki katika mimea na wanyama inarudi angahewa kwa usanisinuru.
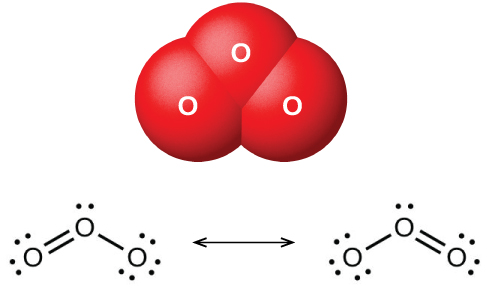
Wakati oksijeni kavu inapitishwa kati ya sahani mbili za kushtakiwa umeme, ozoni (O 3, iliyoonyeshwa kwenye Kielelezo\(\PageIndex{1}\)), allotrope ya oksijeni yenye harufu tofauti, fomu. Kuundwa kwa ozoni kutoka oksijeni ni mmenyuko wa mwisho, ambapo nishati hutoka kwa kutokwa kwa umeme, joto, au mwanga wa ultraviolet:
\[\ce{3O2}(g)\xrightarrow{\ce{electric\: discharge}}\ce{2O3}(g) \hspace{20px} ΔH°=\mathrm{287\: kJ} \nonumber \]
Harufu kali inayohusishwa na vifaa vya umeme vinavyotokana na vifaa vya umeme ni kutokana, kwa sehemu, kwa ozoni.
Ozoni huunda kawaida katika anga ya juu kwa hatua ya mwanga wa ultraviolet kutoka jua kwenye oksijeni huko. Ozoni nyingi za anga hutokea katika stratosphere, safu ya angahewa inayoenea kutoka kilomita 10 hadi 50 juu ya uso wa dunia. Ozoni hii hufanya kama kizuizi cha mwanga wa ultraviolet hatari kutoka jua kwa kunyonya kupitia mmenyuko wa uharibifu wa kemikali:
\[\ce{O3}(g)\xrightarrow{\ce{ultraviolet\: light}}\ce{O}(g)+\ce{O2}(g) \nonumber \]
Atomi za oksijeni za tendaji zinajumuisha tena na oksijeni ya Masi ili kukamilisha mzunguko wa ozoni. Uwepo wa ozoni ya stratospheric hupungua mzunguko wa saratani ya ngozi na madhara mengine ya uharibifu wa mionzi ya ultraviolet. Imekuwa wazi alionyesha kuwa chlorofluorocarbons, CFCs (inayojulikana kibiashara kama Freons), ambayo walikuwa sasa kama propellants erosoli katika makopo dawa na kama refrigerants, unasababishwa kupungua kwa ozoni katika stratosphere. Hii ilitokea kwa sababu mwanga wa ultraviolet pia husababisha CFC kuoza, kuzalisha klorini ya atomiki. Atomi za klorini huguswa na molekuli za ozoni, na kusababisha kuondolewa kwa wavu wa molekuli O 3 kutoka stratosphere. Utaratibu huu unachunguzwa kwa undani katika chanjo yetu ya kinetics ya kemikali. Kuna juhudi duniani kote za kupunguza kiasi cha CFC zinazotumiwa kibiashara, na shimo la ozoni tayari limeanza kupungua kwa ukubwa kadiri viwango vya anga vya klorini atomia hupungua. Wakati ozoni katika stratosphere inatusaidia kutulinda, ozoni katika troposphere ni tatizo. Ozoni hii ni sehemu ya sumu ya smog photochemical.
Matumizi ya ozoni hutegemea reactivity yake na vitu vingine. Inaweza kutumika kama wakala wa blekning kwa mafuta, waxes, vitambaa, na wanga: Inachochea misombo ya rangi katika vitu hivi kwa misombo isiyo rangi. Ni mbadala kwa klorini kama disinfectant kwa maji.
Athari
Oksijeni ya msingi ni wakala mwenye nguvu ya oksidi. Inakabiliwa na mambo mengine mengi na misombo mingi.
Majibu na Elements
Oksijeni humenyuka moja kwa moja kwenye joto la kawaida au kwenye joto la juu na elementi nyingine zote isipokuwa gesi zenye heshima, halojeni, na metali chache za pili na za tatu za mpito za reactivity za chini (zile zilizo na uwezo mkubwa wa kupunguza kuliko shaba). Rust ni mfano wa mmenyuko wa oksijeni na chuma. Metali yenye kazi zaidi huunda peroxides au superoxides. Chini ya metali ya kazi na nonmetals hutoa oksidi. Mifano miwili ya athari hizi ni:
\[\ce{2Mg}(s)+\ce{O2}(g)⟶\ce{2MgO}(s) \nonumber \]
\[\ce{P4}(s)+\ce{5O2}(g)⟶\ce{P4O10}(s) \nonumber \]
Oksidi za halojeni, angalau moja ya gesi nzuri, na metali zilizo na uwezo wa kupunguza zaidi kuliko shaba hazifanyi kwa hatua ya moja kwa moja ya vipengele na oksijeni.
Majibu na Misombo
Oksijeni ya msingi pia humenyuka na misombo fulani. Ikiwa inawezekana kuimarisha mambo yoyote katika kiwanja kilichopewa, oxidation zaidi na oksijeni inaweza kutokea. Kwa mfano, sulfidi hidrojeni, H 2 S, ina sulfuri yenye hali ya oxidation ya 2-. Kwa sababu sulfuri haina kuonyesha hali yake ya juu ya oxidation, tunatarajia H 2 S kuguswa na oksijeni. Inafanya, kutoa maji na dioksidi ya sulfuri. Majibu ni:
\[\ce{2H2S}(g)+\ce{3O2}(g)⟶\ce{2H2O}(l)+\ce{2SO2}(g) \nonumber \]
Inawezekana pia oksidi oksidi kama CO na P 4 O 6 zilizo na kipengele na hali ya chini ya oksidi. Urahisi ambao oksijeni ya msingi huchukua elektroni huonekana na ugumu wa kuondoa elektroni kutoka oksijeni katika oksidi nyingi. Kati ya vipengele, fluorine tu yenye nguvu sana inaweza kuimarisha oksidi ili kuunda gesi ya oksijeni.
Oksidi, Peroxides, na Hidroksidi
Misombo ya metali ya mwakilishi na oksijeni huanguka katika makundi matatu: (1) oksidi, zenye ioni za oksidi, O 2-; (2) peroxides, zenye ioni za peroxides\(\ce{O2^2-}\), pamoja na vifungo vya oksijeni-oksijeni covalent moja na idadi ndogo sana ya superoxides, zenye ions superoxide\(\ce{O2-}\),, pamoja na oksijeni-oksijeni covalent dhamana ili\(\frac{3}{2}\), Aidha, kuna (3) hidroksidi, zenye ions hidroksidi, OH -. Metali zote za mwakilishi huunda oksidi. Baadhi ya metali za kikundi 2 pia huunda peroksidi, MO 2, na metali za kikundi 1 pia huunda peroksidi, M 2 O 2, na superoxides, MO 2.
Oksidi
Inawezekana kuzalisha oksidi za metali nyingi za mwakilishi kwa kupokanzwa hidroksidi zinazofanana (kutengeneza oksidi na maji ya gesi) au kabonati (kutengeneza oxide na CO 2 ya gesi). Ulinganifu kwa mfano athari ni:
\[\ce{2Al(OH)3}(s)\xrightarrow{Δ}\ce{Al2O3}(s)+\ce{3H2O}(g) \nonumber \]
\[\ce{CaCO3}(s)\xrightarrow{Δ}\ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
Hata hivyo, chumvi za chuma za alkali kwa ujumla ni imara sana na haziharibiki kwa urahisi wakati hasira. Oxidi za chuma za alkali hutokana na athari za kupunguza oxidation zinazoundwa na nitrati inapokanzwa au hidroksidi na metali. Ulinganisho wa athari za sampuli ni:
\[\ce{2KNO3}(s)+\ce{10K}(s)\xrightarrow{Δ}\ce{6K2O}(s)+\ce{N2}(g) \nonumber \]
\[\ce{2LiOH}(s)+\ce{2Li}(s)\xrightarrow{Δ}\ce{2Li2O}(s)+\ce{H2}(g) \nonumber \]
Isipokuwa oksidi ya zebaki (II) inawezekana kuzalisha oksidi za metali za vikundi 2—15 kwa kuchoma chuma sambamba hewani. Mwanachama mkubwa zaidi wa kila kikundi, mwanachama ambao athari ya jozi ya ajizi hutamkwa zaidi, hufanya oksidi ambayo hali ya oxidation ya ion ya chuma ni mbili chini ya hali ya kikundi cha oxidation (athari ya jozi ya ajizi). Hivyo, Tl 2 O, PbO, na Bi 2 O 3 fomu wakati wa kuchoma thallium, risasi, na bismuth, kwa mtiririko huo. Oxides ya wanachama nyepesi wa kila kikundi huonyesha hali ya kikundi cha oxidation. Kwa mfano, aina za SNo 2 kutoka kwenye bati ya moto. Oxydi ya zebaki (II), HgO, huunda polepole wakati zebaki inapokanzwa chini ya 500 °C; hutengana kwa joto la juu.
Kuungua wanachama wa vikundi 1 na 2 katika hewa sio njia inayofaa ya kuunda oksidi za vipengele hivi. Metali hizi ni tendaji ya kutosha kuchanganya na nitrojeni hewani, hivyo huunda mchanganyiko wa oksidi na nitridi ioniki. Kadhaa pia huunda peroxides au superoxides wakati wa joto katika hewa.
Oksidi za ioniki zote zina ion ya oksidi, kibali cha ioni cha hidrojeni yenye nguvu sana. Isipokuwa hakuna sana oksidi alumini, Al 2 O 3, bati (IV), SNo 2, na risasi (IV), PbO 2, oxides ya metali mwakilishi kuguswa na asidi kuunda chumvi. Baadhi ya equations kwa athari hizi ni:
\[\ce{Na2O}+\ce{2HNO3}(aq)⟶\ce{2NaNO3}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{CaO}(s)+\ce{2HCL}(aq)⟶\ce{CaCl2}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{SnO}(s)+\ce{2HClO4}(aq)⟶\ce{Sn(ClO4)2}(aq)+\ce{H2O}(l) \nonumber \]
Oxides ya metali ya vikundi 1 na 2 na ya thallium (I) oksidi huguswa na maji na kuunda hidroksidi. Mifano ya athari hizo ni:
\[\ce{Na2O}(s)+\ce{H2O}(l)⟶\ce{NaOH}(aq) \nonumber \]
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(aq) \nonumber \]
\[\ce{Tl2O}(s)+\ce{H2O}(aq)⟶\ce{2TlOH}(aq) \nonumber \]
Oksidi za metali za alkali zina matumizi kidogo ya viwanda, tofauti na oksidi ya magnesiamu, oksidi ya kalsiamu, na oksidi ya al Oxydi ya magnesiamu ni muhimu katika kutengeneza firebrick, crucibles, linings tanuru, na mafuta insulation-maombi ambayo yanahitaji kemikali na utulivu mafuta. Oxydi ya kalsiamu, wakati mwingine huitwa quicklime au chokaa katika soko la viwanda, ni tendaji sana, na matumizi yake kuu yanaonyesha reactivity yake. Oxydi safi ya kalsiamu hutoa mwanga mkali nyeupe wakati unapokanzwa kwa joto la juu (kama ilivyoonyeshwa kwenye Mchoro\(\PageIndex{2}\):). Vikwazo vya oksidi ya kalsiamu iliyochomwa na moto wa gesi yalikuwa taa za hatua katika sinema kabla ya umeme kupatikana. Hii ni chanzo cha maneno “katika mwanga.”
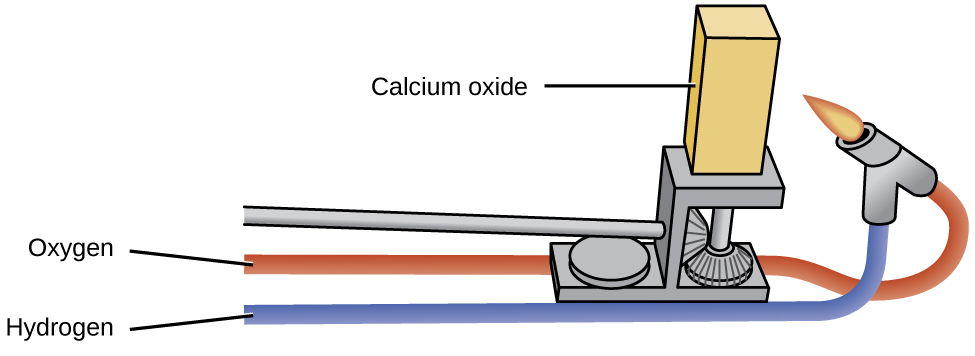
Oxydi ya kalsiamu na hidroksidi ya kalsiamu ni misingi ya gharama nafuu inayotumiwa sana katika usindikaji wa kemikali, ingawa bidhaa nyingi muhimu zilizoandaliwa kutoka kwao hazina kalsiamu. Oxydi ya kalsiamu, CaO, hufanywa na inapokanzwa calcium carbonate, CaCO 3, ambayo inapatikana sana na kwa gharama nafuu kama chokaa au shells za oyster:
\[\ce{CaCO3}(s)⟶\ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
Ingawa mmenyuko huu wa kuharibika hubadilishwa, inawezekana kupata mavuno ya 100% ya CaO kwa kuruhusu CO 2 kutoroka. Inawezekana kuandaa hidroksidi ya kalsiamu na mmenyuko wa asidi-msingi wa oksidi ya chuma yenye mumunyifu na maji:
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(s) \nonumber \]
Wote CaO na Ca (OH) 2 ni muhimu kama besi; wanakubali protoni na neutralize asidi.
Aluminiumini (Al 2 O 3) hutokea katika asili kama corundum ya madini, dutu ngumu sana kutumika kama abrasive kwa kusaga na polishing. Corundum ni muhimu kwa biashara ya kujitia kama ruby na samafi. Rangi ya ruby ni kutokana na kuwepo kwa kiasi kidogo cha chromium; uchafu mwingine huzalisha rangi mbalimbali zinazowezekana kwa samafi. Rubi bandia na samafi sasa hutengenezwa na oksidi ya alumini iliyoyeyuka (kiwango cha kuyeyuka = 2050 °C) na kiasi kidogo cha oksidi ili kuzalisha rangi zinazohitajika na kuyeyusha myeyusho kwa namna ya kuzalisha fuwele kubwa. Lasers ya Ruby hutumia fuwele za ruby za syn
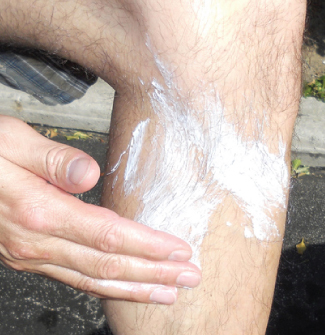
Oxydi ya zinki, ZnO, ilikuwa rangi nyeupe yenye rangi nyeupe; hata hivyo, uchafuzi huwa na discolor kiwanja. Kiwanja pia ni muhimu katika utengenezaji wa matairi ya magari na bidhaa nyingine za mpira, na katika maandalizi ya mafuta ya dawa. Kwa mfano, jua za zinki za oksidi, kama inavyoonekana kwenye Kielelezo\(\PageIndex{3}\), kusaidia kuzuia kuchomwa na jua. Oxydi ya zinki katika jua hizi iko katika mfumo wa nafaka ndogo sana zinazojulikana kama nanoparticles. Dioksidi ya risasi ni sehemu ya betri za kuhifadhi risasi za kushtakiwa. Kiongozi (IV) huelekea kurejea kwenye ioni ya risasi imara zaidi (II) kwa kupata elektroni mbili, hivyo dioksidi risasi ni wakala wenye nguvu ya oksidi.
Peroxides na Superoxides
Peroxides na superoxides ni vioksidishaji vikali na ni muhimu katika michakato ya kemikali. Peroxide ya hidrojeni, H 2 O 2, iliyoandaliwa kutoka kwa peroxides ya chuma, ni bleach muhimu na disinfectant. Peroxides na superoxides huunda wakati chuma au oksidi za chuma za vikundi 1 na 2 huguswa na oksijeni safi kwenye joto la juu. Peroxide ya sodiamu na peroxides ya kalsiamu, strontium, na fomu ya bariamu kwa kupokanzwa chuma sawa au oksidi ya chuma katika oksijeni safi:
\[\ce{2Na}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{Na2O2}(s) \nonumber \]
\[\ce{2Na2O}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{2Na2O2}(s) \nonumber \]
\[\ce{2SrO}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{2SrO2}(s) \nonumber \]
Peroksidi za potasiamu, rubidium, na cesium zinaweza kutayarishwa kwa kupokanzwa chuma au oksidi yake kwa kiasi kikubwa cha oksijeni:
\[\ce{2K}(s)+\ce{O2}(g)⟶\ce{K2O2}(s) \hspace{20px} \mathrm{(2\:mol\: K\: per\: mol\: O_2)} \nonumber \]
Kwa ziada ya oksijeni, fomu ya superoxides KO 2, RBO 2, na CSo 2. Kwa mfano:
\[\ce{K}(s)+\ce{O2}(g)⟶\ce{KO2}(s) \hspace{20px} \ce{(1\: mol\: K\: per\: mol\: O_2)} \nonumber \]
Utulivu wa peroxides na superoxides ya metali ya alkali huongezeka kama ukubwa wa cation huongezeka.
Hidroksidi
Hydroxides ni misombo iliyo na ion ya OH-. Inawezekana kuandaa misombo hii kwa aina mbili za jumla za athari. Hidroksidi za chuma za mumunyifu zinaweza kuzalishwa na mmenyuko wa chuma au oksidi ya chuma na maji. Hidroksidi za chuma zisizo na fomu wakati suluhisho la chumvi la mumunyifu la chuma linachanganya na suluhisho iliyo na ioni za hidroksidi.
Isipokuwa beryllium na magnesiamu, metali ya vikundi 1 na 2 huguswa na maji ili kuunda hidroksidi na gesi ya hidrojeni. Mifano ya athari hizo ni pamoja na:
\[\ce{2Li}(s)+\ce{2H2O}(l)⟶\ce{2LiOH}(aq)+\ce{H2}(g) \nonumber \]
\[\ce{Ca}(s)+\ce{2H2O}(l)⟶\ce{Ca(OH)2}(aq)+\ce{H2}(g) \nonumber \]
Hata hivyo, athari hizi zinaweza kuwa vurugu na hatari; kwa hiyo, ni vyema kuzalisha hidroksidi za chuma za mumunyifu kwa mmenyuko wa oksidi husika na maji:
\[\ce{Li2O}(s)+\ce{H2O}(l)⟶\ce{2LiOH}(aq) \nonumber \]
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(aq) \nonumber \]
Wengi oksidi za chuma ni anhydrides ya msingi. Hii ni dhahiri kwa oksidi za mumunyifu kwa sababu zinaunda hidroksidi za chuma. Wengi oksidi nyingine za chuma hazina mumunyifu na hazifanyi hidroksidi katika maji; hata hivyo, bado ni anhydridi za msingi kwa sababu zitaitikia na asidi.
Inawezekana kuandaa hidroksidi zisizo na maji ya beryllium, magnesiamu, na metali nyingine za mwakilishi kwa kuongeza hidroksidi ya sodiamu kwa suluhisho la chumvi la chuma husika. Ulinganisho wa ionic wavu kwa athari zinazohusisha chumvi ya magnesiamu, chumvi ya alumini, na chumvi ya zinki ni:
\[\ce{Mg^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Mg(OH)2}(s) \nonumber \]
\[\ce{Al^3+}(aq)+\ce{3OH-}(aq)⟶\ce{Al(OH)3}(s) \nonumber \]
\[\ce{Zn^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Zn(OH)2}(s) \nonumber \]
Zaidi ya hidroksidi lazima kuepukwa wakati wa kuandaa alumini, gallium, zinki, na bati (II) hidroksidi, au hidroksidi kufuta na malezi ya ions sambamba tata:\(\ce{Al(OH)4-}\)\(\ce{Ga(OH)4-}\),\(\ce{Zn(OH)4^2-}\), na\(\ce{Sn(OH)3-}\) (Kielelezo\(\PageIndex{4}\)). Kipengele muhimu cha ions tata kwa sura hii ni kwamba huunda na mmenyuko wa msingi wa Lewis na chuma kuwa asidi ya Lewis.

Viwanda hutumia kiasi kikubwa cha hidroksidi ya sodiamu kama msingi wa bei nafuu, wenye nguvu. Kloridi ya sodiamu ni nyenzo za kuanzia kwa ajili ya uzalishaji wa NaOH kwa sababu NaCl ni vifaa vya kuanzia ghali kuliko oksidi. Hidroksidi ya sodiamu ni miongoni mwa kemikali 10 za juu katika uzalishaji nchini Marekani, na uzalishaji huu ulikuwa karibu kabisa na electrolysis ya ufumbuzi wa kloridi ya sodiamu. Utaratibu huu ni mchakato wa klori-alkali, na ni njia ya msingi ya kuzalisha klorini.
Hidroksidi ya sodiamu ni kiwanja cha ionic na hutengana bila kuharibika Ni mumunyifu sana katika maji, kutoa mbali kiasi kikubwa cha joto na kutengeneza ufumbuzi wa msingi sana: gramu 40 za hidroksidi sodiamu hupasuka katika gramu 60 tu za maji saa 25 °C hidroksidi sodiamu huajiriwa katika uzalishaji wa misombo mingine ya sodiamu na hutumiwa neutralize ufumbuzi tindikali wakati wa uzalishaji wa kemikali nyingine kama vile petrochemicals na polima.
Matumizi mengi ya hidroksidi ni kwa neutralization ya asidi (kama vile antacid inavyoonekana katika Kielelezo\(\PageIndex{5}\)) na kwa ajili ya maandalizi ya oksidi na utengano wa mafuta. Kusimamishwa kwa maji ya hidroksidi ya magnesiamu hufanya maziwa ya antacid ya magnesia. Kwa sababu ya upatikanaji wake tayari (kutokana na mmenyuko wa maji na oksidi ya kalsiamu iliyoandaliwa na utengano wa chokaa, CaCO 3), gharama nafuu, na shughuli, hidroksidi ya kalsiamu hutumiwa sana katika maombi ya kibiashara wanaohitaji msingi wa bei nafuu, wenye nguvu. Majibu ya hidroksidi na asidi zinazofaa pia hutumiwa kuandaa chumvi.

Mchakato wa Chlor-Alkali
Ingawa ni tofauti sana kemikali, kuna uhusiano kati ya klorini na hidroksidi ya sodiamu kwa sababu kuna mchakato muhimu wa electrochemical unaozalisha kemikali hizo mbili wakati huo huo. Mchakato unaojulikana kama mchakato wa klori-alkali, hutumia kloridi ya sodiamu, ambayo hutokea katika amana kubwa katika sehemu nyingi za dunia. Hii ni mchakato wa electrochemical kuimarisha ion ya kloridi kwa klorini na kuzalisha hidroksidi ya sodiamu
Kupitisha umeme wa moja kwa moja kwa njia ya suluhisho la NaCl husababisha ions za kloridi kuhamia electrode nzuri ambapo oxidation kwa klorini ya gesi hutokea wakati ion inatoa elektroni kwa electrode:
\[\ce{2Cl-}(aq)⟶\ce{Cl2}(g)+\ce{2e-} \hspace{20px} \textrm{(at the positive electrode)} \nonumber \]
Electroni zinazozalishwa kusafiri kupitia mzunguko wa nje wa umeme kwa electrode hasi. Ingawa ions nzuri za sodiamu zinahamia kuelekea electrode hii hasi, sodiamu ya metali haifanyi kwa sababu ioni za sodiamu ni vigumu sana kupunguza chini ya hali inayotumiwa. (Kumbuka kwamba metali sodium ni kazi ya kutosha kuguswa na maji na hivyo, hata kama zinazozalishwa, ingekuwa mara moja kuguswa na maji kuzalisha ions sodiamu tena.) Badala yake, molekuli za maji huchukua elektroni kutoka kwa electrode na hupunguzwa ili kuunda gesi ya hidrojeni na ions hidroksidi:
\[\ce{2H2O}(l)+\ce{2e-}\textrm{ (from the negative electrode)}⟶\ce{H2}(g)+\ce{2OH-}(aq) \nonumber \]
Matokeo ya jumla ni uongofu wa suluhisho la maji ya NaCl kwa suluhisho la maji la NaOH, Cl 2 ya gesi, na H 2 ya gesi:
\[\ce{2Na+}(aq)+\ce{2Cl-}(aq)+\ce{2H2O}(l)\xrightarrow{\ce{electrolysis}}\ce{2Na+}(aq)+\ce{2OH-}(aq)+\ce{Cl2}(g)+\ce{H2}(g) \nonumber \]
Nonmetal oksijeni misombo
Nonmetali nyingi huguswa na oksijeni kuunda oksidi zisizo za metali. Kulingana na mataifa ya oksidi inapatikana kwa kipengele, aina mbalimbali za oksidi zinaweza kuunda. Fluorine itachanganya na oksijeni ili kuunda fluorides kama vile OF 2, ambapo oksijeni ina hali ya 2+-oxidation.
Kiberiti oksijeni misombo
Ya oksidi mbili za kawaida za sulfuri ni dioksidi sulfuri, SO 2, na trioxide ya sulfuri, SO 3. Harufu ya sulfuri inayowaka hutoka kwa dioksidi sulfuri. Dioksidi ya sulfuri\(\PageIndex{6}\), inavyoonekana kwenye Kielelezo, hutokea katika gesi za volkeno na katika anga karibu na mimea ya viwanda inayowaka mafuta yenye misombo ya sulfuri.
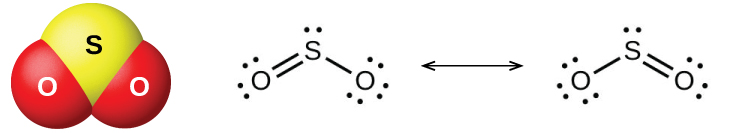
Uzalishaji wa kibiashara wa dioksidi sulfuri hutoka ama kuchoma sulfuri au kuchoma ores sulfidi kama vile ZNs, FeS 2, na Cu 2 S katika hewa. (Kuchoma, ambayo huunda oksidi ya chuma, ni hatua ya kwanza katika kujitenga kwa metali nyingi kutoka kwa ores zao.) Njia rahisi ya kuandaa dioksidi ya sulfuri katika maabara ni kwa hatua ya asidi kali kwenye chumvi za sulfite zenye chumvi za\(\ce{SO3^2-}\) ion au hidrojeni za sulfite zilizo na\(\ce{HSO3-}\). Asidi ya sulfuri, H 2 SO 3, huunda kwanza, lakini haraka hutengana katika dioksidi ya sulfuri na maji. Dioksidi ya sulfuri pia huunda wakati mawakala wengi wa kupunguza huguswa na asidi ya moto, iliyojilimbikizia Trioxide ya sulfuri huunda polepole wakati inapokanzwa dioksidi ya sulfuri na oksijeni pamoja, na mmenyuko ni ex
\[\ce{2SO2}(g)+\ce{O2}(g)⟶\ce{2SO3}(g) \hspace{20px} ΔH°=\mathrm{−197.8\:kJ} \nonumber \]
Dioksidi ya sulfuri ni gesi kwenye joto la kawaida, na molekuli ya SO 2 imepigwa. Trioxide ya sulfuri huyeyuka saa 17 °C na majipu saa 43 °C Katika hali ya mvuke, molekuli zake ni moja SO 3 vitengo (Kielelezo\(\PageIndex{7}\)), lakini katika hali imara, SO 3 ipo katika aina kadhaa za polymeric.
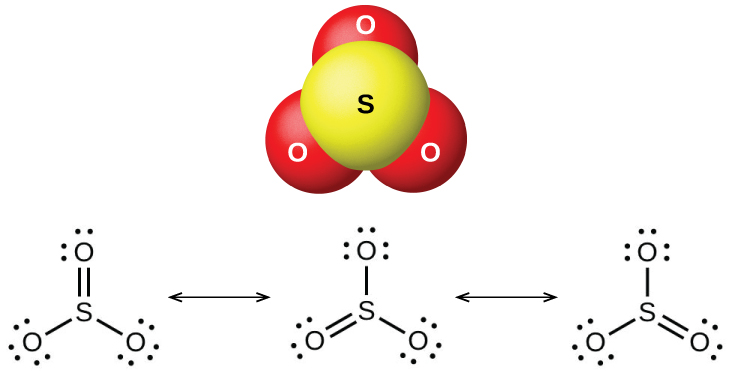
Oksidi za sulfuri huguswa kama asidi ya Lewis yenye oksidi nyingi na hidroksidi katika athari za asidi-msingi za Lewis, huku uundaji wa sulfiti au sulfiti za hidrojeni, na sulfati au sulfati za hidrojeni, mtawalia.
Halogen oksijeni misombo
Halojeni hazipatikani moja kwa moja na oksijeni, lakini inawezekana kuandaa misombo ya oksijeni-halogen ya binary na athari za halojeni na misombo yenye oksijeni. Misombo ya oksijeni na klorini, bromini, na iodini ni oksidi kwa sababu oksijeni ni kipengele cha electronegative zaidi katika misombo hii. Kwa upande mwingine, misombo ya fluorini na oksijeni ni fluoridi kwa sababu fluorini ni kipengele cha electronegative zaidi.
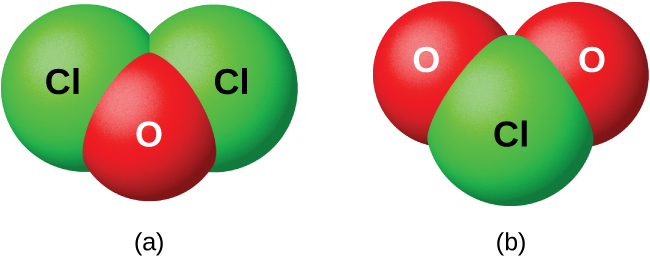
Kama darasa, oksidi ni tendaji sana na imara, na kemia yao haina umuhimu mdogo wa vitendo. Oxide ya dichlorine, inayoitwa rasmi monoxide ya dichlorine, na dioksidi ya klorini, wote inavyoonekana katika Kielelezo\(\PageIndex{8}\), ni misombo tu muhimu ya kibiashara. Wao ni muhimu kama mawakala wa blekning (kwa matumizi na massa na unga) na kwa ajili ya matibabu ya maji.
Nonmetal Oxyacids na chumvi zao
Oksidi zisizo za metali huunda asidi wakati wa kuruhusiwa kuitikia na maji; hizi ni anhydrides asidi. Oxyanions kusababisha inaweza kuunda chumvi na ions mbalimbali za chuma.
Nitrojeni Oxyacids na chumvi
Pentaoxide ya nitrojeni, N 2 O 5, na NO 2 huguswa na maji ili kuunda asidi ya nitriki, HNO 3. Alchemists, mapema karne ya nane, walijua asidi ya nitriki (inavyoonekana kwenye Kielelezo\(\PageIndex{9}\)) kama aqua fortis (maana ya “maji yenye nguvu”). Asidi ilikuwa muhimu katika kujitenga dhahabu na fedha kwa sababu inafuta fedha lakini si dhahabu. Maelekezo ya asidi ya nitriki hutokea katika anga baada ya mvua, na chumvi zake zinashirikiwa sana katika asili. Kuna amana kubwa ya chumvi ya Chile, NaNano 3, katika kanda ya jangwa karibu na mipaka ya Chile na Peru. Chumvi ya Bengal, KNO 3, hutokea India na katika nchi nyingine za Mashariki ya Mbali.
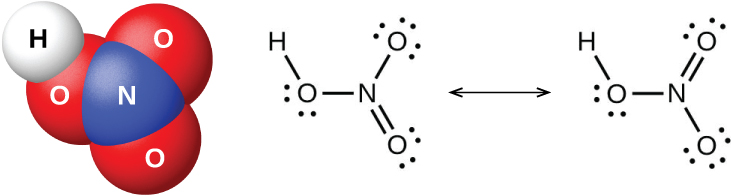
Katika maabara, inawezekana kuzalisha asidi ya nitriki kwa kupokanzwa chumvi ya nitrati (kama vile nitrati ya sodiamu au potasiamu) na asidi iliyojilimbikizia sulfuriki:
\[\ce{NaNO3}(s)+\ce{H2SO4}(l)\xrightarrow{Δ}\ce{NaHSO4}(s)+\ce{HNO3}(g) \nonumber \]
Mchakato wa O stwald ni njia ya kibiashara ya kuzalisha asidi ya nitriki. Utaratibu huu unahusisha oxidation ya amonia kwa oksidi nitriki, NO; oxidation ya oksidi nitriki kwa dioksidi nitrojeni, NO 2; na oxidation zaidi na taratibu ya dioksidi nitrojeni kuunda asidi nitriki:
\[\ce{4NH3}(g)+\ce{5O2}(g)⟶\ce{4NO}(g)+\ce{6H2O}(g) \nonumber \]
\[\ce{2NO}(g)+\ce{O2}(g)⟶\ce{2NO2}(g) \nonumber \]
\[\ce{3NO2}(g)+\ce{H2O}(l)⟶\ce{2HNO3}(aq)+\ce{NO}(g) \nonumber \]
au
\[\ce{4NO2}(g)+\ce{O2}(g)+\ce{2H2O}(g)⟶\ce{4HNO3}(l) \nonumber \]
Asidi safi ya nitriki ni kioevu isiyo rangi. Hata hivyo, mara nyingi huwa njano au kahawia kwa rangi kwa sababu NO 2 huunda kama asidi hutengana. Asidi ya nitriki imara katika suluhisho la maji; ufumbuzi ulio na 68% ya asidi hupatikana kwa kibiashara asidi ya nitriki iliyojilimbikizia. Ni wakala wa oxidizing wenye nguvu na asidi kali.
Kazi ya asidi ya nitriki kwenye chuma mara chache hutoa H 2 (kwa kupunguza H +) kwa zaidi ya kiasi kidogo. Badala yake, kupunguza nitrojeni hutokea. Bidhaa zilizoundwa hutegemea ukolezi wa asidi, shughuli za chuma, na joto. Kwa kawaida, mchanganyiko wa nitrati, oksidi za nitrojeni, na aina mbalimbali za kupunguza fomu. Chini kazi metali kama vile shaba, fedha, na risasi kupunguza kujilimbikizia nitriki asidi hasa kwa nitrojeni dioksidi. Majibu ya asidi ya nitriki ya kuondokana na shaba hutoa NO. Katika kila kesi, chumvi za nitrati za metali huangaza juu ya uvukizi wa ufumbuzi wa matokeo.
Vipengele vya nonmetallic, kama vile sulfuri, kaboni, iodini, na fosforasi, hupata oxidation na asidi iliyojilimbikizia nitriki kwa oksidi zao au oxyacids, na kuundwa kwa NO 2:
\[\ce{S}(s)+\ce{6HNO3}(aq)⟶\ce{H2SO4}(aq)+\ce{6NO2}(g)+\ce{2H2O}(l) \nonumber \]
\[\ce{C}(s)+\ce{4HNO3}(aq)⟶\ce{CO2}(g)+\ce{4NO2}(g)+\ce{2H2O}(l) \nonumber \]
Asidi ya nitriki huchochea misombo mingi; kwa mfano, asidi ya nitriki iliyojilimbikizia kwa urahisi huchanganya asidi hidrokloriki kwa klorini na di Mchanganyiko wa sehemu moja iliyojilimbikizia asidi ya nitriki na sehemu tatu zilizojilimbikizia asidi hidrokloriki (inayoitwa aqua regia, ambayo ina maana ya maji ya kifalme) humenyuka Mchanganyiko huu ni muhimu hasa katika kufuta dhahabu, platinamu, na metali nyingine ambazo ni vigumu zaidi kuzidisha kuliko hidrojeni. Equation kilichorahisishwa kuwakilisha hatua ya aqua regia juu ya dhahabu ni:
\[\ce{Au}(s)+\ce{4HCl}(aq)+\ce{3HNO3}(aq)⟶\ce{HAuCl4}(aq)+\ce{3NO2}(g)+\ce{3H2O}(l) \nonumber \]
Video\(\PageIndex{1}\): Ingawa dhahabu kwa ujumla haifai, unaweza kutazama video ya mchanganyiko tata wa misombo iliyopo katika aqua regia kuifuta ndani ya suluhisho.
Nitrati, chumvi za asidi ya nitriki, huunda wakati metali, oksidi, hidroksidi, au kabonati huguswa na asidi ya nitriki. Nitrati nyingi ni mumunyifu katika maji; hakika, moja ya matumizi muhimu ya asidi nitriki ni kuandaa nitrati za chuma za mumunyifu.
Asidi ya nitriki hupata matumizi makubwa katika maabara na katika viwanda vya kemikali kama asidi kali na wakala wenye nguvu wa oksidi. Ni muhimu katika utengenezaji wa mabomu, rangi, plastiki, na madawa ya kulevya. Salts ya asidi nitriki (nitrati) ni muhimu kama mbolea. Baruti ni mchanganyiko wa nitrati ya potasiamu, sulfuri, na mkaa.
Majibu ya N 2 O 3 na maji hutoa ufumbuzi wa rangi ya bluu ya asidi ya nitrous, HNO 2. Hata hivyo, HNO 2 (inavyoonekana katika Kielelezo\(\PageIndex{10}\)) ni rahisi kujiandaa kwa kuongeza asidi kwa suluhisho la nitriti; asidi ya nitrous ni asidi dhaifu, hivyo ion ya nitriti ni msingi katika suluhisho la maji:
\[\ce{NO2-}(aq)+\ce{H3O+}(aq)⟶\ce{HNO2}(aq)+\ce{H2O}(l) \nonumber \]
Asidi ya nitrous ni imara sana na ipo tu katika suluhisho. Inapingana polepole kwa joto la kawaida (haraka wakati inapokanzwa) ndani ya asidi ya nitriki na oksidi ya nitriki. Asidi ya nitrous ni wakala wa oxidizing wenye nguvu na mawakala wa kupunguza nguvu, na mawakala wenye nguvu ya oksidi huiongezea asidi ya nitriki.
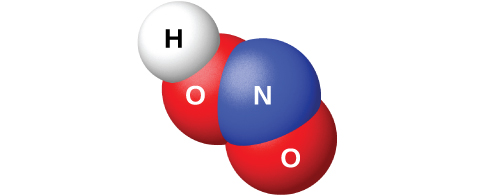
Nitriti ya sodiamu, NaNO 2, ni nyongeza kwa nyama kama vile mbwa za moto na kupunguzwa kwa baridi. Ioni ya nitriti ina kazi mbili. Inapunguza ukuaji wa bakteria ambayo inaweza kusababisha sumu ya chakula, na huongeza uhifadhi wa nyama ya rangi yake nyekundu. Kuongezewa kwa nitriti ya sodiamu kwa bidhaa za nyama ni utata kwa sababu asidi ya nitroasi humenyuka na misombo fulani ya kikaboni ili kuunda darasa la misombo inayojulikana kama nitrosamines. Nitrosamines huzalisha kansa katika wanyama wa maabara. Hii imesababisha FDA kupunguza kiasi cha nano 2 katika vyakula.
Nitrites ni imara zaidi kuliko asidi, lakini nitrites, kama nitrati, inaweza kulipuka. Nitrites, kama nitrati, pia hupumzika katika maji (AgNo 2 ni mumunyifu kidogo tu).
Phosphorus oxyacids na chumvi
Pure orthophosphori asidi, H 3 PO 4 (Kielelezo\(\PageIndex{11}\)), aina colorless, fuwele deliquescent kwamba kuyeyuka katika 42 °C. jina la kawaida ya kiwanja hiki ni asidi fosforasi, na ni kibiashara inapatikana kama KINATACHO 82% ufumbuzi inayojulikana kama syrupy asidi fosforasi. Matumizi moja ya asidi ya fosforasi ni kama nyongeza kwa vinywaji vingi vya laini.
Njia moja ya kibiashara ya kuandaa asidi ya orthophosphori ni kutibu mwamba wa kalsiamu phosphate na asidi iliyojilimbikizia sulfuriki:
\[\ce{Ca3(PO4)2}(s)+\ce{3H2SO4}(aq)⟶\ce{2H3PO4}(aq)+\ce{3CaSO4}(s) \nonumber \]
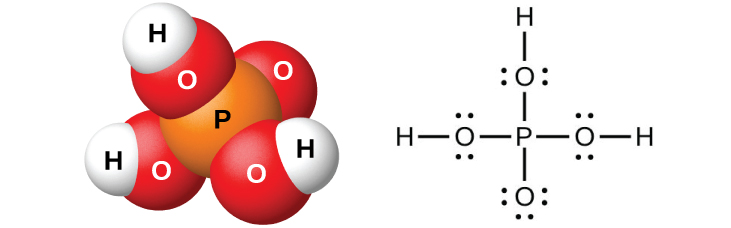
Dilution ya bidhaa na maji, ikifuatiwa na filtration kuondoa calcium sulfate, anatoa ufumbuzi wa asidi diluted machafu na kalsiamu dihidrojeni phosphate, Ca (H 2 PO 4) 2, na misombo mingine yanayohusiana na calcium phosphate mwamba. Inawezekana kuandaa asidi safi ya orthophosphori kwa kufuta P 4 O 10 katika maji.
Kazi ya maji kwenye P 4 O 6, PCL 3, PbR 3, au PI 3 huunda asidi ya fosforasi, H 3 PO 3 (inavyoonekana kwenye Mchoro\(\PageIndex{12}\)). Njia bora ya kuandaa asidi safi ya fosforasi ni kwa hidrolisisi trichloride ya fosforasi:
\[\ce{PCl3}(l)+\ce{3H2O}(l)⟶\ce{H3PO3}(aq)+\ce{3HCl}(g) \nonumber \]
Inapokanzwa suluhisho linalosababisha hufukuza kloridi ya hidrojeni na husababisha uvukizi wa maji. Wakati maji ya kutosha yanapoenea, fuwele nyeupe za asidi ya fosforasi zitaonekana juu ya baridi. Fuwele ni deliquescent, mumunyifu sana katika maji, na kuwa na harufu kama ile ya vitunguu. Mango huyeyuka saa 70.1 °C na hutengana kwa takriban 200 °C kwa kutofautiana kuwa fosfini na asidi ya orthophosphori:
\[\ce{4H3PO3}(l)⟶\ce{PH3}(g)+\ce{3H3PO4}(l) \nonumber \]
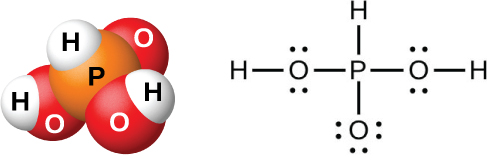
Asidi ya fosforasi huunda mfululizo wa chumvi mbili tu, ambazo zina ion ya phosphite ya dihidrojeni\(\ce{H2PO3-}\), au ion ya phosphate ya hidrojeni\(\ce{HPO3^2-}\), kwa mtiririko huo. Haiwezekani kuchukua nafasi ya atomi ya tatu ya hidrojeni kwa sababu si tindikali sana, kwani si rahisi ionize dhamana ya P-H.
Oxyacids ya sulfuri na chumvi
Maandalizi ya asidi sulfuriki, H 2 SO 4 (Kielelezo\(\PageIndex{13}\)), huanza na oxidation ya sulfuri kwa trioxide ya sulfuri na kisha kugeuza trioxide kwa asidi sulfuriki. Asidi sulfuriki safi ni kiowevu chenye rangi isiyo na rangi, kiowevu cha mafuta kinachofungia saa 10.5 °C Ni mafusho inapokanzwa kwa sababu asidi hutengana na maji na trioksidi ya sulfuri. Mchakato wa joto husababisha kupoteza trioxide zaidi ya sulfuri kuliko maji, mpaka kufikia mkusanyiko wa asidi 98.33%. Asidi ya mkusanyiko huu huchemka saa 338 °C bila mabadiliko zaidi katika mkusanyiko (suluhisho la kuchemsha mara kwa mara) na hujilimbikizia kibiashara H 2 SO 4. Kiasi cha asidi ya sulfuriki inayotumiwa katika sekta huzidi ile ya kiwanja kingine chochote cha viwandani.
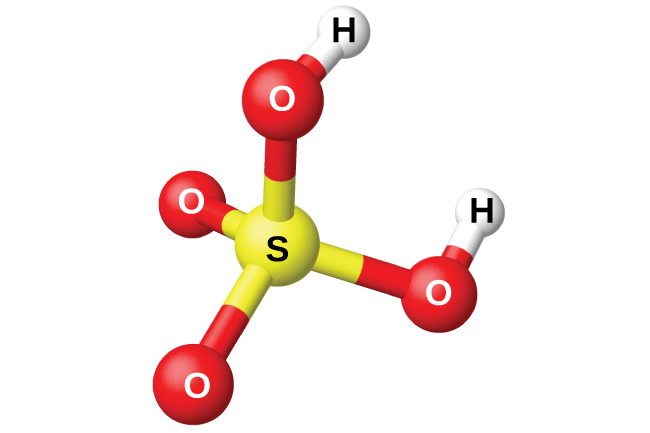
Mshikamano mkubwa wa asidi ya sulfuriki iliyojilimbikizia kwa maji hufanya kuwa wakala mzuri wa maji. Inawezekana kukausha gesi na vinywaji visivyoweza kutumiwa na asidi kwa kupitisha kupitia asidi.
Asidi ya sulfuriki ni asidi kali ya diprotic ambayo ionizes katika hatua mbili. Katika suluhisho la maji, hatua ya kwanza imekamilika. Ionization ya sekondari sio karibu sana, na\(\ce{HSO4-}\) ni asidi yenye nguvu (karibu 25% ionized katika suluhisho la\(\ce{HSO4-}\) chumvi: K = 1.2 × 10 -1 -2).
Kuwa asidi ya diprotic, asidi sulfuriki huunda sulfates zote mbili, kama vile Na 2 SO 4, na sulfates za hidrojeni, kama vile NaHSO 4. Sulfates nyingi ni mumunyifu katika maji; hata hivyo, sulfates ya bariamu, strontium, calcium, na risasi ni kidogo tu mumunyifu katika maji.
Miongoni mwa sulfates muhimu ni Na 2 SO 4 10H 2 O na Epsom chumvi, MgSO 4 7H 2 O. sababu\(\ce{HSO4-}\) ion ni asidi, sulfates hidrojeni, kama vile NaHSO 4, maonyesho tabia tindikali, na kiwanja hiki ni kiungo msingi katika baadhi watakaso wa kaya.
Moto, asidi ya sulfuriki iliyojilimbikizia ni wakala wa oxidizing. Kulingana na mkusanyiko wake, joto, na nguvu ya wakala wa kupunguza, asidi sulfuriki huoksidisha misombo mingi na, katika mchakato, hupungua kwa SO 2,\(\ce{HSO3-}\),\(\ce{SO3^2-}\), S, H 2 S, au S 2-.
Dioksidi ya sulfuri hupasuka katika maji ili kuunda suluhisho la asidi ya sulfurous, kama inavyotarajiwa kwa oksidi ya nonmetal. Asidi ya sulfurous ni imara, na haiwezekani kutenganisha anhydrous H 2 SO 3. Inapokanzwa suluhisho la asidi ya sulfurous hufukuza dioksidi ya sulfuri. Kama asidi nyingine za diprotic, asidi ya sulfuri ionizes katika hatua mbili: Ioni ya sulfite ya hidrojeni\(\ce{HSO3-}\),, na ion ya sulfite\(\ce{SO3^2-}\), fomu. Asidi ya sulfurous ni asidi yenye nguvu sana. Ionization ni karibu 25% katika hatua ya kwanza, lakini ni kidogo sana katika pili (K a1 = 1.2 × 10 -2 na K a2 = 6.2 × 10 -8).
Ili kuandaa sulfite imara na chumvi za sulfite hidrojeni, ni muhimu kuongeza kiasi cha stoichiometric cha msingi kwa suluhisho la asidi sulfurous na kisha kuenea maji. Chumvi hizi pia huunda kutokana na mmenyuko wa SO 2 na oksidi na hidroksidi. Inapokanzwa sulfite ya hidrojeni imara ya sodiamu sulfite, dioksidi sulfuri, na maji:
\[\ce{2NaHSO3}(s)\xrightarrow{Δ}\ce{Na2SO3}(s)+\ce{SO2}(g)+\ce{H2O}(l) \nonumber \]
Wakala wa oxidizing wenye nguvu wanaweza kuimarisha asidi ya sulfurous. Oksijeni katika hewa huiweka oxidizes polepole kwa asidi sulfuriki imara zaidi:
\[\ce{2H2SO3}(aq)+\ce{O2}(g)+\ce{2H2O}(l)\xrightarrow{Δ}\ce{2H3O+}(aq)+\ce{2HSO4-}(aq) \nonumber \]
Ufumbuzi wa sulfites pia huathiriwa na oxidation ya hewa ili kuzalisha sulfates. Hivyo, ufumbuzi wa sulfites daima una sulfates baada ya kufidhiliwa na hewa.
Oxyacids ya Halogen na Salts zao
Misombo ya HXO, HXO 2, HXO 3, na HXO 4, ambapo X inawakilisha Cl, Br, au I, ni hypohalous, halous, halic, na asidi perhalic, kwa mtiririko huo. Nguvu za asidi hizi huongezeka kutoka kwa asidi ya hypohalous, ambayo ni asidi dhaifu sana, kwa asidi ya perhalic, ambayo ni kali sana. Jedwali\(\PageIndex{1}\) linaorodhesha asidi inayojulikana, na, ambapo inajulikana, PK yao maadili hutolewa katika mabano.
| Jina | fluorini | klorini | Bromini | Iodini |
|---|---|---|---|---|
| isiyojali | HOF | HoCl (7.5) | Hobr (8.7) | HOI (11) |
| halous | Clo (2 2.0) | |||
| hali ya hewa | chlo 3 | bro 3 | HIO (30.8) | |
| ya pembeni | chlo 4 | bro 4 | HIO 4 (1.6) | |
| paraperhalic | H 5 IO 6 (1.6) |
Oxyacid inayojulikana tu ya fluorine ni asidi isiyo na uhakika sana ya hypofluorous, HOF, ambayo huandaliwa na mmenyuko wa fluorine ya gesi na barafu:
\[\ce{F2}(g)+\ce{H2O}(s)⟶\ce{HOF}(g)+\ce{HF}(g) \nonumber \]
Kiwanja hiki hakina imara sana na hutengana juu ya -40 °C kiwanja hiki hakioni ndani ya maji, na hakuna chumvi zinazojulikana. Ni uhakika kama jina hypofluorous asidi ni hata sahihi kwa HOF; jina sahihi zaidi huenda hidrojeni hypofluorite.
Athari za klorini na bromini na maji ni sawa na ile ya fluorini na barafu, lakini athari hizi haziendi kukamilika, na mchanganyiko wa halogen na matokeo ya asidi ya hypohalous na hydrohalic. Nyingine isipokuwa HOF, asidi hypohalous zipo tu katika suluhisho. Asidi ya hypohalous ni asidi dhaifu sana; hata hivyo, HoCl ni asidi yenye nguvu kuliko HOBR, ambayo, kwa upande wake, ina nguvu kuliko HOI.
Kuongezea msingi kwa ufumbuzi wa asidi hypohalous hutoa ufumbuzi wa chumvi zilizo na ions za msingi za hypohalite, OX -. Inawezekana kutenganisha chumvi hizi kama solidi. Hypohalites yote ni imara kwa heshima na kutofautiana katika suluhisho, lakini mmenyuko ni polepole kwa hypochlorite. Hypobromite na hypoiodite hazipatikani haraka, hata katika baridi:
\[\ce{3XO-}(aq)⟶\ce{2X-}(aq)+\ce{XO3-}(aq) \nonumber \]
Hypochlorite ya sodiamu ni bleach isiyo na gharama kubwa (Clorox) na germicide. Maandalizi ya kibiashara yanahusisha electrolysis ya baridi, kuondokana, ufumbuzi wa kloridi ya sodiamu yenye maji chini ya hali ambapo klorini inayosababisha na hidroksidi ion inaweza kuguswa Mmenyuko wavu ni:
\[\ce{Cl-}(aq)+\ce{H2O}(l)\xrightarrow{\ce{electrical\: energy}}\ce{ClO-}(aq)+\ce{H2}(g) \nonumber \]
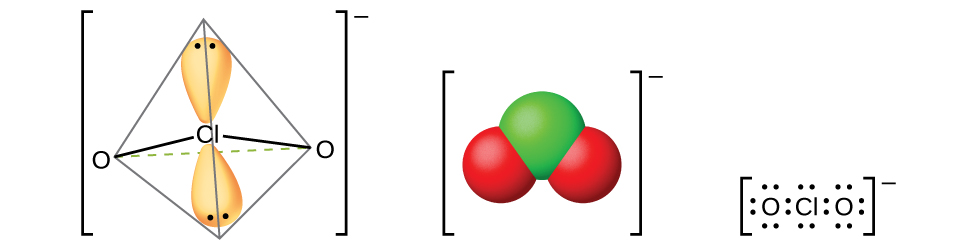
Asidi ya halous inayojulikana tu ni asidi ya klorini, HclO 2, iliyopatikana kwa mmenyuko wa kloriti ya bariamu na asidi ya sulfuriki iliyopunguza:
\[\ce{Ba(ClO2)2}(aq)+\ce{H2SO4}(aq)⟶\ce{BaSO4}(s)+\ce{2HClO2}(aq) \nonumber \]
Kuchuja sulfate ya bariamu isiyosababishwa huacha suluhisho la HClo 2. Asidi ya klorini si imara; hupungua polepole katika suluhisho la kuzalisha klorini dioksidi, asidi hidrokloriki, na maji. Asidi ya chlorous humenyuka na besi ili kutoa chumvi zilizo na ion ya kloriti (inavyoonekana kwenye Mchoro\(\PageIndex{14}\)). Kloriti ya sodiamu hupata matumizi makubwa katika blekning ya karatasi kwa sababu ni wakala wa oxidizing wenye nguvu na haina kuharibu karatasi.
Asidi ya kloriki, ChLo 3, na asidi ya bromic, HBro 3, ni imara tu katika suluhisho. Mmenyuko wa iodini na asidi ya nitriki iliyojilimbikizia hutoa asidi nyeupe iodic asidi, HIO 3:
\[\ce{I2}(s)+\ce{10HNO3}(aq)⟶\ce{2HIO3}(s)+\ce{10NO2}(g)+\ce{4H2O}(l) \nonumber \]
Inawezekana kupata asidi nyepesi ya asidi kutoka kwa chumvi zao za bariamu kwa mmenyuko na asidi ya sulfuriki ya kuondokana. Mmenyuko huo ni sawa na ule uliotumiwa kuandaa asidi ya kloroni. Asidi zote za halic ni asidi kali na mawakala wa oxidizing sana. Asidi huguswa na besi ili kuunda chumvi zilizo na ions za kloreti (inavyoonekana kwenye Mchoro\(\PageIndex{15}\)). Njia nyingine ya maandalizi ni oxidation ya electrochemical ya suluhisho la moto la halide ya chuma ili kuunda chlorates za chuma zinazofaa. Chlorate ya sodiamu ni muuaji wa magugu; kloreti ya potasiamu hutumiwa kama wakala wa oksidi.
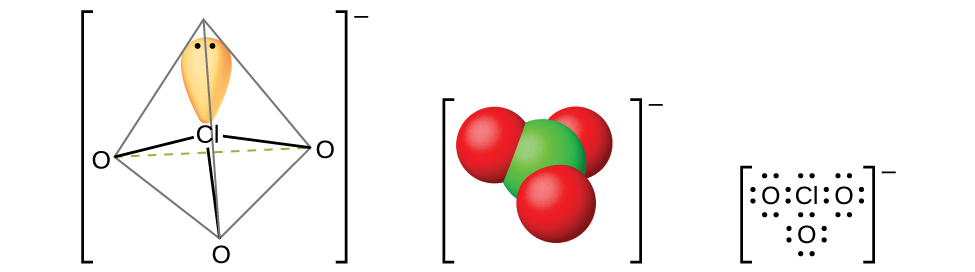
Asidi ya perchloric, HclO 4, huunda wakati wa kutibu perchlorate, kama perchlorate ya potasiamu, na asidi sulfuriki chini ya shinikizo la kupunguzwa. ChClo 4 inaweza kufutwa kutoka mchanganyiko:
\[\ce{KClO4}(s)+\ce{H2SO4}(aq)⟶\ce{HClO4}(g)+\ce{KHSO4}(s) \nonumber \]
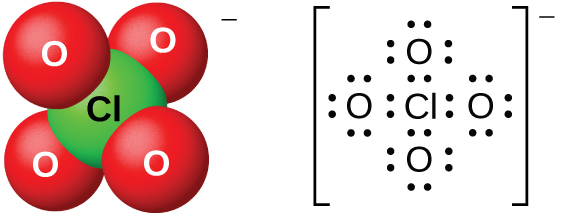
Punguza ufumbuzi wa maji ya asidi ya perchloric ni imara kabisa thermally, lakini viwango vya juu ya 60% ni imara na hatari. Asidi ya perchloric na chumvi zake ni mawakala wenye nguvu za oksidi, kama klorini ya electronegative imara zaidi katika hali ya chini ya oxidation kuliko 7+. Milipuko mikubwa imetokea wakati inapokanzwa ufumbuzi wa kujilimbikizia na vitu vyenye oksidi Hata hivyo, athari zake kama wakala oxidizing ni polepole wakati asidi perchloric ni baridi na kuondokana. Asidi ni kati ya nguvu zaidi ya asidi zote. Chumvi nyingi zilizo na ion ya perchlorate (Kielelezo\(\PageIndex{16}\)) ni mumunyifu. Inawezekana kuwaandaa kutokana na athari za besi na asidi ya perchloric na, kibiashara, na electrolysis ya ufumbuzi wa moto wa kloridi zao.
Chumvi za perbromate ni vigumu kujiandaa, na syntheses bora sasa inahusisha oxidation ya bromates katika suluhisho la msingi na gesi ya fluorini ikifuatiwa na acidification. Kuna wachache, ikiwa ni yoyote, matumizi ya kibiashara ya asidi hii au chumvi zake.
Kuna asidi mbalimbali zilizo na iodini katika hali ya 7+-oxidation; zinajumuisha asidi ya metaperiodic, HIO 4, na asidi ya paraperiodic, H 5 IO 6. Asidi hizi ni mawakala wenye nguvu za oksidi na huguswa na besi ili kuunda chumvi zinazofaa.
Muhtasari
Oksijeni ni moja ya vipengele vya tendaji zaidi. Reactivity hii, pamoja na wingi wake, hufanya kemia ya oksijeni tajiri sana na inaeleweka vizuri. Misombo ya metali ya mwakilishi na oksijeni iko katika makundi matatu (1) oksidi, (2) peroxides na superoxides, na (3) hidroksidi. Inapokanzwa hidroksidi zinazofanana, nitrati, au kabonati ni njia ya kawaida ya kuzalisha oksidi. Inapokanzwa chuma au oksidi ya chuma katika oksijeni inaweza kusababisha kuundwa kwa peroxides na superoxides. Oksidi za mumunyifu hupasuka katika maji ili kuunda ufumbuzi wa hidroksidi. Wengi wa oksidi za metali ni anhydrides ya msingi na huguswa na asidi. Hidroksidi za metali za mwakilishi huguswa na asidi katika athari za asidi-msingi ili kuunda chumvi na maji. Hidroksidi zina matumizi mengi ya kibiashara.
Nonmetali zote isipokuwa fluorini huunda oksidi nyingi. Karibu wote wa oksidi nonmetal ni anhydrides asidi. Asidi ya oxyacids inahitaji atomi za hidrojeni ziunganishwe na atomi za oksijeni katika molekuli badala ya atomu nyingine zisizo za metali. Kwa ujumla, nguvu ya oxyacid huongezeka na idadi ya atomi za oksijeni zilizounganishwa na atomi isiyo ya metali na si kwa hidrojeni.
faharasa
- anhidridi ya msingi
- chuma oxide kwamba tabia kama msingi kuelekea asidi
- mchakato wa klori-alkali
- mchakato wa electrolysis kwa ajili ya awali ya klorini na hidroksidi ya
- sulfate ya hid
- \(\ce{HSO4-}\)ioni
- sulfite hidrojeni
- \(\ce{HSO3-}\)ioni
- hydroxide
- kiwanja cha chuma na ion ya hidroksidi OH - au kikundi -OH
- nitreti
- \(\ce{NO3-}\)ion; chumvi ya asidi ya nitriki
- Mchakato wa Ostwald
- mchakato wa viwanda kutumika kubadili amonia katika asidi nitriki
- oksidi
- binary kiwanja cha oksijeni na kipengele kingine au kikundi, kwa kawaida zenye O 2- ions au kundi -O— au =O
- ozoni
- allotrope ya oksijeni; O 3
- peroksidi
- molekuli zenye atomi oksijeni mbili Bonded pamoja au kama anion,\(\ce{O2^2-}\)
- usanidimwanga
- mchakato ambapo nishati ya mwanga inakuza mmenyuko wa maji na dioksidi kaboni kuunda wanga na oksijeni; hii inaruhusu viumbe vya photosynthetic kuhifadhi nishati
- sulfate
- \(\ce{SO4^2-}\)ioni
- sulfiti
- \(\ce{SO3^2-}\)ioni
- superoxide
- oksidi iliyo na anion\(\ce{O2-}\)


