17.7: Electrolysis
- Page ID
- 176021
- Eleza seli za electrolytic na uhusiano wao na seli za galvanic
- Kufanya mahesabu mbalimbali kuhusiana na electrolysis
Katika seli za galvanic, nishati ya kemikali inabadilishwa kuwa nishati ya umeme. Kinyume chake ni kweli kwa seli za electrolytic. Katika seli za electrolytic, nishati ya umeme husababisha athari zisizo za kawaida kutokea katika mchakato unaojulikana kama electrolysis. Betri ya umeme ya malipo inaonyesha mchakato mmoja kama huo. Nishati ya umeme inabadilishwa kuwa nishati ya kemikali katika betri kama inavyoshtakiwa. Mara baada ya kushtakiwa, betri inaweza kutumika kuimarisha gari. Kanuni hizo zinahusika katika seli za electrolytic kama katika seli za galvanic. Tutaangalia seli tatu za electrolytic na mambo ya kiasi cha electrolysis.
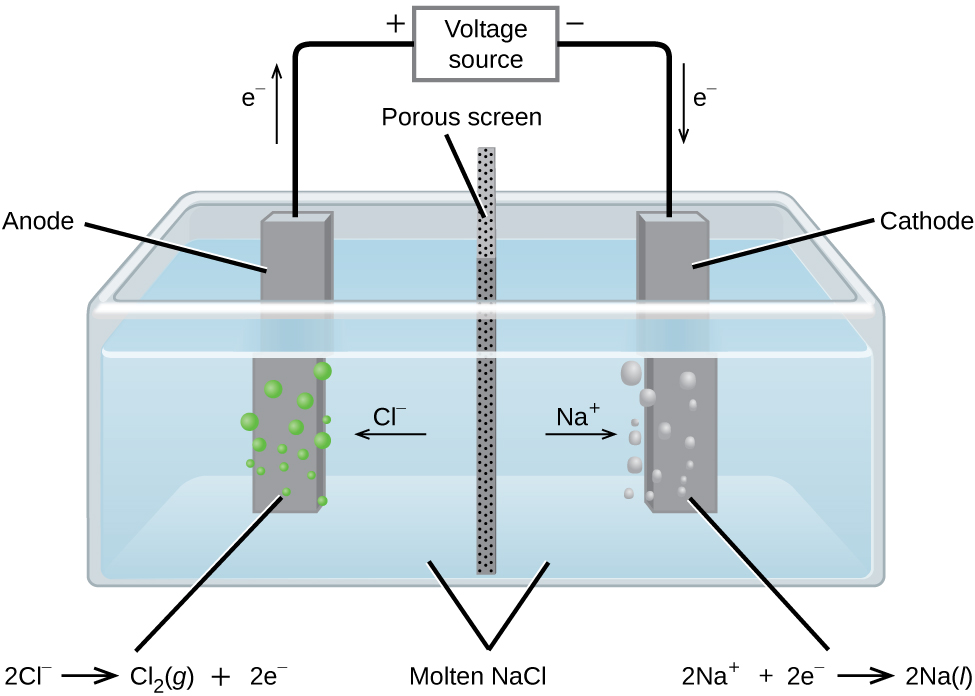
Electrolysis ya Kloridi ya Sodiamu iliyoyeyushwa
Katika kloridi ya sodiamu iliyosafishwa, ions ni huru kuhamia kwenye electrodes ya seli ya electrolytic. Mchoro rahisi wa kiini kibiashara kutumika kuzalisha chuma sodiamu na klorini gesi ni inavyoonekana katika Kielelezo\(\PageIndex{1}\). Sodiamu ni wakala wa kupunguza nguvu na klorini hutumiwa kutakasa maji, na hutumiwa katika antiseptics na katika uzalishaji wa karatasi. Athari ni
\ [kuanza {align}
&\ textrm {anode:}\ ce {2Cl-} (l)\ ce {Cl2} (g) +\ ce {2e-}\ nafasi {20px} E^\ mduara {\ ce {Cl2/Cl-}} =\ hesabu {+1.3\
: V}\\ maandishi {cathode:}\ ce {Na+} (l) +\ ce {e-}\ ce {Na} (l)\ nafasi {20px} E^\ circ_ {\ ce {Na+/Na}} =\ hesabu {-2.7\: V}\\
&\ overline {\ maandishi {jumla :}\ ce {2Na+} (l) +\ ce {2Cl-} (l)\ ce {2Na} (l) +\ ce {Cl2} (g)\ hnafasi {20px} E^\ circ_\ ce {kiini} =\ hesabu {-4.0\: V}}
\ mwisho {align}\ namba\]
Nguvu (betri) inapaswa kutoa kiwango cha chini cha 4 V, lakini, kwa mazoezi, voltages zilizowekwa ni za juu kwa sababu ya kutofautiana katika mchakato yenyewe.
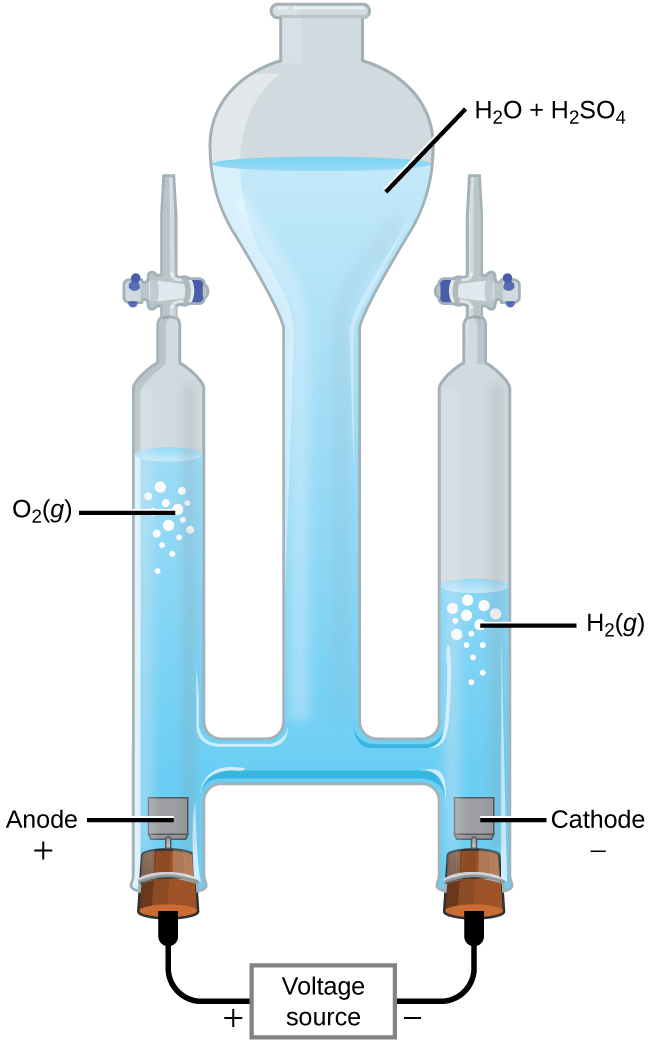
Electrolysis ya Maji
Inawezekana kugawanya maji katika gesi ya hidrojeni na oksijeni kwa electrolysis. Acids ni kawaida aliongeza kuongeza mkusanyiko wa ion hidrojeni katika ufumbuzi (Kielelezo\(\PageIndex{2}\)). Athari ni
\ [kuanza {align}
&\ textrm {anode:}\ ce {2H2O} (l)\ ce {O2} (g) +\ ce {4H +} (aq) +\ ce {4e-}\ nafasi {20px} E^\ mduara\ ce {anode} =\ hesabu {+1.229\: V}\\
&\ texture m {cathode:}\ ce {2H +} (aq) +\ ce {2e-}\ ce {H2} (g)\ nafasi {20px} E^\ mduara\ ce {cathode} =\ hesabu {0\: V}\\
&\ overline {\ textrm { jumla:}\ ce {2H2O} (l)\ ce {2H2} (g) +\ ce {O2} (g)\ h {O2} (g)\ hnafasi {20px} E^\ circ_\ ce {kiini} =\ hesabu {-1.229\: V}}
\ mwisho {align}\ namba\]
Kumbuka kuwa asidi ya sulfuriki haitumiwi na kwamba kiasi cha gesi ya hidrojeni zinazozalishwa ni mara mbili kiasi cha gesi ya oksijeni zinazozalishwa. Voltage ya chini ya kutumika ni 1.229 V.
Electrolysis ya Kloridi ya Sodiamu yenye maji
Electrolisisi ya kloridi yenye maji ya sodiamu ni mfano wa kawaida zaidi wa electrolysis kwa sababu zaidi ya spishi moja zinaweza kuwa na vioksidishaji na kupunguzwa. Kuzingatia anode kwanza, athari iwezekanavyo ni
\ [kuanza {align}
&\ textrm {(i)}\ ce {2Cl-} (q)\ ce {Cl2} (g) +\ ce {2e-}\ nafasi {20px} E^\ mduara\ ce {anode} =\ hisabati {+1.35827\: V}\
&\ maandishi {(ii)}\ ce 2H2O} (l)\ ce {O2} (g) +\ ce {4H +} (q) +\ ce {4e-}\ nafasi {20px} E^\ mduara\ ce {anode} =\ hesabu {+1.229\: V}
\ mwisho {align}\ namba\]
Maadili haya yanaonyesha kwamba maji yanapaswa kuwa iliyooksidishwa kwenye anode kwa sababu uwezo mdogo utahitajika-kutumia mmenyuko (ii) kwa oxidation ingeweza kutoa uwezo mdogo wa seli. Wakati jaribio linaendeshwa, linageuka klorini, si oksijeni, huzalishwa kwenye anode. Mchakato usiyotarajiwa ni wa kawaida katika electrochemistry kwamba umepewa jina la overpotential. Overpotential ni tofauti kati ya voltage ya kiini ya kinadharia na voltage halisi ambayo ni muhimu kusababisha electrolysis. Inageuka kuwa overpotential kwa oksijeni ni ya juu na kwa ufanisi hufanya uwezekano wa kupunguza zaidi chanya. Matokeo yake, chini ya hali ya kawaida, gesi ya klorini ni nini kinachounda kwenye anode.
Sasa fikiria cathode. Kupunguza tatu kunaweza kutokea:
\ [kuanza {align}
&\ textrm {(iii)}\ ce {2H +} (q) +\ ce {2e-}\ ce {H2} (g)\ nafasi {20px} E^\ circ_\ ce {cathode} =\ hesabu {0\: V}\\
&\ textrm {(iv)}\ ce {2H2O} (l) +\ ce {2e-}\ ce {H2} (g) +\ ce {2OH-} (aq)\ nafasi {20px} E^\ mduara\\ ce {cathode} =\ hesabu {-0.8277\ V}\\
&\ maandishi {(v)}\ ce {Na+ } (aq) +\ ce {e-}\ ce {Na} (s)\ hnafasi {20px} E^\ circ_\ ce {cathode} =\ hesabu {-2.71\: V}
\ mwisho {align}\ nonumber\]
Mmenyuko (v) huhukumiwa nje kwa sababu ina uwezo wa kupunguza hasi. Chini ya hali ya hali ya kawaida, mmenyuko (iii) ungependekezwa kwa majibu (iv). Hata hivyo, pH ya suluhisho la kloridi ya sodiamu ni 7, hivyo mkusanyiko wa ions hidrojeni ni 1× 10 -7 M tu. Katika viwango vya chini vile, mmenyuko (iii) hauwezekani na majibu (iv) hutokea. Majibu ya jumla ni basi
\[\textrm{overall: }\ce{2H2O}(l)+\ce{2Cl-}(aq)⟶\ce{H2}(g)+\ce{Cl2}(g)+\ce{2OH-}(aq) \hspace{20px} E^\circ_\ce{cell}=\mathrm{−2.186\: V} \nonumber \]
Kama majibu yanavyoendelea, ions hidroksidi hubadilisha ions kloridi katika suluhisho. Hivyo, hidroksidi ya sodiamu inaweza kupatikana kwa kuhama maji baada ya electrolysis kukamilika. Hidroksidi ya sodiamu ni ya thamani kwa haki yake mwenyewe na hutumiwa kwa vitu kama kusafisha tanuri, kopo ya kukimbia, na katika uzalishaji wa karatasi, vitambaa, na sabuni.
Electroplating
Matumizi muhimu kwa seli za electrolytic ni katika electroplating. Electroplating matokeo katika mipako nyembamba ya chuma moja juu ya uso conductive. Sababu za electroplating ni pamoja na kufanya kitu zaidi sugu kutu, kuimarisha uso, kuzalisha kumaliza zaidi ya kuvutia, au kwa ajili ya kutakasa chuma. Metali zinazotumiwa kwa kawaida katika electroplating ni pamoja na cadmium, chromium, shaba, dhahabu, nikeli, fedha, na bati. Bidhaa za kawaida za walaji ni pamoja na meza ya fedha iliyopambwa au dhahabu-iliyopambwa, sehemu za magari za chrome-plated, na kujitia. Tunaweza kupata wazo la jinsi hii inavyofanya kazi kwa kuchunguza jinsi tableware ya fedha-plated inazalishwa (Kielelezo\(\PageIndex{3}\)).
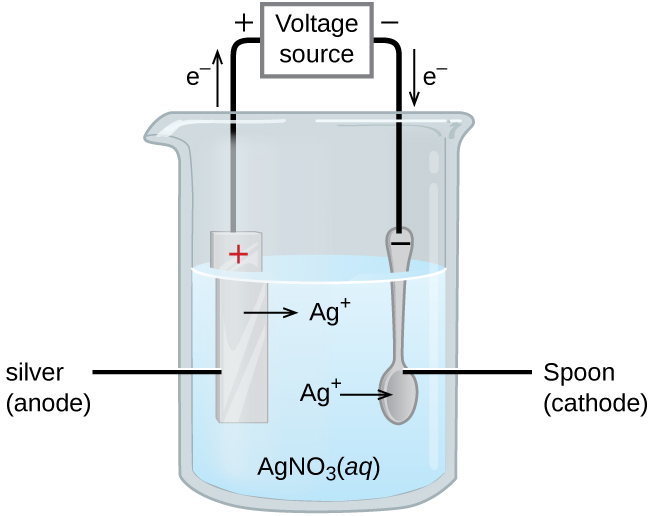
Katika takwimu, anode ina electrode ya fedha, iliyoonyeshwa upande wa kushoto. Cathode iko upande wa kulia na ni kijiko, ambacho kinafanywa kwa chuma cha gharama nafuu. Wote electrodes huingizwa katika suluhisho la nitrati ya fedha. Kama uwezo unaongezeka, mtiririko wa sasa. Chuma cha fedha kinapotea kwenye anode kama inakwenda katika suluhisho.
\[\textrm{anode: }\ce{Ag}(s)⟶\ce{Ag+}(aq)+\ce{e-} \nonumber \]
Uzito wa cathode huongezeka, kama ions za fedha kutoka suluhisho zinawekwa kwenye kijiko.
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s) \nonumber \]
Matokeo halisi ni uhamisho wa chuma cha fedha kutoka kwa anode hadi cathode. Ubora wa kitu ni kawaida kuamua na unene wa fedha zilizowekwa na kiwango cha uhifadhi.
Mambo ya kiasi cha Electrolysis
Kiasi cha sasa ambacho kinaruhusiwa kuingia katika kiini cha electrolytic kinahusiana na idadi ya moles ya elektroni. Idadi ya moles ya elektroni inaweza kuhusiana na reactants na bidhaa kwa kutumia stoichiometry. Kumbuka kwamba kitengo cha SI cha sasa (I) ni ampere (A), ambayo ni sawa na coulomb 1 kwa pili (1 A =\(\mathrm{1\: \dfrac{C}{s}}\)). Malipo ya jumla (Q, katika coulombs) hutolewa na
\[Q=I×t=n×F \nonumber \]
wapi
- Ni wakati katika sekunde,
- n idadi ya moles ya elektroni, na
- F ni mara kwa mara ya Faraday.
Mimea ya elektroni inaweza kutumika katika matatizo ya stoichiometry. Wakati unaotakiwa amana kiasi fulani cha chuma pia inaweza kuombwa, kama ilivyo katika pili ya mifano ifuatayo.
Katika mchakato mmoja uliotumiwa kwa fedha za electroplating, sasa ya 10.23 A ilipitishwa kupitia kiini cha electrolytic kwa saa 1. Ni moles ngapi za elektroni zilizopita kupitia kiini? Ni kiasi gani cha fedha kilichowekwa kwenye cathode kutoka suluhisho la nitrati ya fedha?
Suluhisho
Mara kwa mara ya Faraday inaweza kutumika kubadili chaji (Q) kuwa moles ya elektroni (n). Malipo ni ya sasa (I) imeongezeka kwa wakati
\[n=\dfrac{Q}{F}=\mathrm{\dfrac{\dfrac{10.23\: C}{s}×1\: hr×\dfrac{60\: min}{hr}×\dfrac{60\:s}{min}}{96,485\: C/mol\: e^-}=\dfrac{36,830\: C}{96,485\: C/mol\:e^-}=0.3817\: mol\: e^-} \nonumber \]
Kutoka tatizo, suluhisho lina AgNo 3, hivyo majibu ya cathode inahusisha 1 mole ya elektroni kwa kila mole ya fedha
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s) \nonumber \]
Masi ya atomiki ya fedha ni 107.9 g/mol, hivyo
\[\mathrm{mass\: Ag=0.3817\: mol\: e^-×\dfrac{1\: mol\: Ag}{1\: mol\: e^-}×\dfrac{107.9\: g\: Ag}{1\: mol\: Ag}=41.19\: g\: Ag} \nonumber \]
Angalia jibu lako: Kutoka stoichiometry, mole 1 ya elektroni ingeweza kuzalisha mole 1 ya fedha. Chini ya nusu moja ya mole ya elektroni ilihusika na chini ya nusu ya mole ya fedha ilizalishwa.
Chuma cha alumini kinaweza kufanywa kutoka kwa ions alumini na electrolysis. Je, ni nusu ya mmenyuko katika cathode? Ni umati gani wa chuma cha alumini ungepatikana ikiwa sasa ya 2.50 × 10 3 A ilipita kupitia suluhisho kwa dakika 15.0? Kudhani mavuno ni 100%.
- Jibu
-
\(\ce{Al^3+}(aq)+\ce{3e-}⟶\ce{Al}(s)\); 7.77 mol Al = 210.0 g Al.
Katika maombi moja, safu ya 0.010-mm ya chromium inapaswa kuwekwa kwa sehemu na jumla ya eneo la uso wa 3.3 m 2 kutoka suluhisho la zenye ions za chromium (III). Itachukua muda gani ili kuweka safu ya chromium ikiwa sasa ilikuwa 33.46 A? Uzito wa chromium (chuma) ni 7.19 g/cm 3.
Solution Tatizo hili huleta katika idadi ya mada kufunikwa mapema. Muhtasari wa kile kinachohitajika kufanywa ni:
- Ikiwa malipo ya jumla yanaweza kuamua, muda unaohitajika ni malipo tu yaliyogawanywa na sasa
- Malipo ya jumla yanaweza kupatikana kutoka kwa kiasi cha Cr inahitajika na stoichiometry
- Kiasi cha Cr kinaweza kupatikana kwa kutumia wiani na kiasi Cr kinachohitajika
- Kiasi Cr required ni unene mara eneo
Kutatua katika hatua, na kutunza na vitengo, kiasi cha Cr required ni
\[\mathrm{volume=\left(0.010\: mm×\dfrac{1\: cm}{10\: mm}\right)×\left(3.3\:m^2×\left(\dfrac{10,000\:cm^2}{1\:m^2}\right)\right)=33\: cm^3} \nonumber \]
Sentimita za ujazo zilitumika kwa sababu zinafanana na kitengo cha kiasi kinachotumiwa kwa wiani. Kiasi cha Cr ni basi
\[\mathrm{mass=volume×density=33\cancel{cm^3}×\dfrac{7.19\: g}{\cancel{cm^3}}=237\: g\: Cr} \nonumber \]
\[\mathrm{mol\: Cr=237\: g\: Cr×\dfrac{1\: mol\: Cr}{52.00\: g\: Cr}=4.56\: mol\: Cr} \nonumber \]
Kwa kuwa suluhisho lina ioni za chromium (III), moles 3 za elektroni zinahitajika kwa mole ya Cr. Malipo ya jumla ni basi
\[Q=\mathrm{4.56\: mol\: Cr×\dfrac{3\:mol\: e^-}{1\: mol\: Cr}×\dfrac{96485\: C}{mol\: e^-}=1.32×10^6\:C} \nonumber \]
Wakati unaohitajika ni basi
\[t=\dfrac{Q}{I}=\mathrm{\dfrac{1.32×10^6\:C}{33.46\: C/s}=3.95×10^4\:s=11.0\: hr} \nonumber \]
Angalia jibu lako: Katika tatizo la muda mrefu kama hili, hundi moja huenda haitoshi. Kila moja ya hatua inatoa idadi nzuri, hivyo mambo pengine ni sahihi. Jihadharini na mabadiliko ya kitengo na stoichiometry.
Ni umati gani wa zinki unahitajika kutengeneza juu ya karatasi ya chuma ya 3.00 m × 5.50 m kwa unene wa 0.100 mm ya zinki? Ikiwa zinki hutoka kwa suluhisho la Zn (NO 3) 2 na sasa ni 25.5 A, itachukua muda gani ili kuimarisha juu ya chuma? Uzito wa zinki ni 7.140 g/cm 3.
- Jibu
-
231 g Zn inahitajika dakika 23,000.
Muhtasari
Kutumia umeme kulazimisha mchakato usio wa kawaida kutokea ni electrolysis. Seli za electrolytic ni seli za electrochemical zilizo na uwezo wa seli hasi (maana ya nishati ya bure ya Gibbs), na hivyo ni zisizo za kawaida. Electrolysis inaweza kutokea katika seli electrolytic kwa kuanzisha umeme, ambayo hutoa nishati ya kulazimisha elektroni inapita katika mwelekeo usio wa kawaida. Electrolysis inafanywa katika ufumbuzi, ambao una ions za kutosha hivyo sasa zinaweza kuzunguka. Ikiwa suluhisho lina nyenzo moja tu, kama electrolysis ya kloridi ya sodiamu iliyoyeyuka, ni jambo rahisi kuamua kile kilichooksidishwa na kilichopunguzwa. Katika mifumo ngumu zaidi, kama electrolysis ya kloridi ya sodiamu yenye maji, aina zaidi ya moja inaweza kuwa iliyooksidishwa au kupunguzwa na uwezekano wa kupunguza kiwango hutumiwa kuamua oxidation inayowezekana zaidi (nusu-mmenyuko na uwezo mkubwa wa kupunguza kiwango cha [chanya]) na kupunguza ( nusu-mmenyuko na ndogo [angalau chanya] kiwango kupunguza uwezo). Wakati mwingine athari za nusu zisizotarajiwa hutokea kwa sababu ya overpotential Overpotential ni tofauti kati ya uwezo wa kupunguza nusu-mmenyuko wa kinadharia na voltage halisi inahitajika. Wakati wa sasa, uwezo uliotumiwa lazima uongezwe, na iwezekanavyo kwa mmenyuko tofauti kutokea katika seli ya electrolytic. Malipo ya jumla, Q, ambayo hupita kupitia seli ya electrolytic yanaweza kuonyeshwa kama sasa (I) imeongezeka kwa wakati (Q = It) au kama moles ya elektroni (n) inayoongezeka kwa mara ya Faraday (Q = nF). Mahusiano haya yanaweza kutumika kuamua mambo kama kiasi cha nyenzo zilizotumiwa au zinazozalishwa wakati wa electrolysis, muda gani mmenyuko lazima uendelee, au ni thamani gani ya sasa inahitajika.
Muhtasari
- electrolysis
- mchakato wa kutumia nishati ya umeme ili kusababisha mchakato usio wa kawaida kutokea
- kiini electrolytic
- kiini electrochemical ambayo electrolysis hutumiwa; kiini cha electrochemical na uwezekano wa seli hasi
- kupakaza kwa umeme
- kuweka safu nyembamba ya chuma moja juu ya uso conductive
- uwezo kupita kiasi
- tofauti kati ya uwezo wa kinadharia na uwezo halisi katika kiini electrolytic; voltage “ya ziada” inahitajika kufanya mmenyuko wa electrochemical usio na kawaida kutokea


