15.3: Msawazo pamoja
- Page ID
- 176742
- Eleza mifano ya mifumo inayohusisha usawa wa kemikali mbili (au zaidi)
- Tumia viwango vya reactant na bidhaa kwa mifumo mingi ya usawa
- Linganisha uharibifu na malezi ya electrolyte
Kuna nyakati ambapo mmenyuko mmoja wa usawa hauelezei kwa kutosha mfumo unaojifunza. Wakati mwingine tuna aina zaidi ya moja ya usawa hutokea mara moja (kwa mfano, mmenyuko wa asidi-msingi na mmenyuko wa mvua).
Bahari ni mfano wa pekee wa mfumo wenye ulinganifu mingi, au majimbo mengi ya usawa wa umumunyifu unaofanya kazi wakati huo huo. Dioksidi kaboni katika hewa hupasuka katika maji ya bahari, na kutengeneza asidi kaboni (H 2 CO 3). Asidi ya kaboni kisha ionizes kuunda ions hidrojeni na ions bicarbonate\(\ce{(HCO3- )}\), ambayo inaweza zaidi ionize katika ions zaidi hidrojeni na ions carbonate\(\ce{(CO3^2- )}\):
\[\ce{CO2}(g)⇌\ce{CO2}(aq) \nonumber \]
\[\ce{CO2}(aq)+\ce{H2O}⇌\ce{H2CO3}(aq) \nonumber \]
\[\ce{H2CO3}(aq)⇌\ce{H+}(aq)+\ce{HCO3-}(aq) \nonumber \]
\[\ce{HCO3-}(aq)⇌\ce{H+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
Ya ziada H + ions hufanya maji ya bahari zaidi tindikali. Kuongezeka kwa asidi ya bahari unaweza kuwa na athari mbaya juu ya matumbawe ya kujenga miamba, kwani hawawezi kunyonya calcium carbonate wanahitaji kukua na kudumisha mifupa yao (Kielelezo\(\PageIndex{1}\)). Hii kwa upande huharibu biosystem ya ndani ambayo inategemea afya ya miamba kwa ajili ya kuishi kwake. Ikiwa miamba ya ndani ya kutosha imeathiriwa sawa, kuvuruga kwa maisha ya bahari kunaweza kuonekana duniani kote. Bahari za dunia kwa sasa ziko katikati ya kipindi cha acidification kali, inayoaminika kuwa imeanza katikati ya karne ya kumi na tisa, na ambayo sasa inaharakisha kwa kiwango cha kasi zaidi kuliko mabadiliko yoyote ya pH ya bahari katika miaka milioni 20 iliyopita.

Pata maelezo zaidi kuhusu acidification ya bahari na jinsi unavyoathiri viumbe wengine wa baharini.
Kidogo solidi mumunyifu inayotokana na asidi dhaifu kwa ujumla kufutwa katika asidi kali, isipokuwa bidhaa zao umumunyifu ni ndogo mno. Kwa mfano, tunaweza kufuta CuCo 3, FeS, na Ca 3 (PO 4) 2 katika HCl kwa sababu anions yao ya msingi huguswa ili kuunda asidi dhaifu (H 2 CO 3, H 2 S, na\(\ce{H2PO4-}\)). Kupungua kwa mkusanyiko wa anion husababisha mabadiliko ya viwango vya usawa kwa haki kwa mujibu wa kanuni ya Le Chatelier.

Ya umuhimu hasa kwetu ni kuvunjwa kwa hydroxylapatite, Ca 5 (PO 4) 3 OH, katika asidi. Apatites ni darasa la madini ya kalsiamu phosphate (Kielelezo\(\PageIndex{2}\)); aina ya kibiolojia ya hydroxylapatite inapatikana kama madini kuu katika enamel ya meno yetu. Mchanganyiko wa hydroxylapatite na maji (au mate) ina mchanganyiko wa usawa wa Ca 5 imara (PO 4) 3 OH na kufutwa Ca 2 +,\(\ce{PO4^3-}\), na OH — ions:
\[\ce{Ca5(PO4)3OH}(s)⟶\ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \nonumber \]
Wakati wazi kwa asidi, ions phosphate kuguswa na ions hydronium kuunda ions hidrojeni phosphate na hatimaye, asidi fosforasi:
\[\ce{PO4^3-}(aq)+\ce{H3O+}⇌\ce{H2PO4^2-}+\ce{H2O} \nonumber \]
\[\ce{PO4^2-}(aq)+\ce{H3O+}⇌\ce{H2PO4-}+\ce{H2O} \nonumber \]
\[\ce{H2PO4- + H3O+ ⇌ H3PO4 + H2O} \nonumber \]
Ioni ya hidroksidi inachukua ili kuunda maji:
\[\ce{OH-}(aq)+\ce{H3O+}⇌\ce{2H2O} \nonumber \]
Athari hizi hupungua viwango vya phosphate na hidroksidi ion, na hidroxylapatite ya ziada hupasuka katika suluhisho la tindikali kulingana na kanuni ya Le Chatelier. Meno yetu yanaendelea cavities wakati taka ya asidi zinazozalishwa na bakteria kukua juu yao husababisha hydroxylapatite ya enamel kufuta. Toothpastes za fluoride zina fluoride ya sodiamu, NaF, au fluoride ya stannous [zaidi inayoitwa bati (II) fluoride], SNF 2. Wanafanya kazi kwa kuchukua nafasi ya OH — ion katika hydroxylapatite na F - ion, inayozalisha fluorapatite, Ca 5 (PO 4) 3 F:
\[\ce{NaF + Ca5(PO4)3OH ⇌ Ca5(PO4)3F + Na+ + OH-} \nonumber \]
Ca kusababisha 5 (PO 4) 3 F ni kidogo chini ya mumunyifu kuliko Ca 5 (PO 4) 3 OH, na F - ni msingi dhaifu kuliko OH -. Mambo haya yote hufanya fluorapatite zaidi sugu kushambulia na asidi kuliko hydroxylapatite. Angalia Kemia katika Everyday Life kipengele juu ya jukumu la fluoride katika kuzuia kuoza kwa jino kwa taarifa zaidi.
Kama tulivyoona hapo awali, ioni za fluoride husaidia kulinda meno yetu kwa kukabiliana na hidroxylapatite kuunda fluorapatite, Ca 5 (PO 4) 3 F. kwa kuwa inakosa ioni ya hidroksidi, fluorapatite ni sugu zaidi kwa mashambulizi ya asidi katika midomo yetu na hivyo ni chini ya mumunyifu, kulinda meno yetu. Wanasayansi waligundua kwamba maji ya kawaida ya fluorinated inaweza kuwa na manufaa kwa meno yako, na hivyo ikawa kawaida mazoezi ya kuongeza fluoride kwa maji ya kunywa. Toothpastes na mouthwashes pia zina kiasi cha fluoride (Kielelezo\(\PageIndex{3}\)).

Kwa bahati mbaya, fluoride ya ziada inaweza kupuuza faida zake. Vyanzo vya asili vya maji ya kunywa katika sehemu mbalimbali za dunia vina viwango tofauti vya fluoridi, na mahali ambako ukolezi huo ni wa juu hupatikana kwa hatari fulani za kiafya wakati hakuna chanzo kingine cha maji ya kunywa. Athari kubwa zaidi ya fluoride ya ziada ni ugonjwa wa mfupa, fluorosis ya mifupa. Wakati fluoride ya ziada iko katika mwili, inaweza kusababisha viungo kuwa ngumu na mifupa kuenea. Inaweza kuathiri sana uhamaji na inaweza kuathiri vibaya tezi ya tezi. Fluorosis ya mifupa ni hali ya kuwa zaidi ya watu milioni 2.7 wanakabiliwa na duniani kote. Hivyo wakati fluoride inaweza kulinda meno yetu kutokana na kuoza, Shirika la Ulinzi wa Mazingira la Marekani linaweka kiwango cha juu cha 4 ppm (4 mg/L) ya fluoride katika maji ya kunywa nchini Marekani. Viwango vya fluoride katika maji havijasimamiwa katika nchi zote, hivyo fluorosis ni tatizo katika maeneo yenye viwango vya juu vya fluoride katika maji ya chini.
Wakati mvua ya asidi inashambulia chokaa au marumaru, ambayo ni carbonates ya kalsiamu, mmenyuko hutokea ambayo ni sawa na mashambulizi ya asidi kwenye hidroxylapatite. Ioni ya hidroniamu kutoka mvua ya asidi inachanganya na ioni ya carbonate kutoka kwa carbonate ya kalsiamu na hufanya ioni ya carbonate ya hidrojeni, asidi dhaifu:
\[\ce{H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l) \nonumber \]
Calcium carbonate hidrojeni, Ca (HCO 3) 2, ni mumunyifu, hivyo chokaa na marumaru vitu polepole kufutwa katika mvua asidi.
Ikiwa calcium carbonate imeongezwa kwa asidi iliyojilimbikizia, ioni ya hidroniamu humenyuka na ion ya carbonate kulingana na usawa:
\[\ce{2H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{H2CO3}(aq)+\ce{2H2O}(l) \nonumber \]
(Mvua ya asidi ni kawaida haitoshi tindikali kusababisha mmenyuko huu; hata hivyo, asidi za maabara ni.) Suluhisho linaweza kujazwa na asidi dhaifu ya electrolyte kaboni, ambayo ni imara, na gesi ya dioksidi kaboni inaweza kubadilishwa:
\[\ce{H2CO3}(aq)⟶\ce{CO2}(g)+\ce{H2O}(l) \nonumber \]
Athari hizi hupungua mkusanyiko wa ion carbonate, na ziada ya calcium carbonate hupasuka. Ikiwa asidi ya kutosha iko, mkusanyiko wa ioni ya carbonate imepungua kwa kiwango cha chini ambacho quotient ya mmenyuko kwa ajili ya kuvunjwa kwa carbonate ya kalsiamu bado chini ya bidhaa za umumunyifu wa calcium carbonate, hata baada ya yote ya calcium carbonate imekwisha kufutwa.
Tumia mkusanyiko wa ioni ya amonia ambayo inahitajika ili kuzuia mvua ya Mg (OH) 2 katika suluhisho na [Mg 2 +] = 0.10 M na [NH 3] = 0.10 M.
Suluhisho
Mizani miwili inashiriki katika mfumo huu:
- Majibu (1):\(\ce{Mg(OH)2}(s)⇌\ce{Mg^2+}(aq)+\ce{2OH-}(aq); \hspace{20px} K_\ce{sp}=8.9×10^{−12}\)
- Tabia (2):\(\ce{NH3}(aq)+\ce{H2O}(l)⇌\ce{NH4+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=1.8×10^{−5}\)
Ili kuzuia malezi ya Mg imara (OH) 2, ni lazima kurekebisha mkusanyiko wa OH — ili quotient majibu kwa Equation (1), Q = [Mg 2 +] [OH —] 2, ni chini ya K sp kwa Mg (OH) 2 . (Ili kurahisisha hesabu, tunaamua mkusanyiko wa OH — wakati Q = K sp.) [OH —] inaweza kupunguzwa kwa kuongeza\(\ce{NH4+}\), ambayo mabadiliko majibu (2) upande wa kushoto na kupunguza [OH -].
- Tunaamua [OH —] ambapo Q = K sp wakati [Mg 2 +] = 0.10 M:\[Q=\ce{[Mg^2+][OH- ]^2}=(0.10)\ce{[OH- ]^2}=8.9×10^{−12} \nonumber \]
Mgumu Mg (OH) 2 haitaunda katika suluhisho hili wakati [OH —] ni chini ya 9.4 × 10 —6 M.
- Tunahesabu\(\mathit{[NH_4^+]}\) zinazohitajika kupungua [OH —] hadi 9.4 × 10 —6 M wakati [NH 3] = 0.10. \[K_\ce{b}=\ce{\dfrac{[NH4+][OH- ]}{[NH3]}}=\dfrac{\ce{[NH4+]}(9.4×10^{−6})}{0.10}=1.8×10^{−5} \nonumber \]\[\ce{[NH4+]}=0.19\:M \nonumber \]
Wakati\(\ce{[NH4+]}\) sawa na 0.19 M, [OH —] itakuwa 9.4 × 10 —6 M. \(\ce{[NH4+]}\)Yoyote kubwa kuliko 0.19 M itapunguza [OH —] chini ya 9.4 × 10 —6 M na kuzuia malezi ya Mg (OH) 2.
Fikiria usawa huo wawili:
\[\ce{ZnS}(s)⇌\ce{Zn^2+}(aq)+\ce{S^2-}(aq) \hspace{20px} K_\ce{sp}=1×10^{−27} \nonumber \]
\[\ce{2H2O}(l)+\ce{H2S}(aq)⇌\ce{2H3O+}(aq)+\ce{S^2-}(aq) \hspace{20px} K=1.0×10^{−26} \nonumber \]
na kuhesabu mkusanyiko wa ioni ya hidronium inahitajika ili kuzuia mvua ya ZN katika suluhisho ambalo ni 0.050 M katika Zn 2 + na iliyojaa H 2 S (0.10 M H 2 S).
- Jibu
-
\[\ce{[H3O+]}>0.2\:M \nonumber \]
([S 2—] ni chini ya 2 × 10 —26 M na mvua ya ZN haitokei.)
Kwa hiyo, mahesabu sahihi ya umumunyifu wa yabisi kutoka kwa bidhaa za umumunyifu ni mdogo kwa matukio ambayo mmenyuko muhimu tu hutokea wakati dissolves imara ni malezi ya ions yake.
Halidi za fedha zisizo wazi zinaondolewa kwenye filamu ya picha wakati zinaguswa na thiosulfate ya sodiamu (Na 2 S 2 O 3, inayoitwa hypo) ili kuunda ioni tata\(\ce{Ag(S2O3)2^3-}\) (K f = 4.7 × 10 13). Majibu na bromidi ya fedha ni:
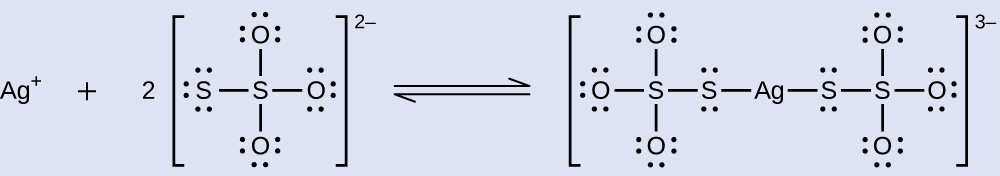
Ni umati gani wa Na 2 S 2 O 3 inahitajika kuandaa 1.00 L ya suluhisho ambalo litafuta 1.00 g ya AgBr kwa kuundwa kwa\(\ce{Ag(S2O3)2^3-}\)?
Suluhisho la Marekani
Mizani miwili inahusishwa wakati AGBr inapokwisha kufuta katika suluhisho iliyo na\(\ce{S2O3^2-}\) ion:
- Majibu (1):\(\ce{AgBr}(s)⇌\ce{Ag+}(aq)+\ce{Br-}(aq) \hspace{20px} K_\ce{sp}=5.0×10^{−13}\)
- Tabia (2):\(\ce{Ag+}(aq)+\ce{S2O3^2-}(aq)⇌\ce{Ag(S2O3)2^3-}(aq) \hspace{20px} K_\ce{f}=4.7×10^{13}\)
Ili 1.00 g ya AgBr kufuta, [Ag +] katika suluhisho ambalo matokeo lazima iwe chini ya kutosha kwa Q kwa Reaction (1) kuwa ndogo kuliko K sp kwa mmenyuko huu. Sisi kupunguza [Ag +] kwa kuongeza\(\ce{S2O3^2-}\) na hivyo kusababisha Reaction (2) kuhama kwa haki. Tunahitaji hatua zifuatazo ili kuamua ni umati gani wa Na 2 S 2 O 3 inahitajika ili kutoa muhimu\(\ce{S2O3^2-}\).
- Sisi mahesabu ya [Br —] zinazozalishwa na kuvunjwa kamili ya 1.00 g ya AgBr (5.33 × 10 —3 mol AgBr) katika 1.00 L ya suluhisho:\[\ce{[Br- ]}=5.33×10^{−3}\:M \nonumber \]
- Tunatumia [Br -] na K sp kuamua kiwango cha juu kinachowezekana cha Ag + ambacho kinaweza kuwepo bila kusababisha upyaji wa AgBr:\[\ce{[Ag+]}=9.4×10^{−11}\:M \nonumber \]
- Tunaamua\(\mathit{[S_2O_3^{2-}]}\) inahitajika kufanya [Ag +] = 9.4 × 10 —11 M baada ya ioni iliyobaki ya Ag + imejibu kwa\(\mathit{S_2O_3^{2-}}\) mujibu wa equation:\[\ce{Ag+ + 2S2O3^2- ⇌ Ag(S2O3)2^3-} \hspace{20px} K_\ce{f}=4.7×10^{13} \nonumber \]
Kwa sababu 5.33 × 10 -3 ml ya AgBr hupasuka:
\ [(5.33×10^ {—3}) - (9.4×10^ {-11}) =5.33×10^ {—3}\ ce {\: mol\ :Ag (S2O3) 2^3-}\\ hakuna idadi]Hivyo, kwa usawa:\(\ce{[Ag(S2O3)2^3- ]}\) = 5.33 × 10 —3 M, [Ag +] = 9.4× 10 —11 M, na Q = K f = 4.7 × 10 13:
\[K_\ce{f}=\ce{\dfrac{[Ag(S2O3)2^3- ]}{[Ag+][S2O3^2- ]^2}}=4.7×10^{13} \nonumber \]\[\ce{[S2O3^2- ]}=1.1×10^{−3}\:M \nonumber \]Wakati\(\ce{[S2O3^2- ]}\) ni 1.1 × 10 —3 M, [Ag +] ni 9.4 × 10 —11 M na AGBr zote zinabaki kufutwa.
- Tunaamua idadi ya moles ya\(\mathit{S_2O_3^{2-}}\) hiyo lazima iongezwe kwenye suluhisho. Hii inalingana na kiasi ambacho humenyuka na Ag + kuunda\(\ce{Ag(S2O3)2^3-}\) pamoja na kiasi cha bure\(\ce{S2O3^2-}\) katika suluhisho katika usawa. Ili kuunda 5.33 × 10 —3 mol ya\(\ce{Ag(S2O3)2^3-}\) inahitaji 2 × (5.33 × 10 —3) mol ya\(\ce{S2O3^2-}\). Aidha, 1.1 × 10 —3 mol ya unreacted\(\ce{S2O3^2-}\) ni sasa (Hatua ya 3). Hivyo, jumla ya\(\ce{S2O3^2-}\) kwamba lazima aliongeza ni:\[\mathrm{2×(5.33×10^{−3}mol\:S_2O_3^{2-}) + 1.1×10^{−3}\:mol\:S_2O_3^{2-} = 1.18×10^{−2}\: mol\:S_2O_3^{2-}} \nonumber \]
- Tunaamua wingi wa Na 2 S 2 O 3 inahitajika kutoa 1.18 × 10 —2 mol\(\mathit{S_2O_3^{2-}}\) kwa kutumia molekuli ya molar ya Na 2 S 2 O 3:\[\mathrm{1.18×10^{−2}\:mol\:S_2O_3^{2-}×\dfrac{158.1\:g\:Na_2S_2O_3}{1\:mol\:Na_2S_2O_3}=1.9\:g\:Na_2S_2O_3} \nonumber \]
Hivyo, 1.00 L ya suluhisho iliyoandaliwa kutoka 1.9 g Na 2 S 2 O 3 hupasuka 1.0 g ya AgBr.
AgCl (s), kloridi ya fedha, inajulikana kuwa na umumunyifu mdogo sana:\(\ce{Ag}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq)\), K sp = 1.6 × 10 —10. Kuongeza amonia kwa kiasi kikubwa huongeza umumunyifu wa AgCl kwa sababu ioni tata huundwa:\(\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq)\), K f = 1.7 × 10 7. Masi gani ya NH 3 inahitajika kuandaa 1.00 L ya suluhisho ambayo itafuta 2.00 g ya AgCl kwa kuundwa kwa\(\ce{Ag(NH3)2+}\)?
- Jibu
-
1.00 L ya suluhisho iliyoandaliwa na 4.81 g NH 3 hupasuka 2.0 g ya AgCl.
Uharibifu dhidi ya malezi ya Electrolyte
Tunaweza kuamua jinsi ya kuhama mkusanyiko wa ions katika usawa kati ya imara kidogo mumunyifu na ufumbuzi wa ions yake kwa kutumia kanuni ya Le Chatelier. Kwa mfano, njia moja ya kudhibiti mkusanyiko wa ioni ya manganese (II), Mn 2 +, katika suluhisho ni kurekebisha pH ya suluhisho na, kwa hiyo, kuendesha usawa kati ya hidroksidi ya manganese imara (II), manganese (II) ion, na ioni ya hidroksidi:
\[\ce{Mn(OH)2}(s) ⇌ \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mn^2+][OH- ]^2} \nonumber \]
Hii inaweza kuwa muhimu kwa kufulia kwa sababu nguo nikanawa katika maji ambayo ina mkusanyiko manganese mno 0.1 mg kwa lita inaweza kubadilika na manganese. Tunaweza kupunguza mkusanyiko wa manganese kwa kuongeza mkusanyiko wa ioni ya hidroksidi. Tunaweza kuongeza, kwa mfano, kiasi kidogo cha NaOH au msingi mwingine kama vile silicates zilizopatikana katika sabuni nyingi za kufulia. Kama mkusanyiko wa OH — ion unavyoongezeka, msawazo hujibu kwa kuhama upande wa kushoto na kupunguza mkusanyiko wa ion Mn 2 + huku ukiongeza kiasi cha imara Mn (OH) 2 katika mchanganyiko wa usawa, kama ilivyotabiriwa na kanuni ya Le Chatelier.
Athari gani juu ya kiasi cha Mg imara (OH) 2 ambayo hupasuka na viwango vya Mg 2 + na OH — wakati kila moja ya yafuatayo yanaongezwa kwenye mchanganyiko wa Mg imara (OH) 2 katika maji kwenye usawa?
- MgCl 2
- KOH
- asidi
- nano 3
- Mg (OH) 2
Suluhisho
Msawazo kati ya Mg imara (OH) 2 na suluhisho la Mg 2 + na OH — ni:
\[\ce{Mg(OH)2}(s) ⇌ \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
(a) Mabadiliko ya mmenyuko upande wa kushoto ili kupunguza matatizo yaliyozalishwa na ziada ya Mg 2 + ion, kwa mujibu wa kanuni ya Le Chatelier. Kwa maneno ya kiasi, aliongeza Mg 2 + husababisha quotient mmenyuko kuwa kubwa kuliko bidhaa umumunyifu (Q> K sp), na Mg (OH) aina 2 mpaka quotient majibu tena sawa K sp. Katika usawa mpya, [OH —] ni ndogo na [[Mg 2 +] ni kubwa kuliko katika suluhisho la Mg (OH) 2 katika maji safi. Mg imara zaidi (OH) 2 iko sasa.
(b) Mabadiliko ya majibu kwa upande wa kushoto ili kupunguza matatizo ya ziada ya OH — ion. Mg (OH) aina 2 mpaka quotient majibu tena sawa K sp. Katika usawa mpya, [OH —] ni mkubwa na [[Mg 2 +] ni chini ya katika suluhisho la Mg (OH) 2 katika maji safi. Mg imara zaidi (OH) 2 iko sasa.
(c) Mkusanyiko wa OH — imepunguzwa kama OH — humenyuka na asidi. Mabadiliko ya majibu kwa haki ya kupunguza matatizo ya chini ya OH — ion. Kwa maneno ya kiasi, kupungua kwa OH — mkusanyiko husababisha quotient ya mmenyuko kuwa ndogo kuliko bidhaa ya umumunyifu (Q <K sp), na ziada Mg (OH) 2 hupasuka mpaka quotient ya majibu tena sawa na K sp. Katika usawa mpya, [OH —] ni ndogo na [[Mg 2 +] ni kubwa kuliko katika suluhisho la Mg (OH) 2 katika maji safi. Zaidi Mg (OH) 2 hupasuka.
(d) NaNO 3 haina aina yoyote ya kushiriki katika msawazo, hivyo tunapaswa kutarajia kwamba haina athari appreciable juu ya viwango vya Mg 2 + na OH —. (Kama tulivyoona hapo awali, chumvi zilizoharibiwa hubadilisha shughuli za ions za electrolyte. Hata hivyo, athari ya chumvi kwa ujumla ni ndogo, na tutapuuza makosa madogo ambayo yanaweza kusababisha.)
(e) nyongeza ya Mg imara (OH) 2 haina athari juu ya umumunyifu wa Mg (OH) 2 au mkusanyiko wa Mg 2 + na OH —. Mkusanyiko wa Mg (OH) 2 hauonekani katika equation kwa quotient ya majibu:
\[Q=\ce{[Mg^2+][OH- ]^2} \nonumber \]
Kwa hiyo, kubadilisha kiasi cha hidroksidi imara ya magnesiamu katika mchanganyiko haina athari kwa thamani ya Q, na hakuna mabadiliko yanahitajika kurejesha Q kwa thamani ya mara kwa mara ya usawa.
Je, ni athari kwa kiasi cha NiCO 3 imara kwamba dissolves na viwango vya Ni 2 + na\(\ce{CO3^2-}\) wakati kila moja ya yafuatayo ni aliongeza kwa mchanganyiko wa kidogo mumunyifu imara NiCO 3 na maji katika usawa?
- Hapana (NO 32)
- kClo 4
- NiCo 3
- K 2 CO 3
- HNO 3 (humenyuka na kutoa carbonate\(\ce{HCO3-}\) au H 2 O na CO 2)
Jibu
(a) wingi wa NiCO 3 (s) ongezeko, [Ni 2 +] huongezeka,\(\ce{[CO3^2- ]}\) hupungua; (b) hakuna athari appreciable; (c) hakuna athari isipokuwa kuongeza kiasi cha NiCO imara 3; (d) wingi wa NiCO 3 (s) ongezeko, [Ni 2 +] hupungua,\(\ce{[CO3^2- ]}\) ongezeko; (e) wingi wa NiCO 3 (s) hupungua, [Ni 2 +] huongezeka,\(\ce{[CO3^2- ]}\) hupungua
Muhtasari
Mifumo kadhaa tunayokutana inajumuisha usawa mingi, mifumo ambapo michakato miwili au zaidi ya usawa hutokea wakati huo huo. Baadhi ya mifano ya kawaida ni pamoja na mvua asidi, fluoridation, na kuvunjwa kwa dioksidi kaboni katika maji ya bahari. Wakati wa kuangalia mifumo hii, tunahitaji kuzingatia kila usawa tofauti na kisha kuchanganya constants ya usawa wa mtu binafsi katika bidhaa moja umumunyifu au majibu quotient kujieleza kwa kutumia zana kutoka sura ya kwanza ya usawa. Kanuni ya Le Chatelier pia lazima izingatiwe, kwa kuwa kila mmenyuko katika mfumo wa usawa nyingi utabadilika kuelekea majibu au bidhaa kulingana na kile kinachoongezwa kwenye mmenyuko wa awali na jinsi unavyoathiri kila mmenyuko wa usawa baadae.
faharasa
- msawazo nyingi
- mfumo unaojulikana na hali zaidi ya moja ya usawa kati ya ionic kidogo ya mumunyifu imara na suluhisho la maji ya ions inayofanya kazi wakati huo huo


