12.1: Viwango vya mmenyuko wa Kemikali
- Page ID
- 176385
- Eleza kiwango cha mmenyuko wa kemikali
- Hutumia maneno ya kiwango kutoka equation uwiano kwa ajili ya kupewa kemikali mmenyuko
- Tumia viwango vya majibu kutoka kwa data ya majaribio
Kiwango ni kipimo cha jinsi baadhi ya mali inatofautiana na wakati. Kasi ni kiwango cha kawaida kinachoonyesha umbali uliosafiri na kitu kwa kiasi fulani cha muda. Mshahara ni kiwango kinachowakilisha kiasi cha pesa kilichopatikana na mtu anayefanya kazi kwa kiasi fulani cha muda. Vivyo hivyo, kiwango cha mmenyuko wa kemikali ni kipimo cha kiasi gani kinachotumiwa, au ni kiasi gani cha bidhaa kinazalishwa, na mmenyuko kwa kiasi fulani cha muda.
Kiwango cha mmenyuko ni mabadiliko katika kiasi cha reactant au bidhaa kwa wakati wa kitengo. Viwango vya majibu kwa hiyo vinatambuliwa kwa kupima utegemezi wa muda wa mali fulani ambayo inaweza kuhusiana na kiasi cha reactant au bidhaa. Viwango vya athari ambazo hutumia au kuzalisha vitu vya gesi, kwa mfano, vinatambuliwa kwa urahisi na kupima mabadiliko kwa kiasi au shinikizo. Kwa athari zinazohusisha dutu moja au zaidi ya rangi, viwango vinaweza kufuatiliwa kupitia vipimo vya ngozi ya mwanga. Kwa athari zinazohusisha electrolytes yenye maji, viwango vinaweza kupimwa kupitia mabadiliko katika conductivity ya suluhisho.
Kwa reactants na bidhaa katika suluhisho, kiasi chao cha jamaa (viwango) hutumiwa kwa urahisi kwa madhumuni ya kuonyesha viwango vya majibu. Ikiwa tunapima mkusanyiko wa peroxide ya hidrojeni, H 2 O 2, katika suluhisho la maji, tunaona kwamba inabadilika polepole baada ya muda kama H 2 O 2 hutengana, kulingana na equation:
\[\ce{2H2O2}(aq)⟶\ce{2H2O}(l)+\ce{O2}(g) \nonumber \]
Kiwango ambacho peroxide ya hidrojeni hutengana inaweza kuelezwa kwa kiwango cha mabadiliko ya mkusanyiko wake, kama inavyoonekana hapa:
\ [kuanza {align*}
\ ce {kiwango\: ya\: utengano\: ya\: H_2O_2}
&=\ mathrm {δ\ dfrac {mabadiliko\: katika\: mkusanyiko\: ya\: reactant} {muda\: muda}\\ [4pt]
&=\ dfrac {\ ce {H2O2}] _ {t_2} - [\ ce {H2O2}] _ {t_1}} {t_2,1t_1}\\ [4pt]
&=\ dfrac {Δ [\ ce {H2O2}]} {Δt}
\ mwisho {align*}\ nonumber\]
Hii uwakilishi hisabati ya mabadiliko katika aina mkusanyiko baada ya muda ni kiwango kujieleza kwa majibu. Mabano yanaonyesha viwango vya molar, na delta ya ishara (Δ) inaonyesha “mabadiliko.” Kwa hiyo,\([\ce{H2O2}]_{t_1}\) inawakilisha mkusanyiko wa molar wa peroxide ya hidrojeni wakati fulani t 1; vivyo hivyo,\([\ce{H2O2}]_{t_2}\) inawakilisha mkusanyiko wa molar wa peroxide ya hidrojeni wakati mwingine t 2; na Δ [H 2 O 2] inawakilisha mabadiliko katika mkusanyiko wa molar ya peroxide ya hidrojeni wakati wa muda Δ t (yaani, t 2 ÷ t 1). Kwa kuwa mkusanyiko wa reactant unapungua kadiri majibu yanavyoendelea, Δ [H 2 O 2] ni wingi hasi; tunaweka ishara hasi mbele ya usemi kwa sababu viwango vya majibu ni, kwa mkataba, kiasi chanya. Kielelezo\(\PageIndex{1}\) hutoa mfano wa data zilizokusanywa wakati wa kuharibika kwa H 2 O 2.
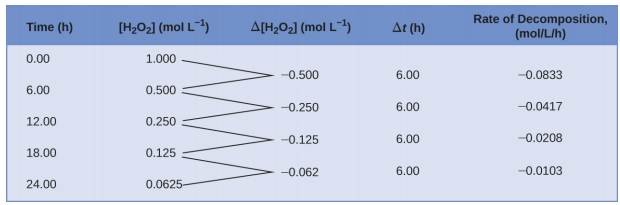
Ili kupata matokeo yaliyoorodheshwa kwa mtengano huu, mkusanyiko wa peroxide ya hidrojeni ulipimwa kila masaa 6 kwa kipindi cha siku kwa joto la mara kwa mara la 40 °C. inavyoonekana hapa kwa kipindi cha kwanza cha saa 6:
\[\dfrac{−Δ[\ce{H2O2}]}{Δt}=\mathrm{\dfrac{−(0.500\: mol/L−1.000\: mol/L)}{(6.00\: h−0.00\: h)}=0.0833\: mol\:L^{−1}\:h^{−1}} \nonumber \]
Angalia kwamba viwango vya majibu hutofautiana na wakati, kupungua kama majibu yanavyoendelea. Matokeo ya kipindi cha mwisho cha saa 6 huzaa kiwango cha majibu ya:
\[\dfrac{−Δ[\ce{H2O2}]}{Δt}=\mathrm{\dfrac{−(0.0625\:mol/L−0.125\:mol/L)}{(24.00\:h−18.00\:h)}=0.0104\:mol\:L^{−1}\:h^{−1}} \nonumber \]
Tabia hii inaonyesha majibu yanaendelea kupungua kwa wakati. Kutumia viwango mwanzoni na mwisho wa kipindi cha muda ambacho kiwango cha mmenyuko kinabadilisha matokeo katika hesabu ya kiwango cha wastani cha mmenyuko juu ya muda huu. Wakati wowote maalum, kiwango ambacho majibu yanaendelea inajulikana kama kiwango chake cha papo hapo. Kiwango cha instantaneous cha mmenyuko katika “wakati sifuri,” wakati majibu huanza, ni kiwango chake cha awali. Fikiria mfano wa gari kupunguza kasi kama inakaribia ishara ya kuacha. Kiwango cha awali cha gari-kinachofanana na mwanzo wa mmenyuko wa kemikali-kitakuwa ni kusoma kwa kasi wakati dereva anaanza kushinikiza mabaki (t 0). Muda mfupi baadaye, kiwango cha instantaneous kwa wakati maalum-kuiita t 1 - itakuwa kiasi fulani polepole, kama ilivyoonyeshwa na kusoma speedometer wakati huo kwa wakati. Wakati unapopita, kiwango cha instantaneous kitaendelea kuanguka mpaka kufikia sifuri, wakati gari (au majibu) ataacha. Tofauti na kasi ya papo hapo, kasi ya wastani ya gari haionyeshwa na speedometer; lakini inaweza kuhesabiwa kama uwiano wa umbali uliosafiri hadi wakati unaotakiwa kuleta gari kwa kuacha kamili (Δ t). Kama gari la kupungua, kiwango cha wastani cha mmenyuko wa kemikali kitaanguka mahali fulani kati ya viwango vya awali na vya mwisho.
Kiwango cha mara moja cha mmenyuko kinaweza kuamua moja ya njia mbili. Ikiwa hali ya majaribio inaruhusu kipimo cha mabadiliko ya mkusanyiko juu ya vipindi vya muda mfupi sana, basi viwango vya wastani vinahesabiwa kama ilivyoelezwa hapo awali hutoa makadirio mazuri ya viwango vya instantaneous. Vinginevyo, utaratibu wa graphical unaweza kutumika kwamba, kwa kweli, hutoa matokeo ambayo yatapatikana ikiwa vipimo vya muda mfupi vinawezekana. Ikiwa tunajenga mkusanyiko wa peroxide ya hidrojeni dhidi ya wakati, kiwango cha instantaneous cha kuharibika kwa H 2 O 2 wakati wowote t hutolewa na mteremko wa mstari wa moja kwa moja ambao ni tangent kwa curve wakati huo (Kielelezo\(\PageIndex{2}\)). Tunaweza kutumia calculus kutathmini mteremko wa mistari hiyo ya tangent, lakini utaratibu wa kufanya hivyo ni zaidi ya upeo wa sura hii.
Waganga mara nyingi hutumia vipande vya mtihani vinavyoweza kupima kiasi cha vitu mbalimbali katika mkojo wa mgonjwa (Kielelezo\(\PageIndex{2}\)). Vipande hivi vya mtihani vina vitendanishi mbalimbali vya kemikali, vilivyoingia kwenye usafi mdogo katika maeneo mbalimbali kando ya mstari, ambayo hupitia mabadiliko ya rangi juu ya yatokanayo na viwango vya kutosha vya vitu maalum. Maelekezo ya matumizi kwa bidragen mtihani mara nyingi kusisitiza kwamba sahihi kusoma wakati ni muhimu kwa ajili ya matokeo mojawapo. Mkazo huu juu ya muda wa kusoma unaonyesha kuwa mambo ya kinetic ya athari za kemikali zinazotokea kwenye mstari wa mtihani ni masuala muhimu.
Mtihani wa glucose ya mkojo hutegemea mchakato wa hatua mbili unaowakilishwa na usawa wa kemikali unaoonyeshwa hapa:
\[\ce{C6H12O6 + O2}\underset{\large\textrm{catalyst}}{\xrightarrow{\hspace{45px}}}\ce{C6H10O6 + H2O2} \label{eq1} \]
\[\ce{2H2O2 + 2I-}\underset{\large\textrm{catalyst}}{\xrightarrow{\hspace{45px}}}\ce{I2 + 2H2O + O2} \label{eq2} \]
Equation\(\ref{eq1}\) inaonyesha oxidation ya glucose katika mkojo ili kutoa glucoactone na peroxide ya hidrojeni. Peroxide ya hidrojeni zinazozalishwa hatimaye huongeza ioni isiyo na rangi ya iodidi ili kuzalisha iodini ya kahawia (Equation\(\ref{eq2}\)), ambayo inaweza kuonekana kuonekana. Vipande vingine vinajumuisha dutu la ziada ambalo humenyuka na iodini ili kuzalisha mabadiliko ya rangi tofauti zaidi.
Athari mbili za mtihani zilizoonyeshwa hapo juu ni za polepole sana, lakini viwango vyao vinaongezeka na enzymes maalum zilizoingia kwenye pedi ya mtihani wa mtihani. Huu ni mfano wa kichocheo, mada iliyojadiliwa baadaye katika sura hii. Mchoro wa kawaida wa mtihani wa glucose kwa matumizi na mkojo unahitaji takriban sekunde 30 kwa kukamilika kwa athari za kutengeneza rangi. Kusoma matokeo hivi karibuni inaweza kusababisha mtu kuhitimisha kwamba mkusanyiko wa glucose wa sampuli ya mkojo ni ya chini kuliko ilivyo kweli (matokeo ya uongo). Kusubiri kwa muda mrefu sana kutathmini mabadiliko ya rangi kunaweza kusababisha chanya cha uongo kutokana na oxidation ya polepole (sio kichocheo) ya iodidi ion na vitu vingine vinavyopatikana kwenye mkojo.

Viwango vya Jamaa vya Majibu
Kiwango cha mmenyuko kinaweza kuelezwa kwa suala la mabadiliko katika kiasi cha reactant yoyote au bidhaa, na inaweza kuwa tu inayotokana na stoichiometry ya mmenyuko. Fikiria majibu yaliyowakilishwa na equation ifuatayo:
\[\ce{2NH3}(g)⟶\ce{N2}(g)+\ce{3H2}(g) \nonumber \]
Sababu stoichiometric inayotokana na equation hii inaweza kutumika kuhusisha viwango vya majibu kwa namna ile ile kwamba wao ni kutumika kuhusiana reactant na bidhaa kiasi. Uhusiano kati ya viwango vya majibu yaliyotolewa kwa suala la uzalishaji wa nitrojeni na matumizi ya amonia, kwa mfano, ni:
\[\mathrm{−\dfrac{Δmol\: NH_3}{Δ\mathit t}×\dfrac{1\: mol\: N_2}{2\: mol\: NH_3}=\dfrac{Δmol\:N_2}{Δ\mathit t}} \nonumber \]
Tunaweza kuelezea hili kwa urahisi zaidi bila kuonyesha vitengo vya sababu ya stoichiometric:
\[−\dfrac{1}{2}\dfrac{\mathrm{Δmol\:NH_3}}{Δt}=\dfrac{\mathrm{Δmol\:N_2}}{Δt} \nonumber \]
Kumbuka kuwa ishara hasi imeongezwa kwa akaunti kwa ishara tofauti za mabadiliko mawili ya kiasi (kiasi cha reactant kinapungua wakati kiasi cha bidhaa kinaongezeka). Ikiwa reactants na bidhaa zipo katika suluhisho moja, kiasi cha molar kinaweza kubadilishwa na viwango:
\[−\dfrac{1}{2}\dfrac{Δ[\ce{NH3}]}{Δt}=\dfrac{Δ[\ce{N2}]}{Δt} \nonumber \]
Vile vile, kiwango cha malezi ya H 2 ni mara tatu kiwango cha malezi ya N 2 kwa sababu moles tatu za fomu H 2 wakati unaohitajika kwa ajili ya kuundwa kwa mole moja ya N 2:
\[\dfrac{1}{3}\dfrac{Δ[\ce{H2}]}{Δt}=\dfrac{Δ[\ce{N2}]}{Δt} \nonumber \]
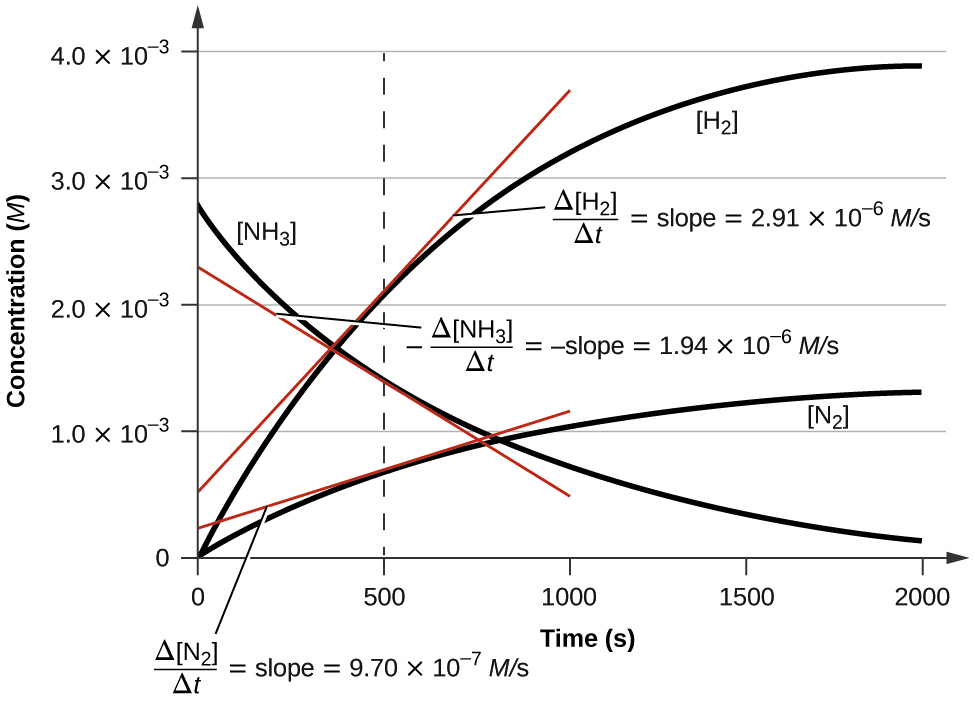
Kielelezo\(\PageIndex{3}\) unaeleza mabadiliko katika viwango baada ya muda kwa ajili ya kuoza ya amonia katika nitrojeni na hidrojeni katika 1100 °C Tunaweza kuona kutoka mteremko wa tangents inayotolewa katika t = 500 sekunde kwamba viwango instantaneous ya mabadiliko katika viwango vya reactants na bidhaa ni kuhusiana na mambo yao ya stoichiometric. Kiwango cha uzalishaji wa hidrojeni, kwa mfano, kinazingatiwa kuwa mara tatu zaidi kuliko ile ya uzalishaji wa nitrojeni:
\[\dfrac{2.91×10^{−6}\:M/\ce s}{9.71×10^{−6}\:M/\ce s}≈3 \nonumber \]
Hatua ya kwanza katika uzalishaji wa asidi ya nitriki ni mwako wa amonia:
\[\ce{4NH3}(g)+\ce{5O2}(g)⟶\ce{4NO}(g)+\ce{6H2O}(g) \nonumber \]
Andika equations zinazohusiana na viwango vya matumizi ya reactants na viwango vya malezi ya bidhaa.
Suluhisho
Kuzingatia stoichiometry ya mmenyuko huu mzuri, viwango vya matumizi ya reactants na malezi ya bidhaa ni:
\[−\dfrac{1}{4}\dfrac{Δ[\ce{NH3}]}{Δt}=−\dfrac{1}{5}\dfrac{Δ[\ce{O2}]}{Δt}=\dfrac{1}{4}\dfrac{Δ[\ce{NO}]}{Δt}=\dfrac{1}{6}\dfrac{Δ[\ce{H2O}]}{Δt} \nonumber \]
Kiwango cha malezi ya Br 2 ni 6.0 × 10 -6 mol/l/s katika mmenyuko ulioelezwa na equation ionic yafuatayo:
\[\ce{5Br- + BrO3- + 6H+ ⟶ 3Br2 + 3H2O} \nonumber \]
Andika equations zinazohusiana na viwango vya matumizi ya reactants na viwango vya malezi ya bidhaa.
- Jibu
-
\[−\dfrac{1}{5}\dfrac{Δ[\ce{Br-}]}{Δt}=−\dfrac{Δ[\ce{BrO3-}]}{Δt}=−\dfrac{1}{6}\dfrac{Δ[\ce{H+}]}{Δt}=\dfrac{1}{3}\dfrac{Δ[\ce{Br2}]}{Δt}=\dfrac{1}{3}\dfrac{Δ[\ce{H2O}]}{Δt} \nonumber \]
Grafu katika Kielelezo\(\PageIndex{3}\) inaonyesha kiwango cha kuharibika kwa H 2 O 2 kwa muda:
\[\ce{2H2O2 ⟶ 2H2O + O2} \nonumber \]
Kulingana na takwimu hizi, kiwango cha instantaneous cha kuharibika kwa H 2 O 2 saa t = 11.1 h imedhamiriwa kuwa 3.20 × 10 ї 2 mol/L/h, yaani:
\[−\dfrac{Δ[\ce{H2O2}]}{Δt}=\mathrm{3.20×10^{−2}\:mol\: L^{−1}\:h^{−1}} \nonumber \]
Ni kiwango gani cha instantaneous cha uzalishaji wa H 2 O na O 2?
Suluhisho
Kutumia stoichiometry ya mmenyuko, tunaweza kuamua kwamba:
\[−\dfrac{1}{2}\dfrac{Δ[\ce{H2O2}]}{Δt}=\dfrac{1}{2}\dfrac{Δ[\ce{H2O}]}{Δt}=\dfrac{Δ[\ce{O2}]}{Δt} \nonumber \]
Kwa hiyo:
na
\[\dfrac{Δ[\ce{O2}]}{Δt}=\mathrm{1.60×10^{−2}\:mol\:L^{−1}\:h^{−1}} \nonumber \]
Ikiwa kiwango cha kuharibika kwa amonia, NH 3, saa 1150 K ni 2.10 × 10 -6 Mol/l/s, ni kiwango gani cha uzalishaji wa nitrojeni na hidrojeni?
- Jibu
-
1.05 × 10 -6 mol/l/s, N 2 na 3.15 × 10 -6 mol/l/s, H 2.
Muhtasari
Kiwango cha mmenyuko kinaweza kuelezwa ama kwa mujibu wa kupungua kwa kiasi cha reactant au ongezeko la kiasi cha bidhaa kwa wakati wa kitengo. Uhusiano kati ya maneno tofauti ya kiwango cha mmenyuko uliotolewa hutolewa moja kwa moja kutoka kwa coefficients ya stoichiometric ya equation inayowakilisha majibu.
faharasa
- kiwango cha wastani
- kiwango cha mmenyuko wa kemikali, kilichohesabiwa kama uwiano wa mabadiliko ya kipimo kwa kiasi au mkusanyiko wa dutu kwa muda wa muda ambao mabadiliko yalitokea;
- kiwango cha awali
- kiwango cha papo hapo cha mmenyuko wa kemikali saa t = 0 s (mara baada ya majibu imeanza)
- kiwango cha instantaneous
- kiwango cha mmenyuko wa kemikali kwa papo yoyote kwa wakati, imedhamiriwa na mteremko wa mstari wa tangential kwenye grafu ya mkusanyiko kama kazi ya wakati
- kiwango cha mmenyuko
- kipimo cha kasi ambayo mmenyuko wa kemikali unafanyika
- kiwango cha kujieleza
- uwakilishi wa hisabati unaohusiana na kiwango cha mmenyuko na mabadiliko katika kiasi, ukolezi, au shinikizo la aina ya reactant au bidhaa kwa wakati wa kitengo


