11.E: Ufumbuzi na Colloids (Mazoezi)
- Page ID
- 176231
11.2: Mchakato wa Uharibifu
Q11.2.1
Je, ufumbuzi hutofautiana na misombo? Kutoka mchanganyiko mwingine?
S11.2.1
Suluhisho linaweza kutofautiana katika muundo, wakati kiwanja hakiwezi kutofautiana katika muundo. Ufumbuzi ni sawa na kiwango cha Masi, wakati mchanganyiko mwingine ni tofauti.
Q11.2.2
Ni ipi kati ya sifa kuu za ufumbuzi tunaweza kuona katika ufumbuzi wa\(\ce{K2Cr2O7}\) umeonyeshwa

Kielelezo: Wakati dichromate ya potasiamu (\(\ce{K2Cr2O7}\)) imechanganywa na maji, huunda suluhisho la machungwa la kawaida. (mikopo: mabadiliko ya kazi na Mark Ott)
S11.2.2
Ufumbuzi ni sawa katika (rangi ni mara kwa mara kote), na muundo wa suluhisho la K 2 Cr 2 O 7 katika maji unaweza kutofautiana.
Q11.2.3
Wakati KNO 3 inapopasuka katika maji, suluhisho linalosababishwa ni baridi zaidi kuliko maji yalikuwa awali.
- Je, uharibifu wa KNO 3 ni mchakato wa mwisho au exothermic?
- Ni hitimisho gani unaweza kuteka kuhusu vivutio vya intermolecular zinazohusika katika mchakato?
- Je! Suluhisho linalosababisha suluhisho bora?
S11.2.3
(a) Mchakato huu ni endothermic kama suluhisho linatumia joto. (b) Kivutio kati ya K + na\(\ce{NO3-}\) ions ni nguvu zaidi kuliko kati ya ions na molekuli ya maji (mwingiliano ion-ion na chini, nishati hasi zaidi). Kwa hiyo, mchakato wa kuvunjwa huongeza nishati ya mwingiliano wa Masi, na hutumia nishati ya joto ya suluhisho ili kuunda tofauti. (c) Hapana, suluhisho bora hutengenezwa bila kutolewa kwa joto au matumizi.
Q11.2.4
Kutoa mfano wa kila aina ya ufumbuzi zifuatazo:
- gesi katika kioevu
- gesi katika gesi
- imara katika imara
S11.2.4
(a) CO 2 katika maji; (b) O 2 katika N 2 (hewa); (c) shaba (suluhisho la bati au metali nyingine katika shaba)
Q11.2.5
Eleza aina muhimu zaidi za vivutio vya intermolecular katika kila ufumbuzi wafuatayo:
- Suluhisho katika Kielelezo.
- NO (l) katika CO (l)
- Cl 2 (g) katika Br 2 (l)
- HCl (aq) katika benzini C 6 H 6 (l)
- Methanoli CH 3 OH (l) katika H 2 O (l)
S11.2.5
(a) majeshi ya ion-dipole; (b) vikosi vya dipole-dipole; (c) vikosi vya utawanyiko; (d) vikosi vya utawanyiko; (e) kuunganisha hidrojeni
Q11.2.5
Kutabiri kama kila moja ya vitu zifuatazo itakuwa zaidi mumunyifu katika maji (polar kutengenezea) au katika hydrocarbon kama vile heptane (C 7 H 16, nonpolar kutengenezea):
- mafuta ya mboga (nonpolar)
- pombe ya isopropyl (polar)
- bromidi ya potasiamu (ionic)
S11.2.5
(a) heptane; (b) maji; (c) maji
Q11.2.6
Joto hutolewa wakati ufumbuzi fulani unapounda; joto hufanywa wakati ufumbuzi mwingine unapounda. Kutoa maelezo ya Masi kwa tofauti kati ya aina hizi mbili za michakato ya hiari.
S11.2.6
Joto hutolewa wakati vikosi vya jumla vya intermolecular (IMF) kati ya molekuli ya solute na kutengenezea ni nguvu zaidi kuliko IMF jumla katika solute safi na katika kutengenezea safi: Kuvunja IMF dhaifu na kutengeneza IMF yenye nguvu hutoa joto. Joto ni kufyonzwa wakati IMF jumla katika ufumbuzi ni dhaifu kuliko jumla ya wale katika solute safi na katika kutengenezea safi: Kuvunja IMF nguvu na kutengeneza IMF dhaifu inachukua joto.
Q11.2.7
Ufumbuzi wa hidrojeni katika palladium unaweza kuundwa kwa kufichua chuma cha Pd kwa gesi H 2. Mkusanyiko wa hidrojeni katika palladium inategemea shinikizo la gesi ya H 2 iliyotumiwa, lakini kwa mtindo mgumu zaidi kuliko inaweza kuelezwa na sheria ya Henry. Chini ya hali fulani, 0.94 g ya gesi ya hidrojeni hupasuka katika 215 g ya chuma cha palladium.
- Kuamua molarity ya suluhisho hili (wiani wa ufumbuzi = 1.8 g/cm 3).
- Kuamua molality ya suluhisho hili (wiani wa ufumbuzi = 1.8 g/cm 3).
- Kuamua asilimia kwa wingi wa atomi za hidrojeni katika suluhisho hili (wiani wa ufumbuzi = 1.8 g/cm 3).
S11.2.7
http://cnx.org/contents/ MH6aqeGX @2 /Mchakato wa Kutengana
11.3: Electrolytes
Q11.3.1
Eleza kwa nini ions Na + na Cl - ni nguvu solvated katika maji lakini si katika hexane, kutengenezea linajumuisha molekuli nonpolar.
S11.3.2
Fuwele za NaCl hupasuka ndani ya maji, kioevu cha polar na wakati mkubwa sana wa dipole, na ions za mtu binafsi zinatengenezwa sana. Hexane ni kioevu kisicho na polar na wakati wa dipole wa sifuri na kwa hiyo, hauingiliani sana na ions za fuwele za NaCl.
Q11.3.2
Eleza kwa nini ufumbuzi wa HbR katika benzini (kutengenezea nonpolar) hauna conductive, wakati ufumbuzi katika maji (kutengenezea polar) ni conductive.
S11.3.2
HbR ni asidi na hivyo molekuli zake huguswa na molekuli za maji ili kuunda H 3 O + na Br - ions zinazotoa conductivity kwa suluhisho. Ingawa HbR ni mumunyifu katika benzini, haina kuguswa kemikali lakini bado kufutwa kama molekuli neutral HbR. Kwa ions hakuna zilizopo katika suluhisho la benzini, ni umeme usio na conductive.
Q11.3.3
Fikiria ufumbuzi uliowasilishwa:
(a) Ni ipi kati ya michoro zifuatazo bora inawakilisha ions katika suluhisho la Fe (NO 3) 3 (aq)?
3_img.jpg") " style="width: 570px; height: 191px;" src="https://chem.libretexts.org/@api/dek...(NO3)3_img.jpg" width="570px" height="191px">
" style="width: 570px; height: 191px;" src="https://chem.libretexts.org/@api/dek...(NO3)3_img.jpg" width="570px" height="191px">
(b) Andika usawa wa kemikali unaoonyesha bidhaa za kufutwa kwa Fe (NO 3) 3.
S11.3.3
(a) Fe (NO 3) 3 ni electrolyte yenye nguvu, kwa hiyo inapaswa kugawanya kabisa katika Fe 3+ na\(\ce{(NO3- )}\) ions. Kwa hiyo, (z) bora inawakilisha suluhisho. (b)\(\ce{Fe(NO3)3}(s)⟶\ce{Fe^3+}(aq)+\ce{3NO3- }(aq)\)
Q11.3.4
Linganisha taratibu zinazotokea wakati methanol (CH 3 OH), kloridi hidrojeni (HCl), na hidroksidi ya sodiamu (NaOH) kufutwa katika maji. Andika equations na kuandaa michoro inayoonyesha fomu ambayo kila moja ya misombo hii iko katika suluhisho lake.
S11.3.3
Methanol\(CH_3OH\), hupasuka katika maji kwa kiwango kikubwa, kuingiliana kupitia bonding hidrojeni.
Methanoli:
\[CH_3OH_{(l)}+H_2O_{(l)}⟶CH_3OH_{(aq)}\]
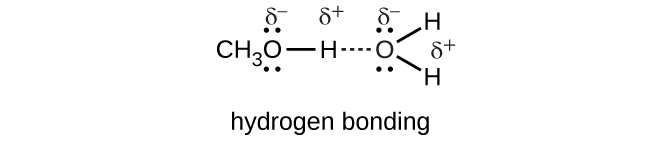
Hidrojeni hidrojeni, HCl, dissolves ndani na humenyuka na maji ili kuzalisha cations hydronium na anions kloridi kwamba ni solvated na mwingiliano nguvu ion-dipole.
Kloridi hidrojeni:
\[HCl{(g)}+H_2O_{(l)} \rightarrow H_3O^+_{(aq)}+Cl^−_{(aq)}\]
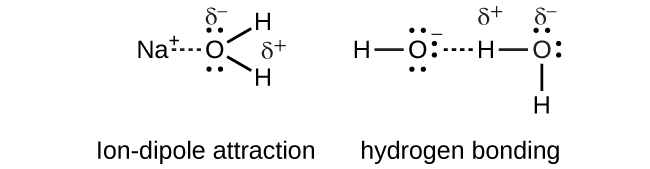
Sodium hydroxide, NaOH, dissolves in water and dissociates to yield sodium cations and hydroxide anions that are strongly solvated by ion-dipole interactions and hydrogen bonding, respectively.
Sodium hydroxide:
\[NaOH_{(s)} \rightarrow Na^+_{(aq)} + OH^−_{(aq)}\]
Q11.3.5
Je! Ni conductivity ya umeme inayotarajiwa ya ufumbuzi wafuatayo?
- NaOh (aq)
- HCl (aq)
- C 6 H 12 O 6 (aq) (glucose)
- NH (3 l)
S11.3.5
(a) conductivity ya juu (solute ni kiwanja cha ionic ambacho kitatenganisha wakati kufutwa); (b) conductivity ya juu (solute ni asidi kali na itaionize kabisa wakati kufutwa); (c) nonconductive (solute ni kiwanja covalent, wala asidi wala msingi, unreactive kuelekea maji); (d) conductivity chini (solute ni msingi dhaifu na itakuwa sehemu ionize wakati kufutwa)
Q11.3.6
Kwa nini imara zaidi ionic misombo umeme nonconductive, wakati ufumbuzi wa maji ya misombo ionic ni conductors nzuri? Je, unatarajia kioevu (kuyeyuka) kiwanja ionic kuwa umeme conductive au nonconductive? Eleza.
S11.3.6
Ya kati lazima iwe na uhuru wa simu, vyombo vya kushtakiwa kuwa umeme conductive. Ions zilizopo katika imara ya ionic imara ni immobilized katika bandia ya fuwele na hivyo imara haiwezi kusaidia sasa umeme. Wakati ions ni kuhamasishwa, ama kwa kuyeyuka imara au kufuta ndani ya maji ili kuondokana na ions, sasa inaweza kati yake na aina hizi za kiwanja ionic ni conductive.
Q11.3.7
Eleza aina muhimu zaidi ya kivutio cha intermolecular inayohusika na ufumbuzi katika kila ufumbuzi wafuatayo:
- ufumbuzi katika Kielelezo
- methanol, CH 3 OH, kufutwa katika ethanol, C 2 H 5 OH
- methane, CH 4, kufutwa katika benzini, C 6 H 6
- halocarbon polar CF 2 Cl 2 kufutwa katika halocarbon polar CF 2 clcfCl 2
- O 2 (l) katika N 2 (l)
S11.3.7
(a) ion-dipole; (b) vifungo vya hidrojeni; (c) vikosi vya utawanyiko; (d) vivutio vya dipole-dipole; (e) vikosi vya utawanyiko
11.4: umumunyifu
Q11.4.1
Tuseme umewasilishwa na suluhisho wazi la thiosulfate ya sodiamu, Na 2 S 2 O 3. Unawezaje kuamua kama suluhisho ni unsaturated, ulijaa, au supersaturated?
S11.4.1
Kuongeza kioo ndogo ya\(Na_2S_2O_3\). Itafuta katika suluhisho lisilojaa, kubaki inaonekana bila kubadilika katika suluhisho lililojaa, au kuanzisha mvua katika suluhisho la supersaturated.
Q11.4.2
Ufumbuzi wa supersaturated wa yabisi zaidi katika maji huandaliwa na ufumbuzi uliojaa baridi. Ufumbuzi mkubwa wa gesi nyingi katika maji huandaliwa na ufumbuzi uliojaa joto. Eleza sababu za tofauti katika taratibu mbili.
S11.4.2
Umumunyifu wa yabisi kawaida hupungua juu ya baridi suluhisho, wakati umumunyifu wa gesi kwa kawaida hupungua inapokanzwa.
Q11.4.3
Pendekeza maelezo ya uchunguzi kwamba ethanol, C 2 H 5 OH, ni kabisa miscible na maji na kwamba ethanethiol, C 2 H 5 SH, ni mumunyifu tu kwa kiwango cha 1.5 g kwa 100 ml ya maji.
S11.4.3
Vifungo vya hidrojeni kati ya maji na C 2 H 5 OH ni nguvu zaidi kuliko vivutio vya intermolecular kati ya maji na C 2 H 5 SH.
Q11.4.4
Tumia asilimia kwa wingi wa KBR katika suluhisho iliyojaa ya KBR katika maji saa 10 °C kwa kutumia takwimu zifuatazo kwa data muhimu, na ripoti asilimia iliyohesabiwa kwa tarakimu moja muhimu.

Grafu hii inaonyesha jinsi umumunyifu wa yabisi kadhaa hubadilika na joto.
S11.4.4
Katika 10 °C umumunyifu wa KBR katika maji ni takriban 60 g kwa 100 g ya maji.
\[\%\; KBr =\dfrac{60\; g\; KBr}{(60+100)\;g\; solution} = 40\%\]
Q11.4.5
Ni ipi kati ya gesi zifuatazo zinatarajiwa kuwa mumunyifu zaidi katika maji? Eleza hoja zako.
- CH 4
- cCl 4
- ChCl 3
S11.4.5
(c) ChCl 3 inatarajiwa kuwa mumunyifu zaidi katika maji. Kati ya gesi tatu, hii pekee ni polar na hivyo ina uwezo wa kupata kivutio kikubwa cha dipole-dipole kwa molekuli za maji.
Q11.4.6
Katika 0 °C na 1.00 atm, kiasi cha 0.70 g ya O 2 kinaweza kufutwa katika 1 L ya maji. Katika 0 °C na 4.00 atm, ni gramu ngapi za O 2 zinazopasuka katika 1 L ya maji?
S11.4.6
Tatizo hili linahitaji matumizi ya sheria ya Henry. equation inayoongoza ni\(C_g = kP_g\).
\[k=\dfrac{C_g}{P_g}=\dfrac{0.70\;g}{1.00\; atm} =0.70\;g\; atm^{−1}\]
Chini ya hali mpya,\(C_g=0.70\;g\;atm^{−1} \times 4.00\; atm = 2.80\; g\).
Q11.4.7
Rejea takwimu zifuatazo kwa maswali matatu yafuatayo:

- Je, mkusanyiko wa CO 2 iliyovunjwa katika kinywaji ilibadilikaje wakati chupa ilifunguliwa?
- Ni nini kilichosababisha mabadiliko haya?
- Je! Kinywaji kisichojaa, kilichojaa, au kilichopandwa na CO 2?
S11.4.7
(a) Ilipungua kama baadhi ya gesi CO 2 kushoto ufumbuzi (inavyothibitishwa na effervescence). (b) Kufungua chupa iliyotolewa high-shinikizo CO 2 gesi juu ya kinywaji. Kupunguza shinikizo la gesi la CO 2, kwa sheria ya Henry, hupunguza umumunyifu kwa CO 2. (c) Ukolezi wa CO 2 uliofutwa utaendelea kupungua kwa polepole mpaka usawa utakaporudishwa kati ya kinywaji na shinikizo la gesi la chini sana la CO 2 kwenye chupa iliyofunguliwa. Mara baada ya ufunguzi, kinywaji, kwa hiyo, kina CO 2 kufutwa katika mkusanyiko mkubwa kuliko umumunyifu wake, hali isiyo ya usawa, na inasemekana kuwa supersaturated.
Q11.4.8
Sheria ya Henry mara kwa mara kwa CO 2 ni\(3.4 \times 10^{−2}\; M/atm\) saa 25 °C Ni shinikizo gani la dioksidi kaboni inahitajika ili kudumisha mkusanyiko wa CO 2 wa 0.10 M katika uwezo wa soda ya limao-chokaa?
S11.4.8
\[P_g=\dfrac{C_g}{k}=\dfrac{0.10\; M}{3.4 \times 10^{−2}\;M/atm} =2.9\; atm\]
Q11.4.9
Sheria ya Henry mara kwa mara kwa O 2 ni\(1.3\times 10^{−3}\; M/atm\) saa 25 °C Ni umati gani wa oksijeni ungeweza kufutwa katika aquarium 40-L saa 25 °C, kuchukua shinikizo la anga la atm 1.00, na kwamba shinikizo la sehemu ya O 2 ni 0.21 atm?
S11.4.9
Anza na sheria ya Henry
\[C_g=kP_g\]
na kuitumia\(O_2\)
\[C(O_2)=(1.3 \times 10^{−3}\; M/atm) (0.21\;atm)=2.7 \times 10^{−4}\;mol/L\]
Kiasi cha jumla ni\ (2.7\ mara 10^ {4-7}\; Mol/L) (40\; L = 1.08\ mara 10^ {¯ 2}\; mol\]
Uzito wa oksijeni ni\((1.08 \times 10^{−2}\; mol)(32.0\; g/mol)=0.346\;g\)
au, kwa kutumia takwimu mbili muhimu,\(0.35\; g\).
Q11.4.10
Ni lita ngapi za gesi ya HCl, kipimo cha 30.0° C na 745 torr, zinahitajika kuandaa 1.25 L ya suluhisho la 3.20- M ya asidi hidrokloriki?
S11.4.10
Kwanza, mahesabu ya moles ya HCl inahitajika. Kisha kutumia sheria bora ya gesi ili kupata kiasi kinachohitajika.
M = MOL L-1
3.20m=xmol1.25L
x = 4.00 ml HCl
Kabla ya kutumia sheria bora ya gesi, mabadiliko ya shinikizo kwa anga na kubadilisha joto kutoka °C hadi kelvin.
\ [1\; atmx = 760torr745torr
x = 0.9803 atm
V= nRTP =( 4.000molHCl) (0.08206latmk-1mol-1) (303.15K) 0.9803atm=102 L HCl
102 L HCl
zaidi http://cnx.org/contents/ 2488FW6w @2 /umumunyifu
11.5: Mali ya Colligative
Q11.5.1
Ambayo ni/ni sehemu ya ufumbuzi macroscopic uwanja na ambayo ni/ni sehemu ya uwanja microscopic: kiwango cha kuchemsha mwinuko, sheria ya Henry, dhamana hidrojeni, ion-dipole kivutio, molarity, nonelectrolyte, nonstoichiometric kiwanja, osmosis, solvated ion?
Q11.5.2
Je, ni maelezo microscopic kwa tabia macroscopic mfano katika [kiungo]?
S11.5.2
Nguvu ya vifungo kati ya molekuli kama ni nguvu kuliko nguvu kati ya tofauti na molekuli. Kwa hiyo, baadhi ya mikoa yatakuwapo ambapo molekuli za maji zitatenganisha molekuli za mafuta na mikoa mingine itakuwapo ambapo molekuli za mafuta zitatenganisha molekuli za maji, na kutengeneza kanda isiyo ya kawaida.
Q11.5.3
Mchoro grafu ya ubora wa shinikizo dhidi ya muda wa mvuke wa maji juu ya sampuli ya maji safi na suluhisho la sukari, kama vinywaji vinavyogeuka hadi nusu ya kiasi chao cha awali.
Q11.5.4
ufumbuzi wa nitrati potassium, electrolyte, na ufumbuzi wa glycerin (C 3 H 5 (OH) 3), nonelectrolyte, wote kuchemsha katika 100.3 °C Nini mali nyingine ya kimwili ya ufumbuzi mbili ni sawa?
S11.5.4
Wote huunda ufumbuzi wa homogeneous; upeo wao wa kiwango cha kuchemsha ni sawa, kama vile kupungua kwa shinikizo la mvuke. Shinikizo la Osmotic na kupungua kwa hatua ya kufungia pia ni sawa kwa ufumbuzi wote.
Q11.5.5
Je! Ni sehemu gani za mole za H 3 PO 4 na maji katika suluhisho la 14.5 g ya H 3 PO 4 katika 125 g ya maji?
Q11.5.6
Je! Ni sehemu gani za mole za HNO 3 na maji katika suluhisho la kujilimbikizia la asidi ya nitriki (68.0% HNO 3 kwa wingi)?
S11.5.6
- Pata idadi ya moles ya HNO 3 na H 2 O katika 100 g ya suluhisho. Pata vipande vya mole kwa vipengele.
- Sehemu ya mole ya HNO 3 ni 0.378. Sehemu ya mole ya H 2 O ni 0.622.
Q11.5.7
Tumia sehemu ya mole ya kila solute na kutengenezea:
- 583 g ya H 2 SO 4 katika kilo 1.50 ya maji-ufumbuzi asidi kutumika katika betri ya magari
- 0.86 g ya NaCl katika 1.00 × 10 2 g ya maji-suluhisho la kloridi ya sodiamu kwa sindano ya ndani
- 46.85 g ya codeine, C 18 H 21 NO 3, katika 125.5 g ya ethanol, C 2 H 5 OH
- 25 g ya I 2 katika 125 g ya ethanol, C 2 H 5 OH
S11.5.7
a.\(583\:g\:\ce{H2SO4}\times\dfrac{1\:mole\:\ce{H2SO4}}{98.08\:g\:\ce{H2SO4}}=5.94\:mole\:\ce{H2SO4}\)\(\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\)\(1.50\:kg\:\ce{H2O}\times\dfrac{1000\:g}{1\:kg}\times\dfrac{1\:mole\:\ce{H2O}}{18.02\:g\:\ce{H2O}}=83.2\:moles\:\ce{H2O}\)
Q11.5.8
Tumia sehemu ya mole ya kila solute na kutengenezea:
- 0.710 kg ya carbonate ya sodiamu (soda ya kuosha), Na 2 CO 3, katika kilo 10.0 za maji—suluhisho iliyojaa saa 0 °C
- 125 g ya NH 4 NO 3 katika 275 g ya maji-mchanganyiko kutumika kutengeneza pakiti ya barafu papo
- 25 g ya Cl 2 katika 125 g ya dichloromethane, CH 2 Cl 2
- 0.372 g ya histamine, C 5 H 9 N, katika 125 g ya chloroform, ChCl 3
S11.5.8
- \(X_\mathrm{Na_2CO_3}=0.0119\);\(X_\mathrm{H_2O}=0.988\);
- \(X_\mathrm{NH_4NO_3}=0.9927\);\(X_\mathrm{H_2O}=0.907\);
- \(X_\mathrm{Cl_2}=0.192\);\(X_\mathrm{CH_2CI_2}=0.808\);
- \(X_\mathrm{C_5H_9N}=0.00426\);\(X_\mathrm{CHCl_3}=0.997\)
Q11.5.9
Tumia sehemu ndogo za methanol, CH 3 OH; ethanol, C 2 H 5 OH; na maji katika suluhisho ambalo ni 40% ya methanol, 40% ya ethanol, na maji 20% kwa wingi. (Kudhani data ni nzuri kwa takwimu mbili muhimu.)
Q11.5.10
Ni tofauti gani kati ya ufumbuzi wa 1 M na suluhisho la m 1?
S11.5.10
Katika suluhisho la M 1, mole imetokana na 1 L ya suluhisho. Katika suluhisho la m 1, mole imetokana na kilo 1 cha kutengenezea.
Q11.5.11
Je, ni molality ya asidi fosforasi, H 3 PO 4, katika suluhisho la 14.5 g ya H 3 PO 4 katika 125 g ya maji?
Q11.5.12
Je, ni molality ya asidi ya nitriki katika suluhisho la kujilimbikizia la asidi ya nitriki (68.0% HNO 3 kwa wingi)?
S11.5.12
(a) Kuamua molekuli ya molar ya HNO 3. Kuamua idadi ya moles ya asidi katika suluhisho. Kutoka kwa idadi ya moles na wingi wa kutengenezea, tambua molality. (b) m 33.7
Q11.5.13
Tumia molality ya kila moja ya ufumbuzi wafuatayo:
- 583 g ya H 2 SO 4 katika kilo 1.50 ya maji-ufumbuzi asidi kutumika katika betri ya magari
- 0.86 g ya NaCl katika 1.00 × 10 2 g ya maji-suluhisho la kloridi ya sodiamu kwa sindano ya ndani
- 46.85 g ya codeine, C 18 H 21 NO 3, katika 125.5 g ya ethanol, C 2 H 5 OH
- 25 g ya I 2 katika 125 g ya ethanol, C 2 H 5 OH
Q11.5.14
Tumia molality ya kila moja ya ufumbuzi wafuatayo:
- 0.710 kg ya carbonate ya sodiamu (soda ya kuosha), Na 2 CO 3, katika kilo 10.0 za maji—suluhisho iliyojaa saa 0°C
- 125 g ya NH 4 NO 3 katika 275 g ya maji-mchanganyiko kutumika kutengeneza pakiti ya barafu papo
- 25 g ya Cl 2 katika 125 g ya dichloromethane, CH 2 Cl 2
- 0.372 g ya histamine, C 5 H 9 N, katika 125 g ya chloroform, ChCl 3
S11.5.14
(a) 6.70 × 10 -1 m; (b) 5.67 m; (c) 2.8 m; (d) 0.0358 m
Q11.5.15
Mkusanyiko wa glucose, C 6 H 12 O 6, katika maji ya kawaida ya mgongo ni\(\mathrm{\dfrac{75\:mg}{100\:g}}\). Je, ni molality ya suluhisho?
Q11.5.16
Suluhisho la 13.0% la K 2 CO 3 kwa wingi lina wiani wa 1.09 g/cm 3. Tumia molality ya suluhisho.
S11.5.16
1.08 m
Q11.5.17
- Kwa nini 1 mol ya kloridi ya sodiamu huzuia kiwango cha kufungia cha kilo 1 cha maji karibu mara mbili kama 1 mol ya glycerini?
- Je! Ni kiwango gani cha kuchemsha cha suluhisho la 115.0 g ya sucrose, C 12 H 22 O 11, katika 350.0 g ya maji?
S11.5.17
- Kuamua molekuli ya molar ya sucrose; kuamua idadi ya moles ya sucrose katika suluhisho; kubadilisha wingi wa kutengenezea kwa vitengo vya kilo; kutoka kwa idadi ya moles na wingi wa kutengenezea, kuamua molality; kuamua tofauti kati ya kiwango cha kuchemsha cha maji na kiwango cha kuchemsha cha suluhisho; kuamua hatua mpya ya kuchemsha.
- 100.5 °C
Q11.5.18
Je, ni kiwango cha kuchemsha cha suluhisho la 9.04 g ya I 2 katika 75.5 g ya benzini, kwa kuzingatia I 2 ni nonvolatile?
Q11.5.19
Je, ni joto la kufungia la suluhisho la 115.0 g ya sucrose, C 12 H 22 O 11, katika 350.0 g ya maji, ambayo hufungua saa 0.0 °C wakati safi?
S11.5.19
(a) Kuamua molekuli ya molar ya sucrose; kuamua idadi ya moles ya sucrose katika suluhisho; kubadilisha wingi wa kutengenezea kwa vitengo vya kilo; kutoka kwa idadi ya moles na wingi wa kutengenezea, kuamua molality; kuamua tofauti kati ya joto la kufungia la maji na kufungia joto la suluhisho; kuamua joto jipya la kufungia. (b) -1.8 °C
Q11.5.20
Je! Ni hatua gani ya kufungia ya suluhisho la 9.04 g ya I 2 katika 75.5 g ya benzini?
Q11.5.21
Shinikizo la kiosmotiki la suluhisho la maji la 1.64 g ya Ca (NO 3) 2 katika maji saa 25 °C ni nini? Kiasi cha suluhisho ni 275 ml.
S11.5.21
(a) Kuamua molekuli ya molar ya Ca (NO 3) 2; kuamua idadi ya moles ya Ca (NO 3) 2 katika suluhisho; kuamua idadi ya moles ya ions katika suluhisho; kuamua molarity ya ions, basi shinikizo la osmotic. (b) 2.67 atm
Q11.5.22
Je, ni shinikizo la kiosmotiki la suluhisho la insulini ya bovini (molekuli ya molar, 5700 g mol -1) saa 18 °C ikiwa 100.0 ml ya suluhisho ina 0.103 g ya insulini?
Q11.5.23
Je, ni molekuli ya molar ya suluhisho la 5.00 g ya kiwanja katika 25.00 g ya tetrakloridi kaboni (bp 76.8 °C; K b = 5.02 °C/ m) ambayo huchemka saa 81.5 °C kwenye atm 1?
S11.5.24
(a) Kuamua mkusanyiko wa molal kutoka kwa mabadiliko katika kiwango cha kuchemsha na K b; kuamua moles ya solute katika suluhisho kutoka kwa mkusanyiko wa molal na wingi wa kutengenezea; kuamua molekuli ya molar kutoka kwa idadi ya moles na wingi wa solute. (b) 2.1 × 10 2 g mol -1
Q11.5.25
Sampuli ya kiwanja kikaboni (nonelectrolyte) yenye uzito wa 1.35 g ilipunguza kiwango cha kufungia cha 10.0 g ya benzini kwa 3.66 °C.
Q11.5.26
Suluhisho la 1.0 m la HCl katika benzini lina kiwango cha kufungia cha 0.4 °C Je, hCl ni electrolyte katika benzini? Eleza.
S11.5.26
Hapana. Benzini safi inafungia saa 5.5 °C, na hivyo hatua ya kufungia iliyozingatiwa ya suluhisho hili inakabiliwa na Δ T f = 5.5 ÷ 0.4 = 5.1 °C Thamani iliyohesabiwa, bila kuchukua ionization ya hCl, ni Δ T f = (1.0 m) (5.14° C/ m) = 5.1 °C Mkataba wa maadili haya inasaidia dhana kwamba HCl si ionized.
Q11.5.27
Suluhisho lina 5.00 g ya urea, CO (NH 2) 2, kiwanja kisichozidi, kilichopasuka katika kilo 0.100 cha maji. Ikiwa shinikizo la mvuke la maji safi kwenye 25 °C ni 23.7 torr, shinikizo la mvuke la suluhisho ni nini?
Q11.5.28
Sampuli ya 12.0-g ya nonelectrolyte inafutwa katika 80.0 g ya maji. Suluhisho linafungia saa -1.94 °C Tathmini ya molekuli ya molar ya dutu hii.
S11.5.28
144 g mol-1
Q11.5.29
Panga ufumbuzi zifuatazo ili kupungua kwa pointi zao za kufungia: 0.1 m Na 3 PO 4, 0.1 m C 2 H 5 OH, 0.01 m CO 2, 0.15 m NaCl, na 0.2 m CaCl 2.
Q11.5.30
Tumia kiwango cha kuchemsha cha kilogramu 0.100 ya maji iliyo na 0.010 mol ya NaCl, 0.020 mol ya Na 2 SO 4, na 0.030 mol ya MgCl 2, kuchukua dissociation kamili ya electrolytes hizi.
S11.5.30
0.870 °C
Q11.5.31
Unawezaje kuandaa suluhisho la maji ya 3.08 m ya glycerini, C 3 H 8 O 3? Je! Ni hatua gani ya kufungia ya suluhisho hili?
Q11.5.32
Sampuli ya sulfuri yenye uzito wa 0.210 g ilifutwa katika 17.8 g ya disulfidi kaboni, CS 2 (K b = 2.43° C/ m). Ikiwa kiwango cha kuchemsha kilikuwa 0.107 °C, ni formula gani ya molekuli ya sulfuri katika disulfidi kaboni?
S11.5.32
S 8
Q11.5.33
Katika jaribio kubwa lililofanyika miaka mingi iliyopita, 5.6977 g ya iodidi ya cadmium katika 44.69 g ya maji iliinua kiwango cha kuchemsha 0.181 °C Hii inaonyesha nini kuhusu asili ya suluhisho la CDi 2?
Q11.5.34
Lysozyme ni enzyme inayounganisha kuta za seli. Sampuli ya 0.100-L ya suluhisho la lysozyme iliyo na 0.0750 g ya enzyme inaonyesha shinikizo la kiosmotiki la 1.32 × 10 -3 atm saa 25 °C Ni nini molekuli ya molar ya lysozyme?
S11.5.34
1.39 × 10 4 g mol -1
Q11.5.35
Shinikizo la kiosmotiki la suluhisho lililo na 7.0 g ya insulini kwa lita ni 23 torr saa 25 °C.
Q11.5.36
Shinikizo la kiosmotiki la damu ya binadamu ni 7.6 atm saa 37 °C Ni masi gani ya glucose, C 6 H 12 O 6, inahitajika kufanya 1.00 L ya suluhisho la maji kwa ajili ya kulisha ndani ya mishipa ikiwa suluhisho lazima liwe na shinikizo la kiosmotiki sawa na damu kwenye joto la mwili, 37 °C?
S11.5.36
54 g
Q11.5.37
Je, ni hatua ya kufungia ya suluhisho la dibromobenzene, C 6 H 4 Br 2, katika kilo 0.250 ya benzini, ikiwa suluhisho la kuchemsha saa 83.5° C?
Q11.5.38
Je, ni kiwango gani cha kuchemsha cha suluhisho la NaCl ndani ya maji ikiwa suluhisho linafungia saa -0.93 °C?
S11.5.38
100.26 °C
Q11.5.39
Fructose ya sukari ina 40.0% C, 6.7% H, na 53.3% O kwa wingi. Suluhisho la 11.7 g ya fructose katika 325 g ya ethanol ina kiwango cha kuchemsha cha 78.59 °C Kiwango cha kuchemsha cha ethanol ni 78.35 °C, na K b kwa ethanol ni 1.20 °C/ m. Fomu ya Masi ya fructose ni nini?
Q11.5.40
Shinikizo la mvuke la methanoli, CH 3 OH, ni 94 torr saa 20 °C. shinikizo la mvuke wa ethanol, C 2 H 5 OH, ni 44 torr kwa joto sawa.
- Tumia sehemu ya mole ya methanol na ya ethanol katika suluhisho la 50.0 g ya methanol na 50.0 g ya ethanol.
- Ethanol na methanol huunda suluhisho linalofanya kama suluhisho bora. Tumia shinikizo la mvuke la methanoli na la ethanoli juu ya suluhisho saa 20 °C.
- Tumia sehemu ya mole ya methanol na ya ethanol katika mvuke juu ya suluhisho.
S11.5.40
(a)\(X_\mathrm{CH_3OH}=0.590\)\(X_\mathrm{C_2H_5OH}=0.410\); (b) shinikizo la mvuke ni: CH 3 OH: 55 torr; C 2 H 5 OH: 18 torr; (c) CH 3 OH: 0.75; C 2 H 5 OH: 0.25
Q11.5.41
Sehemu tatu ya maji ya hewa ya bure hufafanuliwa kama 273.15 K. kwa nini ni muhimu kuwa maji kuwa huru ya hewa?
Q11.5.42
Nyama inaweza kuainishwa kuwa safi (si iliyohifadhiwa) ingawa imehifadhiwa kwenye -1 °C Kwa nini nyama haiwezi kufungia kwenye halijoto hili?
S11.5.42
Ions na misombo zilizopo ndani ya maji ndani ya ng'ombe hupunguza kiwango cha kufungia cha ng'ombe chini ya -1 °C.
Q11.5.43
Kiwanja cha kikaboni kina muundo wa 93.46% C na 6.54% H kwa wingi. Suluhisho la 0.090 g ya kiwanja hiki katika 1.10 g ya kafuri huyeyuka saa 158.4 °C Kiwango cha kuyeyuka cha kafuri safi ni 178.4 °C K f kwa kafuri ni 37.7 °C/ m. Fomu ya Masi ya solute ni nini? Onyesha mahesabu yako.
Q11.5.44
Sampuli ya HgCl 2 yenye uzito wa 9.41 g inafutwa katika 32.75 g ya ethanol, C 2 H 5 OH (K b = 1.20° C/ m). Kiwango cha kuchemsha cha suluhisho ni 1.27 °C Je, HgCl 2 ni electrolyte katika ethanol? Onyesha mahesabu yako.
S11.5.44
\(\mathrm{Δbp}=K_\ce{b}m=(1.20\:°\ce C/m)\mathrm{\left(\dfrac{9.41\:g×\dfrac{1\:mol\: HgCl_2}{271.496\:g}}{0.03275\:kg}\right)=1.27\:°\ce C}\)
Mabadiliko yaliyoonekana yanafanana na mabadiliko ya kinadharia; kwa hiyo, hakuna kujitenga hutokea.
Q11.5.45
Chumvi inajulikana kuwa fluoride ya chuma ya alkali. Uamuzi wa haraka wa takriban wa kiwango cha kufungia unaonyesha kuwa 4 g ya chumvi iliyovunjwa katika g 100 ya maji hutoa suluhisho linalofungia saa -1.4 °C. Onyesha mahesabu yako.
11.6: Colloids
Q11.6.1
Kutambua awamu kutawanyika na kati ya utawanyiko katika kila moja ya mifumo ifuatayo colloidal: wanga utawanyiko, moshi, ukungu, lulu, malai, sabuni yaliyo, jelly, maziwa, akiki.
S11.6.1
| Mfumo wa Colloidal | Awamu ya kutawanyika | Utawanyiko kati |
|---|---|---|
| wanga utawanyiko | wanga | maji |
| moshi | chembe imara | hewa |
| ukungu | maji | hewa |
| lulu | maji | calcium carbonate (CaCO 3) |
| kuchapwa cream | hewa | malai |
| sabuni inayozunguka | hewa | sabuni |
| jeli | juisi ya matunda | gel ya pectini |
| maziwa | butterfat | maji |
| rubi | oksidi ya chromium (III) (Cr 2 O 3) | oksidi ya alumini (Al 2 O 3) |
Q11.6.2
Tofautisha kati ya mbinu za usambazaji na mbinu za condensation za kuandaa mifumo ya colloidal
S11.6.2
Mbinu za utawanyiko hutumia kifaa cha kusaga au njia nyingine za kuleta ugawaji wa chembe kubwa. Mbinu za condensation huleta vitengo vidogo pamoja ili kuunda kitengo kikubwa. Kwa mfano, molekuli za maji katika hali ya mvuke hukusanyika ili kuunda matone madogo sana tunayoyaona kama mawingu.
Q11.6.3
Je, colloids hutofautiana na ufumbuzi kuhusiana na ukubwa wa chembe iliyoenea na homogeneity?
S11.6.3
Ugawanyiko wa colloidal unajumuisha chembe ambazo ni kubwa zaidi kuliko solutes ya ufumbuzi wa kawaida. Chembe za colloidal ni ama molekuli kubwa sana au aggregates ya spishi ndogo ambazo kwa kawaida ni kubwa ya kutosha kuwatawanya mwanga. Colloids ni sawa na kiwango cha macroscopic (Visual), wakati ufumbuzi ni sawa na kiwango cha microscopic (Masi).
Q11.6.4
Eleza hatua ya utakaso wa sabuni.
S11.6.4
Molekuli ya sabuni ina mwisho wa hydrophobic na hydrophilic. Mwisho wa kushtakiwa (hydrophilic), ambao huhusishwa na ioni ya chuma ya alkali, huhakikisha umumunyifu wa maji. mwisho hydrophobic inaruhusu kivutio kwa mafuta, grisi, na vitu vingine sawa nonpolar ambayo kwa kawaida si kufuta katika maji lakini ni vunjwa katika suluhisho na molekuli sabuni.
Q11.6.5
Inawezaje kuonyeshwa kuwa chembe za colloidal zinashtakiwa umeme?
S11.6.5
Ikiwa huwekwa kwenye kiini cha electrolytic, chembe zilizoenea zitahamia kuelekea electrode ambayo hubeba malipo kinyume na malipo yao wenyewe. Katika electrode hii, chembe za kushtakiwa zitaondolewa na zitaunganisha kama usahihi.


