10.1: Vikosi vya Intermolecular
- Page ID
- 176137
- Eleza aina ya vikosi vya intermolecular iwezekanavyo kati ya atomi au molekuli katika awamu kufupishwa (vikosi vya utawanyiko, vivutio vya dipole-dipole, na bonding
- Kutambua aina ya vikosi vya intermolecular vinavyotokana na molekuli maalum kulingana na miundo yao
- Eleza uhusiano kati ya vikosi vya intermolecular vilivyopo ndani ya dutu na joto linalohusishwa na mabadiliko katika hali yake ya kimwili.
Kama ilivyokuwa kwa vitu vya gesi, nadharia ya molekuli ya kinetic inaweza kutumika kuelezea tabia ya yabisi na vinywaji. Katika maelezo yafuatayo, neno chembe litatumika kutaja atomu, molekuli, au ioni. Kumbuka kwamba tutatumia maneno maarufu “kivutio cha intermolecular” kutaja vikosi vya kuvutia kati ya chembe za dutu, bila kujali kama chembe hizi ni molekuli, atomi, au ions.
Fikiria mambo haya mawili ya mazingira ya kiwango cha molekuli katika suala imara, kioevu, na gesi:
- Vipande vilivyo katika imara vimejaa pamoja na mara nyingi hupangwa kwa muundo wa kawaida; katika kioevu, wao ni karibu pamoja na hakuna utaratibu wa kawaida; katika gesi, wao ni mbali mbali na hakuna utaratibu wa kawaida.
- Vipande vilivyo katika imara hutetemeka kuhusu nafasi za kudumu na hazihamia kwa ujumla kuhusiana na kila mmoja; katika kiowevu, huhamia kila mmoja lakini hubakia katika kuwasiliana kimsingi mara kwa mara; katika gesi, huhamia kwa kujitegemea isipokuwa wanapogongana.
Tofauti katika mali ya imara, kiowevu, au gesi huonyesha uwezo wa vikosi vya kuvutia kati ya atomi, molekuli, au ions zinazounda kila awamu. Awamu ambayo dutu ipo inategemea kiwango cha jamaa cha vikosi vyake vya intermolecular (IMF) na nguvu za kinetic (KE) za molekuli zake. IMF s ni majeshi mbalimbali ya kivutio ambayo inaweza kuwepo kati ya atomi na molekuli ya dutu kutokana na matukio ya umeme, kama itakuwa kina katika moduli hii. Vikosi hivi hutumikia kushikilia chembe karibu pamoja, ilhali KE ya chembe hutoa nishati zinazohitajika kushinda vikosi vya kuvutia na hivyo kuongeza umbali kati ya chembe. Kielelezo\(\PageIndex{1}\) unaeleza jinsi mabadiliko katika hali ya kimwili inaweza kuwa ikiwa na mabadiliko ya joto, hivyo, KE wastani, ya dutu fulani.
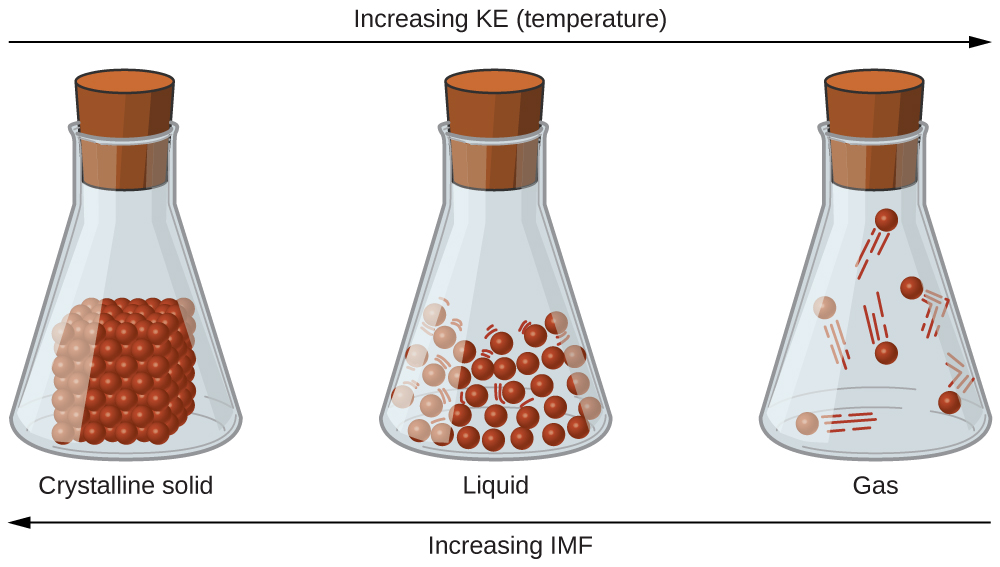
Kama mfano wa michakato iliyoonyeshwa katika takwimu hii, fikiria sampuli ya maji. Wakati maji ya gesi yanapozwa kwa kutosha, vivutio kati ya H 2 O molekuli vitakuwa na uwezo wa kuwashikilia pamoja wakati wanawasiliana; gesi hupungua, kutengeneza kioevu H 2 O. Kwa mfano, maji ya maji yanaunda nje ya kioo baridi kama maji mvuke katika hewa ni kilichopozwa na kioo baridi, kama inavyoonekana katika Kielelezo\(\PageIndex{2}\).

Tunaweza pia kunyunyiza gesi nyingi kwa kuzipunguza, ikiwa hali ya joto sio juu sana. Shinikizo lililoongezeka huleta molekuli za gesi karibu pamoja, kiasi kwamba vivutio kati ya molekuli viwe vikali kuhusiana na KE yao. Kwa hiyo, huunda vinywaji. Butane, C 4 H 10, ni mafuta yaliyotumiwa katika nyepesi za kutosha na ni gesi kwenye joto la kawaida na shinikizo. Ndani ya compartment ya mafuta ya nyepesi, butane inakabiliwa na shinikizo linalosababisha condensation yake kwa hali ya kioevu, kama inavyoonekana kwenye Mchoro\(\PageIndex{3}\).

Hatimaye, ikiwa hali ya joto ya kioevu inakuwa ya kutosha chini, au shinikizo kwenye kioevu inakuwa ya kutosha juu, molekuli za kioevu hazina tena KE ya kutosha kushinda IMF kati yao, na fomu imara. Majadiliano ya kina zaidi ya mabadiliko haya na mengine ya hali, au mabadiliko ya awamu, hutolewa katika moduli ya baadaye ya sura hii.
Nguvu kati ya Molekuli
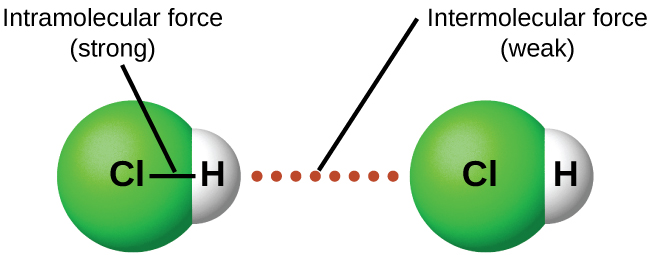
Chini ya hali zinazofaa, vivutio kati ya molekuli zote za gesi zitawafanya kuunda vinywaji au viboko. Hii ni kutokana na vikosi vya intermolecular, sio vikosi vya ndani vya Masi. Vikosi vya Masi ya Intra ni zile ndani ya molekuli zinazoweka molekuli pamoja, kwa mfano vifungo kati ya atomi. Majeshi ya Masi ya Inter ni vivutio kati ya molekuli, ambayo huamua mali nyingi za kimwili za dutu. Kielelezo\(\PageIndex{4}\) unaeleza majeshi haya mbalimbali Masi. Nguvu za vikosi hivi vya kuvutia hutofautiana sana, ingawa kwa kawaida IMF kati ya molekuli ndogo ni dhaifu ikilinganishwa na vikosi vya intramolecular vinavyounganisha atomi pamoja ndani ya molekuli. Kwa mfano, kuondokana na IMF katika mole moja ya HCl kioevu na kuibadilisha kuwa HCl ya gesi inahitaji tu kilojoules 17. Hata hivyo, kuvunja vifungo vya covalent kati ya atomi za hidrojeni na klorini katika mole moja ya HCl inahitaji takriban mara 25 zaidi ya nishati —kilojoules 430.
Vikosi vyote vya kuvutia kati ya atomi zisizo na upande wowote na molekuli zinajulikana kama vikosi vya van der Waals, ingawa kwa kawaida hujulikana zaidi rasmi kama kivutio cha intermolecular. Tutazingatia aina mbalimbali za IMF katika sehemu tatu zifuatazo za moduli hii.
Majeshi ya utawanyiko
Moja ya vikosi vitatu vya van der Waals iko katika awamu zote zilizofupishwa, bila kujali asili ya atomi au molekuli inayojumuisha dutu. Nguvu hii ya kuvutia inaitwa nguvu ya utawanyiko wa London kwa heshima ya mwanafizikia wa Marekani aliyezaliwa na Ujerumani Fritz London ambaye, mwaka wa 1928, alielezea kwanza. Nguvu hii mara nyingi hujulikana kama nguvu ya utawanyiko tu. Kwa sababu elektroni za atomi au molekuli ziko katika mwendo wa mara kwa mara (au, kwa njia nyingine, eneo la elektroni ni chini ya kutofautiana kwa quantum-mitambo), wakati wowote kwa wakati, atomi au molekuli inaweza kuendeleza dipole ya muda mfupi, instantaneous ikiwa elektroni zake zinasambazwa asymmetrically. Uwepo wa dipole hii unaweza, kwa upande wake, kupotosha elektroni za atomi jirani au molekuli, kuzalisha dipole iliyosababishwa. Hizi mbili kwa kasi fluctuating, dipoles muda hivyo kusababisha dhaifu kiasi mvuto umeme kati ya aina - kinachojulikana utawanyiko nguvu kama ile mfano katika Kielelezo\(\PageIndex{5}\).
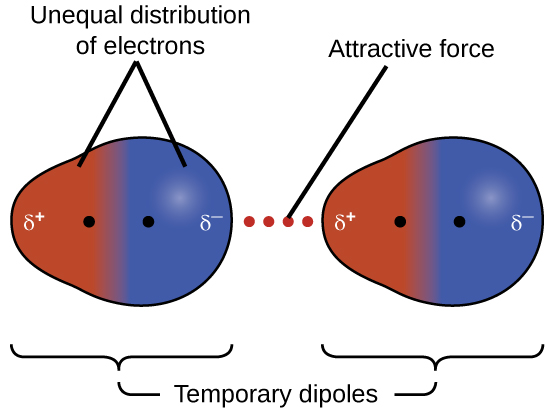
Vikosi vya utawanyiko vinavyoendelea kati ya atomi katika molekuli mbalimbali vinaweza kuvutia molekuli hizo mbili kwa kila mmoja. Majeshi ni dhaifu kiasi, hata hivyo, na kuwa muhimu tu wakati molekuli ni karibu sana. Atomi kubwa na nzito na molekuli zinaonyesha nguvu za utawanyiko kuliko atomi ndogo na nyepesi na molekuli. F 2 na Cl 2 ni gesi kwenye joto la kawaida (kuonyesha nguvu dhaifu za kuvutia); Br 2 ni kioevu, na mimi 2 ni imara (kuonyesha nguvu za kuvutia). Mwelekeo wa kiwango cha kuyeyuka na kuchemsha kwa halojeni huonyesha wazi athari hii, kama inavyoonekana katika Jedwali\(\PageIndex{1}\).
| Halogen | Misa ya molar | Radius Atomiki | Kiwango cha kiwango | Kiwango cha kuchemsha |
|---|---|---|---|---|
| florini, F 2 | 38 g/mol | 72 alasiri | 53 KM | 85 K |
| klorini, Cl 2 | 71 g/mol | 99 alasiri | 172 KM | 238 K |
| bromini, Br 2 | 160 g/mol | 11:14 alasiri | 266 K | 332 KM |
| iodini, mimi 2 | 254 g/mol | 133 alasiri | 387 K | 457 KM |
| astatine, Katika 2 | 420 g/mol | 150 alasiri | 575 K | 610 K |
Ongezeko la viwango vya kuyeyuka na kuchemsha kwa kuongezeka kwa ukubwa wa atomic/Masi inaweza kutambuliwa kwa kuzingatia jinsi nguvu za vikosi vya utawanyiko zinavyoathiriwa na muundo wa elektroniki wa atomi au molekuli katika dutu hii. Katika atomi kubwa, elektroni za valence ni, kwa wastani, mbali zaidi na nuclei kuliko katika atomi ndogo. Kwa hiyo, wao ni chini ya kushikilia na wanaweza kuunda kwa urahisi dipoles za muda ambazo zinazalisha kivutio. Kipimo cha jinsi ilivyo rahisi au vigumu kwa chaji nyingine ya umeme (kwa mfano ioni jirani au molekuli ya polar) kupotosha usambazaji wa malipo ya molekuli (wingu lake la elektroni) hujulikana kama polarizability. Molekuli ambayo ina wingu la chaji linalopotoshwa kwa urahisi inasemekana kuwa polarizable sana na itakuwa na vikosi vikubwa vya utawanyiko; moja yenye wingu la chaji ambalo ni vigumu kupotosha si polarizable sana na litakuwa na vikosi vidogo vya utawanyiko.
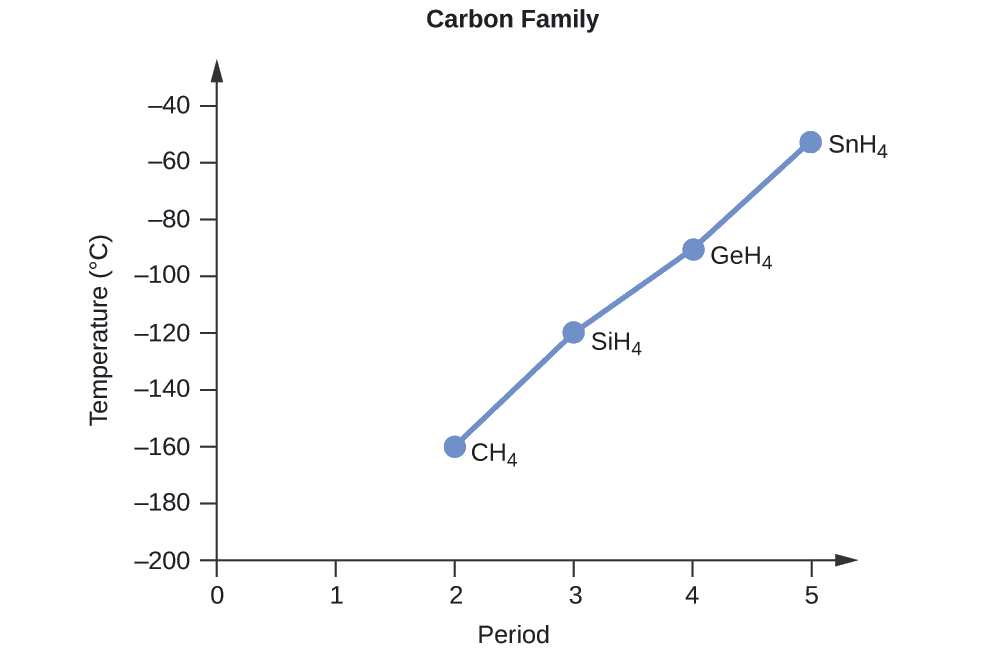
Amri misombo yafuatayo ya kipengele cha kikundi cha 14 na hidrojeni kutoka chini hadi kiwango cha juu cha kuchemsha: CH 4, SiH 4, GeH 4, na SnH 4. Eleza hoja zako.
Suluhisho
Kutumia ujuzi unaopatikana katika sura ya kemikali bonding na jiometri ya Masi, misombo hii yote ni alitabiri kuwa nonpolar, hivyo wanaweza uzoefu vikosi vya utawanyiko tu: ndogo molekuli, chini polarizable na dhaifu vikosi vya utawanyiko; kubwa molekuli, kubwa vikosi vya utawanyiko. Masi ya molar ya CH 4, SiH 4, GeH 4, na SNH 4 ni takriban 16 g/mol, 32 g/mol, 77 g/mol, na 123 g/mol, kwa mtiririko huo. Kwa hiyo, CH 4 inatarajiwa kuwa na kiwango cha chini cha kuchemsha na SnH 4 kiwango cha juu cha kuchemsha. Kuagiza kutoka chini hadi kiwango cha juu cha kuchemsha kinatarajiwa kuwa
CH 4 <SiH 4 <GeH 4 <SNH 4 <SH 4
Grafu ya pointi halisi ya kuchemsha ya misombo hii dhidi ya kipindi cha vipengele vya kikundi 14 inaonyesha utabiri huu kuwa sahihi:
Amri hidrokaboni zifuatazo kutoka chini hadi kiwango cha juu cha kuchemsha: C 2 H 6, C 3 H 8, na C 4 H 10.
- Jibu
-
Yote ya misombo hii ni nonpolar na ina tu majeshi ya usambazaji wa London: molekuli kubwa, vikosi vya utawanyiko mkubwa na kiwango cha juu cha kuchemsha. Kuagiza kutoka chini hadi kiwango cha juu cha kuchemsha ni kwa hiyo
C 2 H 6 <C 3 H 8 <C 4 H 10.
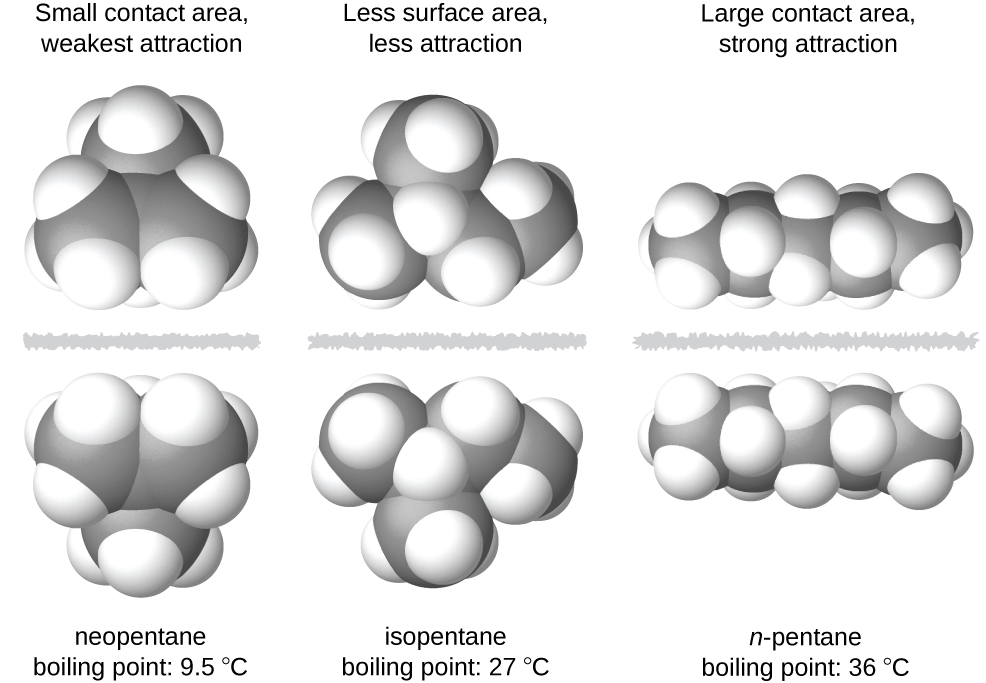
Maumbo ya molekuli pia huathiri ukubwa wa vikosi vya utawanyiko kati yao. Kwa mfano, pointi za kuchemsha kwa isoma n -pentane, isopentane, na neopentane (inavyoonyeshwa kwenye Kielelezo\(\PageIndex{6}\)) ni 36 °C, 27 °C, na 9.5 °C, mtawalia. Japokuwa misombo hii inajumuisha molekuli yenye formula sawa ya kemikali, C 5 H 12, tofauti katika pointi za kuchemsha zinaonyesha kuwa vikosi vya utawanyiko katika awamu ya kioevu ni tofauti, kuwa kubwa zaidi kwa n -pentane na angalau kwa neopentane. Sura ya mviringo ya n -pentane hutoa eneo kubwa la uso linalopatikana kwa kuwasiliana kati ya molekuli, na kusababisha nguvu zinazofanana na nguvu za utawanyiko. Sura ya kompakt zaidi ya isopentane inatoa eneo ndogo la uso inapatikana kwa mawasiliano ya intermolecular na, kwa hiyo, nguvu za utawanyiko dhaifu. Molekuli Neopentane ni kompakt zaidi ya tatu, sadaka angalau inapatikana eneo la uso kwa mawasiliano intermolecular na, kwa hiyo, nguvu dhaifu utawanyiko. Tabia hii ni sawa na uhusiano ambao unaweza kuundwa kati ya vipande vya fasteners za bidhaa za VELCRO: zaidi ya eneo la mawasiliano ya mstari, imara uhusiano.
Geckos wana uwezo wa kushangaza wa kuzingatia nyuso nyingi. Wanaweza haraka kukimbia juu ya kuta laini na katika taken kwamba hawana toe-ana, na wao kufanya hivyo bila ya kuwa na vikombe suction au dutu nata juu ya vidole vyao. Na wakati gecko inaweza kuinua miguu yake kwa urahisi kama inatembea kando ya uso, ikiwa unajaribu kuichukua, inashika kwenye uso. Je, geckos (pamoja na buibui na wadudu wengine) wanaweza kufanya hivyo? Ingawa jambo hili limechunguzwa kwa mamia ya miaka, wanasayansi hivi karibuni walifunua maelezo ya mchakato ambao unaruhusu miguu ya geckos kuishi kwa njia hii.

Vidole vya Gecko vinafunikwa na mamia ya maelfu ya nywele vidogo vinavyojulikana kama setae, huku kila seta, kwa upande wake, hujiunga na mamia ya vidokezo vidogo, vya gorofa, vya pembetatu vinavyoitwa spatulae. Idadi kubwa ya spatulae kwenye setae yake hutoa gecko, iliyoonyeshwa kwenye Kielelezo\(\PageIndex{7}\), na eneo kubwa la jumla la uso kwa kushikamana na uso. Mwaka 2000, Kellar Autumn, ambaye anaongoza timu ya utafiti wa gecko ya taasisi mbalimbali, iligundua kuwa geckos alifuata sawa vizuri kwa dioksidi ya polar silicon na arsenide isiyo ya polar gallium. Hii imeonekana kuwa geckos fimbo na nyuso kwa sababu ya vikosi utawanywa-dhaifu vivutio intermolecular inayotokana na muda, synchronized mgawanyo malipo kati ya mole Ingawa vikosi vya utawanyiko ni dhaifu sana, kivutio cha jumla juu ya mamilioni ya spatulae ni kikubwa cha kutosha kusaidia mara nyingi uzito wa gecko.
Mwaka 2014, wanasayansi wawili walitengeneza mfano wa kuelezea jinsi geckos zinaweza kuhamia haraka kutoka “fimbo” hadi “zisizo na fimbo.” Alex Greaney na Congcong Hu katika Chuo Kikuu cha Jimbo la Oregon walielezea jinsi geckos wanaweza kufikia hili kwa kubadilisha angle kati ya spatulae yao na uso. Miguu ya Geckos, ambayo kwa kawaida haifai, inakuwa fimbo wakati nguvu ndogo ya shear inatumiwa. Kwa kupindua na kuondosha vidole vyao, geckos inaweza kubadilisha kati ya kushikamana na kuondokana na uso, na hivyo huenda kwa urahisi. Uchunguzi zaidi unaweza hatimaye kusababisha maendeleo ya adhesives bora na maombi mengine.
Tazama video hii ili ujifunze zaidi kuhusu utafiti wa Kellar Autumn ulioamua kuwa vikosi vya van der Waals vinahusika na uwezo wa gecko wa kushikamana na kupanda.
Vivutio vya Dipole-Dipole
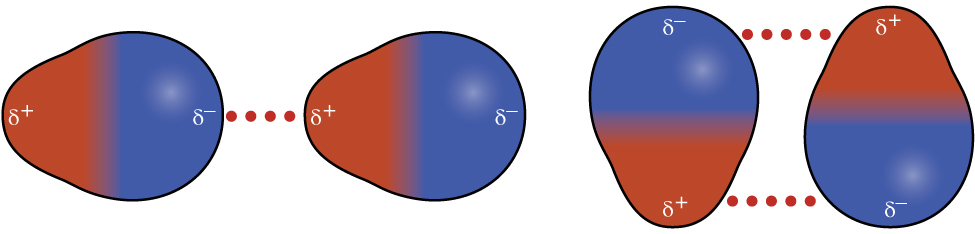
Kumbuka kutoka sura juu ya kemikali bonding na jiometri Masi kwamba molekuli polar na sehemu chanya malipo upande mmoja na sehemu hasi malipo upande wa pili wa molekuli - mgawanyo wa malipo aitwaye dipole. Fikiria molekuli ya polar kama vile kloridi hidrojeni, HCl. Katika molekuli ya HCl, atomi zaidi ya electronegative Cl huzaa malipo ya sehemu hasi, wakati atomi ya chini ya electronegative H huzaa malipo ya chanya ya sehemu. Nguvu ya kuvutia kati ya molekuli ya HCl inatokana na mvuto kati ya mwisho mzuri wa molekuli moja ya HCl na mwisho mbaya wa mwingine. Nguvu hii ya kuvutia inaitwa kivutio cha dipole-dipole - nguvu ya umeme kati ya mwisho wa sehemu nzuri ya molekuli moja polar na mwisho sehemu hasi ya mwingine, kama inavyoonekana katika Kielelezo\(\PageIndex{8}\).
Athari ya kivutio cha dipole-dipole inaonekana wakati sisi kulinganisha mali ya molekuli ya HCl kwa molekuli zisizo za polar F 2. HCl zote mbili na F 2 zinajumuisha idadi sawa ya atomi na zina takriban molekuli sawa ya molekuli. Katika joto la 150 K, molekuli ya dutu zote mbili ingekuwa sawa wastani KE. Hata hivyo, vivutio vya dipole-dipole kati ya molekuli ya HCl ni vya kutosha kuwafanya “kushikamana pamoja” ili kuunda kioevu, wakati nguvu za kutawanyika kiasi dhaifu kati ya molekuli zisizo za polar F 2 hazipo, na hivyo dutu hii ni gesi katika joto hili. Kiwango cha juu cha kawaida cha kuchemsha cha HCl (188 K) ikilinganishwa na F 2 (85 K) ni mfano wa nguvu kubwa ya vivutio vya dipole-dipole kati ya molekuli za HCl, ikilinganishwa na vivutio kati ya molekuli zisizo na polar F 2. Sisi mara nyingi kutumia maadili kama vile kuchemsha au kufungia pointi, au enthalpies ya vaporization au fusion, kama viashiria vya nguvu jamaa ya IMF ya kivutio sasa ndani ya vitu mbalimbali.
Kutabiri ambayo itakuwa na kiwango cha juu cha kuchemsha: N 2 au CO. Eleza hoja zako.
Suluhisho
CO na N 2 ni molekuli za diatomiki na raia wa karibu 28 amu, hivyo wanapata vikosi sawa vya utawanyiko wa London. Kwa sababu CO ni molekuli ya polar, inakabiliwa na vivutio vya dipole-dipole. Kwa sababu N 2 ni nonpolar, molekuli zake haziwezi kuonyesha vivutio vya dipole-dipole. Vivutio vya dipole-dipole kati ya molekuli za CO ni nguvu zaidi kuliko vikosi vya utawanyiko kati ya molekuli za nonpolar N 2, hivyo CO inatarajiwa kuwa na kiwango cha juu cha kuchemsha.
Njia ya kawaida ya kuandaa oksijeni ni utengano
Kutabiri ambayo itakuwa na kiwango cha juu cha kuchemsha:\(\ce{ICl}\) au\(\ce{Br2}\). Eleza hoja zako.
- Jibu
-
ICL. ICL na Br 2 wana raia sawa (~160 amu) na kwa hiyo hupata vikosi sawa vya utawanyiko wa London. iCl ni polar na hivyo pia huonyesha vivutio vya dipole-dipole; Br 2 ni nonpolar na haina. Vivutio vyenye nguvu vya dipole-dipole vinahitaji nishati zaidi kushinda, hivyo iCl itakuwa na kiwango cha juu cha kuchemsha.
hidrojeni kuunganishwa
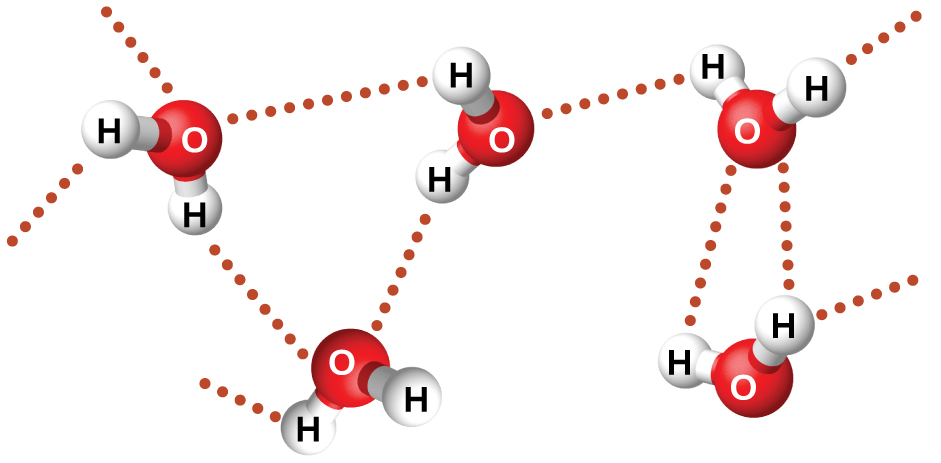
Nitrosyl fluoridi (ONF, molekuli molekuli 49 amu) ni gesi kwenye halijoto la kawaida. Maji (H 2 O, masi ya molekuli 18 amu) ni kiowevu, ingawa ina masi ya chini ya molekuli. Hatuwezi kuhusisha tofauti hii kati ya misombo miwili kwa vikosi vya utawanyiko. Molekuli zote mbili zina takriban umbo sawa na ONF ni molekuli nzito na kubwa. Kwa hiyo, inatarajiwa kupata vikosi muhimu zaidi utawanyiko. Zaidi ya hayo, hatuwezi kuhusisha tofauti hii katika pointi za kuchemsha kwa tofauti katika wakati wa dipole wa molekuli. Molekuli zote mbili ni polar na zinaonyesha wakati wa dipole sawa. Tofauti kubwa kati ya pointi ya kuchemsha ni kutokana na kivutio kikubwa cha dipole-dipole ambacho kinaweza kutokea wakati molekuli ina atomi ya hidrojeni iliyounganishwa na florini, oksijeni, au atomi ya nitrojeni (vipengele vitatu vya electronegative). Tofauti kubwa sana katika electronegativity kati ya atomi H (2.1) na atomi ambayo inaunganishwa (4.0 kwa atomi F, 3.5 kwa atomi O, au 3.0 kwa atomi N), pamoja na ukubwa mdogo sana wa atomi H na ukubwa mdogo wa F, O, au N atomi, husababisha sehemu yenye kujilimbikizia mashtaka na atomi hizi. Molekuli na F-H, O-H, au N-H moieties ni sana kuvutia kwa moieties sawa katika molekuli karibu, hasa nguvu aina ya dipole-dipole kivutio aitwaye hidrojeni bonding. Mifano ya vifungo vya hidrojeni ni pamoja na HF HF, H 2 OHOH, na H 3 NHNH 2, ambapo vifungo vya hidrojeni vinaashiria na dots. Kielelezo\(\PageIndex{9}\) unaeleza hidrojeni bonding kati molekuli
Licha ya matumizi ya neno “dhamana,” kukumbuka kwamba vifungo vya hidrojeni ni vikosi vya kuvutia vya kuvutia, sio nguvu za kuvutia za intramolecular (vifungo vya covalent). Vifungo vya hidrojeni ni dhaifu sana kuliko vifungo vya covalent, tu kuhusu 5 hadi 10% kama nguvu, lakini kwa ujumla ni nguvu zaidi kuliko vivutio vingine vya dipole-dipole na vikosi vya utawanyiko.
Vifungo vya hidrojeni vina athari inayojulikana juu ya mali ya awamu zilizopunguzwa (vinywaji na vikali). Kwa mfano, fikiria mwenendo wa pointi za kuchemsha kwa hidridi za binary za kikundi cha 15 (NH 3, PH 3, AsH 3, na SBH 3), kundi la 16 hidridi (H 2 O, H 2 S, H 2 Se, na H 2 Te), na kundi la 17 hydridi (HF, HCl, HbR, na HI). Pointi ya kuchemsha ya hydrides tatu zaidi kwa kila kikundi hupangwa kwenye Mchoro\(\PageIndex{10}\). Tunapoendelea chini yoyote ya makundi haya, polarities ya molekuli hupungua kidogo, wakati ukubwa wa molekuli huongezeka kwa kiasi kikubwa. Athari za vikosi vya usambazaji vinavyozidi nguvu hutawala ile ya vivutio vya dipole-dipole vinavyozidi kuwa dhaifu, na pointi za kuchemsha zinazingatiwa kuongezeka kwa kasi. Kwa kundi la 15, 16, na 17 hydrides, pointi za kuchemsha kwa kila darasa la misombo huongezeka na kuongezeka kwa molekuli ya Masi kwa vipengele katika vipindi 3, 4, na 5.
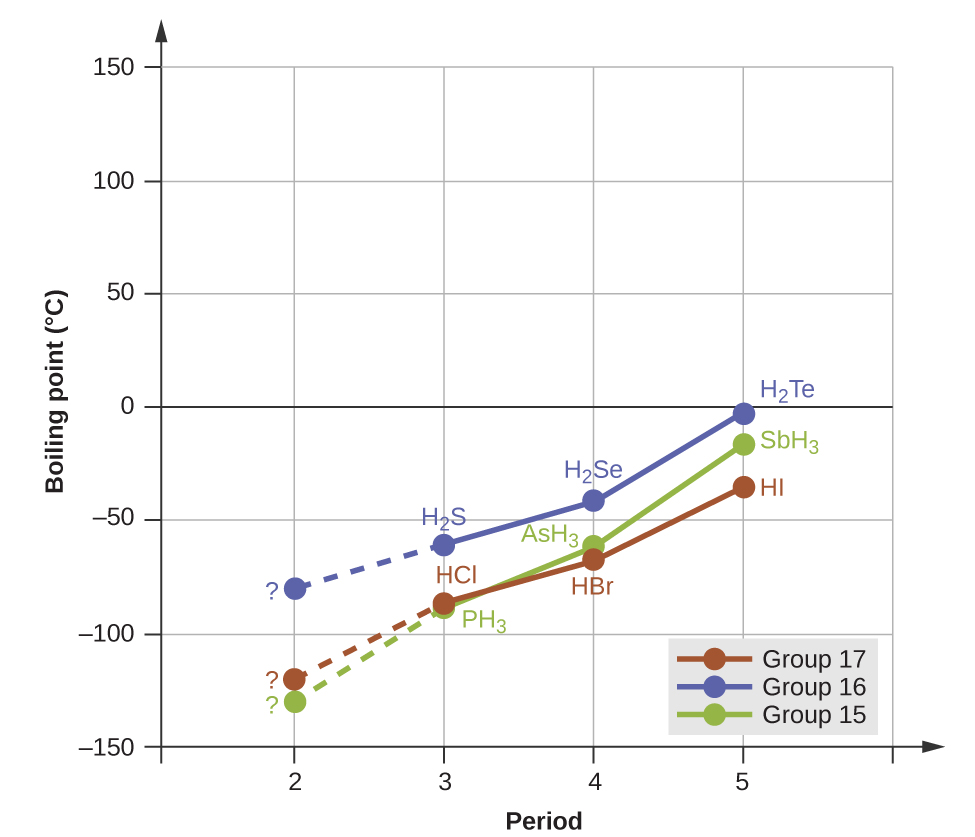
Ikiwa tunatumia mwenendo huu kutabiri pointi za kuchemsha kwa hidridi nyepesi zaidi kwa kila kikundi, tungetarajia NH 3 kuchemsha saa takriban -120 °C, H 2 O kuchemsha takriban -80 °C, na HF kuchemsha takriban -110 °C Hata hivyo, tunapopima pointi za kuchemsha kwa misombo hii, tunaona kuwa ni kasi ya juu kuliko mwenendo bila kutabiri, kama inavyoonekana katika Kielelezo\(\PageIndex{10}\). Tofauti kabisa kati ya utabiri wetu wa naïve na ukweli hutoa ushahidi wa kulazimisha kwa nguvu ya kuunganisha hidrojeni.
Fikiria misombo dimethylether (CH 3 OCH 3), ethanol (CH 3 CH 2 OH), na propane (CH 3 CH 2 CH 3). Vipande vyao vya kuchemsha, si lazima kwa utaratibu, ni -42.1 °C, -24.8 °C, na 78.4 °C Linganisha kila kiwanja na kiwango chake cha kuchemsha. Eleza hoja zako.
Suluhisho
VSEPR-alitabiri maumbo ya CH 3 OCH 3, CH 3 CH 2 OH, na CH 3 CH 2 CH 3 ni sawa, kama vile raia yao ya molar (46 g/mol, 46 g/mol, na 44 g/mol, kwa mtiririko huo), hivyo wataonyesha vikosi sawa vya utawanyiko. Kwa kuwa CH 3 CH 2 CH 3 ni nonpolar, inaweza kuonyesha vikosi vya utawanyiko tu. Kwa sababu CH 3 OCH 3 ni polar, itakuwa pia uzoefu vivutio dipole-dipole. Hatimaye, CH 3 CH 2 OH ina kundi -OH, na hivyo itakuwa uzoefu kipekee nguvu dipole-dipole kivutio inayojulikana kama hidrojeni bonding. Hivyo kuagiza kwa nguvu za IMF, na hivyo kuchemsha pointi, ni CH 3 CH 2 CH 3 <CH 3 = CH 3 OCH 3 <CH 3 CH 2 OH. Kiwango cha kuchemsha cha propane ni -42.1 °C, kiwango cha kuchemsha cha dimethylether ni -24.8 °C, na kiwango cha kuchemsha cha ethanoli ni 78.5 °C.
Ethane (CH 3 CH 3) ina kiwango cha kuyeyuka cha -183 °C na kiwango cha kuchemsha cha -89 °C Kutabiri pointi za kuyeyuka na kuchemsha kwa methylamine (CH 3 NH 2). Eleza hoja zako.
- Jibu
-
Kiwango cha kuyeyuka na kiwango cha kuchemsha kwa methylamini hutabiriwa kuwa kikubwa zaidi kuliko zile za ethane. CH 3 CH 3 na CH 3 NH 2 ni sawa katika ukubwa na wingi, lakini methylamine ina kundi -NH na kwa hiyo inaweza kuonyesha bonding hidrojeni. Hii huongeza sana IMF zake, na kwa hiyo pointi zake za kuyeyuka na za kuchemsha. Ni vigumu kutabiri maadili, lakini maadili yanayojulikana ni kiwango cha kuyeyuka cha -93 °C na kiwango cha kuchemsha cha -6 °C.
Kuunganisha hidrojeni na DNA
Asidi ya Deoxyribonucleic (DNA) hupatikana katika kila viumbe hai na ina maelezo ya maumbile ambayo huamua sifa za viumbe, hutoa mwongozo wa kufanya protini zinazohitajika kwa maisha, na hutumika kama kiolezo cha kupitisha habari hii kwa watoto wa viumbe. Molekuli ya DNA ina minyororo miwili (ya kupambana na) sambamba ya nucleotides ya kurudia, ambayo huunda muundo wake unaojulikana mara mbili wa helical, kama inavyoonekana katika Kielelezo\(\PageIndex{10}\).
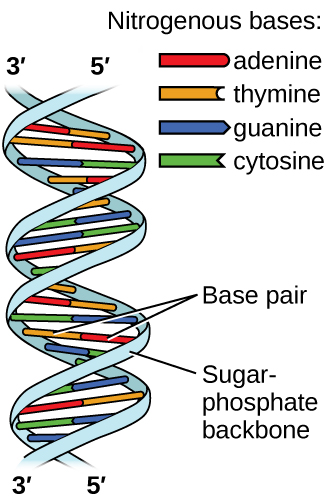
Kila nucleotide ina sukari (deoxyribose) iliyofungwa kwa kundi la phosphate upande mmoja, na moja ya misingi minne ya nitrojeni kwa upande mwingine. Mbili ya besi, cytosine (C) na thymine (T), ni miundo moja-pete inayojulikana kama pyrimidines. Wengine wawili, adenine (A) na guanine (G), ni miundo miwili inayoitwa purines. Msingi huu huunda jozi za msingi za ziada zinazojumuisha purine moja na pyrimidine moja, na kuunganisha adenine na thymine, na cytosine na guanine. Kila jozi ya msingi inafanyika pamoja na kuunganisha hidrojeni. A na T kushiriki vifungo viwili vya hidrojeni, C na G hushiriki tatu, na jozi zote mbili zina sura sawa na muundo Kielelezo\(\PageIndex{12}\)
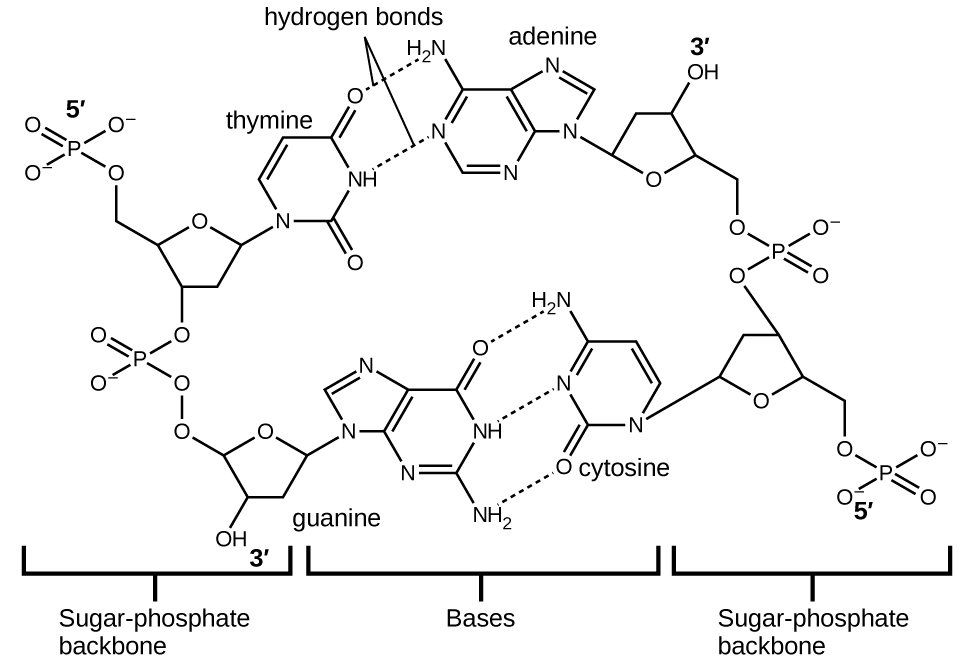
Athari ya jumla ya mamilioni ya vifungo vya hidrojeni hushikilia kwa ufanisi vipande viwili vya DNA pamoja. Muhimu, kuachwa mbili za DNA zinaweza kwa urahisi “unzip” chini katikati kwani vifungo vya hidrojeni ni dhaifu kiasi ikilinganishwa na vifungo vya covalent ambavyo vinashikilia atomi za molekuli ya DNA ya mtu binafsi pamoja. Hii inaruhusu pande zote mbili kufanya kazi kama template ya kuiga.
Muhtasari
Mali ya kimwili ya suala la kufupishwa (maji na yabisi) yanaweza kuelezewa kwa mujibu wa nadharia ya molekuli ya kinetic. Katika kioevu, vikosi vya kuvutia vya intermolecular vinashikilia molekuli katika kuwasiliana, ingawa bado wana nishati ya kutosha ya kinetic kuhamia kila mmoja. Vikosi vya kuvutia vya intermolecular, kwa pamoja hujulikana kama vikosi vya van der Waals, vinahusika na tabia ya majimaji na yabisi na ni umeme katika asili. Vivutio vya Dipole-dipole vinatokana na mvuto wa umeme wa mwisho wa sehemu ya hasi ya molekuli moja ya dipolar kwa mwisho wa sehemu ya mwingine. Dipole ya muda inayotokana na mwendo wa elektroni katika atomu inaweza kushawishi dipole katika atomu iliyo karibu na kutoa kupanda kwa nguvu ya utawanyiko wa London. Vikosi vya London vinaongezeka kwa ukubwa wa Masi. Vifungo vya hidrojeni ni aina maalum ya kivutio cha dipole-dipole ambacho husababisha wakati hidrojeni inaunganishwa na moja ya vipengele vitatu vya electronegative: F, O, au N.
faharasa
- kivutio cha dipole-dipole
- intermolecular kivutio kati ya dipoles mbili kudumu
- nguvu ya utawanyiko
- (pia, London utawanyiko nguvu) kivutio kati ya mbili kwa kasi fluctuating, dipoles muda; muhimu tu wakati chembe ni karibu sana pamoja
- kuunganisha hidrojeni
- hutokea wakati dipoles kipekee nguvu kuvutia; bonding ambayo ipo wakati hidrojeni ni bonded kwa moja ya mambo matatu zaidi electronegative: F, O, au N
- ikiwa dipole
- dipole ya muda inayotengenezwa wakati elektroni za atomi au molekuli zinapotoshwa na dipole ya papo hapo ya atomi jirani au molekuli
- dipole papo hapo
- dipole ya muda mfupi ambayo hutokea kwa muda mfupi wakati elektroni za atomi au molekuli zinagawanywa kwa usawa
- nguvu intermolecular
- noncovalent kuvutia nguvu kati ya atomi, molekuli, na/au ions
- polarizability
- kipimo cha uwezo wa malipo ya kupotosha usambazaji wa malipo ya molekuli (wingu la elektroni)
- van der Waals nguvu
- nguvu ya kuvutia au ya kukataa kati ya molekuli, ikiwa ni pamoja na dipole-dipole, dipole-ikiwa dipole, na vikosi vya utawanyiko wa London; haijumuishi nguvu kutokana na kuunganisha covalent au ionic, au kivutio kati ya ions na molekuli


