7.2: Kuunganishwa kwa ushirikiano
- Page ID
- 176600
- Eleza malezi ya vifungo vya covalent
- Kufafanua electronegativity na kutathmini polarity ya vifungo covalent
Katika misombo ya ionic, elektroni huhamishwa kati ya atomi za vipengele tofauti ili kuunda ions. Lakini hii sio njia pekee ambayo misombo inaweza kuundwa. Atomi zinaweza pia kufanya vifungo vya kemikali kwa kugawana elektroni kati ya kila mmoja. Vifungo vile huitwa vifungo vya covalent. Vifungo vya covalent hutengenezwa kati ya atomi mbili wakati wote wawili wana tabia sawa za kuvutia elektroni kwao wenyewe (yaani, wakati atomi zote mbili zina nguvu za ionization zinazofanana au sawa sawa na ushirika wa elektroni). Kwa mfano, atomi mbili za hidrojeni hufunga kwa covalently kuunda molekuli H 2; kila atomu ya hidrojeni katika molekuli ya H 2 ina elektroni mbili zinazoimarisha, ikitoa kila atomu idadi sawa ya elektroni za valence kama gesi yenye heshima He.
Misombo iliyo na vifungo vya covalent huonyesha mali tofauti za kimwili kuliko misombo ya ionic. Kwa sababu mvuto kati ya molekuli, ambazo hazipatikani umeme, ni dhaifu kuliko ile kati ya ions za kushtakiwa umeme, misombo ya covalent kwa ujumla ina kiwango cha chini sana na cha kuchemsha kuliko misombo ya ionic. Kwa kweli, misombo mingi ya covalent ni vinywaji au gesi kwenye joto la kawaida, na, katika majimbo yao imara, wao ni kawaida sana kuliko yabisi ionic. Zaidi ya hayo, ambapo misombo ionic ni conductors nzuri ya umeme wakati kufutwa katika maji, wengi covalent misombo, kuwa umeme neutral, ni makondakta maskini ya umeme katika hali yoyote.
Uundaji wa vifungo vya Covalent
Atomi zisizo za metali mara nyingi huunda vifungo vyema na atomi zingine zisizo za metali. Kwa mfano, molekuli ya hidrojeni, H 2, ina dhamana ya covalent kati ya atomi zake mbili za hidrojeni. Kielelezo\(\PageIndex{1}\) unaeleza kwa nini dhamana hii ni sumu. Kuanzia upande wa kulia, tuna atomi mbili za hidrojeni tofauti na nishati fulani ya uwezo, iliyoonyeshwa na mstari nyekundu. Pamoja na x -axis ni umbali kati ya atomi mbili. Kama atomi mbili zinakaribia (kusonga kushoto pamoja na x -axis), orbitals yao ya valence (1 s) huanza kuingiliana. Elektroni moja kwenye kila atomi ya hidrojeni kisha huingiliana na viini vyote atomia, vikichukua nafasi karibu na atomi zote mbili. Mvuto mkubwa wa kila elektroni iliyoshirikiwa kwa viini vyote viwili huimarisha mfumo, na nishati inayoweza kupungua kadiri umbali wa dhamana unapungua. Ikiwa atomi zinaendelea kukaribiana, mashtaka mazuri katika viini viwili huanza kurudiana, na nishati inayoweza kuongezeka. Urefu wa dhamana hutegemea umbali ambao nishati ya chini kabisa inapatikana.
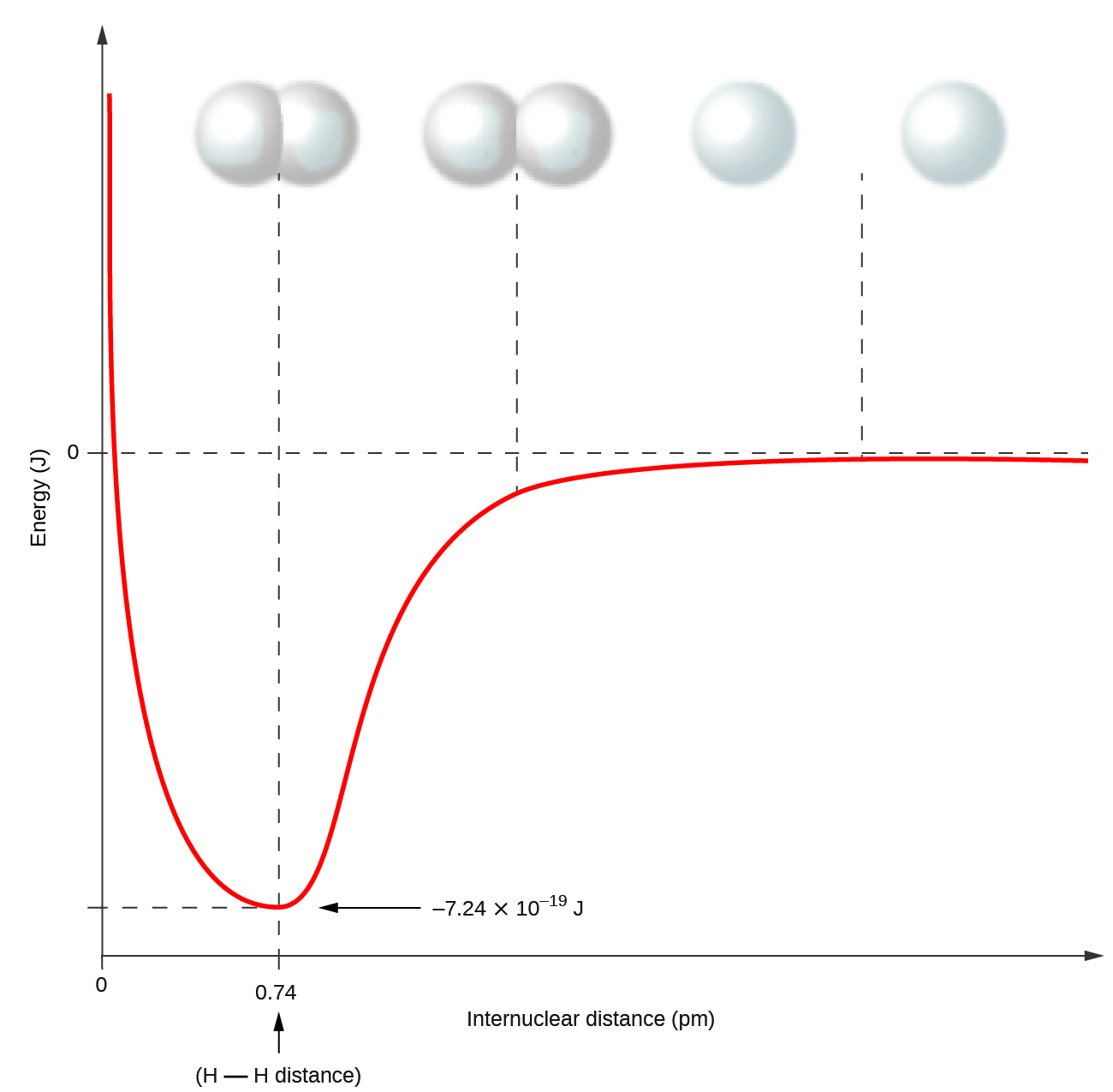
Ni muhimu kukumbuka kwamba nishati lazima iongezwe ili kuvunja vifungo vya kemikali (mchakato wa mwisho), wakati kutengeneza vifungo vya kemikali hutoa nishati (mchakato wa exothermic). Katika kesi ya H 2, dhamana ya covalent ni nguvu sana; kiasi kikubwa cha nishati, 436 kJ, lazima iongezwe ili kuvunja vifungo katika mole moja ya molekuli ya hidrojeni na kusababisha atomi kutenganisha:
\[\ce{H2}(g)⟶\ce{2H}(g)\hspace{20px}ΔH=\mathrm{436\:kJ} \nonumber \]
Kinyume chake, kiasi sawa cha nishati hutolewa wakati mole moja ya molekuli ya H 2 huunda kutoka kwa moles mbili za atomi H:
\[\ce{2H}(g)⟶\ce{H2}(g)\hspace{20px}ΔH=\mathrm{−436\:kJ} \nonumber \]
Pure vs Polar Covalent vifungo
Ikiwa atomi zinazounda dhamana ya covalent zinafanana, kama katika H 2, Cl 2, na molekuli nyingine za diatomiki, basi elektroni katika dhamana lazima ziwe pamoja sawa. Tunataja hili kama dhamana safi ya covalent. Electroni zilizoshirikiwa katika vifungo safi vya covalent zina uwezekano sawa wa kuwa karibu na kila kiini. Katika kesi ya Cl 2, kila atomi huanza na elektroni saba za valence, na kila Cl hushiriki elektroni moja na nyingine, na kutengeneza dhamana moja ya covalent:
\[\ce{Cl + Cl⟶Cl2} \nonumber \]
Idadi ya elektroni karibu na kila atomi ya mtu binafsi ina elektroni sita zisizo za bonding na elektroni mbili zilizoshirikiwa (yaani, bonding) kwa elektroni nane jumla, vinavyolingana na idadi ya elektroni za valence katika argon ya gesi yenye heshima. Kwa kuwa atomi za kuunganisha zinafanana, Cl 2 pia ina dhamana safi ya covalent.
Wakati atomi zilizounganishwa na dhamana ya covalent ni tofauti, elektroni za kuunganisha zinashirikiwa, lakini si sawa. Badala yake, elektroni za kuunganishwa zinavutiwa zaidi na atomu moja kuliko nyingine, na kusababisha kuhama kwa wiani wa elektroni kuelekea atomu hiyo. Usambazaji huu usio sawa wa elektroni unajulikana kama dhamana ya covalent ya polar, inayojulikana na malipo ya chanya ya sehemu kwenye atomi moja na malipo ya sehemu hasi kwa upande mwingine. Atomi inayovutia elektroni zaidi hupata malipo hasi ya sehemu na kinyume chake. Kwa mfano elektroni katika dhamana ya H—Cl ya molekuli ya kloridi hidrojeni hutumia muda mwingi karibu na atomi ya klorini kuliko karibu na atomi ya hidrojeni. Kwa hiyo, katika molekuli ya HCl, atomi ya klorini hubeba malipo ya hasi ya sehemu na atomi ya hidrojeni ina malipo mazuri ya sehemu. Kielelezo\(\PageIndex{2}\) kinaonyesha usambazaji wa elektroni katika dhamana ya H—Cl. Kumbuka kuwa eneo kivuli karibu Cl ni kubwa zaidi kuliko ilivyo karibu H. kulinganisha hii kwa Kielelezo\(\PageIndex{1}\), ambayo inaonyesha hata usambazaji wa elektroni katika H 2 nonpolar dhamana.
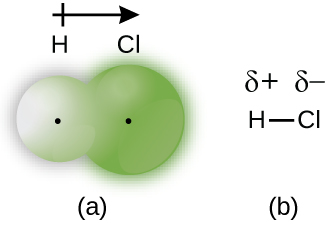
Wakati mwingine huteua atomi chanya na hasi katika dhamana ya covalent ya polar kwa kutumia barua ya chini ya Kigiriki “delta,” δ, na ishara ya pamoja au ishara ndogo ili kuonyesha kama atomi ina malipo ya chanya ya sehemu (δ+) au malipo ya sehemu hasi (δ—). Ishara hii inavyoonekana kwa molekuli ya H—Cl katika Kielelezo\(\PageIndex{2b}\).
Electronegativity
Kama dhamana ni nonpolar au polar covalent imedhamiria kwa mali ya atomi bonding aitwaye electronegativity. Electronegativity ni kipimo cha tabia ya atomi kuvutia elektroni (au wiani wa elektroni) kuelekea yenyewe. Inaamua jinsi elektroni zilizoshirikiwa zinavyosambazwa kati ya atomi hizo mbili katika dhamana. Zaidi ya atomi huvutia elektroni katika vifungo vyake, kubwa ya electronegativity yake. Electroni katika dhamana ya covalent ya polar hubadilishwa kuelekea atomi zaidi ya electronegative; hivyo, atomi zaidi ya electronegative ni moja na malipo ya sehemu hasi. Tofauti kubwa katika electronegativity, zaidi polarized usambazaji elektroni na kubwa mashtaka sehemu ya atomi.
Kielelezo\(\PageIndex{3}\) kinaonyesha maadili ya electronegativity ya vipengele kama ilivyopendekezwa na mmoja wa maduka ya dawa maarufu zaidi ya karne ya ishirini: Linus Pauling. Kwa ujumla, electronegativity huongezeka kutoka kushoto kwenda kulia katika kipindi katika meza ya mara kwa mara na itapungua chini ya kundi. Hivyo, nonmetals, ambayo iko katika haki ya juu, huwa na electronegativities ya juu, na fluorine kipengele zaidi electronegative ya wote (EN = 4.0). Vyuma huwa na kuwa chini ya elementi za elektronegative, na metali ya kundi 1 zina electronegativities ya chini kabisa. Kumbuka kuwa gesi vyeo vinatengwa na takwimu hii kwa sababu atomi hizi kwa kawaida hazishiriki elektroni na atomi zingine kwa kuwa zina ganda kamili la valence. (Wakati misombo ya gesi yenye heshima kama vile XEO 2 ipo, inaweza tu kuundwa chini ya hali mbaya, na hivyo haifai vizuri katika mfano wa jumla wa electronegativity.)
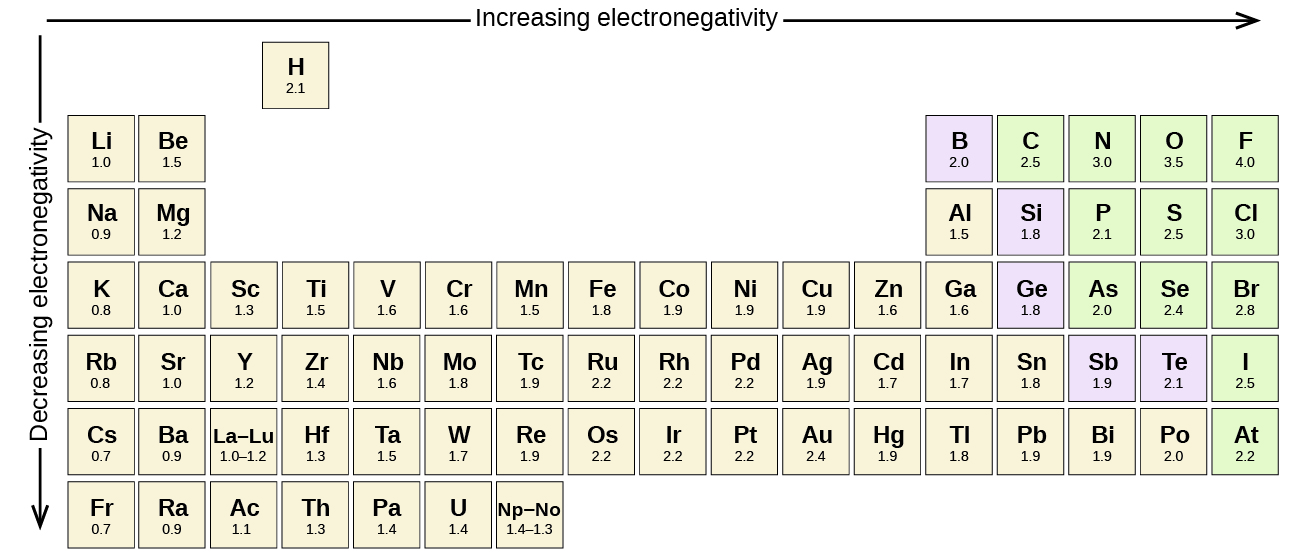
Linus Pauling ndiye mtu pekee aliyepokea tuzo mbili za Nobel zisizoshirikiwa (za kibinafsi): moja kwa kemia mwaka 1954 kwa kazi yake juu ya asili ya vifungo vya kemikali na moja kwa amani mwaka 1962 kwa upinzani wake kwa silaha za uharibifu mkubwa. Alianzisha nadharia nyingi na dhana ambazo ni msingi kwa uelewa wetu wa sasa wa kemia, ikiwa ni pamoja na miundo ya electronegativity na resonance.

Pauling pia alichangia katika nyanja nyingine nyingi badala ya kemia. Utafiti wake juu ya anemia ya seli mundu ulidhihirisha sababu ya ugonjwa huo—uwepo wa protini isiyo ya kawaida iliyorithiwa vinasaba katika damu-na iliweka njia kwa ajili ya uwanja wa jenetiki za Masi. Kazi yake pia ilikuwa muhimu katika kuzuia upimaji wa silaha za nyuklia; alithibitisha kuwa kuanguka kwa mionzi kutokana na upimaji wa nyuklia kulikuwa na hatari ya afya ya umma.
Electronegativity dhidi ya Electron Affinity
Lazima tuwe makini si kuchanganya electronegativity na ushirika wa elektroni. Uhusiano wa elektroni wa elementi ni kiasi cha kimwili kinachoweza kupimika, yaani nishati iliyotolewa au kufyonzwa wakati atomi ya awamu ya gesi pekee inapata elektroni, kipimo katika KJ/mol. Electronegativity, kwa upande mwingine, inaelezea jinsi tightly atomi huvutia elektroni katika dhamana. Ni kiasi cha dimensionless ambacho kinahesabiwa, si kipimo. Pauling inayotokana kwanza maadili electronegativity kwa kulinganisha kiasi cha nishati required kuvunja aina tofauti ya vifungo. Alichagua kiwango cha jamaa cha kiholela kuanzia 0 hadi 4.
Electronegativity na Aina ya Bond
Thamani kamili ya tofauti katika electronegativity (ΔEN) ya atomi mbili zilizounganishwa hutoa kipimo mbaya cha polarity kutarajiwa katika dhamana na, kwa hiyo, aina ya dhamana. Wakati tofauti ni ndogo sana au sifuri, dhamana ni covalent na nonpolar. Wakati ni kubwa, dhamana ni covalent polar au ionic. Maadili kamili ya tofauti za electronegativity kati ya atomi katika vifungo H—H, H—Cl, na Na-Cl ni 0 (nonpolar), 0.9 (covalent polar), na 2.1 (ionic), kwa mtiririko huo. Kiwango ambacho elektroni zinashirikiwa kati ya atomi hutofautiana kutoka sawa kabisa (safi covalent bonding) na sio kabisa (ionic bonding). Kielelezo\(\PageIndex{4}\) inaonyesha uhusiano kati ya tofauti ya electronegativity na aina ya dhamana.

Makadirio mabaya ya tofauti za electronegativity zinazohusiana na covalent, covalent polar, na vifungo ionic inavyoonekana katika Kielelezo\(\PageIndex{4}\). Jedwali hili ni mwongozo wa jumla, hata hivyo, isipokuwa wengi. Kwa mfano, atomi H na F katika HF zina tofauti ya electronegativity ya 1.9, na atomi za N na H katika NH 3 tofauti ya 0.9, lakini misombo hii yote huunda vifungo vinavyochukuliwa kuwa covalent ya polar. Vivyo hivyo, atomi za Na na Cl katika NaCl zina tofauti ya electronegativity ya 2.1, na atomi za Mn na I katika mNi 2 zina tofauti ya 1.0, lakini vitu vyote viwili huunda misombo ya ionic.
Mwongozo bora wa tabia ya covalent au ionic ya dhamana ni kuzingatia aina za atomi zinazohusika na nafasi zao za jamaa katika meza ya mara kwa mara. Vifungo kati ya nonmetali mbili kwa ujumla ni covalent; bonding kati ya chuma na nonmetal mara nyingi ni ionic.
Baadhi ya misombo yana vifungo vyote vya covalent na ionic. Atomi katika ions polyatomic, kama vile OH —,\(\ce{NO3-}\), na\(\ce{NH4+}\), ni uliofanyika pamoja na vifungo covalent polar. Hata hivyo, ions hizi za polyatomic huunda misombo ya ionic kwa kuchanganya na ions ya malipo kinyume. Kwa mfano, nitrati ya potasiamu, KNO 3, ina cation K + na\(\ce{NO3-}\) anion polyatomic. Hivyo, bonding katika nitrate potassium ni ionic, kutokana na mvuto umeme kati ya ions K + na\(\ce{NO3-}\), pamoja na covalent kati ya nitrojeni na oksijeni atomi katika\(\ce{NO3-}\).
Polarities ya dhamana ina jukumu muhimu katika kuamua muundo wa protini. Kutumia maadili ya electronegativity katika Jedwali A2, panga vifungo vifuatavyo vya covalent-vyote vinavyopatikana katika amino asidi-ili kuongezeka kwa polarity. Kisha mteule atomi chanya na hasi kwa kutumia alama δ+ na δ—:
C—H, C-N, C-O, N—H, O—H, —H
Suluhisho
Polarity ya vifungo hivi huongezeka kama thamani kamili ya tofauti ya electronegativity huongezeka. Atomi na jina δ— ni electronegative zaidi ya mbili. Jedwali\(\PageIndex{1}\) linaonyesha vifungo hivi kwa utaratibu wa kuongezeka kwa polarity.
| Bond | ΔEN | Polarity |
|---|---|---|
| C—H | 0.4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| —H | 0.4 | \(\overset{δ−}{\ce S}−\overset{δ+}{\ce H}\) |
| C—N | 0.5 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce N}\) |
| N—H | 0.9 | \(\overset{δ−}{\ce N}−\overset{δ+}{\ce H}\) |
| C—O | 1.0 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce O}\) |
| O—H | 1.4 | \(\overset{δ−}{\ce O}−\overset{δ+}{\ce H}\) |
Silicones ni misombo ya polymeric iliyo na, miongoni mwa wengine, aina zifuatazo za vifungo covalent: Si-O, Si-C, C - H, na C - Kutumia maadili ya electronegativity katika Kielelezo\(\PageIndex{3}\), kupanga vifungo ili kuongeza polarity na mteule atomi chanya na hasi kutumia alama δ+ na δ—.
Jibu
| Bond | Tofauti ya electronegativity | Polarity |
|---|---|---|
| C—C | 0.0 | isiyo ya polar |
| C—H | 0.4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| Si—C | 0.7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce C}\) |
| Si—O | 1.7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce O}\) |
Muhtasari
Vifungo vyema vinaunda wakati elektroni zinashirikiwa kati ya atomi na huvutiwa na viini vya atomi zote mbili. Katika vifungo safi vya covalent, elektroni zinashirikiwa sawa. Katika vifungo vya covalent vya polar, elektroni zinashirikiwa kwa usawa, kama atomi moja ina nguvu kali ya mvuto kwenye elektroni kuliko nyingine. Uwezo wa atomi kuvutia jozi ya elektroni katika dhamana ya kemikali inaitwa electronegativity yake. Tofauti katika electronegativity kati ya atomi mbili huamua jinsi polar dhamana itakuwa. Katika molekuli ya diatomic yenye atomi mbili zinazofanana, hakuna tofauti katika electronegativity, hivyo dhamana ni nonpolar au safi covalent. Wakati tofauti ya electronegativity ni kubwa sana, kama ilivyo kati ya metali na nonmetals, bonding ni sifa kama ionic.
faharasa
- urefu wa dhamana
- umbali kati ya nuclei ya atomi mbili zilizounganishwa ambapo nishati ya chini kabisa inapatikana
- dhamana ya covalent
- dhamana sumu wakati elektroni ni pamoja kati ya atomi
- electronegativity
- tabia ya chembe ya kuvutia elektroni katika dhamana yenyewe
- polar covalent dhamana
- dhamana ya mshikamano kati ya atomi za electronegativities tofauti; dhamana ya covalent na mwisho mzuri na mwisho hasi
- safi covalent dhamana
- (pia, nonpolar covalent dhamana) covalent dhamana kati ya atomi ya electronegativities kufanana


