6.E: Muundo wa umeme na Mali za Mara kwa mara (Mazoezi)
- Page ID
- 176140
6.1: Nishati ya umeme
Q6.1.1
Mwanga unaozalishwa na ishara nyekundu ya neon ni kutokana na chafu ya mwanga na atomi za neon zenye msisimko. Kuelezea kwa usahihi wigo uliozalishwa kwa kupitisha mwanga kutoka taa ya neon kupitia prism.
S6.1.1
Wigo una mistari ya rangi, angalau moja ambayo (labda ni mkali zaidi) ni nyekundu.
Q6.1.2
Kituo cha redio cha FM kilichopatikana saa 103.1 kwenye matangazo ya piga ya FM kwa mzunguko wa 1.031 × 10 8 s -1 (103.1 MHz). Je, ni wavelength ya mawimbi haya ya redio katika mita?
S6.1.2
\(λ=\dfrac{c}{ν}\)
\(λ = \dfrac{2.998 \times10^{8}\: \dfrac{m}{s}}{1.031 \times10^{8}\: \dfrac{1}{s}} = 2.908\:m\)
Q6.1.3
FM-95, kituo cha redio cha FM, kinatangaza kwa mzunguko wa 9.51 × 10 7 s -1 (95.1 MHz). Je, ni wavelength ya mawimbi haya ya redio katika mita?
S6.1.3
\(λ=\dfrac{c}{ν}\)
\(λ = \dfrac{2.998 \times10^{8}\: \dfrac{m}{s}}{9.51 \times10^{7}\: \dfrac{1}{s}} = 3.15 \:m\)
Q6.1.4
Mstari mkali wa violet hutokea saa 435.8 nm katika wigo wa uchafu wa mvuke ya zebaki. Ni kiasi gani cha nishati, katika joules, inapaswa kutolewa na elektroni katika atomi ya zebaki ili kuzalisha photon ya nuru hii?
S6.1.4
\(E= \dfrac{hc}{λ}\)
\(E= \dfrac{(2.998 \times 10^{8} \dfrac{m}{s})\: (6.6262 \times 10^{-34} Js)}{4.358 \times 10^{-7} m}\)
\(=4.56\times 10^{-19}J\)
Q6.1.5
Mwanga na wavelength ya 614.5 nm inaonekana machungwa. Nishati ni nini, katika joules, kwa photon ya mwanga huu wa machungwa? Nishati katika eV ni nini (1 eV = 1.602 × 10 -19 J)?
S6.1.5
1.) Kwanza geuza 614.5 nm katika mita
\(6.145 nm\)=\(6.145 \times10^{-7} m\)
2.) Kisha uhesabu kiasi cha nishati hii ya wavelength ya mwanga ina kutumia equations:
\(E = hν\)na\(ν=\dfrac{c}{λ}\) ambayo inaweza manipulated algebraically katika:\(E=\dfrac{hc}{λ}\)
- h = Plancks mara kwa mara →\(6.6262 \times10^{-34} Js\)
- c = Kasi ya mwanga →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
- λ = wavelength ya photon →\(6.145 \times10^{-7} m\)
\[= \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {6.145 \times 10^{−7}m \ } =3.233 \times 10^{-19} J\]
3.) Kisha kubadilisha Joules katika eV:
\[=(3.233 \times 10^{−19}J) \times\dfrac{1eV}{1.602\times 10^{-19}J} \]\[=2.018 eV\]
Joto lithiamu atomi emit photons mwanga na nishati ya 2.961 × 10 -19 J. mahesabu frequency na wavelength ya moja ya photons hizi. Nishati ya jumla katika mole 1 ya photons hizi ni nini? Je! Rangi ya mwanga uliotolewa ni nini?
S6.1.6
1.) \(E = hν\)na\(ν=\dfrac{E}{h}\)
- h = Plancks mara kwa mara →\(6.6262 \times10^{-34} Js\)
Frequency:\(ν=\dfrac{ 2.961\times 10^{-19}J}{6.6262\times 10^{-34}Js}\ = 4.469\times 10^{14} Hz\)
2.) \(λ=\dfrac{c}{ν}\)
c = Kasi ya mwanga →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
Wavelength:\(λ=\dfrac{ 2.998\times 10^{8}\dfrac {m}{s}}{4.469\times 10^{14}\dfrac {1}{s}}\ = 6.709\times 10^{-7} m\) = Nuru nyekundu
Jumla ya nishati:
\(E= \dfrac{2.961 \times 10^{-19}J}{1\: photon}\times\dfrac{6.022\times 10^{23}\: photons}{1\: mole} = 1.783\times 10^{5} J \)
Q6.1.7
Photon ya mwanga zinazozalishwa na laser ya upasuaji ina nishati ya 3.027 × 10 ,119 J. kuhesabu mzunguko na wavelength ya photon. Nishati ya jumla ni nini katika mole 1 ya photons? Je! Rangi ya mwanga uliotolewa ni nini?
S6.1.7
ν = 4.568 × 10 14 s; λ = 656.3 nm; Nishati mol -1 = 1.823 × 10 5 J mol -1; nyekundu
Q6.1.8
Wakati ioni ya rubidium inapokanzwa kwa joto la juu, mistari miwili inazingatiwa katika wigo wake wa mstari kwenye wavelengths (a) 7.9 × 10 -7 m na (b) 4.2 × 10 -7 m. Tunaona rangi gani wakati tunapunguza joto la rubidium?
Q6.1.9
Wigo wa chafu wa cesium una mistari miwili ambayo frequency ni (a) 3.45 × 10 14 Hz na (b) 6.53 × 10 14 Hz. Je, ni wavelengths na nguvu kwa photon ya mistari miwili? Ni rangi gani mistari?
S6.1.9
(a) λ = 8.69 × 10 -7 m; E = 2.29 × 10 ,119 J; (b) λ = 4.59 × 10 -7 m; E = 4.33 × 10 ,119 J; Rangi ya (a) ni nyekundu; (b) ni bluu.
Q6.1.10
Photons ya mionzi ya infrared huwajibika kwa joto kubwa tunayohisi wakati wa kushikilia mikono yetu kabla ya moto. Photons hizi pia zitapunguza vitu vingine. Ni ngapi photoni za infrared zilizo na urefu wa 1.5 × 10 -6 m zinapaswa kufyonzwa na maji ili joto kikombe cha maji (175 g) kutoka 25.0 °C hadi 40°
S6.1.10
1.) Kwanza tunapaswa kutumia equation: Q=mcΔt ° kuhesabu kiasi cha Nishati katika Joules (J) kwa joto 175g ya H 2 O jumla ya 15 ° Celsius
- m = molekuli katika gramu (g) → 175g
- C = joto maalum la H 2 O (l) →\(\dfrac {4.184 J}{g°C}\)
- ΔT ° = Tofauti katika joto → 40 - 25 =15°
\[q = 175g\times \dfrac {4.184 J}{g°C}\times 15° C\]
q= 11,000 J
2.) Sasa tunahitaji kuhesabu kiasi cha nishati katika Joules (J) kwamba Photon moja yenye urefu wa 1.5x10 -6 m ina. Tutatumia equations:
\(E = hν\)na\(ν=\dfrac{c}{λ}\) ambayo inaweza manipulated algebraically katika:\(E=\dfrac{hc}{λ}\)
- h = Plancks mara kwa mara →\(6.6262 \times10^{-34} Js\)
- c = Kasi ya mwanga →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
- λ = wavelength ya photon →\(1.5 \times10^{-6} m\)
\[= \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {1.5 \times 10^{−6}m \ } =1.3 \times 10^{-19} J\]
Hii ni nishati katika photon moja, kwa hiyo sasa tunapaswa kuona mara ngapi 1.3x10 -19 J inafaa katika 11,000 J kutoka kwa hesabu yetu ya kwanza:
\[= \dfrac{11,000\;J} {1.3 \times 10^{−19}\; \dfrac {J}{photon} } =8.3\times 10^{22} photons\]
\[= 8.3\times 10^{22} photons\]
Q6.1.11
Moja ya vifaa vya radiographic kutumika katika ofisi ya meno hutoa X-ray ya wavelength 2.090 × 10 -11 m Ni nini nishati, katika joules, na mzunguko wa X-ray hii?
S6.1.11
E = 9.502 × 10 -15 J; ν = 1.434 × 10 19 s -1
Q6.1.12
Macho ya reptilia fulani hupita ishara moja ya kuona kwenye ubongo wakati vipokezi vya kuona vinapigwa na photons ya wavelength ya 850 nm. Ikiwa nishati ya jumla ya 3.15 × 10 -14 J inahitajika kusafiri ishara, ni idadi gani ya chini ya photons ambayo inapaswa kugonga receptor?
S6.1.12
1.) Kwanza tunahitaji kubadilisha nanometers kwa mita
850nm = 8.5 x 10 -7 m
2. Kisha hesabu Nishati katika Joules photon ya wavelength hii (λ) inazalisha:
\[(E=\dfrac{hc}{λ}) = \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {8.5 \times 10^{−7}m \ } = 2.3 \times 10^{-19} \dfrac {J}{photon}\]
3.) Kisha tunahitaji kujua ni ngapi ya photons hizi zitachukua ili safari ya ishara ya kuona kwenye ubongo:
\[ \begin{align} &= \dfrac{3.15\times 10^{-14}\;\cancel{J}} {2.3 \times 10^{−19}\; \dfrac {\cancel{J}}{photon} } \\[5pt] &=1.3\times 10^{5}\, photons \end{align}\]
Q6.1.13
RGB rangi televisheni na maonyesho ya kompyuta kutumia zilizopo cathode ray kwamba kuzalisha rangi kwa kuchanganya nyekundu, kijani, na bluu mwanga. Ikiwa tunaangalia skrini na kioo cha kukuza, tunaweza kuona dots za mtu binafsi zinageuka na kuzimwa kama rangi zinabadilika. Kutumia wigo wa mwanga unaoonekana, tambua urefu wa takriban wa kila rangi hizi. Je, ni mzunguko na nishati ya photon ya kila rangi hizi?
S6.1.13
- Nyekunde: 660 nm; 4.54 × 10 14 Hz; 3.01 × 10 -19 J.
- Kijani: 520 nm; 5.77 × 10 14 Hz; 3.82 × 10 -19 J.
- Bluu: 440 nm; 6.81 × 10 14 Hz; 4.51 × 10 -19 J.
Nambari tofauti tofauti pia zinawezekana.
Q6.1.14
Jibu maswali yafuatayo kuhusu laser ya Blu-ray:
- Laser kwenye mchezaji wa Blu-ray ina wavelength ya 405 nm. Katika eneo gani la wigo wa umeme ni mionzi hii? Mzunguko wake ni nini?
- Laser ya Blu-ray ina nguvu ya milliwatts 5 (1 watt = 1 J s -1). Ni photons ngapi za mwanga zinazalishwa na laser saa 1?
- Azimio bora ya mchezaji kwa kutumia laser (kama vile Blu-ray player), ambayo huamua jinsi data ya karibu inaweza kuhifadhiwa kwenye diski ya kompakt, imedhamiriwa kwa kutumia formula ifuatayo: Azimio = 0.60 (λ /NA), ambapo λ ni wavelength ya laser na ni namba ufunuo. Ufunguzi wa namba ni kipimo cha ukubwa wa doa ya mwanga kwenye diski; kubwa NA, ndogo doa. Katika mfumo wa kawaida wa Blu-ray, NA = 0.95. Ikiwa laser 405-nm inatumiwa katika mchezaji wa Blu-ray, ni nini karibu zaidi kwamba habari inaweza kuhifadhiwa kwenye disk Blu-ray?
- Uzito wa data wa disk Blu-ray kutumia laser 405-nm ni 1.5 × 10 7 bits mm -1 2. Disks zina kipenyo cha nje cha 120 mm na shimo la kipenyo cha 15-mm. Ni bits ngapi za data zinaweza kupatikana kwenye diski? Ikiwa disk ya Blu-ray inaweza kushikilia kurasa 9,400,000 za maandishi, ngapi bits data zinahitajika kwa ukurasa uliowekwa? (Kidokezo: Tambua eneo la diski ambayo inapatikana kushikilia data. Eneo ndani ya mduara linatolewa na A = πr 2, ambapo radius r ni nusu moja ya kipenyo.)
Q6.1.15
Je, ni mzunguko wa kizingiti cha chuma cha sodiamu ikiwa photon yenye mzunguko 6.66 × 10 14 s -1 hutoa photon na 7.74 × 10 -20 J kinetic nishati? Je! Athari ya photoelectric itazingatiwa ikiwa sodiamu inaonekana kwa mwanga wa machungwa?
S6.1.15
5.49 × 10 14 s -1; hapana
6.2: Mfano wa Bohr
Q6.2.1
Kwa nini elektroni katika atomi ya hidrojeni ya Bohr imefungwa chini kukazwa wakati ina idadi ya quantum ya 3 kuliko wakati ina idadi ya quantum ya 1?
Q6.2.2
Ina maana gani kusema kwamba nishati ya elektroni katika atomu ni quantized?
S6.2.2
Nishati iliyohesabiwa ina maana kwamba elektroni zinaweza kumiliki maadili fulani ya nishati ya kipekee; maadili kati ya maadili hayo yaliyohesabiwa hayaruhusiwi.
Q6.2.3
Kutumia mfano wa Bohr, tambua nishati, katika joules, muhimu ili ionize atomi ya hidrojeni ya hali ya ardhi. Onyesha mahesabu yako.
Q6.2.4
Volt elektroni (eV) ni kitengo rahisi cha nishati kwa kuonyesha nguvu za atomic wadogo. Ni kiasi cha nishati ambayo elektroni inapata wakati inakabiliwa na uwezo wa volt 1;\(1 \;eV = 1.602 \times 10^{-19}\; J\). Kwa kutumia mfano Bohr, kuamua nishati, katika volts elektroni, ya photon zinazozalishwa wakati elektroni katika atomi hidrojeni hatua kutoka obiti na\(n = 5\) obiti na\(n = 2\). Onyesha mahesabu yako.
S6.2.4
\[E=E_2−E_5=2.179 \times 10^{−18} \left (\dfrac{1}{n_2^2}−\dfrac{1}{n^2_5}\right) \; J\]
\[ = 2.179 \times 10^{-18} \left (\dfrac{1}{2^2}−\dfrac{1}{5^2}\right)=4.576 \times 10^{−19}\; J\]
\[= \dfrac{4.576\times 10^{−19}\;J} {1.602 \times 10^{−19}\;J \; eV^{−1} } =2.856\; eV\]
Q6.2.5
Kutumia mfano wa Bohr, tambua nishati ya chini kabisa kwa elektroni katika\(He^+\) ion.
Q6.2.6
Kutumia mfano wa Bohr, tambua nishati ya elektroni iliyo na\(n = 6\) atomi ya hidrojeni.
S6.2.6
-8.716 × 10—18 M
Q6.2.7
Kutumia mfano wa Bohr, tambua nishati ya elektroni iliyo na\(n = 8\) atomi ya hidrojeni.
Q6.2.8
Jinsi mbali na kiini katika angstroms (1 angstrom =\(1 \times 10^{–10}\; \ce m\)) ni elektroni katika atomi ya hidrojeni ikiwa ina nishati ya\(-8.72 \times 10^{-20}\; \ce J\)?
S6.2.8
\(−3.405 \times 10^{−20} J\)
Q6.2.9
Je, ni radius, katika angstroms, ya orbital ya elektroni na n = 8 katika atomi ya hidrojeni?
Q6.2.10
Kutumia mfano wa Bohr, tambua nishati katika joules ya photon zinazozalishwa wakati elektroni katika\(\ce{He^{+}}\) ion inatoka kwenye obiti na n = 5 hadi obiti na n = 2.
Q6.2.11
Kutumia mfano wa Bohr, tambua nishati katika joules ya photon zinazozalishwa wakati elektroni katika ioni ya Li2+ inatoka kwenye obiti na n = 2 hadi obiti na n = 1.
S6.2.11
1.471 × 10—17 M
Q6.2.12
Fikiria idadi kubwa ya atomi za hidrojeni na elektroni nasibu kusambazwa katika n = 1, 2, 3, na 4 orbits
- Ni wangapi wavelengths tofauti za nuru zinazotolewa na atomi hizi kama elektroni zinaanguka katika orbitals ya chini ya nishati?
- Tumia nguvu za chini na za juu za mwanga zinazozalishwa na mabadiliko yaliyoelezwa katika sehemu (a).
- Tumia masafa na wavelengths ya mwanga zinazozalishwa na mabadiliko yaliyoelezwa katika sehemu (b).
Q6.2.13
Je, mfano wa Bohr na mfano wa Rutherford wa atomi ni sawa? Je, ni tofauti gani?
Q6.2.14
Spectra ya hidrojeni na ya kalsiamu huonyeshwa katika [kiungo]]. Ni nini kinachosababisha mistari katika spectra hizi? Kwa nini rangi ya mistari ni tofauti? Pendekeza sababu ya uchunguzi kwamba wigo wa kalsiamu ni ngumu zaidi kuliko wigo wa hidrojeni.
S6.2.14
Wote wawili huhusisha kiini nzito kiasi na elektroni zinazozunguka, ingawa madhubuti kusema, mfano wa Bohr unafanya kazi kwa atomi moja za elektroni au ioni tu. Kwa mujibu wa mitambo ya classical, mfano wa Rutherford anatabiri miniature “mfumo wa jua” na elektroni zinazohamia juu ya kiini katika njia za mviringo au elliptical ambazo zimefungwa kwa ndege. Kama mahitaji ya nadharia classical sumakuumeme kwamba elektroni katika njia hizo ingekuwa emit mionzi sumakuumeme ni kupuuzwa, atomi kama itakuwa imara, kuwa na nishati ya mara kwa mara na kasi angular, lakini bila emit mwanga wowote inayoonekana (kinyume na uchunguzi). Kama classical sumakuumeme nadharia inatumika, Rutherford atomi ingekuwa emit mionzi sumakuumeme ya kuendelea kuongeza frequency (kinyume na aliona kipekee spectra), na hivyo kupoteza nishati mpaka atomu kuanguka katika muda mfupi absurdly (kinyume na aliona utulivu wa muda mrefu wa atomi). Bohr mfano anakuwa classical mechanics mtazamo wa orbits mviringo funge kwa ndege kuwa nishati ya mara kwa mara na kasi angular, lakini kuzuia haya kwa maadili quantized tegemezi idadi moja quantum, n. elektroni orbiting katika mfano Bohr ni kudhani si emit mionzi yoyote sumakuumeme wakati kusonga juu ya kiini katika njia zake za stationary, lakini atomi inaweza emit au kunyonya mionzi ya umeme wakati elektroni inabadilika kutoka obiti moja hadi nyingine. Kwa sababu ya njia zilizohesabiwa, “kuruka kwa quantum” hiyo itazalisha spectra isiyo ya kawaida, kwa kukubaliana na uchunguzi.
6.3: Maendeleo ya Theory ya Quantum
Q6.3.1
Je, mfano wa Bohr na mfano wa mitambo ya quantum wa atomi ya hidrojeni ni sawa? Je, ni tofauti gani?
S6.3.1
Mifano zote mbili zina kiini cha kati chaji chanya na elektroni zinazozunguka kiini kufuatana na uwezo wa umeme wa Coulomb. Bohr mfano akubali kwamba elektroni hoja katika orbits mviringo kuwa na quantized nguvu, angular kasi, na radii kwamba ni maalum kwa idadi moja quantum, n = 1, 2, 3,..., lakini quantization hii ni dhana dharula yaliyotolewa na Bohr kuingiza quantization katika kimsingi classical mechanics maelezo ya chembe. Bohr alidhani pia kwamba elektroni zinazozunguka kiini kwa kawaida hazitoi wala kunyonya mionzi ya sumakuumeme, lakini fanya hivyo wakati elektroni inapobadilisha obiti tofauti. Katika quantum mitambo mfano elektroni si hoja katika orbits sahihi (obiti kama kukiuka Heisenberg uhakika kanuni) na badala yake, tafsiri probabilistic ya nafasi ya elektroni katika papo yoyote, na kazi ya hisabati aitwaye wavefunction ambayo inaweza kutumika kuamua elektroni nafasi uwezekano usambazaji. Hizi wavefunctions, au orbitals, ni tatu-dimensional mawimbi stationary ambayo inaweza kuwa maalum kwa idadi tatu quantum kwamba kutokea kwa kawaida kutokana na hisabati yao ya msingi (hakuna dhana ad hoc required): kuu quantum idadi, n (moja moja kutumiwa na Bohr), ambayo bayana shells vile kwamba orbitals kuwa sawa n wote wana nishati sawa na takriban kiwango sawa cha anga; kasi ya angular quantum namba l, ambayo ni kipimo cha kasi ya angular ya orbital na inalingana na maumbo ya jumla ya orbitals, pamoja na kubainisha subshells kama vile orbitals kuwa sawa l (na n) wote wana nishati sawa; na mwelekeo quantum namba m, ambayo ni kipimo cha z sehemu ya kasi ya angular na inafanana na mwelekeo wa orbitals. Bohr mfano anatoa kujieleza sawa kwa nishati kama quantum mitambo kujieleza na hivyo, wote vizuri akaunti kwa ajili ya wigo wa kipekee hidrojeni (mfano wa kupata majibu sahihi kwa sababu mbaya, kitu ambacho wanafunzi wengi kemia wanaweza huruma na), lakini anatoa makosa kujieleza kwa kasi ya angular (Bohr orbits lazima wote wana kasi isiyo ya sifuri angular, lakini baadhi orbitals quantum [s orbitals] inaweza kuwa na sifuri angular kasi).
Q6.3.2
Je! Ni maadili gani ya kuruhusiwa kwa kila namba nne za quantum: n, l, m l, na m s?
Q6.3.3
Eleza mali ya elektroni inayohusishwa na kila moja ya namba nne za quantum zifuatazo: n, l, m l, na m s.
S6.3.3
n huamua aina ya jumla ya thamani ya nishati na umbali unaowezekana ambao elektroni inaweza kuwa kutoka kiini. l huamua sura ya orbital. m l huamua mwelekeo wa orbitals ya thamani sawa l kwa heshima kwa kila mmoja. m s huamua spin ya elektroni.
Q6.3.4
Jibu maswali yafuatayo:
- Bila kutumia namba za quantum, kuelezea tofauti kati ya shells, subshells, na orbitals ya atomi.
- Nambari za quantum za shells, subshells, na orbitals ya atomi hutofautiana?
Q6.3.5
Tambua subshell ambayo elektroni na namba zifuatazo za quantum zinapatikana:
- n = 2, l = 1
- n = 4, l = 2
- n = 6, l = 0
S6.3.5
(a) 2 p; (b) 4 d; (c) 6 s
Q6.3.6
Ni ipi kati ya subshells zilizoelezwa katika Swali la 5 zilizo na orbitals zilizoharibika? Ni wangapi wa mzunguko unaoharibika katika kila mmoja?
Q6.3.7
Tambua subshell ambayo elektroni na namba zifuatazo za quantum zinapatikana:
- n = 3, l = 2
- n = 1, l = 0
- n = 4, l = 3
S6.3.7
(a) 3 d; (b) 1 s; (c) 4 f
Q6.3.8
Ni ipi kati ya subshells zilizoelezwa katika Swali la 7 zina vyenye uharibifu? Ni wangapi wa mzunguko unaoharibika katika kila mmoja?
Q6.3.9
Mchoro uso wa mipaka ya a\(d_{x^2−y^2}\) na p y orbital. Hakikisha kuonyesha na kuandika alama.
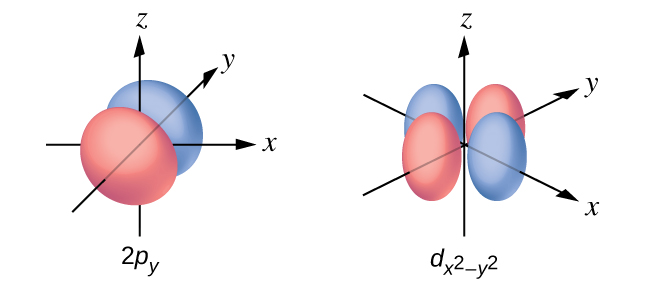
Q6.3.10
Mchoro p x na d xz orbitals. Hakikisha kuonyesha na kuandika kuratibu.
Q6.3.11
Fikiria orbitals iliyoonyeshwa hapa kwa muhtasari.
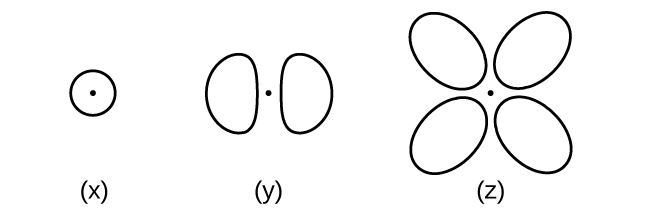
- Nambari ya juu ya elektroni zilizomo katika orbital ya aina (x) ni nini? Ya aina (y)? Ya aina (z)?
- Ni aina ngapi za aina (x) zinapatikana katika shell na n = 2? Ni aina ngapi (y)? Ni aina ngapi (z)?
- Andika seti ya namba za quantum kwa elektroni katika orbital ya aina (x) katika shell yenye n = 4. Ya orbital ya aina (y) katika shell na n = 2. Ya orbital ya aina (z) katika shell na n = 3.
- ni ndogo iwezekanavyo n thamani kwa orbital ya aina (x) nini? Ya aina (y)? Ya aina (z)?
- Je! Ni maadili gani ya l na m l kwa orbital ya aina (x)? Ya aina (y)? Ya aina (z)?
S6.3.11
(a) x. 2, y. 2, z. 2; (b) x. 1, y. 3, z. 0; (c) x 4 0 0\(\dfrac{1}{2}\), y. 2 1 0 \(\dfrac{1}{2}\), z. 3 2 0 \(\dfrac{1}{2}\); (d) x. 1, y. 2, z. 3; (e) x. l = 0, ml = 0, y. l = 1, ml = –1, 0, or +1, z. l = 2, ml = –2, –1, 0, +1, +2
Q6.3.12
State the Heisenberg uncertainty principle. Describe briefly what the principle implies.
Q6.3.13
How many electrons could be held in the second shell of an atom if the spin quantum number ms could have three values instead of just two? (Hint: Consider the Pauli exclusion principle.)
S6.3.13
12
Q6.3.14
Which of the following equations describe particle-like behavior? Which describe wavelike behavior? Do any involve both types of behavior? Describe the reasons for your choices.
- \(c = λν\)
- \(E=\dfrac{mν^2}{2}\)
- \(r=\dfrac{n^2a_0}{Z}\)
- \(E = hν\)
- \(λ=\dfrac{h}{mν}\)
Q6.3.15
Write a set of quantum numbers for each of the electrons with an n of 4 in a Se atom.
S6.3.15
| n | l | ml | s |
|---|---|---|---|
| 4 | 0 | 0 | \(+\dfrac{1}{2}\) |
| 4 | 0 | 0 | \(−\dfrac{1}{2}\) |
| 4 | 1 | −1 | \(+\dfrac{1}{2}\) |
| 4 | 1 | 0 | \(+\dfrac{1}{2}\) |
| 4 | 1 | +1 | \(+\dfrac{1}{2}\) |
| 4 | 1 | −1 | \(−\dfrac{1}{2}\) |
6.4: Electronic Structure of Atoms (Electron Configurations)
Q6.4.1
Read the labels of several commercial products and identify monatomic ions of at least four transition elements contained in the products. Write the complete electron configurations of these cations.
Q6.4.2
Read the labels of several commercial products and identify monatomic ions of at least six main group elements contained in the products. Write the complete electron configurations of these cations and anions.
S6.4.2
For example, Na+: 1s22s22p6; Ca2+: 1s22s22p6; Sn2+: 1s22s22p63s23p63d104s24p64d105s2; F–: 1s22s22p6; O2–: 1s22s22p6; Cl–: 1s22s22p63s23p6.
Q6.4.3
Using complete subshell notation (not abbreviations, 1s22s22p6, and so forth), predict the electron configuration of each of the following atoms:
- C
- P
- V
- Sb
- Sm
S6.4.3
a.) 1s22s22p2
b.) 1s22s22p63s23p3
c.) 1s22s22p63s23p63d34s2
d.) 1s22s22p63s23p63d104s24p64d105s25p3
e.) 1s22s22p63s23p63d104s24p64d104f65s25p66s2
Q6.4.4
Using complete subshell notation (1s22s22p6, and so forth), predict the electron configuration of each of the following atoms:
- N
- Si
- Fe
- Te
- Tb
S6.4.4
- 1s22s22p3;
- 1s22s22p63s23p2;
- 1s22s22p63s23p64s23d6;
- 1s22s22p63s23p64s23d104p65s24d105p4;
- 1s22s22p63s23p64s23d104p65s24d105p66s24f9
Q6.4.5
Is 1s22s22p6 the symbol for a macroscopic property or a microscopic property of an element? Explain your answer.
Q6.4.6
What additional information do we need to answer the question “Which ion has the electron configuration 1s22s22p63s23p6”?
S6.4.6
The charge on the ion.
Q6.4.7
Draw the orbital diagram for the valence shell of each of the following atoms:
- C
- P
- V
- Sb
- Ru
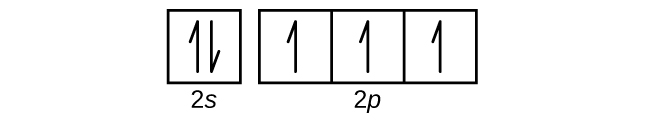
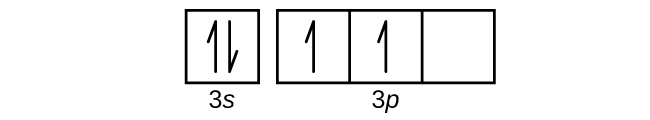
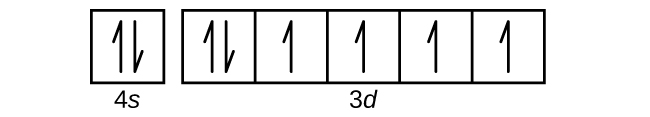
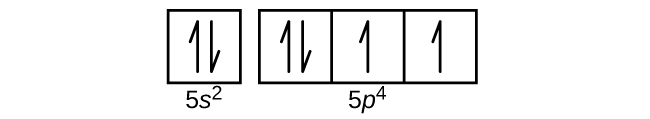
Q6.4.8
Use an orbital diagram to describe the electron configuration of the valence shell of each of the following atoms:
- N
- Si
- Fe
- Te
- Mo
S6.4.8
(a)

Q6.4.9
Kutumia nukuu kamili ya subshell (1 s 2 2 s 2 p 6, na kadhalika), kutabiri usanidi wa elektroni wa ions zifuatazo.
- N 3—
- Ca 2+
- S —
- Cs 2+
- Gari 2+
- Mungu 3+
Q6.4.10
Ambayo atomi ina usanidi wa elektroni: 1 s 2 s 2 s 2 p 6 3 s 2 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 2?
S6.4.10
Zr
Q6.4.11
Ambayo atomi ina usanidi wa elektroni: 1 s 2 2 s 2 p 6 3 s 2 3 p 6 3 d 7 4 s 2?
S6.4.11
Co; Cobalt
Q6.4.12
Ioni ipi iliyo na malipo ya +1 ina usanidi wa elektroni 1 s 2 s 2 s 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 ? Ambayo ion na malipo -2 ina Configuration hii?
S6.4.12
Sura +, Se 2
Q6.4.13
Ni ipi kati ya atomi zifuatazo zina elektroni tatu tu za valence: Li, B, N, F, Ne?
S6.4.13
B; Boroni
Q6.4.14
Ni ipi kati ya yafuatayo ina elektroni mbili zisizo na nguvu?
- Mg
- na
- S
- Wote Mg na S
- Wote Si na S.
S6.4.14
Ingawa wote (b) na (c) ni sahihi, (e) huzunguka zote mbili na ni jibu bora.
Q6.4.15
Ni atomi ipi ambayo itatarajiwa kuwa na nusu-kujazwa 6 p subshell?
S6.4.15
Bi; Bismuth
Q6.4.16
Ambayo atomu itakuwa inatarajiwa kuwa na nusu kujazwa 4 s subshell?
S6.4.16
K
Q6.4.17
Katika eneo moja la Australia, ng'ombe hawakustawi licha ya kuwepo kwa lishe zinazofaa. Uchunguzi ulionyesha sababu ya kukosekana kwa cobalt ya kutosha katika udongo. Cobalt huunda cations katika majimbo mawili ya oxidation, Co 2+ na Co 3+. Andika muundo wa elektroni wa cations mbili.
Q6.4.18
Thallium ilitumika kama sumu katika hadithi ya siri ya Agatha Christie “The Pale Horse.” Thallium ina aina mbili za cationic zinazowezekana, +1 na +3. Misombo ya +1 ni imara zaidi. Andika muundo wa elektroni wa cation +1 ya thallium.
S6.4.18
1 s 2 2 s 2 p 6 3 s 2 3 s 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 5 s 2, 5 p 6, 6 s 2, 4 f 14, 5 d 10;
Q6.4.19
Andika usanidi wa elektroni kwa atomi au ions zifuatazo:
- B 3+
- O —
- Cl 3+
- Ca 2+
- Ti
Q6.4.20
Kobalt—60 na iodini—131 ni isotopi za mionzi zinazotumika kwa kawaida katika dawa za nyukl Ni protoni ngapi, nyutroni, na elektroni ziko katika atomi za isotopu hizi? Andika usanidi kamili wa elektroni kwa kila isotopu.
S6.4.20
Co ina protoni 27, elektroni 27, na neutroni 33:1 s 2 2 s 2 2 p 6 3 s 2 3 s 2 p 6 4 s 2 3 d 7.
Ina protoni 53, elektroni 53, na neutroni 78:1 s 2 s 2 s 2 p 6 3 s 2 p 3 s 3 p 6 d 10 4 s 2 4 p 6 4 4 d 10 5 s 2 5 p 5.
Q6.4.21
Andika seti ya namba za quantum kwa kila moja ya elektroni yenye n ya 3 katika atomi ya Sc.
6.5: Tofauti za mara kwa mara katika Mali za Element
Q6.5.1
Kulingana na nafasi zao katika meza ya mara kwa mara, kutabiri ambayo ina radius ndogo ya atomiki: Mg, Sr, Si, Cl, I.
S6.5.1
Cl
Q6.5.2
Kulingana na nafasi zao katika meza ya mara kwa mara, kutabiri ambayo ina radius kubwa ya atomiki: Li, Rb, N, F, I.
Q6.5.3
Kulingana na nafasi zao katika meza ya mara kwa mara, kutabiri ambayo ina nishati kubwa zaidi ya ionization: Mg, Ba, B, O, Te.
S6.5.3
O
Q6.5.4
Kulingana na nafasi zao katika meza ya mara kwa mara, kutabiri ambayo ina nishati ndogo zaidi ya ionization: Li, Cs, N, F, I.
Q6.5.5
Kulingana na nafasi zao katika meza ya mara kwa mara, cheo atomi zifuatazo ili kuongeza nishati ya kwanza ya ionization: F, Li, N, Rb
S6.5.5
Rb <Li <N <F
Q6.5.6
Kulingana na nafasi zao katika meza ya mara kwa mara, cheo atomi zifuatazo au misombo ili kuongeza nishati ya kwanza ya ionization: Mg, O, S, Si
Q6.5.7
Atomi za kikundi gani katika meza ya mara kwa mara zina usanidi wa elektroni wa shell ya valence ya ns 2 np 3?
S6.5.7
15 (5A)
Q6.5.8
Atomi za kikundi gani katika meza ya mara kwa mara zina usanidi wa elektroni wa shell ya valence ya ns 2?
Q6.5.9
Kulingana na nafasi zao katika meza ya mara kwa mara, weka orodha ya atomi zifuatazo ili kuongeza radius: Mg, Ca, Rb, Cs.
S6.5.9
Mg <Ca <Rb <Cs
Q6.5.10
Kulingana na nafasi zao katika meza ya mara kwa mara, weka orodha ya atomi zifuatazo ili kuongeza radius: Sr, Ca, Si, Cl.
Q6.5.11
Kulingana na nafasi zao katika meza ya mara kwa mara, weka ions zifuatazo ili kuongeza radius: K +, Ca 2+, Al 3+, Si 4+.
S6.5.11
Si 4+ <All 3+ <Ca 2+ <K +
Q6.5.12
Orodha ions zifuatazo ili kuongeza radius: Li +, Mg 2+, Br -, Te 2—.
Q6.5.13
Ni atomi na/au ion ni (ni) isoelectronic na Br +: Se 2+, Se, As -, Kr, Ga 3+, Cl -?
S6.5.13
Se, kama -
Q6.5.14
Ni ipi kati ya atomi na ions zifuatazo ni (ni) isoelectronic na S 2+: Si 4+, Cl 3+, Ar, As 3+, Si, Al 3+?
Q6.5.15
Linganisha namba zote mbili za protoni na elektroni zilizopo katika kila cheo ions zifuatazo ili kuongeza radius: kama 3—, Br -, K +, Mg 2+.
S6.5.15
Mg 2+ <K + <Br — <Kama 3—
Q6.5.16
Ya mambo tano Al, Cl, I, Na, Rb, ambayo ina majibu ya exothermic zaidi? (E inawakilisha atomi.) Jina gani linapewa nishati kwa majibu? Kidokezo: kumbuka mchakato unaoonyeshwa haufanani na ushirika wa elektroni
\(\ce{E+}(g)+\ce{e-}⟶\ce{E}(g)\)
Q6.5.17
Of the five elements Sn, Si, Sb, O, Te, which has the most endothermic reaction? (E represents an atom.) What name is given to the energy for the reaction?
\[\ce{E}(g)⟶\ce{E+}(g)+\ce{e-}\]
S6.5.17
O, IE1
Q6.5.18
The ionic radii of the ions S2–, Cl–, and K+ are 184, 181, 138 pm respectively. Explain why these ions have different sizes even though they contain the same number of electrons.
Q6.5.19
Which main group atom would be expected to have the lowest second ionization energy?
S6.5.19
Ra
Q6.5.20
Explain why Al is a member of group 13 rather than group 3?


