5.2: Calorimetry
- Page ID
- 176892
- Eleza mbinu ya calorimetry
- Tumia na kutafsiri joto na mali zinazohusiana kwa kutumia data ya kawaida ya calorimetry
Mbinu moja tunaweza kutumia kupima kiasi cha joto kinachohusika katika mchakato wa kemikali au kimwili hujulikana kama calorimetry. Calorimetry hutumiwa kupima kiasi cha joto kuhamishiwa au kutoka kwa dutu. Kwa kufanya hivyo, joto hubadilishana na kitu cha sanifu (calorimeter). Mabadiliko ya joto ya sehemu ya kupimia ya calorimeter inabadilishwa kuwa kiasi cha joto (tangu calibration ya awali ilitumiwa kuanzisha uwezo wake wa joto). Upimaji wa uhamisho wa joto kwa kutumia mbinu hii inahitaji ufafanuzi wa mfumo (dutu au vitu vinavyofanyika mabadiliko ya kemikali au kimwili) na mazingira yake (vipengele vingine vya vifaa vya kupima ambavyo hutumikia kutoa joto kwa mfumo au kunyonya joto kutoka kwenye mfumo). Maarifa ya uwezo wa joto wa mazingira, na vipimo vya makini vya raia wa mfumo na mazingira na joto lao kabla na baada ya mchakato inaruhusu mtu kuhesabu joto lililohamishwa kama ilivyoelezwa katika sehemu hii.
Kalorimeter ni kifaa kinachotumiwa kupima kiasi cha joto kinachohusika katika mchakato wa kemikali au kimwili. Kwa mfano, wakati mmenyuko wa exothermic hutokea katika suluhisho katika calorimeter, joto linalozalishwa na mmenyuko linafyonzwa na suluhisho, ambalo huongeza joto lake. Wakati mmenyuko wa mwisho hutokea, joto linalohitajika linatokana na nishati ya joto ya suluhisho, ambayo inapungua joto lake (Kielelezo\(\PageIndex{1}\)). Mabadiliko ya joto, pamoja na joto maalum na wingi wa suluhisho, inaweza kutumika kuhesabu kiasi cha joto kinachohusika katika kesi yoyote.
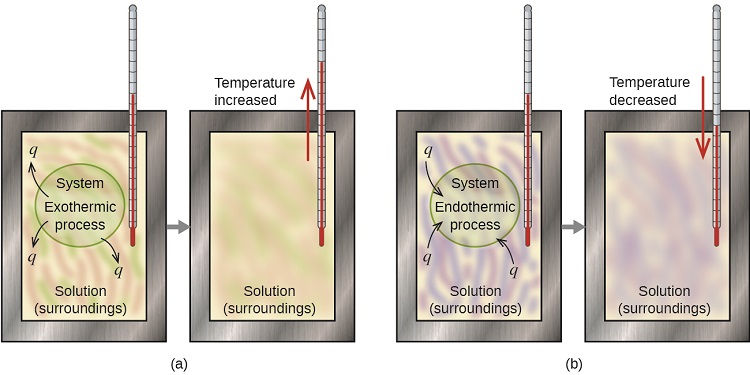
Kwa mkataba, q hupewa ishara mbaya (-) wakati mfumo unatoa joto kwa mazingira (exothermic); q hupewa ishara nzuri (+) wakati mfumo unachukua joto kutoka kwa mazingira (endothermic).
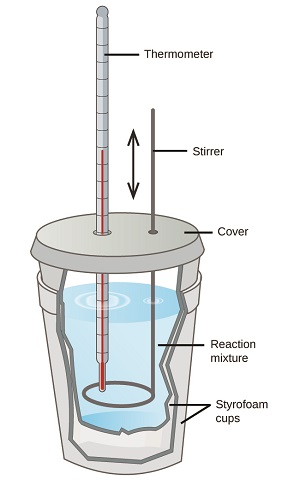
Wanasayansi hutumia calorimeters vizuri maboksi kwamba wote lakini kuzuia uhamisho wa joto kati ya calorimeter na mazingira yake. Hii inawezesha uamuzi sahihi wa joto linalohusika katika michakato ya kemikali, maudhui ya nishati ya vyakula, na kadhalika. Wanafunzi wa kemia ya kawaida hutumia calorimeters rahisi zilizojengwa kutoka vikombe vya polystyrene (Kielelezo\(\PageIndex{2}\)). Hizi rahisi kutumia “kikombe cha kahawa” calorimeters kuruhusu kubadilishana zaidi joto na mazingira yao, na hivyo kuzalisha maadili chini ya nishati sahihi.
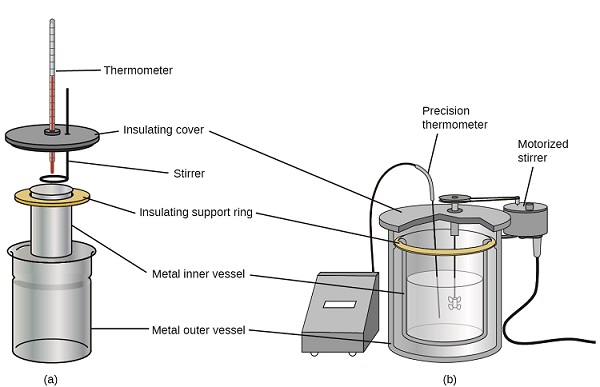
Calorimeters za ufumbuzi wa kibiashara zinapatikana pia. Kiasi cha calorimeters cha gharama nafuu mara nyingi hujumuisha vikombe viwili vidogo vilivyotengenezwa kwa njia ambayo hupunguza mawasiliano ya mafuta wakati wa matumizi, pamoja na kifuniko cha maboksi, stirrer ya handheld, na thermometer rahisi. Calorimeters ghali zaidi kutumika kwa ajili ya sekta na utafiti kawaida kuwa vizuri maboksi, kikamilifu iliyoambatanishwa majibu chombo, motorized kuchochea utaratibu, na sahihi zaidi joto sensor (Kielelezo\(\PageIndex{3}\)).
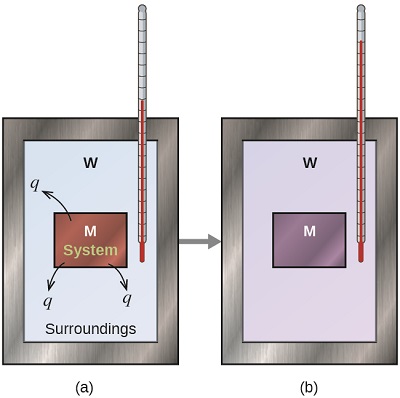
Kabla ya kufanya mazoezi ya calorimetry yanayohusisha athari za kemikali, fikiria mfano rahisi unaoonyesha wazo la msingi nyuma ya kalorimetry. Tuseme sisi awali tuna dutu ya juu ya joto, kama vile kipande cha moto cha chuma (M), na dutu la chini la joto, kama vile maji baridi (W). Ikiwa tunaweka chuma ndani ya maji, joto litatoka kutoka M hadi W. joto la M litapungua, na joto la W litaongezeka, mpaka vitu viwili vina joto sawa - yaani, wakati wanafikia usawa wa joto (Kielelezo\(\PageIndex{4}\)). Ikiwa hii hutokea katika calorimeter, kwa hakika uhamisho huu wote wa joto hutokea kati ya vitu viwili, bila joto lililopatikana au kupotea kwa calorimeter au mazingira ya calorimeter. Chini ya hali hizi nzuri, mabadiliko ya joto halisi ni sifuri:
\[q_\mathrm{\,substance\: M} + q_\mathrm{\,substance\: W}=0 \label{5.3.1} \]
Uhusiano huu unaweza kupangwa upya ili kuonyesha kwamba joto lililopatikana kwa dutu M ni sawa na joto lililopotea na dutu W:
\[q_\mathrm{\,substance\: M}=-q_\mathrm{\,substance\: W} \label{5.3.2} \]
Ukubwa wa joto (mabadiliko) kwa hiyo ni sawa kwa vitu vyote viwili, na ishara hasi inaonyesha tu kwamba\(q_{substance\, M}\) na\(q_{substance\, W}\) ni kinyume na mwelekeo wa mtiririko wa joto (faida au kupoteza) lakini haionyeshi ishara ya hesabu ya thamani ya q (ambayo imedhamiriwa na kama jambo katika swali faida au kupoteza joto, kwa ufafanuzi). Katika hali maalum ilivyoelezwa,\(q_{substance\, M}\) ni thamani hasi na\(q_{substance\, W}\) ni chanya, kwani joto huhamishwa kutoka M hadi W.
Kipande cha moto cha 360-g cha rebar (fimbo ya chuma inayotumiwa kuimarisha saruji) imeshuka ndani ya 425 mL ya maji saa 24.0 °C Halijoto la mwisho la maji hupimwa kama 42.7 °C Kuhesabu joto la awali la kipande cha rebar. Fikiria joto maalum la chuma ni takriban sawa na ile ya chuma (Jedwali T4), na kwamba uhamisho wote wa joto hutokea kati ya rebar na maji (hakuna kubadilishana joto na mazingira).
Suluhisho
Joto la maji huongezeka kutoka 24.0 °C hadi 42.7 °C, hivyo maji huchukua joto. Joto hilo lilitoka kwenye kipande cha rebar, ambacho awali kilikuwa kwenye joto la juu. Kwa kuzingatia kwamba uhamisho wote wa joto ulikuwa kati ya rebar na maji, bila joto “limepotea” kwa mazingira, kisha joto lililotolewa na rebar = - joto lililochukuliwa na maji, au:
\[q_\ce{rebar}=−q_\ce{water} \nonumber \]
Kwa kuwa tunajua jinsi joto linahusiana na kiasi kingine cha kupimika, tuna:
\[(c×m×ΔT)_\ce{rebar}=−(c×m×ΔT)_\ce{water} \nonumber \]
Kuruhusu f = mwisho na i = awali, katika fomu iliyopanuliwa, hii inakuwa:
\[ c_\ce{rebar}×m_\ce{rebar}×(T_\mathrm{f,rebar}−T_\mathrm{i,rebar})=−c_\ce{water}×m_\ce{water}×(T_\mathrm{f,water}−T_\mathrm{i,water}) \nonumber \]
Uzito wa maji ni 1.0 g/ml, hivyo 425 ml ya maji = 425 g Ikibainisha kuwa joto la mwisho la rebar na maji ni 42.7 °C, badala ya maadili inayojulikana huzaa:
\[ \mathrm{(0.449\:J/g\: °C)(360g)(42.7°C−\mathit T_\mathrm{i,rebar})=-(4.184\:J/g\: °C)(425\:g)(42.7°C−24.0°C)} \nonumber \]
\[\mathrm{\mathit T_{i,rebar}=\dfrac{(4.184\:J/g\: °C)(425\:g)(42.7°C−24.0°C)}{(0.449\:J/g\: °C)(360\:g)}+42.7°C} \nonumber \]
Kutatua hili kunampa Ti, rebar= 248 °C, hivyo joto la awali la rebar lilikuwa 248 °C.
Kipande cha shaba cha 248-g kinashuka ndani ya 390 ml ya maji kwenye 22.6 °C Halijoto la mwisho la maji lilipimwa kama 39.9 °C Kuhesabu joto la awali la kipande cha shaba. Fikiria kwamba uhamisho wote wa joto hutokea kati ya shaba na maji.
- Jibu
-
Halijoto ya awali ya shaba ilikuwa 335.6 °C.
Kipande cha shaba cha 248-g awali saa 314 °C kinashuka ndani ya 390 mL ya maji awali saa 22.6 °C Kutokana kwamba uhamisho wote wa joto hutokea kati ya shaba na maji, kuhesabu joto la mwisho.
- Jibu
-
Halijoto ya mwisho (iliyofikiwa na shaba na maji) ni 38.7 °C.
Njia hii pia inaweza kutumika kuamua kiasi kingine, kama vile joto maalum la chuma kisichojulikana.
Kipande cha chuma cha 59.7 g kilichokuwa kimejaa ndani ya maji ya moto kilihamishwa haraka ndani ya 60.0 ml ya maji awali saa 22.0 °C joto la mwisho ni 28.5 °C Tumia data hizi kuamua joto maalum la chuma. Tumia matokeo haya kutambua chuma.
Suluhisho
Kutokana na uhamisho kamili wa joto, joto lililotolewa na chuma = -joto lililochukuliwa na maji, au:
\[q_\ce{metal}=−q_\ce{water} \nonumber \]
Katika fomu iliyopanuliwa, hii ni:
\[c_\ce{metal}×m_\ce{metal}×(T_\mathrm{f,metal}−T_\mathrm{i, metal})=−c_\ce{water}×m_\ce{water}×(T_\mathrm{f,water}−T_\mathrm{i,water}) \nonumber \]
Akibainisha kuwa tangu chuma kilipokuwa kimejaa maji ya moto, joto lake la awali lilikuwa 100.0 °C; na kwamba kwa maji, 60.0 mL = 60.0 g; tuna:
\[\mathrm{(\mathit c_{metal})(59.7\:g)(28.5°C−100.0°C)=−(4.18\:J/g\: °C)(60.0\:g)(28.5°C−22.0°C)} \nonumber \]
Kutatua hili:
\[\mathrm{\mathit c_{metal}=\dfrac{−(4.184\:J/g\: °C)(60.0\:g)(6.5°C)}{(59.7\:g)(−71.5°C)}=0.38\:J/g\: °C} \nonumber \]
Kulinganisha hili na maadili katika Jedwali T4, joto letu maalum la majaribio ni karibu zaidi na thamani ya shaba (0.39 J/g °C), hivyo tunatambua chuma kama shaba.
Kipande cha 92.9-g cha chuma cha fedha/kijivu kinawaka hadi 178.0 °C, halafu huhamishwa haraka ndani ya 75.0 ml ya maji awali saa 24.0 °C Baada ya dakika 5, chuma na maji vimefikia joto sawa: 29.7 °C Kuamua joto maalum na utambulisho wa chuma. (Kumbuka: Unapaswa kupata kwamba joto maalum ni karibu na ile ya metali mbili tofauti. Eleza jinsi unaweza kuamua kwa uaminifu utambulisho wa chuma).
- Jibu
-
\(c_{metal}= 0.13 \;J/g\; °C\)
Joto hili maalum ni karibu na lile la dhahabu au risasi. Itakuwa vigumu kuamua ambayo chuma hii ilikuwa msingi tu juu ya maadili ya namba. Hata hivyo, uchunguzi kwamba chuma ni fedha/kijivu pamoja na thamani ya joto maalum inaonyesha kwamba chuma ni kuongoza.
Tunapotumia calorimetry kuamua joto linalohusika katika mmenyuko wa kemikali, kanuni sawa ambazo tumejadili zinatumika. Kiasi cha joto kinachotumiwa na calorimeter mara nyingi ni ndogo ya kutosha ili tuweze kuipuuza (ingawa si kwa vipimo sahihi sana, kama ilivyojadiliwa baadaye), na calorimeter inapunguza kubadilishana nishati na mazingira. Kwa sababu nishati haijaundwa wala kuharibiwa wakati wa mmenyuko wa kemikali, hakuna mabadiliko ya jumla ya nishati wakati wa majibu. Joto zinazozalishwa au zinazotumiwa katika mmenyuko (“mfumo”), mmenyuko, pamoja na joto linaloweza kufyonzwa au kupotea na suluhisho (“mazingira”)\(q_{solution}\), lazima iongeze hadi sifuri:
\[q_\ce{reaction}+q_\ce{solution}=0\ \label{ 5.3.10} \]
Hii ina maana kwamba kiasi cha joto kilichozalishwa au kinachotumiwa katika mmenyuko ni sawa na kiasi cha joto kinachotumiwa au kilichopotea na suluhisho:
\[q_\ce{reaction}=−q_\ce{solution} \label{5.3.11} \]
Dhana hii iko katika moyo wa matatizo yote ya calorimetry na mahesabu.
Wakati 50.0 ml ya 0.10 M HCl (aq) na 50.0 ml ya 1.00 M NaOH (aq), wote kwa 22.0 °C, huongezwa kwenye calorimeter ya kikombe cha kahawa, joto la mchanganyiko hufikia kiwango cha juu cha 28.9 °C Ni kiasi gani cha joto kinachozalishwa na mmenyuko huu?
\[\ce{HCl}(aq)+\ce{NaOH}(aq)⟶\ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
Suluhisho la Marekani
Ili kutazama kile kinachoendelea, fikiria kwamba unaweza kuchanganya ufumbuzi huo kwa haraka sana kwamba hakuna majibu yalifanyika wakati walichanganya; kisha baada ya kuchanganya, majibu yalifanyika. Wakati wa kuchanganya, una 100.0 ml ya mchanganyiko wa HCl na NaOH saa 22.0 °C HCl na NaOH kisha huitikia mpaka joto la suluhisho lifikia 28.9 °C.
Joto lililotolewa na mmenyuko ni sawa na ile iliyochukuliwa na suluhisho. Kwa hiyo:
\[q_\ce{reaction}=−q_\ce{solution} \nonumber \]
(Ni muhimu kukumbuka kuwa uhusiano huu unashikilia tu ikiwa calorimeter haina kunyonya joto lolote kutokana na mmenyuko, na hakuna kubadilishana joto kati ya calorimeter na mazingira yake.)
Kisha, tunajua kwamba joto linaloingizwa na suluhisho linategemea joto lake maalum, wingi, na mabadiliko ya joto:
\[q_\ce{solution}=(c×m×ΔT)_\ce{solution} \nonumber \]
Ili kuendelea na hesabu hii, tunahitaji kufanya mawazo machache zaidi au makadirio. Kwa kuwa suluhisho ni la maji, tunaweza kuendelea kama maji kwa suala la joto lake maalum na maadili ya wingi. Uzito wa maji ni takriban 1.0 g/ml, hivyo 100.0 ml ina wingi wa 1.0 × 10 2 g (takwimu mbili muhimu). Joto maalum la maji ni takriban 4.18 J/g °C, kwa hiyo tunatumia hilo kwa joto maalum la suluhisho. Kubadilisha maadili haya hutoa:
\[\mathrm{\mathit q_{solution}=(4.184\:J/g\: °C)(1.0×10^2\:g)(28.9°C−22.0°C)=2.89×10^3\:J} \nonumber \]
Hatimaye, kwa kuwa tunajaribu kupata joto la mmenyuko, tuna:
\[q_\ce{reaction}=−q_\ce{solution}=−2.89×10^3\:J \nonumber \]
Ishara hasi inaonyesha kwamba mmenyuko ni exothermic. Inazalisha 2.89 kJ ya joto.
Wakati 100 ml ya NaCl 0.200 M (aq) na 100 ml ya 0.200 M AgNo 3 (aq), zote mbili kwenye 21.9 °C, huchanganywa katika kalorimeter ya kikombe cha kahawa, halijoto huongezeka hadi 23.5 °C kama aina imara za AgCl. Ni joto gani linalozalishwa na mmenyuko huu wa mvua? Ni mawazo gani uliyofanya ili kuamua thamani yako?
- Jibu
-
\(1.34 \times 10^3\; J\); kudhani hakuna joto linachukuliwa na calorimeter, hakuna joto linalobadilishwa kati ya calorimeter na mazingira yake, na kwamba joto maalum na wingi wa suluhisho ni sawa na yale ya maji
Wakati wa kufanya kazi au kucheza nje siku ya baridi, unaweza kutumia joto mkono kwa joto mikono yako (Kielelezo\(\PageIndex{5}\)). Joto la kawaida la kawaida la mkono lina suluhisho la supersaturated la NaC 2 H 3 O 2 (acetate ya sodiamu) na disc ya chuma. Bending disk inajenga maeneo ya nucleation karibu na ambayo metastable NaC 2 H 3 O 2 haraka crystallizes (sura ya baadaye juu ya ufumbuzi kuchunguza kueneza na supersaturation kwa undani zaidi).
Mchakato\(\ce{NaC2H3O2}(aq)⟶\ce{NaC2H3O2}(s)\) huo ni exothermic, na joto zinazozalishwa na mchakato huu linafyonzwa na mikono yako, na hivyo huwasha moto (angalau kwa muda). Ikiwa joto la mkono linatengenezwa tena, NaC 2 H 3 O 2 hupasuka na inaweza kutumika tena.

Mwingine kawaida mkono joto hutoa joto wakati ni ripped wazi, kuwasababishia chuma na maji katika mkono joto kwa oksijeni katika hewa. Toleo moja rahisi la mmenyuko huu wa exothermic ni
\[\ce{2Fe(s) + 3/2 O2(g) ⟶ Fe2O3(s)}.\ n\nonumber \]
Chumvi katika joto la mkono huchochea mmenyuko, hivyo hutoa joto kwa kasi zaidi; selulosi, vermiculite, na mkaa ulioamilishwa husaidia kusambaza joto sawasawa. Aina nyingine za joto za mkono hutumia maji nyepesi (kichocheo cha platinum husaidia kioevu nyepesi oxidize exothermically), mkaa (mkaa oxidizes katika kesi maalum), au vitengo vya umeme vinavyozalisha joto kwa kupitisha sasa umeme kutoka betri kupitia waya za kupinga.
Wakati nitrati imara ya amonia inapasuka katika maji, suluhisho inakuwa baridi. Hii ni msingi wa “pakiti ya barafu ya papo hapo” (Kielelezo\(\PageIndex{5}\)). Wakati 3.21 g ya NH 4 NO 3 imara hupasuka katika 50.0 g ya maji kwenye 24.9 °C katika calorimeter, halijoto hupungua hadi 20.3 °C.
Tumia thamani ya q kwa mmenyuko huu na ueleze maana ya ishara yake ya hesabu. Hali mawazo yoyote uliyoifanya.

Suluhisho
Tunadhani kwamba calorimeter inazuia uhamisho wa joto kati ya suluhisho na mazingira yake ya nje (ikiwa ni pamoja na calorimeter yenyewe), katika hali hiyo:
\[q_\ce{rxn}=−q_\ce{soln} \nonumber \]
na “rxn” na “soln” kutumika kama shorthand kwa “majibu” na “ufumbuzi,” kwa mtiririko huo.
Kutokana pia kwamba joto maalum ya suluhisho ni sawa na ile ya maji, tuna:
\[\begin{align*} q_\ce{rxn} &=−q_\ce{soln}=−(c×m×ΔT)_\ce{soln}\\ &=\mathrm{−[(4.184J/g\: °C)×(53.2\:g)×(20.3°C−24.9°C)]}\\ &=\mathrm{−[(4.184J/g\: °C)×(53.2\:g)×(−4.6°C)]}\\ &+\mathrm{1.0×10^3\:J=+1.0\:kJ} \end{align*}\]
Ishara nzuri kwa q inaonyesha kwamba uharibifu ni mchakato wa mwisho.
Wakati sampuli ya 3.00-g ya kCl iliongezwa hadi 3.00 × 10 2 g ya maji katika calorimeter ya kikombe cha kahawa, joto lilipungua kwa 1.05 °C Ni kiasi gani cha joto kinachohusika katika kuvunjwa kwa kCl? Uliyofanya mawazo gani?
- Jibu
-
1.33 kJ; kudhani kwamba calorimeter inazuia uhamisho wa joto kati ya suluhisho na mazingira yake ya nje (ikiwa ni pamoja na calorimeter yenyewe) na kwamba joto maalum la suluhisho ni sawa na ile ya maji.
Ikiwa kiasi cha joto kinachochukuliwa na calorimeter ni kubwa mno kupuuza au ikiwa tunahitaji matokeo sahihi zaidi, basi tunapaswa kuzingatia joto lililofanywa na suluhisho na kwa calorimeter.
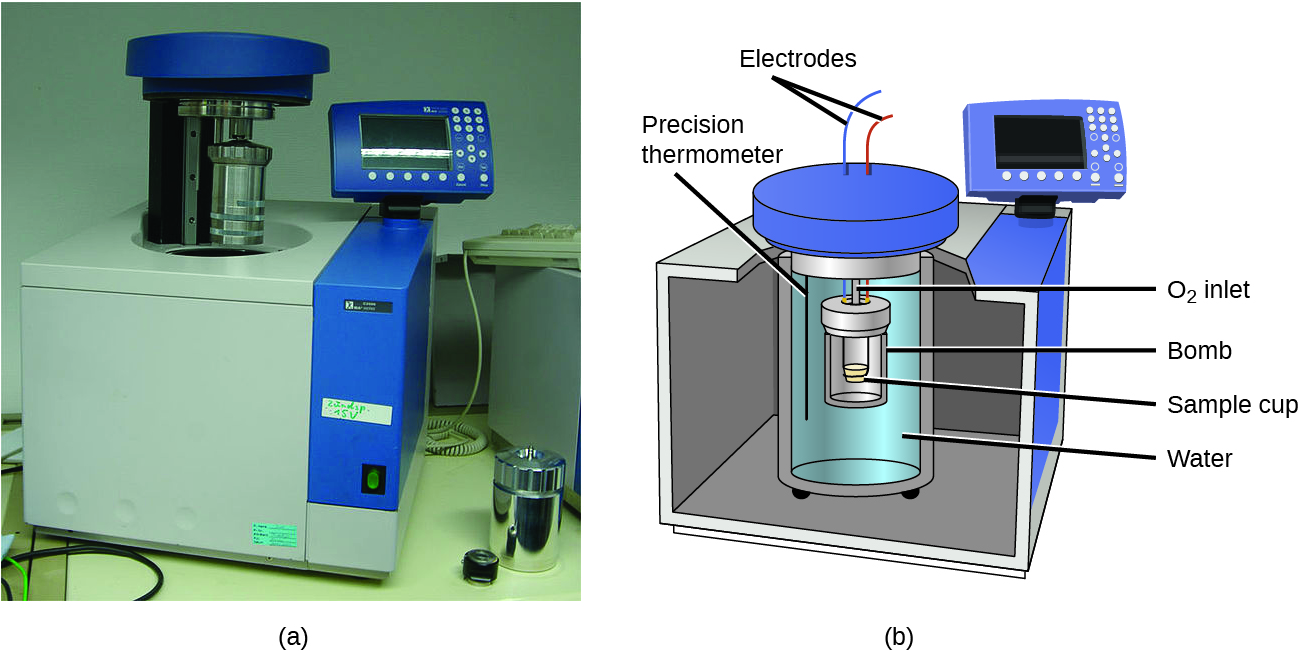
Calorimeters ilivyoelezwa ni iliyoundwa kufanya kazi kwa shinikizo la mara kwa mara (anga) na ni rahisi kupima mtiririko wa joto unaoongozana na taratibu zinazotokea katika suluhisho. Aina tofauti ya calorimeter ambayo inafanya kazi kwa kiasi cha mara kwa mara, inayojulikana kwa colloquially kama calorimeter ya bomu, hutumiwa kupima nishati zinazozalishwa na athari zinazozalisha kiasi kikubwa cha joto na bidhaa za gesi, kama vile athari za mwako. (Neno “bomu” linatokana na uchunguzi kwamba athari hizi zinaweza kuwa na nguvu za kutosha kufanana na milipuko ambayo ingeharibu kalori nyingine.) Aina hii ya calorimeter ina chombo cha chuma kilicho imara (“bomu”) ambacho kina majibu na yenyewe imejaa maji (Kielelezo\(\PageIndex{6}\)). Sampuli imewekwa kwenye bomu, ambayo hujazwa na oksijeni kwenye shinikizo la juu. Cheche ndogo ya umeme hutumiwa kupuuza sampuli. Nishati zinazozalishwa na mmenyuko inakabiliwa na bomu la chuma na maji yanayozunguka. Ongezeko la joto hupimwa na, pamoja na uwezo wa joto unaojulikana wa calorimeter, hutumiwa kuhesabu nishati zinazozalishwa na majibu. Calorimeters za bomu zinahitaji calibration kuamua uwezo wa joto wa calorimeter na kuhakikisha matokeo sahihi. Calibration imekamilika kwa kutumia mmenyuko na q inayojulikana, kama vile kiasi cha kipimo cha asidi benzoiki kinachopuuzwa na cheche kutoka waya ya fyuzi ya nikeli inayohesabiwa kabla na baada ya mmenyuko. Mabadiliko ya joto yanayotokana na mmenyuko inayojulikana hutumiwa kuamua uwezo wa joto wa calorimeter. Calibration kwa ujumla hufanyika kila wakati kabla ya calorimeter kutumiwa kukusanya data za utafiti.
Video\(\PageIndex{1}\): Video ya mtazamo jinsi calorimeter ya bomu imeandaliwa kwa hatua.
Wakati 3.12 g ya glucose, C 6 H 12 O 6, inateketezwa katika calorimeter ya bomu, joto la calorimeter huongezeka kutoka 23.8 °C hadi 35.6 °C Kalorimeter ina 775 g ya maji, na bomu yenyewe ina uwezo wa joto wa 893 J/°C Kiasi gani cha joto kilichozalishwa na mwako wa sampuli ya glucose?
Suluhisho
Mwako hutoa joto ambalo kimsingi linafyonzwa na maji na bomu. (Kiasi cha joto kinachotumiwa na bidhaa za mmenyuko na oksijeni isiyo ya kawaida ni ndogo na kushughulika nao ni zaidi ya upeo wa maandiko haya. Tutawapuuza katika mahesabu yetu.)
Joto lililozalishwa na mmenyuko linafyonzwa na maji na bomu:
\ [kuanza {align*}
&q_\ ce {rxn} =\( q_\ ce {maji} +q_\ ce {bomu})\\
&=\ mathrm {} [(4.184\ :J/g\: °C) × (775\: g) × (35.6° C—23.8°C) +893\ :J/° C × (35.6° C—23.8°C) +893\ :J/° C × (35.6° C—23.8°C) +893\ :J/° C × (35.6° C—23.8°C) +893\ :J/° C × (35.6° C—23.8°C)]}\\
&=\ hesabu {- (38,300\: J+10,500\: J}\\
&=\ hesabu {-48,800\: J=-48.8\: KJ}
\ mwisho { align*}\ nonumber\]
Mmenyuko huu ulitoa 48.7 kJ ya joto wakati 3.12 g ya glucose ilichomwa moto.
Wakati 0.963 g ya benzini, C 6 H 6, inateketezwa katika kalorimeter ya bomu, halijoto ya calorimeter huongezeka kwa 8.39 °C bomu ina uwezo wa joto ya 784 J/°C na imejaa ndani ya 925 mL ya maji. Ni kiasi gani cha joto kilichozalishwa na mwako wa sampuli ya glucose?
Jibu-
39.0 kJ
Tangu kwanza ilijengwa mwaka wa 1899, kalori 35 zimejengwa kupima joto lililozalishwa na mtu aliye hai. 1 Calorimeters zote za mwili wa miundo mbalimbali ni kubwa ya kutosha kushikilia mwanadamu binafsi. Hivi karibuni, calorimeters nzima ya chumba huruhusu shughuli za kawaida zifanyike, na calorimeters hizi zinazalisha data ambazo zinaonyesha kwa karibu zaidi ulimwengu wa kweli. Calorimeters hizi hutumiwa kupima kimetaboliki ya watu binafsi chini ya hali tofauti za mazingira, utawala tofauti wa chakula, na hali tofauti za afya, kama vile ugonjwa wa kisukari. Kwa binadamu, kimetaboliki ni kawaida kipimo katika kalori kwa siku. Kalori ya lishe (Kalori) ni kitengo cha nishati kinachotumiwa kupima kiasi cha nishati inayotokana na kimetaboliki ya vyakula; Kalori moja ni sawa na kalori 1000 (1 kcal), kiasi cha nishati kinachohitajika ili kuchoma kilo 1 cha maji kwa 1 °C.
Katika maisha yako ya kila siku, unaweza kuwa na ujuzi zaidi na nishati zinazotolewa katika kalori, au kalori za lishe, ambazo hutumiwa kupima kiasi cha nishati katika vyakula. Kalori moja (cal) = hasa 4.184 joules, na kalori moja (kumbuka mtaji) = 1000 cal, au 1 kcal. (Hii ni takriban kiasi cha nishati kinachohitajika ili kuchoma kilo 1 cha maji kwa 1 °C.)
Macronutrients katika chakula ni protini, wanga, na mafuta au mafuta. Protini hutoa kalori 4 kwa gramu, wanga pia hutoa kalori 4 kwa gramu, na mafuta na mafuta hutoa takriban 9 kalori/G. maandiko ya lishe kwenye paket chakula kuonyesha maudhui caloric ya huduma moja ya chakula, pamoja na kuvunjika kwa kalori kutoka kila moja ya macronutrients tatu ( Kielelezo\(\PageIndex{7}\)).

Kwa mfano ulioonyeshwa katika (b), nishati ya jumla kwa sehemu ya 228-g inahesabiwa na:
\[\mathrm{(5\:g\: protein×4\:Calories/g)+(31\:g\: carb×4\:Calories/g)+(12\:g\: fat×9\:Calories/g)=252\:Calories} \label{5.3.X} \]
Kwa hiyo, unaweza kutumia maandiko ya chakula kuhesabu kalori zako. Lakini maadili yanatoka wapi? Na ni sahihi jinsi gani? Maudhui ya caloric ya vyakula yanaweza kuamua kwa kutumia calorimetry ya bomu; yaani, kwa kuchoma chakula na kupima nishati iliyo nayo. Sampuli ya chakula hupimwa, imechanganywa katika blender, kufungia-kavu, chini ya poda, na kuundwa ndani ya pellet. Pellet huchomwa ndani ya calorimeter ya bomu, na mabadiliko ya joto ya kipimo hubadilishwa kuwa nishati kwa gramu ya chakula.
Leo, maudhui ya caloric kwenye maandiko ya chakula yanatokana na njia inayoitwa mfumo wa Atwater ambayo hutumia maudhui ya caloric ya wastani wa sehemu mbalimbali za kemikali za chakula, protini, kabohaidreti, na mafuta. Kiasi cha wastani ni zile zinazotolewa katika equation na zinatokana na matokeo mbalimbali yaliyotolewa na kalorimetry ya bomu ya vyakula vyote. Kiasi cha kabohaidreti kinapunguzwa kiasi fulani kwa maudhui ya fiber, ambayo ni kabohaidreti isiyoweza kuharibika. Kuamua maudhui ya nishati ya chakula, kiasi cha kabohaidreti, protini, na mafuta kila mmoja huongezeka kwa kalori wastani kwa gramu kwa kila mmoja na bidhaa zinazotolewa ili kupata nishati ya jumla.
Muhtasari
Calorimetry hutumiwa kupima kiasi cha nishati ya joto iliyohamishwa katika mchakato wa kemikali au kimwili. Hii inahitaji kipimo cha makini cha mabadiliko ya joto yanayotokea wakati wa mchakato na raia wa mfumo na mazingira. Kiasi hiki cha kipimo kinatumika kisha kukokotoa kiasi cha joto zinazozalishwa au kinachotumiwa katika mchakato kwa kutumia mahusiano maalumu ya hisabati. Calorimeters ni iliyoundwa ili kupunguza ubadilishaji wa nishati kati ya mfumo unaojifunza na mazingira yake. Wao mbalimbali kutoka calorimeters rahisi kikombe kahawa kutumiwa na wanafunzi utangulizi kemia kwa calorimeters kisasa bomu kutumika kuamua maudhui ya nishati ya chakula.
maelezo ya chini
- 1 Francis D. Reardon na wenzake. “Calorimeter ya binadamu ya Snellen ilibadilishwa upya, imebadilishwa tena na kuboreshwa: Tabia za kubuni na utendaji.” Medical na Biolojia Engineering na Computing 8 (2006) 721—28, Snellen calorimeter binadamu upya, re-engineered na kuboreshwa: kubuni na utendaji tabia [link.springer.com].
faharasa
- bomu ya calorimeter
- kifaa iliyoundwa kupima mabadiliko ya nishati kwa michakato inayotokea chini ya hali ya kiasi mara kwa mara; kawaida kutumika kwa ajili ya athari kuwashirikisha reactants imara na gesi au bidhaa
- kipimajoto
- kifaa kutumika kupima kiasi cha joto kufyonzwa au iliyotolewa katika mchakato kemikali au kimwili
- kipimo cha kaloriometry
- mchakato wa kupima kiasi cha joto kushiriki katika mchakato wa kemikali au kimwili
- kalori ya lishe (Calorie)
- kitengo kutumika kwa ajili ya kupima nishati zinazotolewa na digestion ya vyakula, hufafanuliwa kama 1000 cal au 1 kcal
- mazingira
- jambo lolote zaidi ya mfumo unaojifunza
- mfumo
- sehemu ya jambo kufanyiwa mabadiliko ya kemikali au kimwili kuwa alisoma


