2.3: Muundo wa Atomiki na Ishara
- Page ID
- 176253
- Andika na kutafsiri alama zinazoonyesha namba atomia, idadi ya wingi, na malipo ya atomi au ion
- Eleza kitengo cha molekuli ya atomiki na wastani wa molekuli
- Tumia wastani wa wingi wa atomiki na wingi wa isotopiki
Maendeleo ya nadharia ya atomia ya kisasa yalifunua mengi kuhusu muundo wa ndani wa atomi. Ilijifunza ya kwamba atomu ina kiini kidogo sana kilichoundwa na protoni chaji chanya na neutroni zisizochajwa, zikizungukwa na kiasi kikubwa zaidi cha nafasi zenye elektroni zilizochajiwa vibaya. Kiini kina wingi wa masi ya atomu kwa sababu protoni na nyutroni ni nzito sana kuliko elektroni, ilhali elektroni huchukua karibu wote kiasi cha atomi. Kipenyo cha atomu ni juu ya oda ya 10 -10 m, ilhali kipenyo cha kiini ni takriban 10 -15 m—takriban mara 100,000 ndogo. Kwa mtazamo kuhusu ukubwa wao wa jamaa, fikiria hili: Ikiwa kiini kilikuwa ukubwa wa blueberry, atomi itakuwa juu ya ukubwa wa uwanja wa mpira wa miguu (Kielelezo\(\PageIndex{1}\)).

Atomi-na protoni, nyutroni, na elektroni zinazoziandika-ni ndogo mno. Kwa mfano, atomu ya kaboni ina uzani chini ya 2\(\times\) 10 -23 g, na elektroni ina chaji ya chini ya 2\(\times\) 10 —19 C (coulomb). Tunapoelezea tabia za vitu vidogo kama vile atomi, tunatumia vitengo vidogo vilivyofaa vya kipimo, kama vile kitengo cha molekuli atomia (amu) na kitengo cha msingi cha malipo (e). AMU awali ilifafanuliwa kulingana na hidrojeni, elementi nyepesi zaidi, halafu baadaye kwa suala la oksijeni. Tangu 1961, imefafanuliwa kuhusiana na isotopu nyingi zaidi ya kaboni, atomi ambazo zinapewa raia wa hasa 12 amu. (Isotopu hii inajulikana kama “kaboni-12" kama itajadiliwa baadaye katika moduli hii.) Hivyo, amu moja ni hasa\(1/12\) ya masi ya atomu moja ya kaboni-12:1 amu = 1.6605\(\times\) 10 -24 g. (Dalton (Da) na kitengo cha umati atomia kilichounganishwa (u) ni vitengo mbadala ambavyo ni sawa na amu.) Kitengo cha msingi cha malipo (pia kinachojulikana malipo ya msingi) ni sawa na ukubwa wa malipo ya elektroni (e) na e = 1.602\(\times\) 10 -19 C.
Protoni ina masi ya 1.0073 amu na chaji ya 1+. Neutroni ni chembe nzito kidogo yenye masi 1.0087 amu na chaji ya sifuri; kama jina lake linavyoonyesha, haina upande wowote. Electroni ina chaji ya 1- na ni chembe nyepesi sana yenye masi ya takriban 0.00055 amu (itachukua takriban elektroni 1800 ili kulinganisha masi ya protoni moja. Mali ya chembe hizi za msingi zinafupishwa katika Jedwali\(\PageIndex{1}\). (Mwanafunzi mwangalifu anaweza kutambua kwamba jumla ya chembe za subatomiki za atomi hazifanani na masi halisi ya atomu: Masi ya jumla ya protoni sita, neutroni sita, na elektroni sita ni 12.0993 amu, kubwa kidogo kuliko amu 12.00 ya atomu halisi ya kaboni-12. Masi hii “kukosa” inajulikana kama kasoro ya wingi, na utajifunza kuhusu hilo katika sura ya kemia ya nyuklia.)
| Jina | Eneo | Malipo (C) | Kitengo cha malipo | Misa (amu) | Misa (g) |
|---|---|---|---|---|---|
| elektroni | nje ya kiini | \(−1.602 \times 10^{−19}\) | 1- | 0.00055 | \(0.00091 \times 10^{−24}\) |
| protoni | kiini | \(1.602 \times 10^{−19}\) | 1+ | 1.00727 | \(1.67262 \times 10^{−24}\) |
| neutroni | kiini | 0 | 0 | 1.00866 | \(1.67493 \times10^{−24}\) |
Idadi ya protoni katika kiini cha atomi ni namba atomia yake (\(Z\)). Hii ni sifa inayofafanua ya elementi: Thamani yake huamua utambulisho wa atomu. Kwa mfano, atomu yoyote iliyo na protoni sita ni elementi kaboni na ina namba atomia 6, bila kujali nyutroni nyingi au elektroni zinaweza kuwa nazo. Atomu ya neutral lazima iwe na idadi sawa ya mashtaka mazuri na hasi, hivyo idadi ya protoni inalingana na idadi ya elektroni. Kwa hiyo, namba atomia pia inaonyesha idadi ya elektroni katika atomi. Idadi ya protoni na nyutroni katika atomu inaitwa namba yake ya masi (A). Kwa hiyo idadi ya nyutroni ni tofauti kati ya namba ya masi na namba atomia: A — Z = idadi ya nyutroni.
\ [\ kuanza {align*}
\ ce {atomiki\: nambari\ :( Z)\: &=\: nambari\: ya\: protoni\\
masi\: idadi\ :( A)\: &=\: idadi\: protoni + idadi\: ya\: neutroni\\
A-Z\: &=\ :nambari\: ya\: neutroni}
\ mwisho {align*\} hakuna nambari\]
Atomi hazina upande wowote wa umeme ikiwa zina idadi sawa ya protoni zenye chaji chanya na elektroni zenye chaji hasi. Wakati idadi ya chembe hizi za subatomiki si sawa, atomu inashtakiwa kwa umeme na inaitwa ioni. Malipo ya atomu hufafanuliwa kama ifuatavyo:
Malipo ya atomiki = idadi ya protoni - idadi ya elektroni
Kama itajadiliwa kwa undani zaidi baadaye katika sura hii, atomi (na molekuli) kawaida hupata malipo kwa kupata au kupoteza elektroni. Atomu inayopata elektroni moja au zaidi itaonyesha chaji hasi na inaitwa anioni. Atomi zenye chaji chanya zinazoitwa cations zinaundwa wakati atomu inapoteza elektroni moja au zaidi. Kwa mfano, atomi ya sodiamu ya neutral (Z = 11) ina elektroni 11. Ikiwa atomu hii inapoteza elektroni moja, itakuwa cation yenye chaji 1+ (11 ÷ 10 = 1+). Atomu ya oksijeni isiyo na upande wowote (Z = 8) ina elektroni nane, na ikiwa inapata elektroni mbili itakuwa anion yenye chaji 2- (8 - 10 = 2-).
Iodini ni kipengele muhimu cha kufuatilia katika mlo wetu; inahitajika kuzalisha homoni ya tezi. Iodini haitoshi katika chakula inaweza kusababisha maendeleo ya goiter, kupanua kwa tezi ya tezi (Kielelezo\(\PageIndex{2}\)).
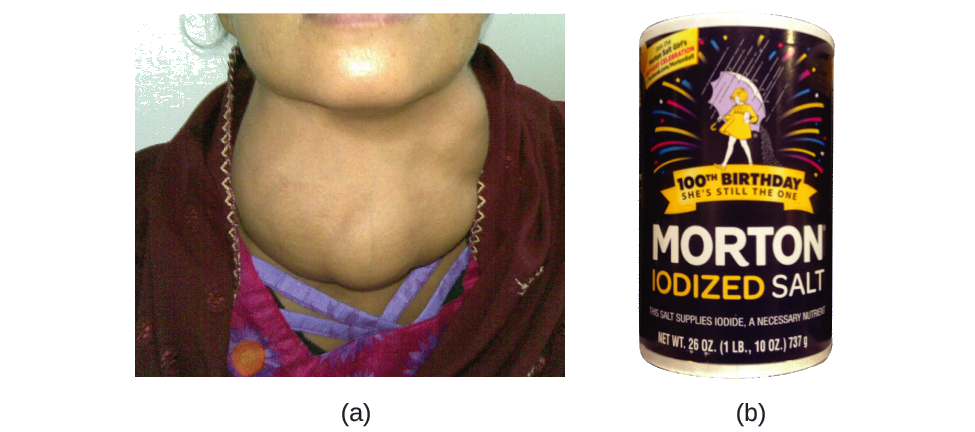
Kuongezewa kwa kiasi kidogo cha iodini kwa chumvi la meza (chumvi inayoongezewa madini ya iodini) kimsingi imeondoa wasiwasi huu wa afya nchini Marekani, lakini asilimia 40 ya idadi ya watu duniani bado iko katika hatari ya upungufu wa iodini. Atomi za iodini huongezwa kama anioni, na kila moja ina chaji 1 na idadi kubwa ya 127. Tambua idadi ya protoni, neutroni, na elektroni katika mojawapo ya anioni hizi za iodini.
Suluhisho
Idadi atomia ya iodini (53) inatuambia ya kwamba atomu ya iodini isiyo na upande wowote ina protoni 53 katika kiini chake na elektroni 53 nje ya kiini chake. Kwa sababu jumla ya idadi ya protoni na nyutroni inalingana na idadi ya wingi, 127, idadi ya nyutroni ni 74 (127- 53 = 74). Kwa kuwa iodini inaongezwa kama anioni 1-, idadi ya elektroni ni 54 [53 — (1—) = 54].
Ioni ya platinamu ina idadi kubwa ya 195 na ina elektroni 74. Ni protoni ngapi na neutrons zina vyenye, na ni malipo gani?
- Jibu
-
Protoni 78; 117 neutroni; malipo ni 4+
Symbols kemikali
Alama ya kemikali ni kifupi tunachotumia kuonyesha elementi au atomi ya elementi. Kwa mfano, ishara ya zebaki ni Hg (Kielelezo\(\PageIndex{3}\)). Tunatumia ishara hiyo ili kuonyesha atomi moja ya zebaki (uwanja wa microscopic) au kuandika chombo cha atomi nyingi za zebaki ya kipengele (kikoa cha macroscopic).

Ishara za elementi kadhaa za kawaida na atomi zao zimeorodheshwa katika Jedwali\(\PageIndex{2}\). Alama zingine zinatokana na jina la kawaida la elementi; nyingine ni vifupisho vya jina katika lugha nyingine. Ishara zina barua moja au mbili, kwa mfano, H kwa hidrojeni na Cl kwa klorini. Ili kuepuka kuchanganyikiwa na maelezo mengine, barua ya kwanza ya ishara ni mtaji. Kwa mfano, Co ni ishara ya kipengele cobalt, lakini CO ni alama ya monoxide ya kaboni ya kiwanja, ambayo ina atomi za vipengele kaboni (C) na oksijeni (O). Vipengele vyote vinavyojulikana na alama zao ziko kwenye meza ya mara kwa mara.
| Element | Mkono | Element | Mkono |
|---|---|---|---|
| alumini | Al | chuma | Fe (kutoka ferrum) |
| bromini | Br | risasi | Pb (kutoka plumbum) |
| kalsiamu | Ca | magnesiamu | Mg |
| kaboni | C | zebaki | Hg (kutoka hydrargyrum) |
| klorini | Cl | naitrojeni | N |
| chromium | Cr | oksijeni | O |
| kobalti | mwenzi | potasiamu | K (kutoka kalium) |
| shaba | Cu (kutoka cuprum) | silikoni | na |
| florini | F | fedha | Ag (kutoka Argentum) |
| dhahabu | Au (kutoka aurum) | sodiamu | Na (kutoka natrium) |
| heliamu | Yeye | salfa | S |
| haidrojeni | H | mkebe | Sn (kutoka stannum) |
| iodini | I | zinki | Zn |
Kijadi, mvumbuzi (au wavumbuzi) wa kipengele kipya hutaja kipengele. Hata hivyo, mpaka jina litakapotambuliwa na Umoja wa Kimataifa wa Kemia safi na Applied (IUPAC), jina lililopendekezwa la elementi mpya limetokana na neno la Kilatini (s) kwa namba atomia yake. Kwa mfano, kipengele 106 kiliitwa unnilhexium (Unh), kipengele 107 kiliitwa unnilseptium (Uns), na kipengele 108 kiliitwa unniloctium (Uno) kwa miaka kadhaa. Elementi hizi sasa zimeitwa jina la wanasayansi au maeneo; kwa mfano, elementi 106 sasa inajulikana kama seaborgium (Sg) kwa heshima ya Glenn Seaborg, mshindi wa Tuzo ya Nobel ambaye alikuwa hai katika ugunduzi wa elementi kadhaa nzito.
Isotopu
Ishara ya isotopu maalum ya kipengele chochote imeandikwa kwa kuweka namba ya wingi kama superscript upande wa kushoto wa ishara ya kipengele (Kielelezo\(\PageIndex{4}\)). Nambari atomia wakati mwingine huandikwa kama subscript iliyotangulia alama, lakini kwa kuwa namba hii inafafanua utambulisho wa elementi, kama ilivyo alama yake, mara nyingi huachwa. Kwa mfano, magnesiamu ipo kama mchanganyiko wa isotopi tatu, kila mmoja mwenye namba atomia ya 12 na yenye idadi kubwa ya 24, 25, na 26, kwa mtiririko huo. Isotopi hizi zinaweza kutambuliwa kama 24 Mg, 25 Mg, na 26 Mg. Alama hizi za isotopu zinasomwa kama “elementi, namba ya wingi” na zinaweza kuonyeshwa sambamba na usomaji huu. Kwa mfano, 24 Mg inasomewa kama “magnesiamu 24,” na inaweza kuandikwa kama “magnesium-24" au “Mg-24.” 25 Mg inasomewa kama “magnesiamu 25,” na inaweza kuandikwa kama “magnesium-25” au “Mg-25.” Atomi zote za magnesiamu zina protoni 12 katika kiini chao. Wanatofautiana tu kwa sababu atomi ya Mg 24 ina nyutroni 12 katika kiini chake, atomi ya 25 Mg ina nyutroni 13, na mg 26 ina neutroni 14.
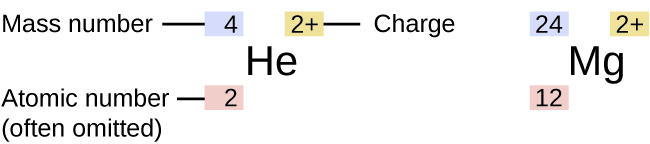
Habari kuhusu isotopi za asili zinazotokea za elementi zenye namba atomia 1 hadi 10 zinatolewa katika Jedwali\(\PageIndex{2}\). Kumbuka kuwa pamoja na majina na alama za kawaida, isotopu za hidrojeni mara nyingi hujulikana kwa kutumia majina ya kawaida na alama zinazoambatana. Hidrojeni -2, mfano wa 2 H, pia huitwa deuterium na wakati mwingine mfano D. hidrojeni-3, mfano wa 3 H, pia huitwa tritium na wakati mwingine mfano T.
| Element | Mkono | Idadi Atomiki | Idadi ya protoni | Idadi ya Neutroni | Misa (amu) | % Asili Wingi |
|---|---|---|---|---|---|---|
| hidrojeni | \(\ce{^1_1H}\) (protiamu) |
1 | 1 | 0 | 1.0078 | 99.989 |
| \(\ce{^2_1H}\) (deuterium) |
1 | 1 | 1 | 2.0141 | 0.0115 | |
| \(\ce{^3_1H}\) (tritiamu) |
1 | 1 | 2 | 3.01605 | — (kufuatilia) | |
| heliamu | \(\ce{^3_2He}\) | 2 | 2 | 1 | 3.01603 | 0.00013 |
| \(\ce{^4_2He}\) | 2 | 2 | 2 | 4.0026 | 100 | |
| lithiamu | \(\ce{^6_3Li}\) | 3 | 3 | 3 | 6.0151 | 7.59 |
| \(\ce{^7_3Li}\) | 3 | 3 | 4 | 7.0160 | 92.41 | |
| berili | \(\ce{^9_4Be}\) | 4 | 4 | 5 | 9.0122 | 100 |
| boroni | \(\ce{^{10}_5B}\) | 5 | 5 | 5 | 10.0129 | 19.9 |
| \(\ce{^{11}_5B}\) | 5 | 5 | 6 | 11.0093 | 80.1 | |
| kaboni | \(\ce{^{12}_6C}\) | 6 | 6 | 6 | 12.0000 | 98.89 |
| \(\ce{^{13}_6C}\) | 6 | 6 | 7 | 13.0034 | 1.11 | |
| \(\ce{^{14}_6C}\) | 6 | 6 | 8 | 14.0032 | — (kufuatilia) | |
| nitrojeni | \(\ce{^{14}_7N}\) | 7 | 7 | 7 | 14.0031 | 99.63 |
| \(\ce{^{15}_7N}\) | 7 | 7 | 8 | 15.0001 | 0.37 | |
| oksijeni | \(\ce{^{16}_8O}\) | 8 | 8 | 8 | 15.9949 | 99.757 |
| \(\ce{^{17}_8O}\) | 8 | 8 | 9 | 16.9991 | 0.038 | |
| \(\ce{^{18}_8O}\) | 8 | 8 | 10 | 17.9992 | 0.205 | |
| florini | \(\ce{^{19}_9F}\) | 9 | 9 | 10 | 18.9984 | 100 |
| neon | \(\ce{^{20}_{10}Ne}\) | 10 | 10 | 10 | 19.9924 | 90.48 |
| \(\ce{^{21}_{10}Ne}\) | 10 | 10 | 11 | 20.9938 | 0.27 | |
| \(\ce{^{22}_{10}Ne}\) | 10 | 10 | 12 | 21.9914 | 9.25 |
Atomiki Misa
Kwa sababu kila protoni na kila neutroni huchangia takriban amu moja kwa masi ya atomu, na kila elektroni huchangia mbali kidogo, masi atomia ya atomu moja ni takriban sawa na namba yake ya masi (namba nzima). Hata hivyo, raia wastani wa atomi za elementi nyingi si namba nzima kwa sababu elementi nyingi zipo kiasili kama mchanganyiko wa isotopi mbili au zaidi.
Masi ya elementi inayoonyeshwa katika meza ya mara kwa mara au iliyoorodheshwa katika meza ya raia atomia ni uzito, wastani wa wingi wa isotopi zote zilizopo katika sampuli inayotokea kiasili ya elementi hiyo. Hii ni sawa na jumla ya molekuli ya isotopu ya kila mtu inayoongezeka kwa wingi wake wa sehemu.
\[\mathrm{average\: mass}=\sum_{i}(\mathrm{fractional\: abundance\times isotopic\: mass})_i \nonumber \]
Kwa mfano elementi boroni inaundwa na isotopi mbili: Takriban 19.9% za atomi zote za boroni ni 10 B zenye masi ya 10.0129 amu, na 80.1% iliyobaki ni 11 B yenye masi ya amu 11.0093. Masi ya atomiki ya wastani kwa boroni imehesabiwa kuwa:
\ [kuanza {align*}
\ textrm {boroni wastani molekuli} &=\\ mathrm {(0.199\ mara 10.0129\: amu) + (0.801\ mara 11.0093\: amu)}\\
&=\\ hesabu {1.99\: amu+8.82\: amu}\\
&=\ mathrm {10.81\: amu}
\ {align*}\ nonumber\]
Ni muhimu kuelewa ya kwamba hakuna atomi moja ya boroni yenye uzani hasa 10.8 amu; amu 10.8 ni masi ya wastani ya atomi zote za boroni, na atomi za boroni binafsi zina uzito ama takriban 10 au amu 11.
Meteorite iliyopatikana katikati ya Indiana ina athari za neon ya gesi yenye heshima iliyochukuliwa kutoka upepo wa jua wakati wa safari ya meteorite kupitia mfumo wa jua. Uchambuzi wa sampuli ya gesi ilionyesha kuwa ilikuwa na 91.84% 20 Ne (molekuli 19.9924 amu), 0.47% 21 Ne (molekuli 20.9940 amu), na 7.69% 22 Ne (molekuli 21.9914 amu). Je, ni wingi wa wastani wa neon katika upepo wa jua?
Suluhisho
\ [kuanza {align*}
\ mathrm {wastani\: molekuli} &=\ hesabu {(0.9184\ mara 19.9924\: amu) + (0.0047\ mara 20.9940\: amu) + (0.0769\ mara 21.9914\: amu)}\\
&=\ mathrm {(18.36+0.099+1.69)\: amu}\\
&=\ hesabu {20.15\: amu}
\ mwisho {align*}\ nonumber\]
Masi ya wastani ya atomu ya neon katika upepo wa jua ni 20.15 amu. (Masi ya wastani ya atomi ya neon duniani ni 20.1796 amu. Matokeo haya yanaonyesha kwamba tunaweza kupata tofauti kidogo katika wingi asilia wa isotopu, kulingana na asili yao.)
Sampuli ya magnesiamu inapatikana kuwa na atomi 78.70% ya 24 Mg (masi 23.98 amu), 10.13% ya atomi 25 Mg (masi 24.99 amu), na 11.17% ya atomi 26 Mg (masi 25.98 amu). Tumia molekuli wastani wa atomi ya Mg.
- Jibu
-
24.31 hivi
Tunaweza pia kufanya tofauti za aina hii ya hesabu, kama inavyoonekana katika mfano unaofuata.
Klorini inayotokea kwa kawaida ina 35 Cl (molekuli 34.96885 amu) na 37 Cl (molekuli 36.96590 amu), ikiwa na molekuli wastani wa 35.453 amu. ni asilimia muundo wa Cl katika suala la isotopu hizi mbili?
Suluhisho
Masi ya wastani ya klorini ni sehemu ambayo ni mara 35 Cl wingi wa 35 Cl pamoja na sehemu ambayo ni 37 Cl mara wingi wa 37 Cl.
\[\mathrm{average\: mass=(fraction\: of\: ^{35}Cl\times mass\: of\: ^{35}Cl)+(fraction\: of\: ^{37}Cl\times mass\: of\: ^{37}Cl)} \nonumber \]
Ikiwa tunaruhusu x kuwakilisha sehemu ambayo ni 35 Cl, basi sehemu ambayo ni 37 Cl inawakilishwa na 1.00 - x.
(Sehemu ambayo ni 35 Cl + sehemu ambayo ni 37 Cl lazima kuongeza hadi 1, hivyo sehemu ya 37 Cl lazima sawa 1.00 - sehemu ya 35 Cl.)
Kubadilisha hii katika equation wastani wa molekuli, tuna:
\ [kuanza {align*}
\ mathrm {35.453\: amu} & =( x\ mara 34.96885\:\ ce {amu}) + [(1.00-x)\ mara 36.96590\:\ ce {amu}]\\
35.453 &=34.96885x+36.96590-36.96590x\
1.99705x &=1.513\\
x&=\ dfrac {1.513} {1.99705} =0.7576
\ mwisho {align*}\ hakuna idadi\]
Hivyo kutatua mavuno: x = 0.7576, ambayo ina maana kwamba 1.00 - 0.7576 = 0.2424. Kwa hiyo, klorini ina 75.76% 35 Cl na 24.24% 37 Cl.
Shaba inayotokea kwa kawaida ina 63 Cu (molekuli 62.9296 amu) na 65 Cu (molekuli 64.9278 amu), ikiwa na molekuli wastani wa 63.546 amu. Asilimia muundo wa Cu katika suala la isotopu hizi mbili ni nini?
- Jibu
-
69.15% Cu-63 na 30.85% Cu-65
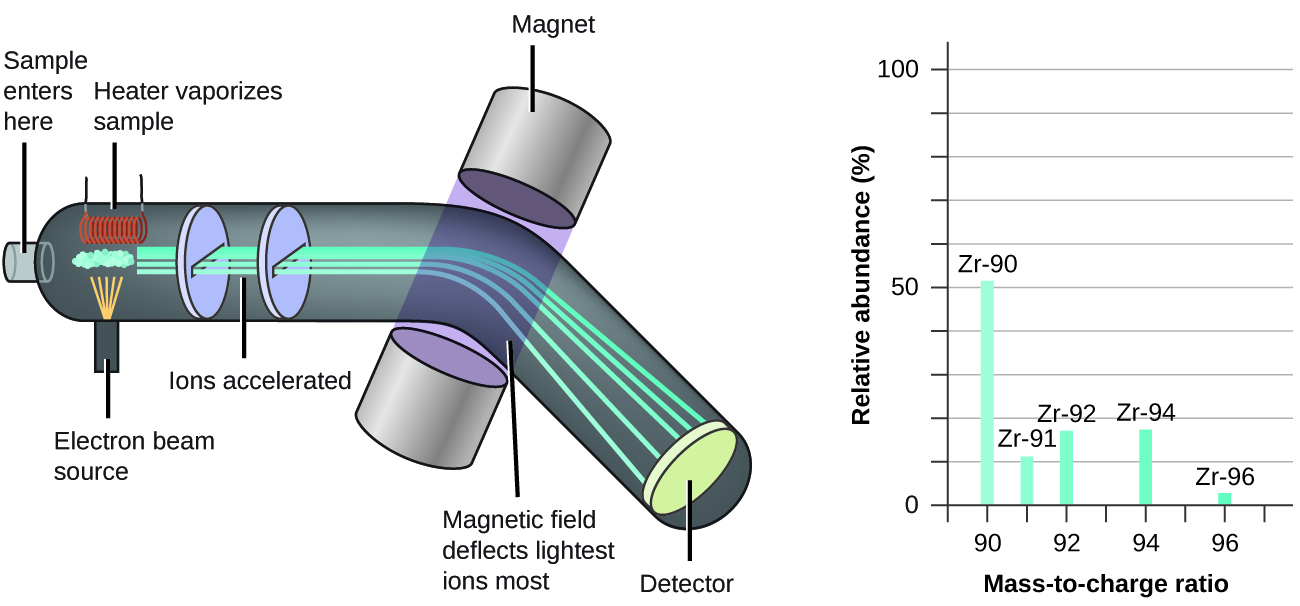
Tukio na wingi wa asili wa isotopu zinaweza kuamua majaribio kwa kutumia chombo kinachoitwa spectrometer ya molekuli. Misa spectrometry (MS) hutumika sana katika kemia, forensics, dawa, sayansi ya mazingira, na nyanja nyingine nyingi kuchambua na kusaidia kutambua vitu katika sampuli ya nyenzo. Katika kawaida molekuli spectrometer (Kielelezo\(\PageIndex{5}\)), sampuli ni vaporized na wazi kwa high-nishati elektroni boriti ambayo husababisha atomi sampuli ya (au molekuli) kuwa umeme kushtakiwa, kawaida kwa kupoteza elektroni moja au zaidi. Hizi cations kisha kupita katika (variable) umeme au magnetic shamba kwamba deflects njia ya kila cation kwa kiasi kwamba inategemea wote uzito wake na malipo (sawa na jinsi njia ya kubwa chuma mpira kuzaa rolling nyuma sumaku ni deflected kwa kiwango kidogo kwamba ile ya chuma ndogo BB). Ions hugunduliwa, na njama ya idadi ya jamaa ya ions yanayotokana dhidi ya uwiano wao wa molekuli hadi malipo (wigo wa wingi) hufanywa. Urefu wa kila kipengele cha wima au kilele katika wigo wa wingi ni sawa na sehemu ya cations na uwiano maalum wa malipo. Tangu matumizi yake ya awali wakati wa maendeleo ya nadharia ya atomia ya kisasa, MS imebadilika kuwa chombo chenye nguvu kwa uchambuzi wa kemikali katika matumizi mbalimbali.
Video\(\PageIndex{1}\): Tazama video hii kutoka kwa Royal Society for Chemistry kwa maelezo mafupi ya rudiments ya spectrometry ya molekuli.
Muhtasari
Atomu ina kiini kidogo chenye chaji chanya kilichozungukwa na elektroni. Kiini kina protoni na nyutroni; kipenyo chake ni ndogo zaidi ya mara 100,000 kuliko ile ya atomu. Masi ya atomu moja kwa kawaida huonyeshwa katika vitengo vya molekuli atomia (amu), ambayo hujulikana kama masi atomia. Amu hufafanuliwa kama hasa\(1/12\) ya masi ya atomu kaboni-12 na ni sawa na 1.6605\(\times\) 10 -24 g.
Protoni ni chembe nzito kiasi na chaji ya 1+ na masi ya 1.0073 amu. Neutroni ni chembe nzito kiasi zisizo na chaji na masi ya amu 1.0087. Electroni ni chembe nyepesi zenye chaji ya 1- na masi ya 0.00055 amu. Idadi ya protoni katika kiini huitwa namba atomia (Z) na ni mali inayofafanua utambulisho wa msingi wa atomu. Jumla ya idadi ya protoni na nyutroni katika kiini huitwa namba ya wingi na, iliyoelezwa kwa amu, ni takriban sawa na masi ya atomu. Atomu haina upande wowote wakati ina idadi sawa ya elektroni na protoni.
Isotopi za elementi ni atomi zenye namba atomia ileile lakini namba tofauti za molekuli; isotopi za elementi, kwa hiyo, hutofautiana tu kwa idadi ya nyutroni ndani ya kiini. Wakati elementi inayotokea asili inaundwa na isotopi kadhaa, masi atomia ya elementi inawakilisha wastani wa raia wa isotopi zinazohusika. Alama ya kemikali inatambua atomi katika dutu kwa kutumia alama, ambazo ni vifupisho moja-, mbili-, au tatu kwa atomi.
Mlinganyo muhimu
- \(\mathrm{average\: mass}=\sum_{i}(\mathrm{fractional\: abundance \times isotopic\: mass})_i\)
faharasa
- anion
- chaji vibaya chembe au molekuli (ina elektroni zaidi ya protoni)
- molekuli atomiki
- wastani wa wingi wa atomi ya kipengele, walionyesha katika amu
- kitengo cha molekuli ya atomiki (amu)
- (pia, kitengo cha umoja wa atomiki, u, au Dalton, Da) kitengo cha wingi sawa na\(\dfrac{1}{12}\) ya wingi wa atomi ya 12 C
- namba atomiki (Z)
- idadi ya protoni katika kiini cha atomi
- cation
- chanya chaji chanya au molekuli (ina elektroni chache kuliko protoni)
- ishara ya kemikali
- moja-, mbili-, au tatu herufi abbreviation kutumika kuwakilisha elementi au atomi zake
- Dalton (Da)
- kitengo mbadala sawa na kitengo cha molekuli ya atomiki
- kitengo cha msingi cha malipo
- (pia huitwa malipo ya msingi) sawa na ukubwa wa malipo ya elektroni (e) na e = 1.602\(\times\) 10 -19 C
- ioni
- atomi ya kushtakiwa umeme au molekuli (ina idadi isiyo sawa ya protoni na elektroni)
- idadi kubwa (A)
- jumla ya idadi ya neutroni na protoni katika kiini cha atomi
- umoja wa umati wa atomiki kitengo (u)
- kitengo mbadala sawa na kitengo cha molekuli ya atomiki


