3.5: Michakato ya Thermodynamic
- Page ID
- 175570
Mwishoni mwa sehemu hii, utaweza:
- Eleza mchakato wa thermodynamic
- Tofautisha kati ya michakato ya nusu-static na isiyo ya nusu-static
- Tumia kiasi cha kimwili, kama vile joto lililohamishwa, kazi iliyofanyika, na mabadiliko ya ndani ya nishati kwa michakato ya isothermal, adiabatic, na ya mzunguko wa thermodynamic
Katika kutatua matatizo ya mitambo, tunajitenga mwili unaozingatiwa, kuchambua vikosi vya nje vinavyofanya juu yake, na kisha kutumia sheria za Newton kutabiri tabia yake. Katika thermodynamics, tunachukua mbinu sawa. Tunaanza kwa kutambua sehemu ya ulimwengu tunayotaka kujifunza; pia inajulikana kama mfumo wetu. (Tulifafanua mfumo mwanzoni mwa sura hii kama kitu chochote ambacho mali yake ni ya manufaa kwetu; inaweza kuwa atomi moja au Dunia nzima.) Mara baada ya mfumo wetu kuchaguliwa, tunaamua jinsi mazingira, au mazingira, yanavyoingiliana na mfumo. Hatimaye, pamoja na mwingiliano unaeleweka, tunasoma tabia ya joto ya mfumo kwa msaada wa sheria za thermodynamics.
Tabia ya joto ya mfumo inaelezwa kwa suala la vigezo vya thermodynamic. Kwa gesi bora, vigezo hivi ni shinikizo, kiasi, joto, na idadi ya molekuli au moles ya gesi. Aina tofauti za mifumo kwa ujumla zinahusika na seti tofauti za vigezo. Kwa mfano, vigezo vya thermodynamic kwa bendi ya mpira iliyotiwa ni mvutano, urefu, joto, na wingi.
Hali ya mfumo inaweza kubadilika kama matokeo ya mwingiliano wake na mazingira. Mabadiliko katika mfumo yanaweza kuwa ya haraka au polepole na kubwa au ndogo. Njia ambayo hali ya mfumo inaweza kubadilika kutoka hali ya awali hadi hali ya mwisho inaitwa mchakato wa thermodynamic. Kwa madhumuni ya uchambuzi katika thermodynamics, ni muhimu kugawanya michakato kama ama nusu-static au isiyo ya nusu-static, kama tunavyoelezea sasa.
Michakato ya nusu ya tuli na isiyo ya nusu-tuli
Mchakato wa nusu-tuli unahusu mchakato wa idealized au wa kufikiri ambapo mabadiliko katika hali hufanywa polepole kidogo ili kila papo hapo, mfumo unaweza kudhani kuwa katika usawa wa thermodynamic na yenyewe na kwa mazingira. Kwa mfano, fikiria inapokanzwa kilo 1 cha maji kutoka\(21^oC\) joto\(20^oC\) hadi shinikizo la mara kwa mara la anga 1. Ili joto maji polepole sana, tunaweza kufikiria kuweka chombo na maji katika umwagaji mkubwa ambayo inaweza kuwa polepole joto kama kwamba joto la umwagaji linaweza kuongezeka polepole kidogo kutoka\(20^oC\) kwa\(21^oC\). Ikiwa tunaweka kilo 1 cha maji\(20^oC\) moja kwa moja ndani\(21^oC\) ya kuoga kwenye joto la maji litafufuliwa haraka\(21^oC\) kwa njia isiyo ya tuli.
Michakato ya nusu ya tuli hufanyika polepole kwa kutosha kwamba mfumo unabaki katika usawa wa thermodynamic kwa kila papo, licha ya ukweli kwamba mfumo hubadilika kwa muda. Msawazo wa thermodynamic wa mfumo ni muhimu kwa mfumo kuwa na maadili mazuri ya mali macroscopic kama vile joto na shinikizo la mfumo kwa kila papo hapo. Kwa hiyo, michakato ya nusu-static inaweza kuonyeshwa kama njia zilizoelezwa vizuri katika nafasi ya hali ya mfumo.
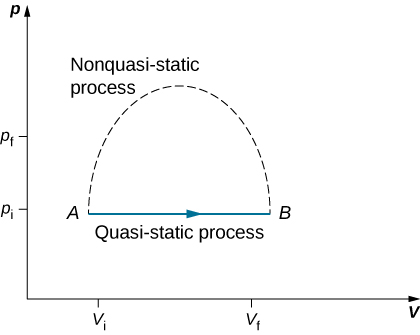
Kwa kuwa michakato ya nusu-tuli haiwezi kufikiwa kabisa kwa mabadiliko yoyote ya mwisho ya mfumo, taratibu zote katika asili ni zisizo za nusu-static. Mifano ya michakato ya nusu-static na isiyo ya nusu-static inavyoonekana kwenye Kielelezo\(\PageIndex{1}\). Licha ya ukweli kwamba mabadiliko yote ya mwisho yanapaswa kutokea kimsingi yasiyo ya nusu-tuli katika hatua fulani ya mabadiliko, tunaweza kufikiria kufanya mchakato mkubwa wa nusu-tuli sambamba na kila mchakato wa nusu-tuli. Kwa kuwa michakato ya nusu-tuli inaweza kuchambuliwa kwa uchambuzi, sisi hasa tunasoma michakato ya nusu-static katika kitabu hiki. Tayari tumeona kwamba katika mchakato wa nusu-static kazi na gesi hutolewa na PDV.
Michakato ya Isothermal
Mchakato wa isothermal ni mabadiliko katika hali ya mfumo kwa joto la kawaida. Utaratibu huu unafanywa kwa kuweka mfumo katika usawa wa joto na umwagaji mkubwa wa joto wakati wa mchakato. Kumbuka kwamba umwagaji wa joto ni mfumo mkubwa wa “usio na mwisho” ambao joto halibadilika. Katika mazoezi, joto la umwagaji wa mwisho hudhibitiwa na kuongeza au kuondoa kiasi cha mwisho cha nishati kama kesi inaweza kuwa.
Kama mfano wa mchakato wa isothermal, fikiria silinda ya gesi yenye pistoni inayohamia immersed katika tank kubwa ya maji ambayo joto huhifadhiwa mara kwa mara. Kwa kuwa pistoni inahamia kwa uhuru, shinikizo ndani\(P_{in}\) ni sawa na shinikizo nje\(P_{out}\) na uzito fulani kwenye pistoni, kama ilivyo kwenye Mchoro\(\PageIndex{2}\).
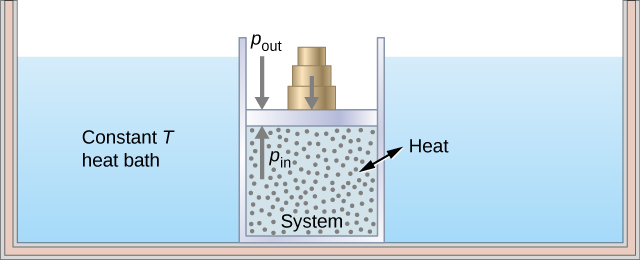
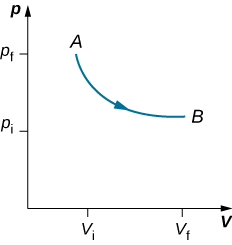
Kama uzito kwenye pistoni huondolewa, usawa wa nguvu kwenye pistoni huendelea. Nguvu ya nonzero ya wavu kwenye pistoni ingesababisha pistoni kuharakisha, na kusababisha ongezeko la kiasi. Upanuzi wa gesi hupunguza gesi kwa joto la chini, ambayo inafanya uwezekano wa joto kuingia kutoka kwenye umwagaji wa joto ndani ya mfumo mpaka joto la gesi litakapowekwa upya kwa joto la umwagaji wa joto. Ikiwa uzito huondolewa kwa hatua ndogo, shinikizo katika mfumo hupungua polepole kidogo. Kwa njia hii, mchakato wa isothermal unaweza kufanywa nusu-statically. Mstari wa isothermal kwenye mchoro (p, V) unawakilishwa na mstari wa pembe kutoka hatua ya mwanzo A hadi kumaliza hatua B, kama inavyoonekana kwenye Mchoro\(\PageIndex{3}\). Kwa gesi bora, mchakato wa isothermal ni hyperbolic, tangu kwa gesi bora kwa joto la kawaida,\(p \propto \frac{1}{V}\).
Mchakato isothermal alisoma katika sura hii ni nusu-tuli kazi, kwa kuwa isothermal katika mabadiliko ya kiasi, lazima kuwa na uwezo wa hali ya joto ya mfumo katika kila hatua, ambayo inawezekana tu kama mfumo ni katika usawa mafuta kuendelea. Mfumo lazima uondoke kwa usawa ili hali ibadilike, lakini kwa michakato ya nusu-tuli, tunafikiria kwamba mchakato unafanywa kwa hatua ndogo sana kama vile kuondoka kwa usawa kunaweza kufanywa kwa kifupi na ndogo kama tunavyopenda.
Michakato mingine ya nusu ya static ya riba kwa gesi ni michakato ya isobaric na isochoric. Mchakato wa isobaric ni mchakato ambapo shinikizo la mfumo haubadilika, wakati mchakato wa isochoric s ni mchakato ambapo kiasi cha mfumo haubadilika.
Michakato ya Adiabatic
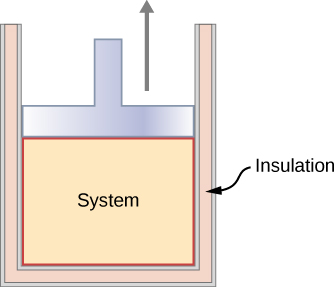
Katika mchakato wa adiabatic, mfumo ni maboksi kutoka mazingira yake ili ingawa hali ya mfumo inabadilika, hakuna joto linaruhusiwa kuingia au kuacha mfumo, kama inavyoonekana kwenye Mchoro\(\PageIndex{3}\). Mchakato wa adiabatic unaweza kufanywa ama nusu-statically au yasiyo ya nusu-statically. Wakati mfumo unapoongezeka kwa kasi, ni lazima ufanyie kazi dhidi ya ulimwengu wa nje, na hivyo nishati yake inakwenda chini, ambayo inaonekana katika kupungua kwa joto la mfumo. Upanuzi wa adiabatic husababisha kupungua kwa joto, na ukandamizaji wa adiabatic husababisha ongezeko la joto. Sisi kujadili upanuzi adiabatic tena katika sehemu ya michakato Adiabatic kwa ajili ya gesi bora.
Michakato ya mzunguko
Tunasema kwamba mfumo unaendelea kupitia mchakato wa mzunguko ikiwa hali ya mfumo mwishoni ni sawa na hali mwanzoni. Kwa hiyo, mali ya hali kama joto, shinikizo, kiasi, na nishati ya ndani ya mfumo hazibadilika juu ya mzunguko kamili:\[\Delta E_{int} = 0.\]
Wakati sheria ya kwanza ya thermodynamics inatumika kwa mchakato wa mzunguko, tunapata uhusiano rahisi kati ya joto ndani ya mfumo na kazi iliyofanywa na mfumo juu ya mzunguko:
\[Q = W \, (cyclic \, process).\]
Michakato ya thermodynamic pia inajulikana kwa kuwa au haipatikani. Mchakato wa kurekebishwa ni moja ambayo inaweza kufanywa ili kurejesha njia yake kwa mabadiliko tofauti katika mazingira. Mchakato huo lazima pia uwe na nusu-static. Kumbuka, hata hivyo, kwamba mchakato wa nusu-static sio lazima urekebishwe, kwani kunaweza kuwa na vikosi vya dissipative vinavyohusika. Kwa mfano, kama msuguano ulitokea kati ya pistoni na kuta za silinda iliyo na gesi, nishati iliyopotea kwa msuguano ingetuzuia kuzalisha majimbo ya awali ya mfumo.
Tulizingatia michakato kadhaa ya thermodynamic:
- Mchakato wa isothermal, wakati ambapo joto la mfumo hubakia mara kwa mara
- Mchakato wa adiabatic, wakati ambapo hakuna joto linalohamishiwa au kutoka kwenye mfumo
- Mchakato wa isobaric, wakati ambapo shinikizo la mfumo haubadilika
- Mchakato wa isochoric, wakati ambapo kiasi cha mfumo haubadilika
Michakato mingine mingi pia hutokea ambayo haifai katika aina yoyote ya makundi haya manne.
Tazama tovuti hii ili kuanzisha mchakato wako mwenyewe katika mchoro wa PV. Angalia kama unaweza kuhesabu maadili yaliyotabiriwa na simulation kwa joto, kazi, na mabadiliko katika nishati ya ndani.


