17.7: Eletrólise
- Page ID
- 184720
- Descreva as células eletrolíticas e sua relação com as células galvânicas
- Execute vários cálculos relacionados à eletrólise
Nas células galvânicas, a energia química é convertida em energia elétrica. O oposto é verdadeiro para as células eletrolíticas. Nas células eletrolíticas, a energia elétrica faz com que reações não espontâneas ocorram em um processo conhecido como eletrólise. O carregamento da bateria elétrica mostra um desses processos. A energia elétrica é convertida em energia química na bateria à medida que é carregada. Uma vez carregada, a bateria pode ser usada para alimentar o automóvel. Os mesmos princípios estão envolvidos nas células eletrolíticas e nas células galvânicas. Examinaremos três células eletrolíticas e os aspectos quantitativos da eletrólise.
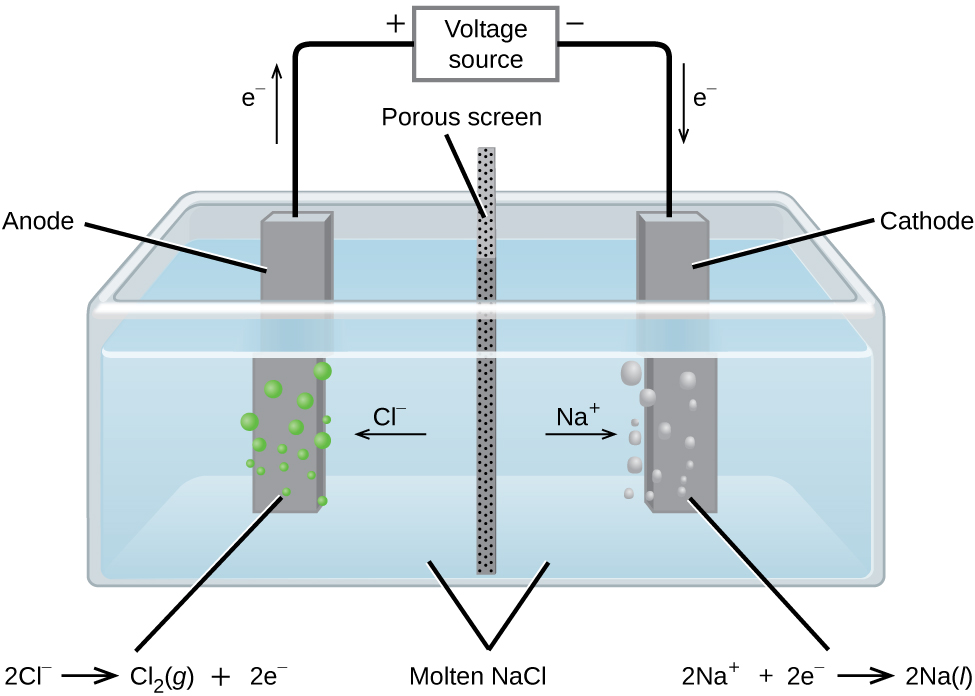
A eletrólise do cloreto de sódio fundido
No cloreto de sódio fundido, os íons podem migrar livremente para os eletrodos de uma célula eletrolítica. Um diagrama simplificado da célula usada comercialmente para produzir metal sódico e gás cloro é mostrado na Figura\(\PageIndex{1}\). O sódio é um forte agente redutor e o cloro é usado para purificar a água e é usado em antissépticos e na produção de papel. As reações são
\ [\ begin {align}
&\ textrm {ânodo:}\ ce {2Cl-} (l) ⟶\ ce {Cl2} (g) +\ ce {2e-}\ hspace {20px} E^\ circ_ {\ ce {Cl2/Cl-}} =\ mathrm {+1.3\: V}\\
&\ textrm {cátodo:}\ ce {Na+} (l) +\ ce {e-} ⟶\ ce {Na} (l)\ hspace {20px} E^\ circ_ {\ ce {Na+/Na}} =\ mathrm {−2.7\: V}\\
&\ overline {\ textrm {geral :}\ ce {2Na+} (l) +\ ce {2Cl-} (l) ⟶\ ce {2Na} (l) +\ ce {Cl2} (g)\ hspace {20px} E^\ circ_\ ce {cell} =\ mathrm {−4.0\: V}}
\ end {align}\ nonumber\]
A fonte de alimentação (bateria) deve fornecer no mínimo 4 V, mas, na prática, as tensões aplicadas geralmente são mais altas devido a ineficiências no próprio processo.
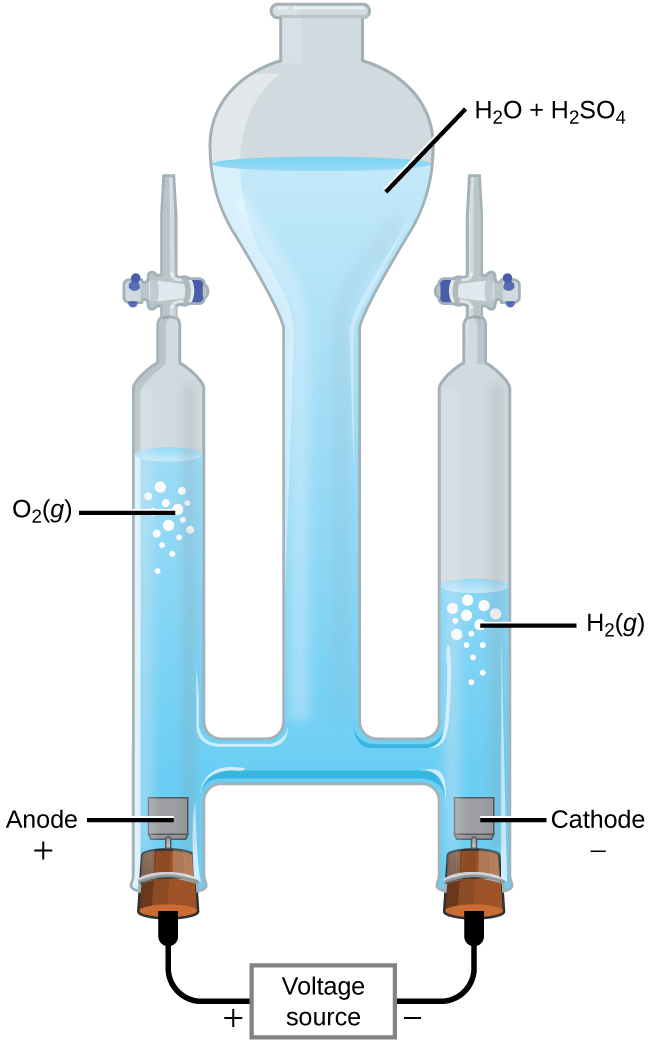
A eletrólise da água
É possível dividir a água em gás hidrogênio e oxigênio por eletrólise. Os ácidos são normalmente adicionados para aumentar a concentração de íon hidrogênio na solução (Figura\(\PageIndex{2}\)). As reações são
\ [\ begin {align}
&\ textrm {ânodo:}\ ce {2H2O} (l) ⟶\ ce {O2} (g) +\ ce {4H+} (aq) +\ ce {4e-}\ hspace {20px} E^\ circ_\ ce {ânodo} =\ mathrm {+1,229\: V}\\
& textrm {cátodo:}\ ce {2H+} (aq) +\ ce {2e-} ⟶\ ce {H2} (g)\ hspace {20px} E^\ circ_\ ce {cátodo} =\ mathrm {0\: V}\\
&\ overline {\ textrm { geral:}\ ce {2H2O} (l) ⟶\ ce {2H2} (g) +\ ce {O2} (g)\ hspace {20px} E^\ circ_\ ce {cell} =\ mathrm {−1.229\: V}}
\ end {align}\ nonumber\]
Observe que o ácido sulfúrico não é consumido e que o volume de gás hidrogênio produzido é o dobro do volume de gás oxigênio produzido. A tensão mínima aplicada é de 1,229 V.
A eletrólise do cloreto de sódio aquoso
A eletrólise do cloreto de sódio aquoso é o exemplo mais comum de eletrólise porque mais de uma espécie pode ser oxidada e reduzida. Considerando primeiro o ânodo, as possíveis reações são
\ [\ begin {align}
&\ textrm {(i)}\ ce {2Cl-} (aq) ⟶\ ce {Cl2} (g) +\ ce {2e-}\ hspace {20px} E^\ circ_\ ce {ânodo} =\ mathrm {+1,35827\: V}\\
&\ textrm {(ii)}\ ce {2H2O} (l) ⟶\ ce {O2} (g) +\ ce {4H+} (aq) +\ ce {4e-}\ hspace {20px} E^\ circ_\ ce {ânodo} =\ mathrm {+1,229\: V}
\ end {alinhar}\ nonumber\]
Esses valores sugerem que a água deve ser oxidada no ânodo porque um potencial menor seria necessário - usar a reação (ii) para a oxidação resultaria em um potencial celular menos negativo. Quando o experimento é executado, verifica-se que o cloro, não o oxigênio, é produzido no ânodo. O processo inesperado é tão comum em eletroquímica que recebeu o nome de superpotencial. O superpotencial é a diferença entre a tensão teórica da célula e a tensão real necessária para causar eletrólise. Acontece que o superpotencial de oxigênio é bastante alto e efetivamente torna o potencial de redução mais positivo. Como resultado, em condições normais, o gás cloro é o que realmente se forma no ânodo.
Agora, considere o cátodo. Três reduções podem ocorrer:
\ [\ begin {align}
&\ textrm {(iii)}\ ce {2H+} (aq) +\ ce {2e-} ⟶\ ce {H2} (g)\ hspace {20px} E^\ circ_\ ce {cátodo} =\ mathrm {0\: V}\\
&\ textrm {(iv)}\ ce {2H2O} (l) +\ ce {2e-} ⟶\ ce {H2} (g) +\ ce {2OH-} (aq)\ hspace {20px} E^\ circ_\ ce {cátodo} =\ mathrm {−0,8277\ :V}\\
&\ textrm {(v)}\ ce {Na+ } (aq) +\ ce {e-} ⟶\ ce {Na} (s)\ hspace {20px} E^\ circ_\ ce {cátodo} =\ mathrm {−2.71\: V}
\ end {align}\ nonumber\]
A reação (v) é descartada porque tem um potencial de redução tão negativo. Sob condições de estado padrão, a reação (iii) seria preferível à reação (iv). No entanto, o pH de uma solução de cloreto de sódio é 7, então a concentração de íons hidrogênio é de apenas 1 × 10 −7 M. Em concentrações tão baixas, a reação (iii) é improvável e a reação (iv) ocorre. A reação geral é então
\[\textrm{overall: }\ce{2H2O}(l)+\ce{2Cl-}(aq)⟶\ce{H2}(g)+\ce{Cl2}(g)+\ce{2OH-}(aq) \hspace{20px} E^\circ_\ce{cell}=\mathrm{−2.186\: V} \nonumber \]
Conforme a reação prossegue, os íons hidróxido substituem os íons cloreto em solução. Assim, o hidróxido de sódio pode ser obtido evaporando a água após a conclusão da eletrólise. O hidróxido de sódio é valioso por si só e é usado para coisas como limpador de forno, abridor de drenos e na produção de papel, tecidos e sabão.
Galvanoplastia
Um uso importante para células eletrolíticas é na galvanoplastia. A galvanoplastia resulta em uma fina camada de um metal sobre uma superfície condutora. Os motivos para a galvanoplastia incluem tornar o objeto mais resistente à corrosão, fortalecer a superfície, produzir um acabamento mais atraente ou purificar o metal. Os metais comumente usados na galvanoplastia incluem cádmio, cromo, cobre, ouro, níquel, prata e estanho. Os produtos de consumo comuns incluem talheres prateados ou banhados a ouro, peças automotivas cromadas e joias. Podemos ter uma ideia de como isso funciona investigando como os utensílios de mesa prateados são produzidos (Figura\(\PageIndex{3}\)).
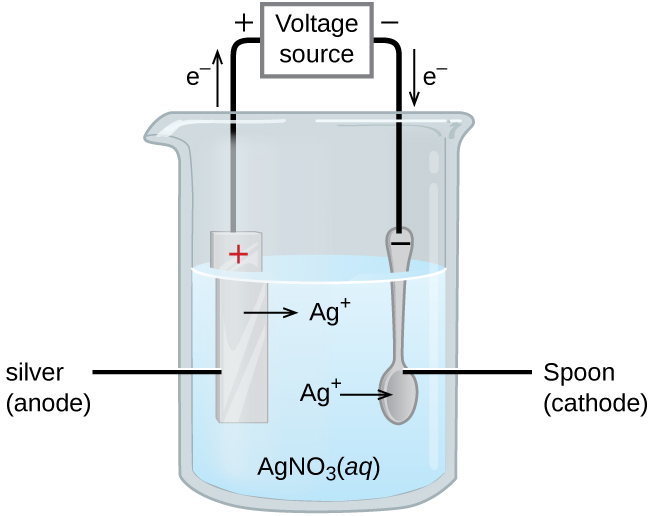
Na figura, o ânodo consiste em um eletrodo de prata, mostrado à esquerda. O cátodo está localizado à direita e é a colher, feita de metal barato. Ambos os eletrodos são imersos em uma solução de nitrato de prata. À medida que o potencial aumenta, a corrente flui. O metal prateado é perdido no ânodo à medida que entra em solução.
\[\textrm{anode: }\ce{Ag}(s)⟶\ce{Ag+}(aq)+\ce{e-} \nonumber \]
A massa do cátodo aumenta à medida que os íons de prata da solução são depositados na colher
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s) \nonumber \]
O resultado final é a transferência do metal prateado do ânodo para o cátodo. A qualidade do objeto geralmente é determinada pela espessura da prata depositada e pela taxa de deposição.
Aspectos quantitativos da eletrólise
A quantidade de corrente que pode fluir em uma célula eletrolítica está relacionada ao número de moles de elétrons. O número de moles de elétrons pode ser relacionado aos reagentes e produtos usando a estequiometria. Lembre-se de que a unidade SI para corrente (I) é o ampere (A), que é o equivalente a 1 coulomb por segundo (1 A =\(\mathrm{1\: \dfrac{C}{s}}\)). A carga total (Q, em coulombs) é dada por
\[Q=I×t=n×F \nonumber \]
onde
- t é o tempo em segundos,
- n o número de moles de elétrons, e
- F é a constante de Faraday.
Moles de elétrons podem ser usados em problemas de estequiometria. O tempo necessário para depositar uma quantidade específica de metal também pode ser solicitado, como no segundo dos exemplos a seguir.
Em um processo usado para galvanoplastia de prata, uma corrente de 10,23 A passou por uma célula eletrolítica por exatamente 1 hora. Quantos moles de elétrons passaram pela célula? Qual massa de prata foi depositada no cátodo a partir da solução de nitrato de prata?
Solução
A constante de Faraday pode ser usada para converter a carga (Q) em moles de elétrons (n). A carga é a corrente (I) multiplicada pelo tempo
\[n=\dfrac{Q}{F}=\mathrm{\dfrac{\dfrac{10.23\: C}{s}×1\: hr×\dfrac{60\: min}{hr}×\dfrac{60\:s}{min}}{96,485\: C/mol\: e^-}=\dfrac{36,830\: C}{96,485\: C/mol\:e^-}=0.3817\: mol\: e^-} \nonumber \]
A partir do problema, a solução contém AgNO 3, então a reação no cátodo envolve 1 mol de elétrons para cada mol de prata
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s) \nonumber \]
A massa atômica da prata é 107,9 g/mol, então
\[\mathrm{mass\: Ag=0.3817\: mol\: e^-×\dfrac{1\: mol\: Ag}{1\: mol\: e^-}×\dfrac{107.9\: g\: Ag}{1\: mol\: Ag}=41.19\: g\: Ag} \nonumber \]
Verifique sua resposta: A partir da estequiometria, 1 mol de elétrons produziria 1 mol de prata. Menos de meio mol de elétrons estava envolvido e menos da metade de um mol de prata foi produzido.
O metal de alumínio pode ser feito de íons de alumínio por eletrólise. Qual é a meia-reação no cátodo? Qual massa de metal de alumínio seria recuperada se uma corrente de 2,50 × 10 3 A passasse pela solução por 15,0 minutos? Suponha que o rendimento seja de 100%.
- Resposta
-
\(\ce{Al^3+}(aq)+\ce{3e-}⟶\ce{Al}(s)\); 7,77 mol Al = 210,0 g Al.
Em uma aplicação, uma camada de cromo de 0,010 mm deve ser depositada em uma peça com uma área de superfície total de 3,3 m 2 a partir de uma solução contendo íons cromo (III). Quanto tempo levaria para depositar a camada de cromo se a corrente fosse de 33,46 A? A densidade do cromo (metal) é 7,19 g/cm 3.
Solução Esse problema traz vários tópicos abordados anteriormente. Um esboço do que precisa ser feito é:
- Se a carga total puder ser determinada, o tempo necessário é apenas a carga dividida pela corrente
- A carga total pode ser obtida a partir da quantidade de Cr necessária e da estequiometria
- A quantidade de Cr pode ser obtida usando a densidade e o volume Cr necessários
- O volume Cr necessário é a espessura vezes a área
Resolvendo em etapas e cuidando das unidades, o volume de Cr necessário é
\[\mathrm{volume=\left(0.010\: mm×\dfrac{1\: cm}{10\: mm}\right)×\left(3.3\:m^2×\left(\dfrac{10,000\:cm^2}{1\:m^2}\right)\right)=33\: cm^3} \nonumber \]
Centímetros cúbicos foram usados porque correspondem à unidade de volume usada para a densidade. A quantidade de Cr é então
\[\mathrm{mass=volume×density=33\cancel{cm^3}×\dfrac{7.19\: g}{\cancel{cm^3}}=237\: g\: Cr} \nonumber \]
\[\mathrm{mol\: Cr=237\: g\: Cr×\dfrac{1\: mol\: Cr}{52.00\: g\: Cr}=4.56\: mol\: Cr} \nonumber \]
Como a solução contém íons cromo (III), são necessários 3 moles de elétrons por mol de Cr. A carga total é então
\[Q=\mathrm{4.56\: mol\: Cr×\dfrac{3\:mol\: e^-}{1\: mol\: Cr}×\dfrac{96485\: C}{mol\: e^-}=1.32×10^6\:C} \nonumber \]
O tempo necessário é então
\[t=\dfrac{Q}{I}=\mathrm{\dfrac{1.32×10^6\:C}{33.46\: C/s}=3.95×10^4\:s=11.0\: hr} \nonumber \]
Verifique sua resposta: Em um problema longo como esse, uma única verificação provavelmente não é suficiente. Cada uma das etapas fornece um número razoável, então as coisas provavelmente estão corretas. Preste muita atenção às conversões de unidades e à estequiometria.
Que massa de zinco é necessária para galvanizar a parte superior de uma chapa de ferro de 3,00 m × 5,50 m até uma espessura de 0,100 mm de zinco? Se o zinco vier de uma solução de Zn (NO 3) 2 e a corrente for 25,5 A, quanto tempo demorará para galvanizar a parte superior do ferro? A densidade do zinco é 7,140 g/cm 3.
- Resposta
-
231 g de Zn exigiram 23.000 minutos.
Resumo
Usar eletricidade para forçar a ocorrência de um processo não espontâneo é eletrólise. As células eletrolíticas são células eletroquímicas com potenciais celulares negativos (ou seja, uma energia livre de Gibbs positiva) e, portanto, não são espontâneas. A eletrólise pode ocorrer nas células eletrolíticas através da introdução de uma fonte de alimentação, que fornece a energia para forçar os elétrons a fluir na direção não espontânea. A eletrólise é feita em soluções, que contêm íons suficientes para que a corrente possa fluir. Se a solução contiver apenas um material, como a eletrólise do cloreto de sódio fundido, é simples determinar o que é oxidado e o que é reduzido. Em sistemas mais complicados, como a eletrólise do cloreto de sódio aquoso, mais de uma espécie pode ser oxidada ou reduzida e os potenciais de redução padrão são usados para determinar a oxidação mais provável (a meia-reação com o maior potencial de redução padrão [mais positivo]) e a redução (o meia-reação com o menor potencial de redução padrão [menos positivo]). Às vezes, meias-reações inesperadas ocorrem devido ao excesso de potencial. O sobrepotencial é a diferença entre o potencial teórico de redução da meia-reação e a tensão real necessária. Quando presente, o potencial aplicado deve ser aumentado, possibilitando que uma reação diferente ocorra na célula eletrolítica. A carga total, Q, que passa por uma célula eletrolítica pode ser expressa como a corrente (I) multiplicada pelo tempo (Q = It) ou como os moles de elétrons (n) multiplicados pela constante de Faraday (Q = nF). Essas relações podem ser usadas para determinar coisas como a quantidade de material usado ou gerado durante a eletrólise, por quanto tempo a reação deve prosseguir ou qual valor da corrente é necessário.
Resumo
- electrólise
- processo usando energia elétrica para fazer com que um processo não espontâneo ocorra
- célula eletrolítica
- célula eletroquímica na qual a eletrólise é usada; célula eletroquímica com potenciais celulares negativos
- galvanoplastia
- depositando uma fina camada de um metal em cima de uma superfície condutora
- superpotencial
- diferença entre o potencial teórico e o potencial real em uma célula eletrolítica; a tensão “extra” necessária para fazer com que alguma reação eletroquímica não espontânea ocorra


