17.5: Baterias e células de combustível
- Page ID
- 184748
- Classifique as baterias como primárias ou secundárias
- Liste algumas das características e limitações das baterias
- Forneça uma descrição geral de uma célula de combustível
Uma bateria é uma célula eletroquímica ou uma série de células que produz uma corrente elétrica. Em princípio, qualquer célula galvânica pode ser usada como bateria. Uma bateria ideal nunca se esgotaria, produziria uma voltagem imutável e seria capaz de suportar extremos ambientais de calor e umidade. As baterias reais encontram um equilíbrio entre as características ideais e as limitações práticas. Por exemplo, a massa da bateria de um carro é de cerca de 18 kg ou cerca de 1% da massa de um carro comum ou caminhão leve. Esse tipo de bateria forneceria energia quase ilimitada se usado em um smartphone, mas seria rejeitado para esse aplicativo por causa de sua massa. Portanto, nenhuma bateria é “melhor” e as baterias são selecionadas para uma aplicação específica, mantendo em mente coisas como a massa da bateria, seu custo, confiabilidade e capacidade atual. Existem dois tipos básicos de baterias: primárias e secundárias. Algumas baterias de cada tipo são descritas a seguir.
Visite este site para saber mais sobre baterias.
Baterias primárias
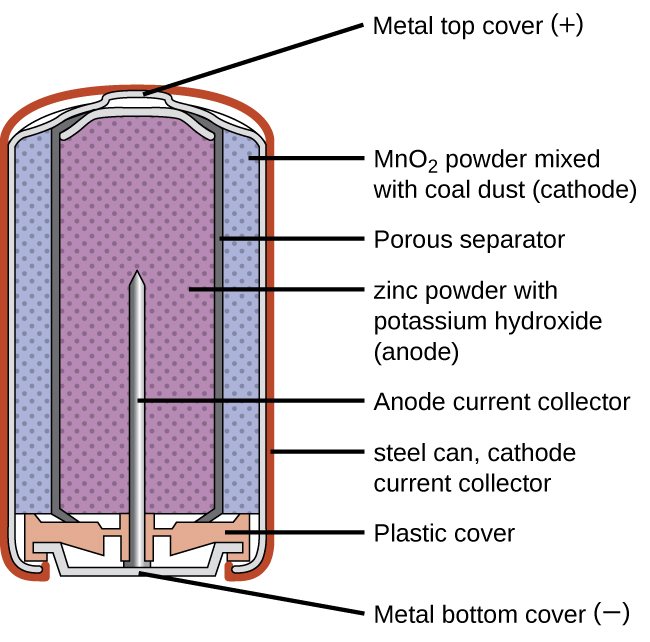
As baterias primárias são de uso único porque não podem ser recarregadas. Uma bateria primária comum é a célula seca (Figura\(\PageIndex{1}\)). A célula seca é uma bateria de zinco-carbono. A lata de zinco serve tanto como recipiente quanto como eletrodo negativo. O eletrodo positivo é uma haste feita de carbono que é cercada por uma pasta de óxido de manganês (IV), cloreto de zinco, cloreto de amônio, pó de carbono e uma pequena quantidade de água. A reação no ânodo pode ser representada como a oxidação comum do zinco:
\[\ce{Zn}(s)⟶\ce{Zn^2+}(aq)+\ce{2e-} \hspace{20px} E^\circ_{\ce{Zn^2+/Zn}}=\mathrm{−0.7618\: V} \nonumber \]
A reação no cátodo é mais complicada, em parte porque ocorre mais de uma reação. A série de reações que ocorre no cátodo é de aproximadamente
\[\ce{2MnO2}(s)+\ce{2NH4Cl}(aq)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2NH3}(aq)+\ce{H2O}(l)+\ce{2Cl-} \nonumber \]
A reação geral da bateria de zinco-carbono pode ser representada como
\[\ce{2MnO2}(s) + \ce{2NH4Cl}(aq) + \ce{Zn}(s) ⟶ \ce{Zn^2+}(aq) + \ce{Mn2O3}(s) + \ce{2NH3}(aq) + \ce{H2O}(l) + \ce{2Cl-} \nonumber \]
com um potencial celular geral que é inicialmente de cerca de 1,5 V, mas diminui à medida que a bateria é usada. É importante lembrar que a voltagem fornecida por uma bateria é a mesma, independentemente do tamanho da bateria. Por esse motivo, as baterias D, C, A, AA e AAA têm a mesma tensão nominal. No entanto, baterias maiores podem fornecer mais moles de elétrons. À medida que o recipiente de zinco se oxida, seu conteúdo acaba vazando, portanto, esse tipo de bateria não deve ser deixado em nenhum dispositivo elétrico por longos períodos.

Pilhas alcalinas (Figura)\(\PageIndex{2}\)) were developed in the 1950s partly to address some of the performance issues with zinc–carbon dry cells. They are manufactured to be exact replacements for zinc-carbon dry cells. As their name suggests, these types of batteries use alkaline electrolytes, often potassium hydroxide. The reactions are
\[\begin{align*} &\textrm{anode: }\ce{Zn}(s)+\ce{2OH-}(aq)⟶\ce{ZnO}(s)+\ce{H2O}(l)+\ce{2e-} \hspace{40px} E^\circ_\ce{anode}=\mathrm{−1.28\: V}\\ &\underline{\textrm{cathode: }\ce{2MnO2}(s)+\ce{H2O}(l)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2OH-}(aq) \hspace{40px} E^\circ_\ce{cathode}=\mathrm{+0.15\: V}}\\ &\textrm{overall: }\ce{Zn}(s)+\ce{2MnO2}(s)⟶\ce{ZnO}(s)+\ce{Mn2O3}(s) \hspace{40px} E^\circ_\ce{cell}=\mathrm{+1.43\: V} \end{align*} \nonumber \]
Uma bateria alcalina pode fornecer cerca de três a cinco vezes a energia de uma célula seca de zinco-carbono de tamanho similar. As baterias alcalinas são propensas a vazar hidróxido de potássio, portanto, elas também devem ser removidas dos dispositivos para armazenamento a longo prazo. Embora algumas pilhas alcalinas sejam recarregáveis, a maioria não é. As tentativas de recarregar uma bateria alcalina que não é recarregável geralmente levam à ruptura da bateria e ao vazamento do eletrólito de hidróxido de potássio.
Baterias secundárias
As baterias secundárias são recarregáveis. Esses são os tipos de baterias encontrados em dispositivos como smartphones, tablets eletrônicos e automóveis.
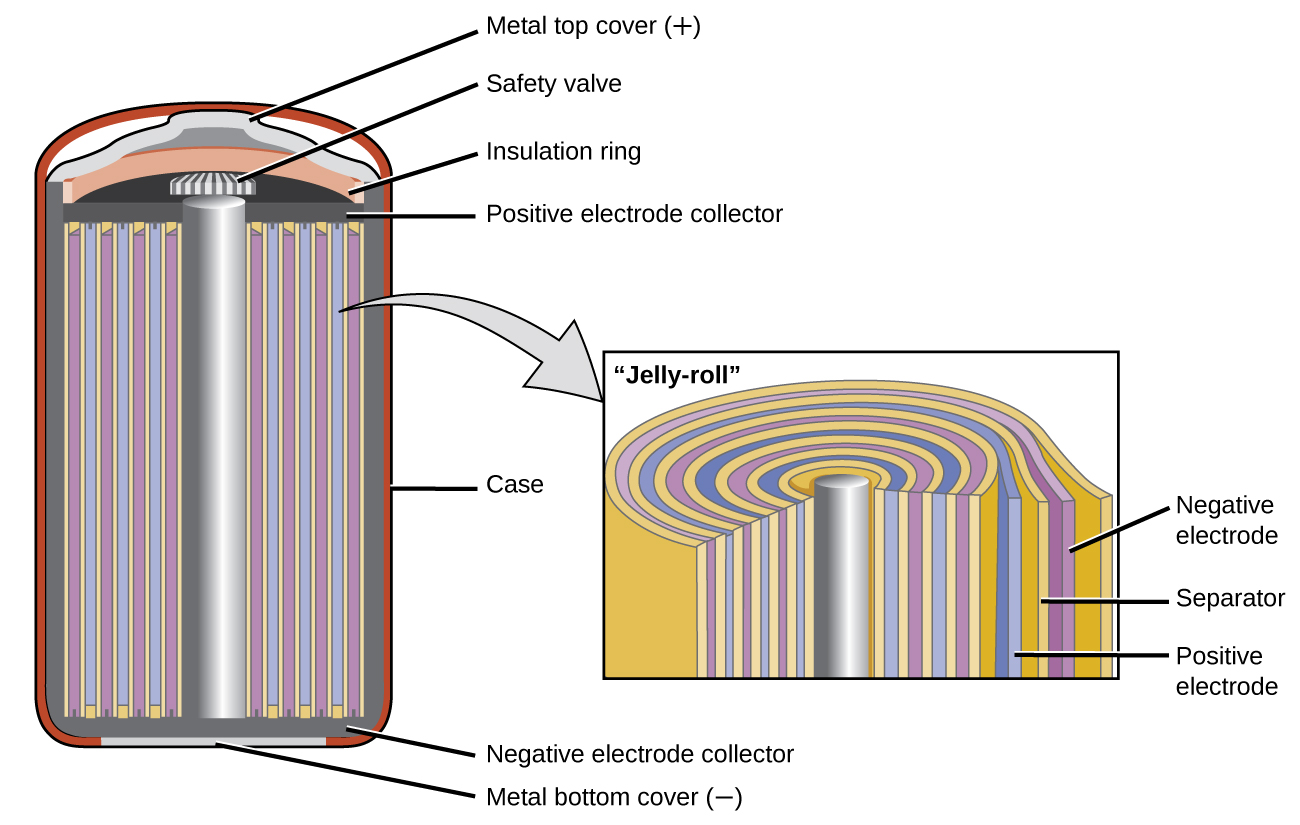
As baterias de níquel-cádmio ou NiCd (Figura\(\PageIndex{3}\)) consistem em um cátodo niquelado, ânodo revestido de cádmio e um eletrodo de hidróxido de potássio. As placas positivas e negativas, que são impedidas de entrar em curto-circuito pelo separador, são enroladas juntas e colocadas na caixa. Esse é um design “gelatinoso” e permite que a célula NiCd forneça muito mais corrente do que uma bateria alcalina de tamanho semelhante. As reações são
\ [\ begin {align*}
&\ textrm {ânodo:}\ ce {Cd} (s) +\ ce {2OH-} (aq) ⟶\ ce {Cd (OH) 2} (s) +\ ce {2e-}\\
&\ underline {\ textrm {cátodo:}\ ce {NiO2} (s) +\ ce {2H2O} (l) +\ ce {2e-} ⟶\ ce {Ni (OH) 2} (s) +\ ce {2OH-} (aq)}\\
&\ textrm {geral:}\ ce {Cd} (s) +\ ce {NiO2} (s) +\ ce {2H2O} (l) ⟶\ ce {Cd (OH) 2} (s) +\ ce {2H2O} (l) ⟶\ ce {Cd (OH) 2} (s)\ ce {NiO2} (s) +\ ce {2H2O} (l) ⟶\ ce {Ni (OH) 2} (s)\ end {align*}\ nonumber\]
A voltagem é de cerca de 1,2 V a 1,25 V quando a bateria descarrega. Quando tratada adequadamente, uma bateria de NiCd pode ser recarregada cerca de 1000 vezes. O cádmio é um metal pesado tóxico, portanto, as baterias de NiCd nunca devem ser abertas ou colocadas no lixo comum.
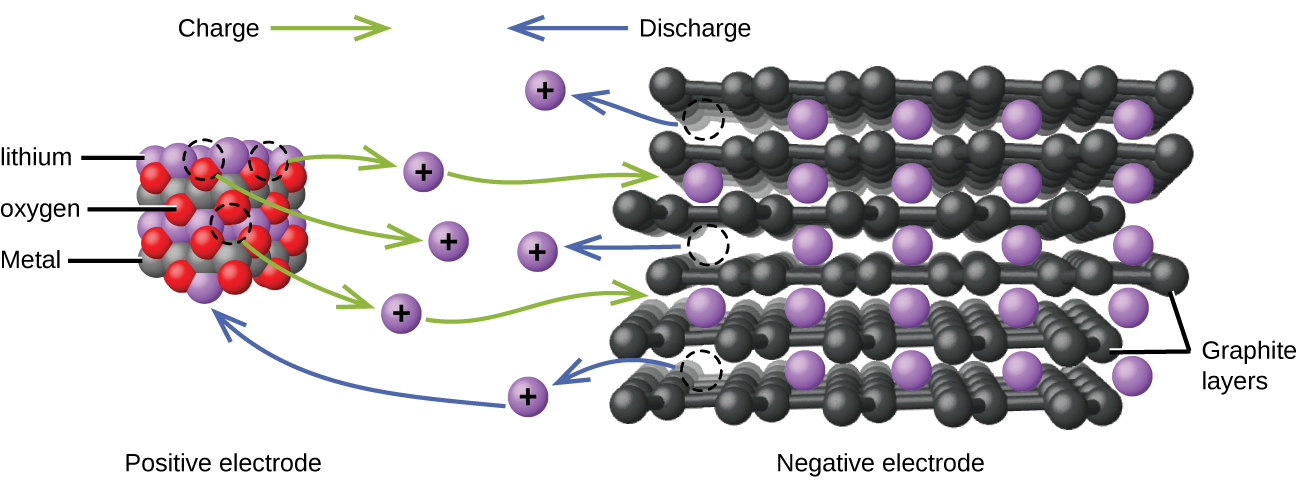
As baterias de íon de lítio (Figura\(\PageIndex{4}\)) estão entre as baterias recarregáveis mais populares e são usadas em muitos dispositivos eletrônicos portáteis. As reações são
\[\begin{align*} &\textrm{anode: }\ce{LiCoO2}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{Li+}+x\ce{e-}\\ &\textrm{cathode: }x\ce{Li+}+x\ce{e-}+x\ce{C6}⇌x\ce{LiC6}\\ &\overline{\textrm{overall: }\ce{LiCoO2}+x\ce{C6}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{LiC6}} \end{align*} \nonumber \]
Com os coeficientes representando moles, x não é mais do que cerca de 0,5 moles. A voltagem da bateria é de cerca de 3,7 V. As baterias de lítio são populares porque podem fornecer uma grande quantidade de corrente, são mais leves do que baterias comparáveis de outros tipos, produzem uma voltagem quase constante à medida que são descarregadas e perdem lentamente a carga quando armazenadas.
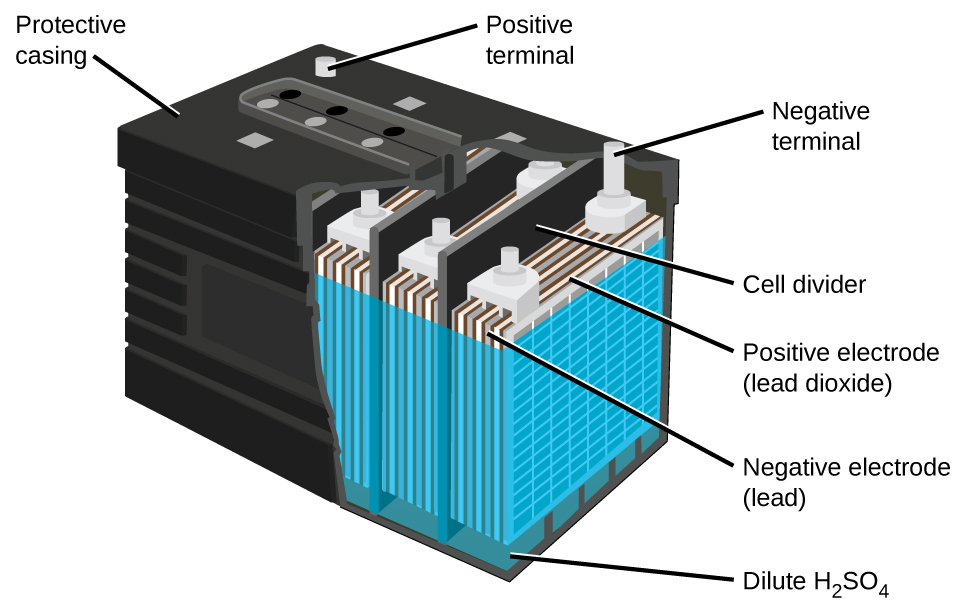
A bateria de chumbo-ácido (Figura\(\PageIndex{5}\)) é o tipo de bateria secundária usada em seu automóvel. É barato e capaz de produzir a alta corrente exigida pelos motores de partida de automóveis. As reações para uma bateria de chumbo-ácido são
\[\begin{align*} &\textrm{anode: }\ce{Pb}(s)+\ce{HSO4-}(aq)⟶\ce{PbSO4}(s)+\ce{H+}(aq)+\ce{2e-}\\ &\underline{\textrm{cathode: } \ce{PbO2}(s)+\ce{HSO4-}(aq)+\ce{3H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)}\\ &\textrm{overall: }\ce{Pb}(s)+\ce{PbO2}(s)+\ce{2H2SO4}(aq)⟶\ce{2PbSO4}(s)+\ce{2H2O}(l) \end{align*} \nonumber \]
Cada célula produz 2 V, portanto, seis células são conectadas em série para produzir uma bateria automotiva de 12 V. As baterias de chumbo-ácido são pesadas e contêm um eletrólito líquido cáustico, mas muitas vezes ainda são a bateria preferida devido à sua alta densidade de corrente. Como essas baterias contêm uma quantidade significativa de chumbo, elas devem sempre ser descartadas adequadamente.
Pilhas de combustível
Uma célula de combustível é um dispositivo que converte energia química em energia elétrica. As células de combustível são semelhantes às baterias, mas requerem uma fonte contínua de combustível, geralmente hidrogênio. Eles continuarão a produzir eletricidade enquanto o combustível estiver disponível. Células de combustível de hidrogênio têm sido usadas para fornecer energia para satélites, cápsulas espaciais, automóveis, barcos e submarinos (Figura\(\PageIndex{6}\)).
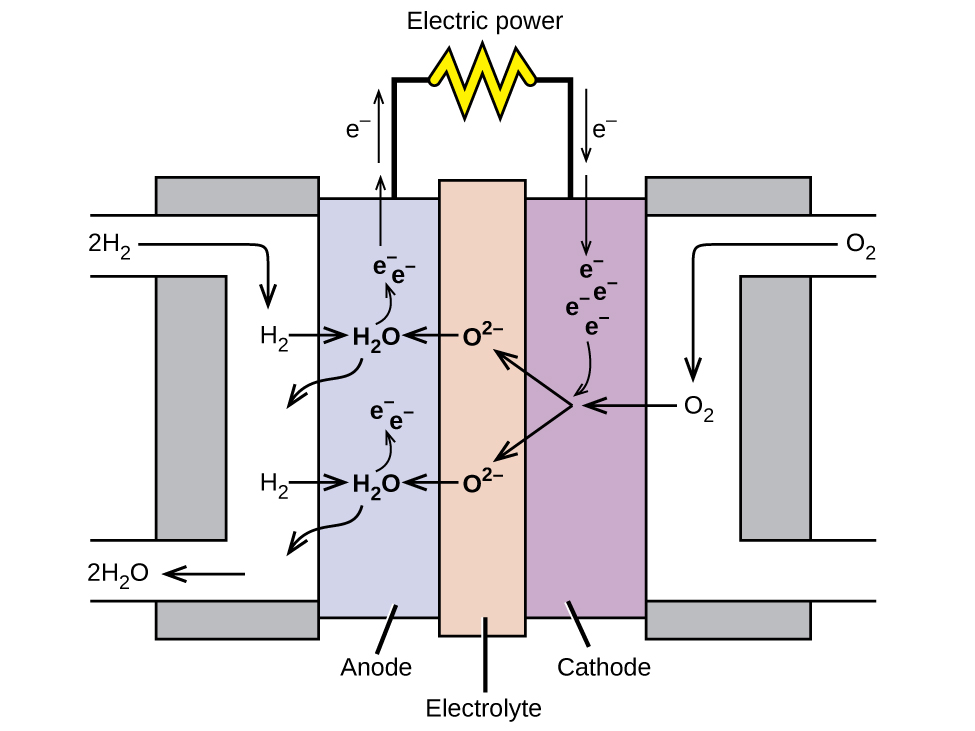
Em uma célula de combustível de hidrogênio, as reações são
\ [\ begin {align*}
&\ textrm {ânodo:}\ ce {2H2 + 2O^2- ⟶ 2H2O + 4e-}\\
&\ underline {\ textrm {cátodo:}\ ce {O2 + 4e- ⟶ 2O^2-}\ hspace {55px}}\\
&\ textrm {geral:}\ ce {22O H2 + O2 ⟶ 2H2O}\ end {align*}\ nonumber\]
A tensão é de cerca de 0,9 V. A eficiência das células de combustível é tipicamente de 40% a 60%, o que é maior do que o motor de combustão interna típico (25% a 35%) e, no caso da célula de combustível de hidrogênio, produz apenas água como escape. Atualmente, as células de combustível são bastante caras e contêm características que fazem com que elas falhem após um tempo relativamente curto.
Resumo
As baterias são células galvânicas, ou uma série de células, que produzem uma corrente elétrica. Quando as células são combinadas em baterias, o potencial da bateria é um múltiplo inteiro do potencial de uma única célula. Existem dois tipos básicos de baterias: primárias e secundárias. As baterias primárias são de “uso único” e não podem ser recarregadas. As células secas e (a maioria) das pilhas alcalinas são exemplos de baterias primárias. O segundo tipo é recarregável e é chamado de bateria secundária. Exemplos de baterias secundárias incluem baterias de níquel-cádmio (NiCd), chumbo-ácido e íon de lítio. As células de combustível são semelhantes às baterias, pois geram uma corrente elétrica, mas requerem adição contínua de combustível e oxidante. A célula de combustível de hidrogênio usa hidrogênio e oxigênio do ar para produzir água e geralmente é mais eficiente do que os motores de combustão interna.
Resumo
- bateria alcalina
- bateria primária que usa um eletrólito alcalino (geralmente hidróxido de potássio); projetada para ser um substituto exato para a célula seca, mas com mais armazenamento de energia e menos vazamento de eletrólitos do que a célula seca típica
- pilha
- célula galvânica ou série de células que produz uma corrente; em teoria, qualquer célula galvânica
- célula seca
- bateria primária, também chamada de bateria de zinco-carbono; pode ser usada em qualquer orientação porque usa uma pasta como eletrólito; tende a vazar eletrólito quando armazenada
- célula de combustível
- dispositivos que produzem uma corrente elétrica desde que combustível e oxidante sejam continuamente adicionados; mais eficientes do que motores de combustão interna
- bateria de ácido de chumbo
- bateria secundária que consiste em várias células; a bateria de chumbo-ácido encontrada em automóveis tem seis células e uma voltagem de 12 V
- bateria de íon de lítio
- bateria secundária muito popular; usa íons de lítio para conduzir corrente e é leve, recarregável e produz um potencial quase constante à medida que descarrega
- bateria de níquel-cádmio
- (bateria de NiCd) bateria secundária que usa cádmio, que é um metal pesado tóxico; mais pesada que as baterias de íon de lítio, mas com características de desempenho semelhantes
- bateria primária
- bateria não recarregável de uso único
- bateria secundária
- bateria que pode ser recarregada


