16.1: Espontaneidade
- Page ID
- 184644
pherd
- Faça a distinção entre processos espontâneos e não espontâneos
- Descreva a dispersão de matéria e energia que acompanha certos processos espontâneos
Nesta seção, considere as diferenças entre dois tipos de mudanças em um sistema: aquelas que ocorrem espontaneamente e aquelas que ocorrem somente com a entrada contínua de energia. Ao fazer isso, entenderemos por que alguns sistemas são naturalmente inclinados a mudar em uma direção sob certas condições. Também obteremos uma visão de como a espontaneidade de um processo afeta a distribuição de energia e matéria dentro do sistema.
Processos espontâneos e não espontâneos
Os processos têm uma tendência natural de ocorrer em uma direção sob um determinado conjunto de condições. A água fluirá naturalmente em declive, mas o fluxo em subida requer intervenção externa, como o uso de uma bomba. Um processo espontâneo é aquele que ocorre naturalmente sob certas condições. Um processo não espontâneo, por outro lado, não ocorrerá a menos que seja “conduzido” pela entrada contínua de energia de uma fonte externa. Um processo que é espontâneo em uma direção sob um determinado conjunto de condições não é espontâneo na direção inversa. À temperatura ambiente e à pressão atmosférica típica, por exemplo, o gelo derrete espontaneamente, mas a água não congela espontaneamente.
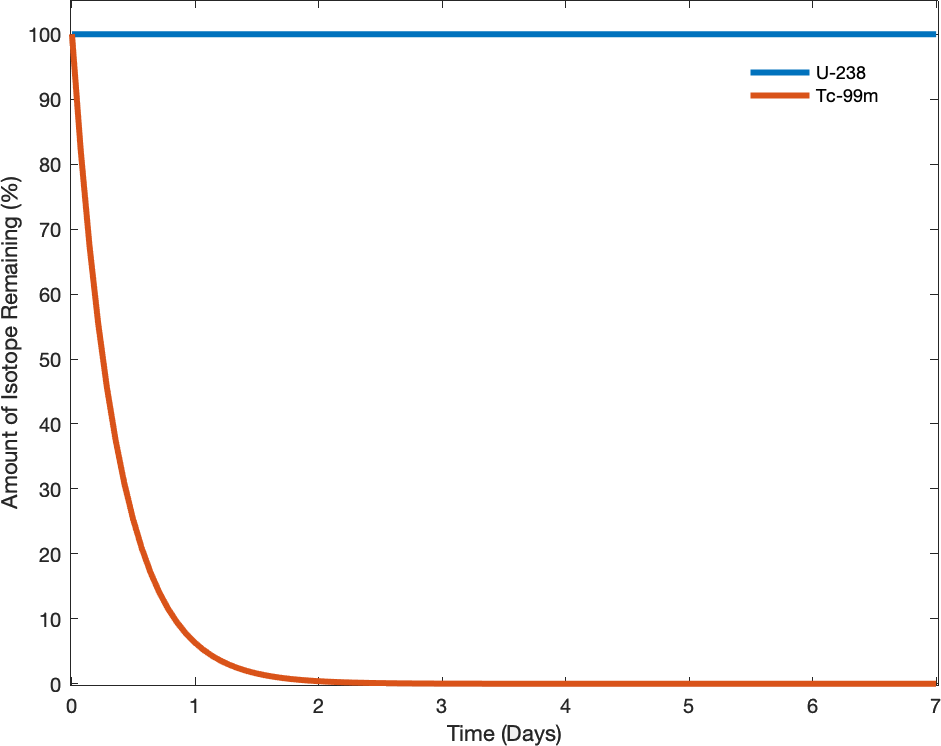
A espontaneidade de um processo não está correlacionada com a velocidade do processo. Uma mudança espontânea pode ser tão rápida que é essencialmente instantânea ou tão lenta que não pode ser observada em nenhum período prático de tempo. Para ilustrar esse conceito, considere o decaimento dos isótopos radioativos, um tópico tratado mais detalhadamente no capítulo sobre química nuclear. O decaimento radioativo é, por definição, um processo espontâneo no qual os núcleos de isótopos instáveis emitem radiação à medida que são convertidos em núcleos mais estáveis. Todos os processos de decaimento ocorrem espontaneamente, mas as taxas nas quais diferentes isótopos decaem variam amplamente. O tecnécio-99M é um radioisótopo popular para estudos de imagens médicas que sofre um decaimento relativamente rápido e apresenta uma meia-vida de cerca de seis horas. O urânio-238 é o isótopo mais abundante de urânio, e sua decomposição ocorre muito mais lentamente, exibindo uma meia-vida de mais de quatro bilhões de anos (Figura\(\PageIndex{1}\)).
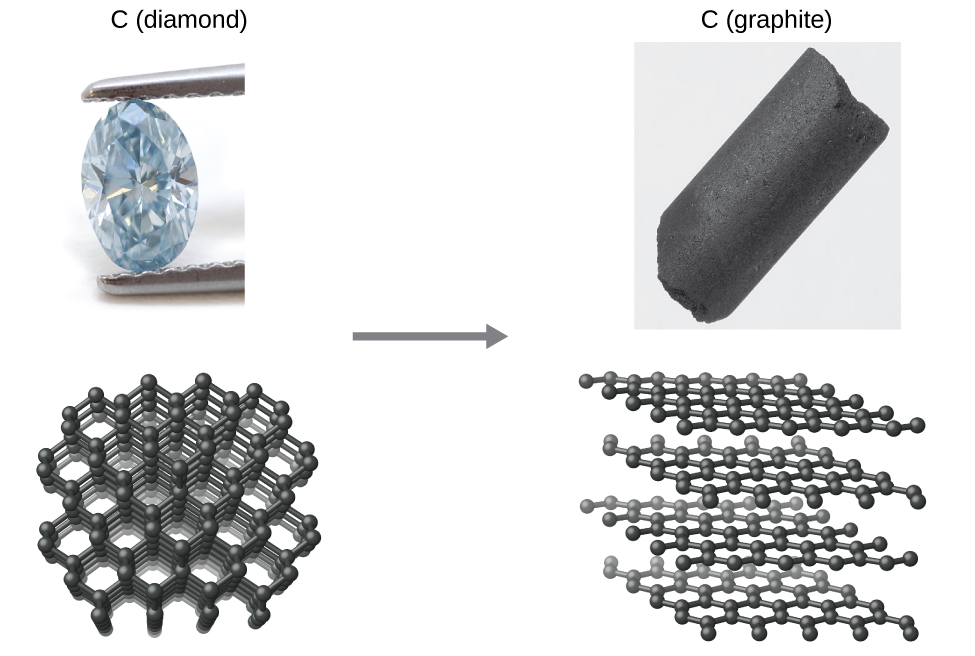
Como outro exemplo, considere a conversão de diamante em grafite (Figura\(\PageIndex{2}\)).
\[\ce{C(s, diamond)}⟶\ce{C(s, graphite)} \label{Eq1} \]
O diagrama de fases do carbono indica que o grafite é a forma estável desse elemento sob pressão atmosférica ambiente, enquanto o diamante é o alótropo estável em pressões muito altas, como as presentes durante sua formação geológica. Cálculos termodinâmicos do tipo descrito na última seção deste capítulo indicam que a conversão de diamante em grafite à pressão ambiente ocorre espontaneamente, mas observa-se que os diamantes existem e persistem nessas condições. Embora o processo seja espontâneo em condições ambientais típicas, sua taxa é extremamente lenta e, portanto, para todos os fins práticos, os diamantes são de fato “para sempre”. Situações como essas enfatizam a importante distinção entre os aspectos termodinâmicos e cinéticos de um processo. Nesse caso específico, diz-se que os diamantes são termodinamicamente instáveis, mas cineticamente estáveis em condições ambientais.
Dispersão de matéria e energia
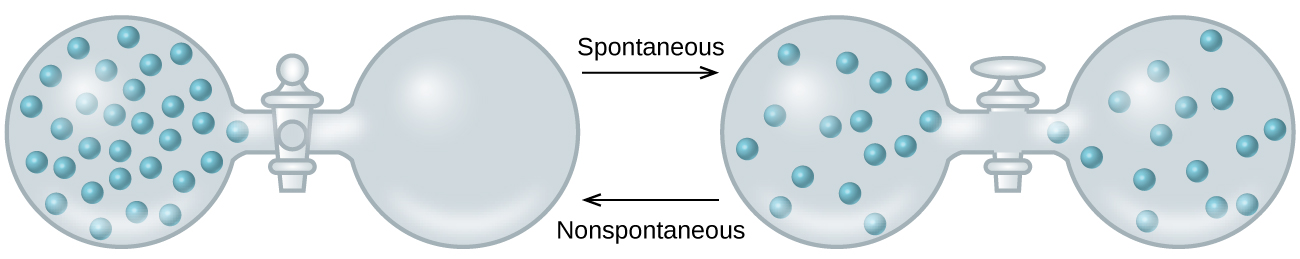
À medida que ampliamos nossa discussão sobre conceitos termodinâmicos em direção ao objetivo de prever a espontaneidade, considere agora um sistema isolado que consiste em dois frascos conectados a uma válvula fechada. Inicialmente, há um gás ideal à esquerda e um vácuo à direita (Figura\(\PageIndex{3}\)). Quando a válvula é aberta, o gás se expande espontaneamente para encher os dois frascos. Lembrando a definição de trabalho de volume de pressão do capítulo sobre termoquímica, observe que nenhum trabalho foi feito porque a pressão no vácuo é zero.
\[ \begin{align} w&=−PΔV \\[4pt]&=0 \,\,\, \mathrm{(P=0\: in\: a\: vaccum)} \label{Eq2} \end{align} \]
Observe também que, como o sistema está isolado, nenhum calor foi trocado com o ambiente (q = 0). A primeira lei da termodinâmica confirma que não houve mudança na energia interna do sistema como resultado desse processo.
\[ \begin{align} ΔU&=q+w \tag{First Law of Thermodynamics} \\[4pt] &=0+0=0 \label{Eq3}\end{align} \]
A espontaneidade desse processo, portanto, não é consequência de nenhuma mudança de energia que acompanhe o processo. Em vez disso, o movimento do gás parece estar relacionado à maior e mais uniforme dispersão da matéria que resulta quando o gás pode se expandir. Inicialmente, o sistema era composto por um frasco contendo matéria e outro frasco sem nada. Depois que o processo espontâneo ocorreu, a matéria foi distribuída de forma mais ampla (ocupando o dobro de seu volume original) e mais uniformemente (presente em quantidades iguais em cada frasco).
Agora, considere dois objetos em temperaturas diferentes: objeto X na temperatura T X e objeto Y na temperatura T Y, com T X > T Y (Figura\(\PageIndex{4}\)). Quando esses objetos entram em contato, o calor flui espontaneamente do objeto mais quente (X) para o mais frio (Y). Isso corresponde a uma perda de energia térmica em X e um ganho de energia térmica em Y.
\[q_\ce{X}<0 \hspace{20px} \ce{and} \hspace{20px} q_\ce{Y}=−q_\ce{X}>0 \label{Eq4} \]
Do ponto de vista desse sistema de dois objetos, não houve ganho ou perda líquida de energia térmica, mas a energia térmica disponível foi redistribuída entre os dois objetos. Esse processo espontâneo resultou em uma dispersão de energia mais uniforme.

Conforme ilustrado pelos dois processos descritos, um fator importante na determinação da espontaneidade de um processo é até que ponto ele altera a dispersão ou distribuição de matéria e/ou energia. Em cada caso, ocorreu um processo espontâneo que resultou em uma distribuição mais uniforme de matéria ou energia.
Descreva como a matéria e a energia são redistribuídas quando os seguintes processos espontâneos ocorrem:
- Um sólido sublima.
- Um gás se condensa.
- Uma gota de corante alimentar adicionada a um copo de água forma uma solução com cor uniforme.
Solução

- A sublimação é a conversão de um sólido (densidade relativamente alta) em um gás (densidade muito menor). Esse processo produz uma dispersão muito maior da matéria, já que as moléculas ocuparão um volume muito maior após a transição do sólido para o gás. No entanto, uma entrada de energia do ambiente é necessária para que as moléculas saiam da fase sólida e entrem na fase gasosa.
- A condensação é a conversão de um gás (densidade relativamente baixa) em líquido (densidade muito maior). Esse processo produz uma dispersão muito menor da matéria, já que as moléculas ocuparão um volume muito menor após a transição do gás para o líquido. À medida que as moléculas de gás se movem juntas para formar as gotículas de líquido, elas formam forças intermoleculares e, assim, liberam energia para o ambiente.
- O processo em questão é a diluição. As moléculas de corante alimentar ocupam inicialmente um volume muito menor (a gota da solução de corante) do que ocupam quando o processo é concluído (no copo cheio de água). O processo, portanto, implica uma maior dispersão da matéria. O processo também pode produzir uma dispersão mais uniforme da matéria, já que o estado inicial do sistema envolve duas regiões de diferentes concentrações de corante (alta na gota, zero na água) e o estado final do sistema contém uma única concentração de corante por toda parte. Esse processo pode ocorrer sem uma mudança na energia porque as moléculas têm energia cinética em relação à temperatura da água e, portanto, estarão constantemente em movimento.
Descreva como a matéria e a energia são redistribuídas quando você esvazia um recipiente de ar comprimido em uma sala.
- Resposta
-
Esse processo envolve uma dispersão maior e mais uniforme da matéria, pois é permitido que o ar comprimido no recipiente se expanda para o ar de baixa pressão da sala. O processo também requer uma entrada de energia para interromper as forças intermoleculares entre as moléculas de gás bem espaçadas que são originalmente comprimidas no recipiente. Se você tocasse no bocal do recipiente, notaria que está frio porque as moléculas que saem estão retirando energia do ambiente e o recipiente faz parte do ambiente.
Resumo
Os processos químicos e físicos têm uma tendência natural de ocorrer em uma direção sob certas condições. Um processo espontâneo ocorre sem a necessidade de uma entrada contínua de energia de alguma fonte externa, enquanto um processo não espontâneo exige isso. Sistemas que passam por um processo espontâneo podem ou não experimentar um ganho ou perda de energia, mas eles experimentarão uma mudança na forma como a matéria e/ou energia é distribuída dentro do sistema. Nesta seção, discutimos apenas a decomposição nuclear, mudanças físicas de substâncias puras e eventos macroscópicos, como água fluindo ladeira abaixo. Nas seções a seguir, discutiremos misturas e reações químicas, situações nas quais a descrição da espontaneidade se torna mais desafiadora.
Glossário
- processo não espontâneo
- processo que requer entrada contínua de energia de uma fonte externa
- mudança espontânea
- processo que ocorre sem uma entrada contínua de energia de uma fonte externa


