16.2: Entropia
- Page ID
- 184631
- Definir entropia
- Explicar a relação entre a entropia e o número de microestados
- Preveja o sinal da mudança de entropia para processos químicos e físicos
Em 1824, aos 28 anos, Nicolas Léonard Sadi Carnot (Figura\(\PageIndex{2}\)) publicou os resultados de um extenso estudo sobre a eficiência dos motores térmicos a vapor. Em uma revisão posterior das descobertas de Carnot, Rudolf Clausius introduziu uma nova propriedade termodinâmica que relaciona o fluxo de calor espontâneo que acompanha um processo com a temperatura na qual o processo ocorre. Essa nova propriedade foi expressa como a razão entre o calor reversível (q rev) e a temperatura kelvin (T). O termo processo reversível se refere a um processo que ocorre em uma taxa tão lenta que está sempre em equilíbrio e sua direção pode ser alterada (pode ser “revertida”) por uma mudança infinitesimalmente pequena em alguma condição. Observe que a ideia de um processo reversível é um formalismo necessário para apoiar o desenvolvimento de vários conceitos termodinâmicos; nenhum processo real é verdadeiramente reversível, mas sim classificado como irreversível.

Semelhante a outras propriedades termodinâmicas, essa nova quantidade é uma função de estado e, portanto, sua mudança depende apenas dos estados inicial e final de um sistema. Em 1865, Clausius chamou essa propriedade de entropia (S) e definiu sua mudança para qualquer processo da seguinte forma:
\[ΔS=\dfrac{q_\ce{rev}}{T} \label{Eq1} \]
A mudança de entropia para um processo real e irreversível é então igual à do processo teórico reversível que envolve os mesmos estados inicial e final.
Entropia e microestados
Seguindo o trabalho de Carnot e Clausius, Ludwig Boltzmann desenvolveu um modelo estatístico em escala molecular que relacionou a entropia de um sistema ao número de microestados possíveis para o sistema. Um microestado (\(\Omega\))é uma configuração específica das localizações e energias dos átomos ou moléculas que compõem um sistema como o seguinte:
\[S=k \ln \Omega \label{Eq2} \]
Aqui k é a constante de Boltzmann e tem um valor de\(1.38 \times 10^{−23}\, J/K\).
Quanto às outras funções de estado, a mudança na entropia de um processo é a diferença entre seus valores finais (S f) e iniciais (S i):
\[\begin{align} ΔS &=S_\ce{f}−S_\ce{i} \nonumber \\[4pt] &=k \ln \Omega_\ce{f} − k \ln \Omega_\ce{i} \nonumber \\[4pt] &=k \ln\dfrac{\Omega_\ce{f}}{\Omega_\ce{i}} \label{Eq2a} \end{align} \]
Para processos que envolvem um aumento no número de microestados do sistema\(\Omega_f > \Omega_i\), a entropia do sistema aumenta,\(ΔS > 0\). Por outro lado, processos que reduzem o número de microestados no sistema,\(\Omega_f < \Omega_i\), produzem uma diminuição na entropia do sistema,\(ΔS < 0\). Essa interpretação da entropia em escala molecular fornece um link para a probabilidade de que um processo ocorra, conforme ilustrado nos próximos parágrafos.
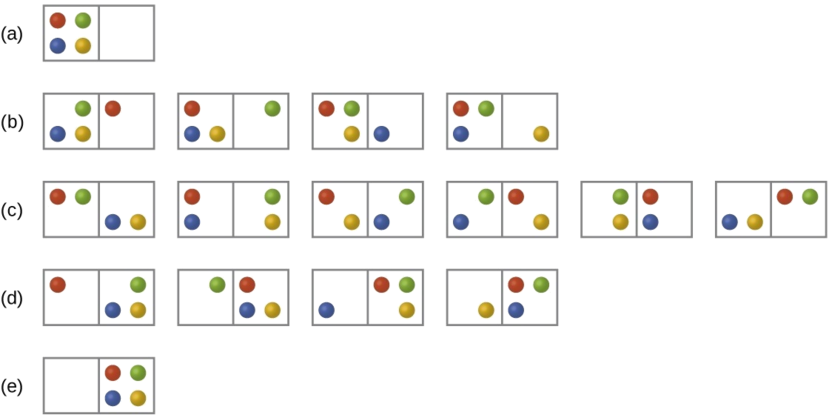
Considere o caso geral de um sistema composto por N partículas distribuídas entre n caixas. O número de microestados possíveis para esse sistema é n N. Por exemplo, distribuir quatro partículas entre duas caixas resultará em 2 4 = 16 microestados diferentes, conforme ilustrado na Figura\(\PageIndex{2}\). Microestados com arranjos de partículas equivalentes (sem considerar identidades individuais de partículas) são agrupados e chamados de distribuições (às vezes chamados de macroestados ou configurações). A probabilidade de um sistema existir com seus componentes em uma determinada distribuição é proporcional ao número de microestados dentro da distribuição. Como a entropia aumenta logaritmicamente com o número de microestados, a distribuição mais provável é, portanto, a de maior entropia.
Para esse sistema, a configuração mais provável é um dos seis microestados associados à distribuição (c), onde as partículas são distribuídas uniformemente entre as caixas, ou seja, uma configuração de duas partículas em cada caixa. A probabilidade de encontrar o sistema nessa configuração é
\[\dfrac{6}{16} = \dfrac{3}{8} \nonumber \]
A configuração menos provável do sistema é aquela em que todas as quatro partículas estão em uma caixa, correspondendo às distribuições (a) e (e), cada uma com uma probabilidade de
\[\dfrac{1}{16} \nonumber \]
A probabilidade de encontrar todas as partículas em apenas uma caixa (seja a caixa esquerda ou a caixa direita) é então
\[\left(\dfrac{1}{16}+\dfrac{1}{16}\right)=\dfrac{2}{16} = \dfrac{1}{8} \nonumber \]
À medida que você adiciona mais partículas ao sistema, o número de microestados possíveis aumenta exponencialmente (2 N). Um sistema macroscópico (do tamanho de um laboratório) normalmente consistiria em moles de partículas (N ~ 10 23), e o número correspondente de microestados seria incrivelmente grande. No entanto, independentemente do número de partículas no sistema, as distribuições nas quais números aproximadamente iguais de partículas são encontrados em cada caixa são sempre as configurações mais prováveis.
A distribuição mais provável é, portanto, a de maior entropia.
A descrição anterior de um gás ideal se expandindo para o vácuo é um exemplo macroscópico desse modelo de partícula em uma caixa. Para esse sistema, confirma-se que a distribuição mais provável é aquela em que a matéria está mais uniformemente dispersa ou distribuída entre os dois frascos. O processo espontâneo pelo qual o gás contido inicialmente em um frasco se expande para encher os dois frascos igualmente, portanto, produz um aumento na entropia para o sistema.

Uma abordagem semelhante pode ser usada para descrever o fluxo espontâneo de calor. Considere um sistema composto por dois objetos, cada um contendo duas partículas e duas unidades de energia (representadas como “*”) na Figura\(\PageIndex{3}\). O objeto quente é composto pelas partículas A e B e inicialmente contém as duas unidades de energia. O objeto frio é composto por partículas C e D, que inicialmente não têm unidades de energia. A distribuição (a) mostra os três microestados possíveis para o estado inicial do sistema, com ambas as unidades de energia contidas no objeto quente. Se uma das duas unidades de energia for transferida, o resultado será a distribuição (b) consistindo em quatro microestados. Se ambas as unidades de energia forem transferidas, o resultado será uma distribuição (c) que consiste em três microestados. Assim, podemos descrever esse sistema por um total de dez microestados. A probabilidade de o calor não fluir quando os dois objetos são colocados em contato, ou seja, que o sistema permaneça na distribuição (a), é\(\frac{3}{10}\). O mais provável é que o fluxo de calor produza uma das outras duas distribuições, sendo a probabilidade combinada\(\frac{7}{10}\). O resultado mais provável é o fluxo de calor para produzir a dispersão uniforme da energia representada pela distribuição (b), sendo a probabilidade dessa configuração\(\frac{4}{10}\). Quanto ao exemplo anterior de dispersão de matéria, extrapolar esse tratamento para coleções macroscópicas de partículas aumenta dramaticamente a probabilidade da distribuição uniforme em relação às outras distribuições. Isso apóia a observação comum de que colocar objetos quentes e frios em contato resulta em um fluxo de calor espontâneo que, em última análise, equaliza as temperaturas dos objetos. E, novamente, esse processo espontâneo também é caracterizado por um aumento na entropia do sistema.
Considere o sistema mostrado aqui. Qual é a mudança na entropia de um processo que converte o sistema de distribuição (a) para (c)?

Solução
Estamos interessados na seguinte mudança:
O número inicial de microestados é um, os seis finais:
\[\begin{align} ΔS &=k \ln\dfrac{\Omega_\ce{c}}{\Omega_\ce{a}} \nonumber \\[4pt] &= 1.38×10^{−23}\:J/K × \ln\dfrac{6}{1} \nonumber \\[4pt] &= 2.47×10^{−23}\:J/K \nonumber \end{align} \nonumber \]
O sinal desse resultado é consistente com a expectativa; como há mais microestados possíveis para o estado final do que para o estado inicial, a mudança na entropia deve ser positiva.
Considere o sistema mostrado na Figura\(\PageIndex{3}\). Qual é a mudança na entropia do processo em que toda a energia é transferida do objeto quente (AB) para o objeto frio (CD)?
- Resposta
-
0 KG/KG
Prevendo o sinal de ΔS
As relações entre entropia, microestados e dispersão de matéria/energia descritas anteriormente nos permitem fazer generalizações sobre as entropias relativas das substâncias e prever o sinal de mudanças de entropia para processos químicos e físicos. Considere as mudanças de fase ilustradas na Figura\(\PageIndex{4}\). Na fase sólida, os átomos ou moléculas são restritos a posições quase fixas em relação uns aos outros e são capazes de oscilações apenas modestas em relação a essas posições. Com localizações essencialmente fixas para as partículas componentes do sistema, o número de microestados é relativamente pequeno. Na fase líquida, os átomos ou moléculas são livres para se mover uns sobre os outros, embora permaneçam relativamente próximos uns dos outros. Essa maior liberdade de movimento resulta em uma maior variação nas possíveis localizações das partículas, portanto, o número de microestados é correspondentemente maior do que o do sólido. Como resultado, S líquido > S sólido e o processo de conversão de uma substância de sólido em líquido (fusão) são caracterizados por um aumento na entropia, ΔS > 0. Pela mesma lógica, o processo recíproco (congelamento) exibe uma diminuição na entropia, ΔS < 0.
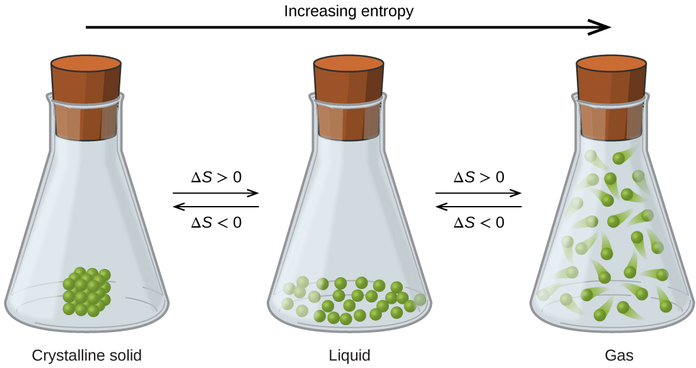
Agora, considere a fase de vapor ou gás. Os átomos ou moléculas ocupam um volume muito maior do que na fase líquida; portanto, cada átomo ou molécula pode ser encontrado em muito mais locais do que na fase líquida (ou sólida). Consequentemente, para qualquer substância, gás S > S líquido > S sólido e os processos de vaporização e sublimação também envolvem aumentos na entropia, ΔS > 0. Da mesma forma, as transições de fase recíprocas, condensação e deposição, envolvem diminuições na entropia, ΔS < 0.
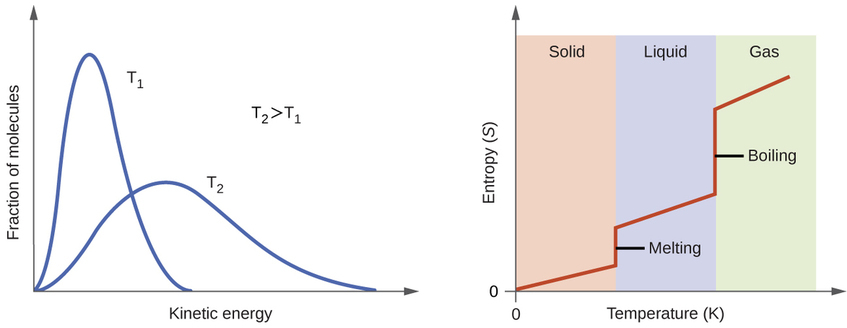
De acordo com a teoria cinético-molecular, a temperatura de uma substância é proporcional à energia cinética média de suas partículas. Aumentar a temperatura de uma substância resultará em vibrações mais extensas das partículas nos sólidos e traduções mais rápidas das partículas em líquidos e gases. Em temperaturas mais altas, a distribuição das energias cinéticas entre os átomos ou moléculas da substância também é mais ampla (mais dispersa) do que em temperaturas mais baixas. Assim, a entropia de qualquer substância aumenta com a temperatura (Figura\(\PageIndex{5}\)).
A entropia de uma substância é influenciada pela estrutura das partículas (átomos ou moléculas) que compõem a substância. Com relação às substâncias atômicas, os átomos mais pesados possuem maior entropia em uma determinada temperatura do que os átomos mais leves, o que é uma consequência da relação entre a massa de uma partícula e o espaçamento dos níveis quantizados de energia translacional (que é um tópico além do escopo de nosso tratamento). Para moléculas, um número maior de átomos (independentemente de suas massas) aumenta as formas pelas quais as moléculas podem vibrar e, portanto, o número de microestados possíveis e a entropia do sistema.
Finalmente, variações nos tipos de partículas afetam a entropia de um sistema. Em comparação com uma substância pura, na qual todas as partículas são idênticas, a entropia de uma mistura de dois ou mais tipos diferentes de partículas é maior. Isso se deve às orientações e interações adicionais que são possíveis em um sistema composto por componentes não idênticos. Por exemplo, quando um sólido se dissolve em um líquido, as partículas do sólido experimentam uma maior liberdade de movimento e interações adicionais com as partículas do solvente. Isso corresponde a uma dispersão mais uniforme de matéria e energia e a um maior número de microestados. O processo de dissolução, portanto, envolve um aumento na entropia, ΔS > 0.
Considerar os vários fatores que afetam a entropia nos permite fazer previsões informadas do sinal de ΔS para vários processos químicos e físicos, conforme ilustrado no Exemplo.
Preveja o sinal da mudança de entropia para os seguintes processos. Indique o motivo de cada uma de suas previsões.
- Um mol de água líquida à temperatura ambiente\(⟶\) um mol de água líquida a 50 °C
- \(\ce{Ag+}(aq)+\ce{Cl-}(aq)⟶\ce{AgCl}(s)\)
- \(\ce{C6H6}(l)+\dfrac{15}{2}\ce{O2}(g)⟶\ce{6CO2}(g)+\ce{3H2O}(l)\)
- \(\ce{NH3}(s)⟶\ce{NH3}(l)\)
Solução SS
- positivo, aumentos de temperatura
- negativo, redução no número de íons (partículas) em solução, diminuição da dispersão da matéria
- diminuição líquida negativa na quantidade de espécies gasosas
- positivo, transição de fase do sólido para o líquido, aumento líquido na dispersão da matéria
Preveja o sinal da mudança de entalpia para os seguintes processos. Dê um motivo para sua previsão.
- \(\ce{NaNO3}(s)⟶\ce{Na+}(aq)+\ce{NO3-}(aq)\)
- o congelamento de água líquida
- \(\ce{CO2}(s)⟶\ce{CO2}(g)\)
- \(\ce{CaCO}(s)⟶\ce{CaO}(s)+\ce{CO2}(g)\)
- Responda a um
-
Positivo; O sólido se dissolve para dar um aumento de íons móveis na solução.
- Resposta b
-
Negativo; O líquido se torna um sólido mais ordenado.
- Resposta c
-
Positivo; O sólido relativamente ordenado se torna um gás
- Resposta d
-
Positivo; Há uma produção líquida de um mol de gás.
Resumo
Entropia (\(S\)) é uma função de estado que pode estar relacionada ao número de microestados de um sistema (o número de maneiras pelas quais o sistema pode ser organizado) e à razão entre o calor reversível e a temperatura em Kelvin. Pode ser interpretado como uma medida da dispersão ou distribuição de matéria e/ou energia em um sistema e é frequentemente descrito como representando a “desordem” do sistema. Para uma determinada substância,\(S_{solid} < S_{liquid} \ll S_{gas}\) em um determinado estado físico a uma determinada temperatura, a entropia é tipicamente maior para átomos mais pesados ou moléculas mais complexas. A entropia aumenta quando um sistema é aquecido e quando as soluções se formam. Usando essas diretrizes, o sinal de mudanças de entropia para algumas reações químicas pode ser previsto de forma confiável.
Equações-chave
- \(ΔS=\dfrac{q_\ce{rev}}{T}\)
- S = k em W
- \(ΔS=k\ln\dfrac{W_\ce{f}}{W_\ce{i}}\)
Glossário
- entropia (S)
- função de estado que é uma medida da dispersão de matéria e/ou energia dentro de um sistema, determinada pelo número de microestados do sistema frequentemente descritos como uma medida da desordem do sistema
- microestado (W)
- possível configuração ou disposição de matéria e energia dentro de um sistema
- processo reversível
- processo que ocorre tão lentamente que é capaz de reverter a direção em resposta a uma mudança infinitesimalmente pequena nas condições; construção hipotética que só pode ser aproximada por processos reais removidos


