15.3: Equilíbrios acoplados
- Page ID
- 185273
- Descreva exemplos de sistemas envolvendo dois (ou mais) equilíbrios químicos simultâneos
- Calcule as concentrações de reagentes e produtos para vários sistemas de equilíbrio
- Compare a dissolução e a fraca formação de eletrólitos
Há momentos em que uma reação de equilíbrio não descreve adequadamente o sistema que está sendo estudado. Às vezes, temos mais de um tipo de equilíbrio ocorrendo ao mesmo tempo (por exemplo, uma reação ácido-base e uma reação de precipitação).
O oceano é um exemplo único de um sistema com múltiplos equilíbrios ou vários estados de equilíbrio de solubilidade trabalhando simultaneamente. O dióxido de carbono no ar se dissolve na água do mar, formando ácido carbônico (H 2 CO 3). O ácido carbônico então ioniza para formar íons hidrogênio e íons bicarbonato\(\ce{(HCO3- )}\), que podem se ionizar ainda mais em mais íons de hidrogênio e íons carbonato\(\ce{(CO3^2- )}\):
\[\ce{CO2}(g)⇌\ce{CO2}(aq) \nonumber \]
\[\ce{CO2}(aq)+\ce{H2O}⇌\ce{H2CO3}(aq) \nonumber \]
\[\ce{H2CO3}(aq)⇌\ce{H+}(aq)+\ce{HCO3-}(aq) \nonumber \]
\[\ce{HCO3-}(aq)⇌\ce{H+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
O excesso de íons H + torna a água do mar mais ácida. O aumento da acidificação dos oceanos pode então ter impactos negativos nos corais que constroem recifes, pois eles não conseguem absorver o carbonato de cálcio de que precisam para crescer e manter seus esqueletos (Figura\(\PageIndex{1}\)). Isso, por sua vez, perturba o biossistema local que depende da saúde dos recifes para sua sobrevivência. Se um número suficiente de recifes locais for afetado de forma semelhante, as interrupções na vida marinha podem ser sentidas globalmente. Os oceanos do mundo estão atualmente no meio de um período de intensa acidificação, que se acredita ter começado em meados do século XIX, e que agora está se acelerando a uma taxa mais rápida do que qualquer mudança no pH oceânico nos últimos 20 milhões de anos.

Saiba mais sobre a acidificação dos oceanos e como ela afeta outras criaturas marinhas.
Sólidos levemente solúveis derivados de ácidos fracos geralmente se dissolvem em ácidos fortes, a menos que seus produtos de solubilidade sejam extremamente pequenos. Por exemplo, podemos dissolver CuCo 3, FeS e Ca 3 (PO 4) 2 em HCl porque seus ânions básicos reagem para formar ácidos fracos (H 2 CO 3, H 2 S e\(\ce{H2PO4-}\)). A diminuição resultante na concentração do ânion resulta em uma mudança das concentrações de equilíbrio para a direita, de acordo com o princípio de Le Chatelier.

De particular relevância para nós é a dissolução da hidroxilapatita, Ca 5 (PO 4) 3 OH, em ácido. As apatitas são uma classe de minerais de fosfato de cálcio (Figura\(\PageIndex{2}\)); uma forma biológica de hidroxilapatita é encontrada como o principal mineral no esmalte de nossos dentes. Uma mistura de hidroxilapatita e água (ou saliva) contém uma mistura de equilíbrio de Ca 5 (PO 4) 3 OH sólido e íons Ca 2 +\(\ce{PO4^3-}\), e OH — dissolvidos:
\[\ce{Ca5(PO4)3OH}(s)⟶\ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \nonumber \]
Quando expostos ao ácido, os íons fosfato reagem com os íons hidrônio para formar íons hidrogenofosfato e, finalmente, ácido fosfórico:
\[\ce{PO4^3-}(aq)+\ce{H3O+}⇌\ce{H2PO4^2-}+\ce{H2O} \nonumber \]
\[\ce{PO4^2-}(aq)+\ce{H3O+}⇌\ce{H2PO4-}+\ce{H2O} \nonumber \]
\[\ce{H2PO4- + H3O+ ⇌ H3PO4 + H2O} \nonumber \]
O íon hidróxido reage para formar água:
\[\ce{OH-}(aq)+\ce{H3O+}⇌\ce{2H2O} \nonumber \]
Essas reações diminuem as concentrações de íons fosfato e hidróxido, e hidroxilapatita adicional se dissolve em uma solução ácida de acordo com o princípio de Le Chatelier. Nossos dentes desenvolvem cáries quando resíduos ácidos produzidos pelas bactérias que crescem neles fazem com que a hidroxilapatita do esmalte se dissolva. Os cremes dentais com flúor contêm fluoreto de sódio, NaF ou fluoreto estanoso [mais apropriadamente denominado fluoreto de estanho (II)], SnF 2. Eles funcionam substituindo o íon OH - na hidroxilapatita pelo íon F -, produzindo fluorapatita, Ca 5 (PO 4) 3 F:
\[\ce{NaF + Ca5(PO4)3OH ⇌ Ca5(PO4)3F + Na+ + OH-} \nonumber \]
O Ca 5 (PO 4) 3 F resultante é ligeiramente menos solúvel do que Ca 5 (PO 4) 3 OH, e F - é uma base mais fraca que OH -. Ambos os fatores tornam a fluorapatita mais resistente ao ataque de ácidos do que a hidroxilapatita. Consulte o artigo Química na vida cotidiana sobre o papel do flúor na prevenção da cárie dentária para obter mais informações.
Como vimos anteriormente, os íons de flúor ajudam a proteger nossos dentes ao reagir com a hidroxilapatita para formar fluorapatita, Ca 5 (PO 4) 3 F. Como não possui um íon hidróxido, a fluorapatita é mais resistente aos ataques de ácidos em nossa boca e, portanto, é menos solúvel, protegendo nossos dentes. Os cientistas descobriram que a água fluorada naturalmente pode ser benéfica para os dentes e, portanto, tornou-se prática comum adicionar flúor à água potável. Cremes dentais e enxaguantes bucais também contêm quantidades de flúor (Figura\(\PageIndex{3}\)).

Infelizmente, o excesso de flúor pode anular suas vantagens. As fontes naturais de água potável em várias partes do mundo têm concentrações variáveis de flúor, e locais onde essa concentração é alta estão sujeitos a certos riscos à saúde quando não há outra fonte de água potável. O efeito colateral mais grave do excesso de flúor é a doença óssea, a fluorose esquelética. Quando há excesso de flúor no corpo, isso pode fazer com que as articulações endureçam e os ossos engrossem. Pode afetar gravemente a mobilidade e afetar negativamente a glândula tireoidea. A fluorose esquelética é uma condição da qual mais de 2,7 milhões de pessoas sofrem em todo o mundo. Portanto, embora o flúor possa proteger nossos dentes da cárie, a Agência de Proteção Ambiental dos EUA define um nível máximo de 4 ppm (4 mg/L) de flúor na água potável nos EUA. Os níveis de flúor na água não são regulamentados em todos os países, então a fluorose é um problema em áreas com altos níveis de flúor nas águas subterrâneas.
Quando a chuva ácida ataca o calcário ou o mármore, que são carbonatos de cálcio, ocorre uma reação semelhante ao ataque ácido à hidroxilapatita. O íon hidrônio da chuva ácida se combina com o íon carbonato dos carbonatos de cálcio e forma o íon hidrogenocarbonato, um ácido fraco:
\[\ce{H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l) \nonumber \]
O hidrogenocarbonato de cálcio, Ca (HCO 3) 2, é solúvel, então objetos de calcário e mármore se dissolvem lentamente na chuva ácida.
Se o carbonato de cálcio for adicionado a um ácido concentrado, o íon hidrônio reage com o íon carbonato de acordo com a equação:
\[\ce{2H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{H2CO3}(aq)+\ce{2H2O}(l) \nonumber \]
(A chuva ácida geralmente não é suficientemente ácida para causar essa reação; no entanto, os ácidos de laboratório são.) A solução pode ficar saturada com o ácido carbônico eletrolítico fraco, que é instável, e o gás dióxido de carbono pode ser desenvolvido:
\[\ce{H2CO3}(aq)⟶\ce{CO2}(g)+\ce{H2O}(l) \nonumber \]
Essas reações diminuem a concentração de íons carbonato e o carbonato de cálcio adicional se dissolve. Se houver ácido suficiente, a concentração de íon carbonato é reduzida a um nível tão baixo que o quociente de reação para a dissolução do carbonato de cálcio permanece menor do que o produto de solubilidade do carbonato de cálcio, mesmo após a dissolução de todo o carbonato de cálcio.
Calcule a concentração de íon amônio necessária para evitar a precipitação de Mg (OH) 2 em uma solução com [Mg 2 +] = 0,10 M e [NH 3] = 0,10 M.
Solução
Dois equilíbrios estão envolvidos nesse sistema:
- Reação (1):\(\ce{Mg(OH)2}(s)⇌\ce{Mg^2+}(aq)+\ce{2OH-}(aq); \hspace{20px} K_\ce{sp}=8.9×10^{−12}\)
- Reação (2):\(\ce{NH3}(aq)+\ce{H2O}(l)⇌\ce{NH4+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=1.8×10^{−5}\)
Para evitar a formação de Mg (OH) 2 sólido, devemos ajustar a concentração de OH — para que o quociente de reação da Equação (1), Q = [Mg 2 +] [OH —] 2, seja menor que K sp para Mg (OH) 2 . (Para simplificar o cálculo, determinamos a concentração de OH — quando Q = K sp.) [OH —] pode ser reduzido pela adição de\(\ce{NH4+}\), o que desloca a Reação (2) para a esquerda e reduz [OH —].
- Determinamos o [OH —] no qual Q = K sp quando [Mg 2 +] = 0,10 M:\[Q=\ce{[Mg^2+][OH- ]^2}=(0.10)\ce{[OH- ]^2}=8.9×10^{−12} \nonumber \]
O Mg sólido (OH) 2 não se formará nesta solução quando [OH —] for menor que 9,4 × 10 —6 M.
- Calculamos a\(\mathit{[NH_4^+]}\) necessidade de diminuir [OH —] para 9,4 × 10 —6 M quando [NH 3] = 0,10. \[K_\ce{b}=\ce{\dfrac{[NH4+][OH- ]}{[NH3]}}=\dfrac{\ce{[NH4+]}(9.4×10^{−6})}{0.10}=1.8×10^{−5} \nonumber \]\[\ce{[NH4+]}=0.19\:M \nonumber \]
Quando for\(\ce{[NH4+]}\) igual a 0,19 M, [OH —] será 9,4 × 10 —6 M. Qualquer\(\ce{[NH4+]}\) valor maior que 0,19 M reduzirá [OH —] abaixo de 9,4 × 10 —6 M e evitará a formação de Mg (OH) 2.
Considere os dois equilíbrios:
\[\ce{ZnS}(s)⇌\ce{Zn^2+}(aq)+\ce{S^2-}(aq) \hspace{20px} K_\ce{sp}=1×10^{−27} \nonumber \]
\[\ce{2H2O}(l)+\ce{H2S}(aq)⇌\ce{2H3O+}(aq)+\ce{S^2-}(aq) \hspace{20px} K=1.0×10^{−26} \nonumber \]
e calcule a concentração de íon hidrônio necessária para evitar a precipitação de ZnS em uma solução que é 0,050 M em Zn 2 + e saturada com H 2 S (0,10 M H 2 S).
- Responda
-
\[\ce{[H3O+]}>0.2\:M \nonumber \]
([S 2—] é menor que 2 × 10 —26 M e a precipitação de ZnS não ocorre.)
Portanto, os cálculos precisos da solubilidade dos sólidos do produto de solubilidade são limitados aos casos em que a única reação significativa que ocorre quando o sólido se dissolve é a formação de seus íons.
Os haletos de prata não expostos são removidos do filme fotográfico quando reagem com o tiossulfato de sódio (Na 2 S 2 O 3, chamado hipo) para formar o íon complexo\(\ce{Ag(S2O3)2^3-}\) (K f = 4,7 × 10 13). A reação com o brometo de prata é:
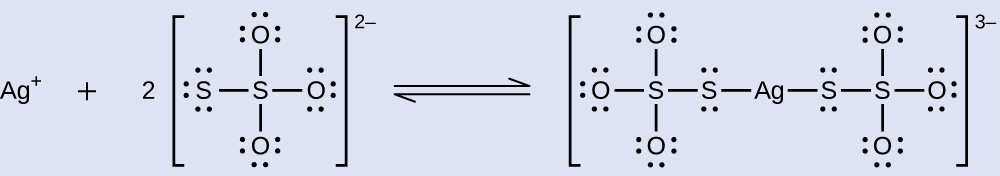
Qual massa de Na 2 S 2 O 3 é necessária para preparar 1,00 L de uma solução que dissolverá 1,00 g de AgBr pela formação de\(\ce{Ag(S2O3)2^3-}\)?
Solução SS
Dois equilíbrios estão envolvidos quando o AgBr se dissolve em uma solução contendo o\(\ce{S2O3^2-}\) íon:
- Reação (1):\(\ce{AgBr}(s)⇌\ce{Ag+}(aq)+\ce{Br-}(aq) \hspace{20px} K_\ce{sp}=5.0×10^{−13}\)
- Reação (2):\(\ce{Ag+}(aq)+\ce{S2O3^2-}(aq)⇌\ce{Ag(S2O3)2^3-}(aq) \hspace{20px} K_\ce{f}=4.7×10^{13}\)
Para que 1,00 g de AgBr se dissolva, o [Ag +] na solução resultante deve ser baixo o suficiente para que Q for Reaction (1) seja menor que K sp para essa reação. Reduzimos [Ag +] adicionando\(\ce{S2O3^2-}\) e, assim, fazemos com que a Reação (2) se desloque para a direita. Precisamos das seguintes etapas para determinar qual massa de Na 2 S 2 O 3 é necessária para fornecer o necessário\(\ce{S2O3^2-}\).
- Calculamos o [Br —] produzido pela dissolução completa de 1,00 g de AgBr (5,33 × 10 —3 mol de AgBr) em 1,00 L de solução:\[\ce{[Br- ]}=5.33×10^{−3}\:M \nonumber \]
- Usamos [Br —] e K sp para determinar a concentração máxima possível de Ag + que pode estar presente sem causar reprecipitação de AgBr:\[\ce{[Ag+]}=9.4×10^{−11}\:M \nonumber \]
- Determinamos o\(\mathit{[S_2O_3^{2-}]}\) necessário para fazer [Ag +] = 9,4 × 10 —11 M após o íon Ag + restante ter reagido de\(\mathit{S_2O_3^{2-}}\) acordo com a equação:\[\ce{Ag+ + 2S2O3^2- ⇌ Ag(S2O3)2^3-} \hspace{20px} K_\ce{f}=4.7×10^{13} \nonumber \]
Porque 5,33 × 10 —3 mol de AgBr se dissolvem:
\ [(5,33×10^ {−3}) − (9,4×10^ {−11}) =5,33×10^ {−3}\ ce {\ :mol\ :Ag (S2O3) 2^3-}\\ nonumber]Assim, em equilíbrio:\(\ce{[Ag(S2O3)2^3- ]}\) = 5,33 × 10 —3 M, [Ag +] = 9,4 × 10 —11 M e Q = K f = 4,7 × 10 13:
\[K_\ce{f}=\ce{\dfrac{[Ag(S2O3)2^3- ]}{[Ag+][S2O3^2- ]^2}}=4.7×10^{13} \nonumber \]\[\ce{[S2O3^2- ]}=1.1×10^{−3}\:M \nonumber \]Quando\(\ce{[S2O3^2- ]}\) é 1,1 × 10 —3 M, [Ag +] é 9,4 × 10 —11 M e todo AgBr permanece dissolvido.
- Determinamos o número total de moles\(\mathit{S_2O_3^{2-}}\) que devem ser adicionados à solução. Isso é igual à quantidade que reage com o Ag + para se formar\(\ce{Ag(S2O3)2^3-}\) mais a quantidade de livre\(\ce{S2O3^2-}\) na solução em equilíbrio. Para formar 5,33 × 10 —3 mol de, é\(\ce{Ag(S2O3)2^3-}\) necessário 2 × (5,33 × 10 —3) mol de\(\ce{S2O3^2-}\). Além disso, 1,1 × 10 —3 mol de não reagido\(\ce{S2O3^2-}\) está presente (Etapa 3). Assim, o valor total\(\ce{S2O3^2-}\) que deve ser adicionado é:\[\mathrm{2×(5.33×10^{−3}mol\:S_2O_3^{2-}) + 1.1×10^{−3}\:mol\:S_2O_3^{2-} = 1.18×10^{−2}\: mol\:S_2O_3^{2-}} \nonumber \]
- Determinamos a massa de Na 2 S 2 O 3 necessária para dar 1,18 × 10 —2 mol\(\mathit{S_2O_3^{2-}}\) usando a massa molar de Na 2 S 2 O 3:\[\mathrm{1.18×10^{−2}\:mol\:S_2O_3^{2-}×\dfrac{158.1\:g\:Na_2S_2O_3}{1\:mol\:Na_2S_2O_3}=1.9\:g\:Na_2S_2O_3} \nonumber \]
Assim, 1,00 L de uma solução preparada a partir de 1,9 g Na 2 S 2 O 3 dissolve 1,0 g de AgBr.
Sabe-se que o AgCl (s), cloreto de prata, tem uma solubilidade muito baixa:\(\ce{Ag}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq)\), K sp = 1,6 × 10 —10. A adição de amônia aumenta significativamente a solubilidade do AgCl porque um íon complexo é formado:\(\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq)\), K f = 1,7 × 10 7. Qual massa de NH 3 é necessária para preparar 1,00 L de solução que dissolverá 2,00 g de AgCl pela formação de\(\ce{Ag(NH3)2+}\)?
- Responda
-
1,00 L de uma solução preparada com 4,81 g de NH 3 dissolve 2,0 g de AgCl.
Dissolução versus formação fraca de eletrólitos
Podemos determinar como mudar a concentração de íons no equilíbrio entre um sólido levemente solúvel e uma solução de seus íons aplicando o princípio de Le Chatelier. Por exemplo, uma forma de controlar a concentração do íon manganês (II), Mn 2 +, em uma solução é ajustar o pH da solução e, consequentemente, manipular o equilíbrio entre o hidróxido de manganês (II) sólido levemente solúvel, o íon manganês (II) e o íon hidróxido:
\[\ce{Mn(OH)2}(s) ⇌ \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mn^2+][OH- ]^2} \nonumber \]
Isso pode ser importante para uma lavanderia, pois roupas lavadas em água com concentração de manganês superior a 0,1 mg por litro podem ficar manchadas pelo manganês. Podemos reduzir a concentração de manganês aumentando a concentração de íon hidróxido. Poderíamos adicionar, por exemplo, uma pequena quantidade de NaOH ou alguma outra base, como os silicatos encontrados em muitos detergentes para a roupa. À medida que a concentração de íon OH aumenta, o equilíbrio responde deslocando-se para a esquerda e reduzindo a concentração do íon Mn 2 + enquanto aumenta a quantidade de Mn sólido (OH) 2 na mistura de equilíbrio, conforme previsto pelo princípio de Le Chatelier.
Qual é o efeito na quantidade de Mg (OH) 2 sólido que se dissolve e nas concentrações de Mg 2 + e OH — quando cada um dos seguintes itens é adicionado a uma mistura de Mg (OH) 2 sólido em água em equilíbrio?
- MgCl 2
- KOH
- um ácido
- Ano 3
- Mg (OH) 2
Solução
O equilíbrio entre o Mg sólido (OH) 2 e uma solução de Mg 2+ e OH — é:
\[\ce{Mg(OH)2}(s) ⇌ \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
(a) A reação se desloca para a esquerda para aliviar o estresse produzido pelo íon Mg 2 + adicional, de acordo com o princípio de Le Chatelier. Em termos quantitativos, o Mg 2 + adicionado faz com que o quociente de reação seja maior do que o produto de solubilidade (Q > K sp) e o Mg (OH) 2 se forme até que o quociente de reação seja novamente igual a K sp. No novo equilíbrio, [OH —] é menor e [Mg 2 +] é maior do que na solução de Mg (OH) 2 em água pura. Mg (OH) 2 mais sólido está presente.
(b) A reação muda para a esquerda para aliviar o estresse do íon OH adicional. Mg (OH) 2 se forma até que o quociente de reação seja novamente igual a K sp. No novo equilíbrio, [OH —] é maior e [Mg 2 +] é menor do que na solução de Mg (OH) 2 em água pura. Mg (OH) 2 mais sólido está presente.
(c) A concentração de OH — é reduzida à medida que o OH — reage com o ácido. A reação muda para a direita para aliviar o estresse de menos íon OH. Em termos quantitativos, a diminuição na concentração de OH — faz com que o quociente de reação seja menor do que o produto de solubilidade (Q < K sp) e Mg (OH) 2 adicional se dissolva até que o quociente de reação seja novamente igual a K colher de chá. No novo equilíbrio, [OH —] é menor e [Mg 2 +] é maior do que na solução de Mg (OH) 2 em água pura. Mais Mg (OH) 2 é dissolvido.
(d) O NaNO 3 não contém nenhuma das espécies envolvidas no equilíbrio, portanto, devemos esperar que ele não tenha nenhum efeito apreciável nas concentrações de Mg 2 + e OH -. (Como vimos anteriormente, os sais dissolvidos alteram as atividades dos íons de um eletrólito. No entanto, o efeito do sal geralmente é pequeno e devemos negligenciar os pequenos erros que podem resultar dele.)
(e) A adição de Mg (OH) 2 sólido não tem efeito na solubilidade do Mg (OH) 2 ou na concentração de Mg 2 + e OH —. A concentração de Mg (OH) 2 não aparece na equação do quociente de reação:
\[Q=\ce{[Mg^2+][OH- ]^2} \nonumber \]
Assim, alterar a quantidade de hidróxido de magnésio sólido na mistura não tem efeito sobre o valor de Q, e nenhuma mudança é necessária para restaurar Q ao valor da constante de equilíbrio.
Qual é o efeito na quantidade de NiCo 3 sólido que se dissolve e nas concentrações de Ni 2 + e\(\ce{CO3^2-}\) quando cada um dos seguintes itens é adicionado a uma mistura do sólido NiCo 3 ligeiramente solúvel e água em equilíbrio?
- Não (NO 32)
- KClO 4
- NiCo 3
- K 2 CO 3
- HNO 3 (reage com\(\ce{HCO3-}\) carbonato fornecendo H 2 O e CO 2)
Responda
(a) a massa de NiCo 3 (s) aumenta, [Ni 2 +] aumenta,\(\ce{[CO3^2- ]}\) diminui; (b) nenhum efeito apreciável; (c) nenhum efeito exceto para aumentar a quantidade de NiCo 3 sólido; (d) a massa de NiCo 3 (s) aumenta, [Ni 2 +] diminui,\(\ce{[CO3^2- ]}\) aumenta; (e) a massa de NiCo 3 (s) diminui, [Ni 2 +] aumenta,\(\ce{[CO3^2- ]}\) diminui
Resumo
Vários sistemas que encontramos consistem em múltiplos equilíbrios, sistemas em que dois ou mais processos de equilíbrio estão ocorrendo simultaneamente. Alguns exemplos comuns incluem chuva ácida, fluoretação e dissolução do dióxido de carbono na água do mar. Ao analisar esses sistemas, precisamos considerar cada equilíbrio separadamente e, em seguida, combinar as constantes de equilíbrio individuais em um produto de solubilidade ou expressão do quociente de reação usando as ferramentas do primeiro capítulo de equilíbrio. O princípio de Le Chatelier também deve ser considerado, pois cada reação em um sistema de equilíbrio múltiplo mudará para reagentes ou produtos com base no que é adicionado à reação inicial e como isso afeta cada reação de equilíbrio subsequente.
Glossário
- equilíbrio múltiplo
- sistema caracterizado por mais de um estado de equilíbrio entre um sólido iônico levemente solúvel e uma solução aquosa de íons trabalhando simultaneamente


