15.2: Ácidos e bases de Lewis
- Page ID
- 185291
- Explicar o modelo de Lewis de química ácido-base
- Escreva equações para a formação de adutos e íons complexos
- Execute cálculos de equilíbrio envolvendo constantes de formação
Em 1923, G. N. Lewis propôs uma definição generalizada do comportamento ácido-base na qual ácidos e bases são identificados por sua capacidade de aceitar ou doar um par de elétrons e formar uma ligação covalente coordenada.
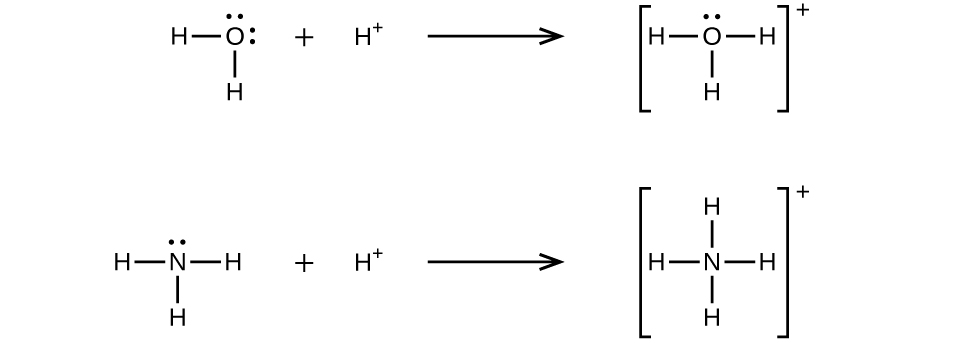
Uma ligação covalente coordenada (ou ligação dativa) ocorre quando um dos átomos na ligação fornece os dois elétrons de ligação. Por exemplo, uma ligação covalente coordenada ocorre quando uma molécula de água se combina com um íon hidrogênio para formar um íon hidrônio. Uma ligação covalente coordenada também ocorre quando uma molécula de amônia se combina com um íon de hidrogênio para formar um íon amônio. Ambas as equações são mostradas aqui.
Definição: Ácidos e bases de Lewis
- Um ácido de Lewis é qualquer espécie (molécula ou íon) que pode aceitar um par de elétrons, e uma base de Lewis é qualquer espécie (molécula ou íon) que pode doar um par de elétrons.
Uma reação ácido-base de Lewis ocorre quando uma base doa um par de elétrons para um ácido. Um aduto ácido-base de Lewis, um composto que contém uma ligação covalente coordenada entre o ácido de Lewis e a base de Lewis, é formado. As equações a seguir ilustram a aplicação geral do conceito de Lewis.
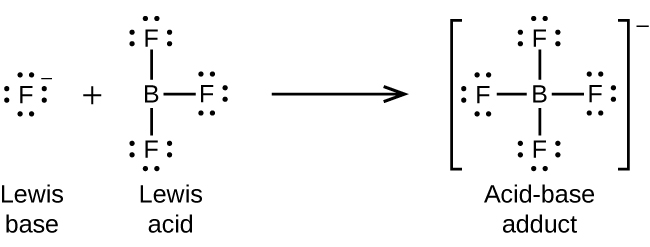
O átomo de boro no trifluoreto de boro, BF 3, tem apenas seis elétrons em sua camada de valência. Estando aquém do octeto preferido, o BF 3 é um ácido de Lewis muito bom e reage com muitas bases de Lewis; um íon flúor é a base de Lewis nessa reação, doando um de seus pares solitários:
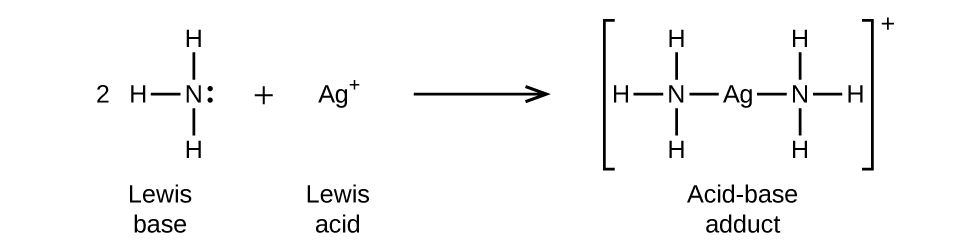
Na reação a seguir, cada uma das duas moléculas de amônia, bases de Lewis, doa um par de elétrons para um íon de prata, o ácido de Lewis:
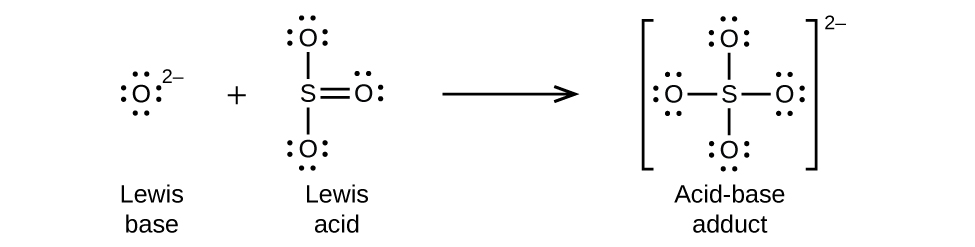
Óxidos não metálicos atuam como ácidos de Lewis e reagem com íons óxidos, bases de Lewis, para formar oxiânions:
Muitas reações ácido-base de Lewis são reações de deslocamento nas quais uma base de Lewis desloca outra base de Lewis de um aduto ácido-base, ou nas quais um ácido de Lewis desloca outro ácido de Lewis:
A última reação de deslocamento mostra como a reação de um ácido Brønsted-Lowry com uma base se encaixa no conceito de Lewis. Um ácido Brønsted-Lowry, como o HCl, é um aduto ácido-base de acordo com o conceito de Lewis, e a transferência de prótons ocorre porque um aduto ácido-base mais estável é formado. Assim, embora as definições de ácidos e bases nas duas teorias sejam bem diferentes, as teorias se sobrepõem consideravelmente.
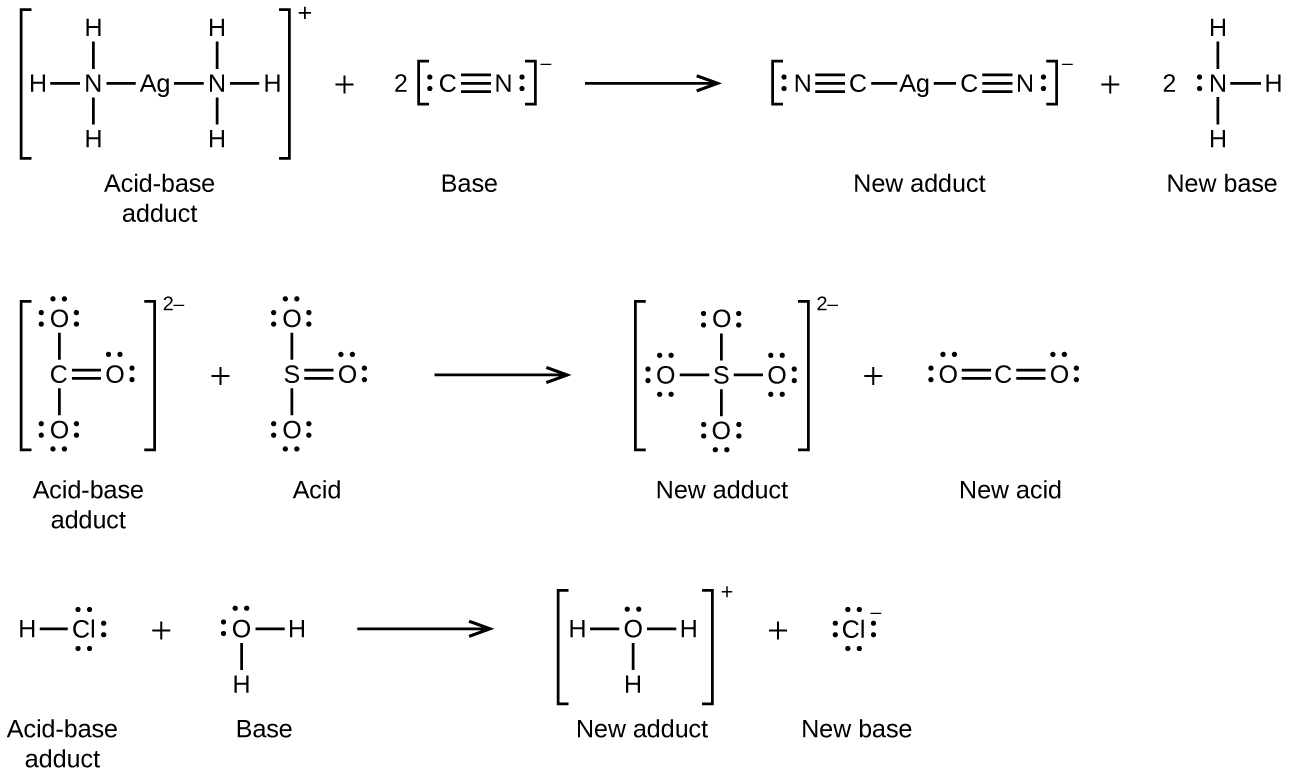
Muitos sólidos iônicos levemente solúveis se dissolvem quando a concentração do íon metálico na solução é diminuída por meio da formação de íons complexos (poliatômicos) em uma reação ácido-base de Lewis. Por exemplo, o cloreto de prata se dissolve em uma solução de amônia porque o íon prata reage com a amônia para formar o complexo íon\(\ce{Ag(NH3)2+}\) n. A estrutura de Lewis do\(\ce{Ag(NH3)2+}\) íon é:
As equações para a dissolução de AgCl em uma solução de NH 3 são:
\[\ce{AgCl}(s)⟶\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⟶\ce{Ag(NH3)2+}(aq) \nonumber \]
\[\textrm{Net: }\ce{AgCl}(s)+\ce{2NH3}(aq)⟶\ce{Ag(NH3)2+}(aq)+\ce{Cl-}(aq) \nonumber \]
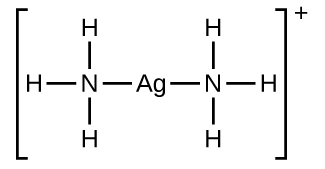
O hidróxido de alumínio se dissolve em uma solução de hidróxido de sódio ou outra base forte devido à formação do íon complexo\(\ce{Al(OH)4-}\). A estrutura de Lewis do\(\ce{Al(OH)4-}\) íon é:
As equações para a dissolução são:
\[\ce{Al(OH)3}(s)⟶\ce{Al^3+}(aq)+\ce{3OH-}(aq) \nonumber \]
\[\ce{Al^3+}(aq)+\ce{4OH-}(aq)⟶\ce{Al(OH)4-}(aq) \nonumber \]
\[\textrm{Net: }\ce{Al(OH)3}(s)+\ce{OH-}(aq)⟶\ce{Al(OH)4-}(aq) \nonumber \]
O sulfeto de mercúrio (II) se dissolve em uma solução de sulfeto de sódio porque o HgS reage com o íon S 2—:
\[\ce{HgS}(s)⟶\ce{Hg^2+}(aq)+\ce{S^2-}(aq) \nonumber \]
\[\ce{Hg^2+}(aq)+\ce{2S^2-}(aq)⟶\ce{HgS2^2-}(aq) \nonumber \]
\[\textrm{Net: }\ce{HgS}(s)+\ce{S^2-}(aq)⟶\ce{HgS2^2-}(aq) \nonumber \]
Um íon complexo consiste em um átomo central, normalmente um cátion de metal de transição, cercado por íons ou moléculas chamadas ligantes. Esses ligantes podem ser moléculas neutras como H 2 O ou NH 3, ou íons como CN - ou OH -. Frequentemente, os ligantes agem como bases de Lewis, doando um par de elétrons para o átomo central. Os ligantes se agregam em torno do átomo central, criando um novo íon com uma carga igual à soma das cargas e, na maioria das vezes, um íon metálico de transição. Esse arranjo mais complexo é o motivo pelo qual o íon resultante é chamado de íon complexo. O íon complexo formado nessas reações não pode ser previsto; ele deve ser determinado experimentalmente. Os tipos de ligações formadas em íons complexos são chamados de ligações covalentes coordenadas, pois os elétrons dos ligantes estão sendo compartilhados com o átomo central. Por causa disso, os íons complexos às vezes são chamados de complexos de coordenação. Isso será estudado mais detalhadamente nos próximos capítulos.
A constante de equilíbrio para a reação dos componentes de um íon complexo para formar o íon complexo em solução é chamada de constante de formação (K f) (às vezes chamada de constante de estabilidade). Por exemplo, o íon complexo\(\ce{Cu(CN)2-}\) é mostrado aqui:
![]()
Ele se forma pela reação:
\[\ce{Cu+}(aq)+\ce{2CN-}(aq)⇌\ce{Cu(CN)2-}(aq) \nonumber \]
Em equilíbrio:
\[K_\ce{f}=Q=\ce{\dfrac{[Cu(CN)2- ]}{[Cu+][CN- ]^2}} \nonumber \]
O inverso da constante de formação é a constante de dissociação (K d), a constante de equilíbrio para a decomposição de um íon complexo em seus componentes em solução. Trabalharemos com as constantes de dissociação mais detalhadamente nos exercícios desta seção. A Tabela E4 e a Tabela\(\PageIndex{1}\) são tabelas de constantes de formação. Em geral, quanto maior a constante de formação, mais estável é o complexo; no entanto, como no caso dos valores de K sp, a estequiometria do composto deve ser considerada.
| Substância | K f a 25 °C |
|---|---|
| \(\ce{[Cd(CN)4]^2-}\) | 3 × 10 18 |
| \(\ce{Ag(NH3)2+}\) | 1,7 × 10 7 |
| \(\ce{[AlF6]^3-}\) | 7 × 10 19 |
Como exemplo de dissolução por formação de íons complexos, vamos considerar o que acontece quando adicionamos amônia aquosa a uma mistura de cloreto de prata e água. O cloreto de prata se dissolve levemente em água, dando uma pequena concentração de Ag + ([Ag +] = 1,3 × 10 —5 M):
\[\ce{AgCl}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
No entanto, se o NH 3 estiver presente na água, o íon complexo,\(\ce{Ag(NH3)2+}\), pode se formar de acordo com a equação:
\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq) \nonumber \]
com
\[K_\ce{f}=\ce{\dfrac{[Ag(NH3)2+]}{[Ag+][NH3]^2}}=1.7×10^7 \nonumber \]
O grande tamanho dessa constante de formação indica que a maioria dos íons de prata livres produzidos pela dissolução do AgCl se combinam com o NH 3 para se formar\(\ce{Ag(NH3)2+}\). Como consequência, a concentração de íons de prata, [Ag +], é reduzida e o quociente de reação para a dissolução do cloreto de prata, [Ag +] [Cl —], fica abaixo do produto de solubilidade do AgCl:
\[Q=\ce{[Ag+][Cl- ]}<K_\ce{sp} \nonumber \]
Mais cloreto de prata então se dissolve. Se a concentração de amônia for grande o suficiente, todo o cloreto de prata se dissolve.
Calcule a concentração do íon prata em uma solução que inicialmente é 0,10 M em relação\(\ce{Ag(NH3)2+}\) a.
Solução SS
Usamos o caminho familiar para resolver esse problema:
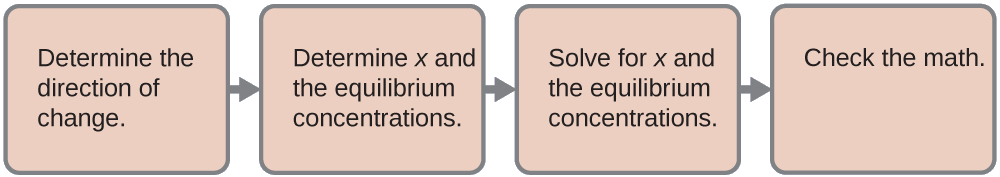
- Determine a direção da mudança. O íon complexo\(\ce{Ag(NH3)2+}\) está em equilíbrio com seus componentes, conforme representado pela equação:\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq) \nonumber \]
Escrevemos o equilíbrio como uma reação de formação porque a Tabela E4 lista as constantes de formação para íons complexos. Antes do equilíbrio, o quociente de reação é maior do que a constante de equilíbrio (K_f = 1,7\ times 10^7\), e\(Q=\dfrac{0.10}{0 \times 0} = \infty\) (é infinitamente grande), então a reação muda para a esquerda para alcançar o equilíbrio.


