11.E: Soluções e colóides (exercícios)
- Page ID
- 184871
11.2: O processo de dissolução
Q11.2.1
Como as soluções diferem dos compostos? De outras misturas?
S11.2.1
Uma solução pode variar em composição, enquanto um composto não pode variar em composição. As soluções são homogêneas no nível molecular, enquanto outras misturas são heterogêneas.
Q11.2.2
Quais das principais características das soluções podemos ver nas soluções\(\ce{K2Cr2O7}\) mostradas na

Figura: Quando o dicromato de potássio (\(\ce{K2Cr2O7}\)) é misturado com água, ele forma uma solução homogênea de laranja. (crédito: modificação do trabalho de Mark Ott)
S11.2.2
As soluções são as mesmas por toda parte (a cor é constante por toda parte) e a composição de uma solução de K 2 Cr 2 O 7 em água pode variar.
Q11.2.3
Quando o KNO 3 é dissolvido em água, a solução resultante é significativamente mais fria do que a água era originalmente.
- A dissolução do KNO 3 é um processo endotérmico ou exotérmico?
- Que conclusões você pode tirar sobre as atrações intermoleculares envolvidas no processo?
- A solução resultante é a solução ideal?
S11.2.3
(a) O processo é endotérmico, pois a solução está consumindo calor. (b) A atração entre o K + e os\(\ce{NO3-}\) íons é mais forte do que entre os íons e as moléculas de água (as interações íon-íon têm uma energia menor e mais negativa). Portanto, o processo de dissolução aumenta a energia das interações moleculares e consome a energia térmica da solução para compensar a diferença. (c) Não, uma solução ideal é formada sem liberação ou consumo de calor apreciável.
Q11.2.4
Dê um exemplo de cada um dos seguintes tipos de soluções:
- um gás em um líquido
- um gás em um gás
- um sólido em um sólido
S11.2.4
(a) CO 2 na água; (b) O 2 em N 2 (ar); (c) bronze (solução de estanho ou outros metais em cobre)
Q11.2.5
Indique os tipos mais importantes de atrações intermoleculares em cada uma das seguintes soluções:
- A solução na Figura.
- NO (l) em CO (l)
- Cl 2 (g) em Br 2 (l)
- HCl (aq) em benzeno C 6 H 6 (l)
- Metanol CH 3 OH (l) em H 2 O (l)
S 11.2.5
(a) forças de dipolo de íons; (b) forças dipolo-dipolo; (c) forças de dispersão; (d) forças de dispersão; (e) ligação de hidrogênio
Q11.2.5
Preveja se cada uma das seguintes substâncias seria mais solúvel em água (solvente polar) ou em um hidrocarboneto como o heptano (C 7 H 16, solvente não polar):
- óleo vegetal (não polar)
- álcool isopropílico (polar)
- brometo de potássio (iônico)
S 11.2.5
(a) heptano; (b) água; (c) água
Q11.2.6
O calor é liberado quando algumas soluções se formam; o calor é absorvido quando outras soluções se formam. Forneça uma explicação molecular para a diferença entre esses dois tipos de processos espontâneos.
S11.2.6
O calor é liberado quando as forças intermoleculares totais (IMFs) entre as moléculas de soluto e solvente são mais fortes do que as FMI totais no soluto puro e no solvente puro: quebrar IMFs mais fracos e formar FMI mais fortes libera calor. O calor é absorvido quando o total de IMFs na solução é mais fraco do que o total daqueles no soluto puro e no solvente puro: quebrar IMFs mais fortes e formar IMFs mais fracos absorve o calor.
Q11.2.7
Soluções de hidrogênio no paládio podem ser formadas pela exposição do metal Pd ao gás H 2. A concentração de hidrogênio no paládio depende da pressão do gás H2 aplicado, mas de uma forma mais complexa do que a descrita pela lei de Henry. Sob certas condições, 0,94 g de gás hidrogênio são dissolvidos em 215 g de metal paládio.
- Determine a molaridade dessa solução (densidade da solução = 1,8 g/cm 3).
- Determine a molalidade desta solução (densidade da solução = 1,8 g/cm 3).
- Determine a porcentagem em massa de átomos de hidrogênio nesta solução (densidade da solução = 1,8 g/cm 3).
S11.2.7
http://cnx.org/contents/ MH6AQEGx @2 /O processo de dissolução
11.3: Eletrólitos
Q11.3.1
Explique por que os íons Na + e Cl − são fortemente solvatados em água, mas não em hexano, um solvente composto por moléculas não polares.
S11.3.2
Cristais de NaCl se dissolvem em água, um líquido polar com um momento de dipolo muito grande, e os íons individuais ficam fortemente solvatados. O hexano é um líquido não polar com um momento de dipolo zero e, portanto, não interage significativamente com os íons dos cristais de NaCl.
Q11.3.2
Explique por que as soluções de HBr no benzeno (um solvente não polar) não são condutoras, enquanto as soluções em água (um solvente polar) são condutoras.
S11.3.2
O HBr é um ácido e, portanto, suas moléculas reagem com as moléculas de água para formar íons H 3 O + e Br − que fornecem condutividade à solução. Embora o HBr seja solúvel em benzeno, ele não reage quimicamente, mas permanece dissolvido como moléculas neutras de HBr. Sem íons presentes na solução de benzeno, ela não é eletricamente condutora.
Q11.3.3
Considere as soluções apresentadas:
(a) Qual dos seguintes esboços representa melhor os íons em uma solução de Fe (NO 3) 3 (aq)?
3_img.jpg") " style="width: 570px; height: 191px;" src="https://chem.libretexts.org/@api/dek...(NO3)3_img.jpg" width="570px" height="191px">
" style="width: 570px; height: 191px;" src="https://chem.libretexts.org/@api/dek...(NO3)3_img.jpg" width="570px" height="191px">
(b) Escreva uma equação química balanceada mostrando os produtos da dissolução de Fe (NO 3) 3.
S11.3.3
(a) Fe (NO 3) 3 é um eletrólito forte, portanto, deve se dissociar completamente em Fe 3+ e\(\ce{(NO3- )}\) íons. Portanto, (z) representa melhor a solução. (b)\(\ce{Fe(NO3)3}(s)⟶\ce{Fe^3+}(aq)+\ce{3NO3- }(aq)\)
Q11.3.4
Compare os processos que ocorrem quando o metanol (CH 3 OH), o cloreto de hidrogênio (HCl) e o hidróxido de sódio (NaOH) se dissolvem na água. Escreva equações e prepare esboços mostrando a forma na qual cada um desses compostos está presente em sua respectiva solução.
S11.3.3
O metanol,\(CH_3OH\), se dissolve na água em todas as proporções, interagindo via ligação de hidrogênio.
Metanol:
\[CH_3OH_{(l)}+H_2O_{(l)}⟶CH_3OH_{(aq)}\]
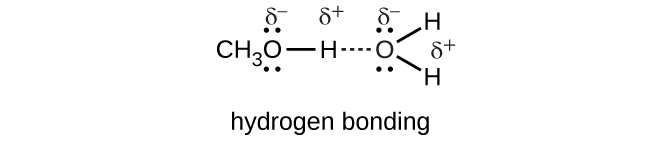
O cloreto de hidrogênio, HCl, se dissolve e reage com a água para produzir cátions de hidrônio e ânions cloreto que são solvatados por fortes interações íon-dipolo.
Cloreto de hidrogênio:
\[HCl{(g)}+H_2O_{(l)} \rightarrow H_3O^+_{(aq)}+Cl^−_{(aq)}\]
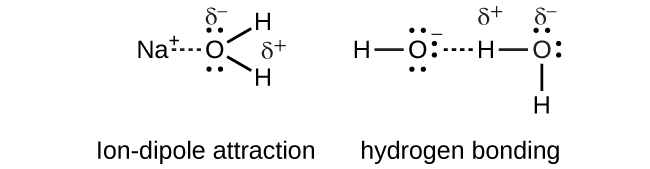
Sodium hydroxide, NaOH, dissolves in water and dissociates to yield sodium cations and hydroxide anions that are strongly solvated by ion-dipole interactions and hydrogen bonding, respectively.
Sodium hydroxide:
\[NaOH_{(s)} \rightarrow Na^+_{(aq)} + OH^−_{(aq)}\]
Q11.3.5
Qual é a condutividade elétrica esperada das seguintes soluções?
- NaOH (aq)
- HCl (aq)
- C 6 H 12 O 6 (aq) (glicose)
- NH 3 (l)
S 11.3.5
(a) alta condutividade (o soluto é um composto iônico que se dissociará quando dissolvido); (b) alta condutividade (o soluto é um ácido forte e se ioniza completamente quando dissolvido); (c) não condutivo (o soluto é um composto covalente, nem ácido nem base, não reativo à água); (d) baixa condutividade (o soluto é um base fraca e ionizará parcialmente quando dissolvida)
Q11.3.6
Por que a maioria dos compostos iônicos sólidos não são eletricamente condutores, enquanto as soluções aquosas de compostos iônicos são bons condutores? Você esperaria que um composto iônico líquido (fundido) fosse eletricamente condutor ou não condutor? Explique.
S11.3.6
Um meio deve conter entidades livremente móveis e carregadas para ser eletricamente condutor. Os íons presentes em um sólido iônico típico são imobilizados em uma rede cristalina e, portanto, o sólido não é capaz de suportar uma corrente elétrica. Quando os íons são mobilizados, seja derretendo o sólido ou dissolvendo-o em água para dissociar os íons, a corrente pode fluir e essas formas do composto iônico são condutoras.
Q11.3.7
Indique o tipo mais importante de atração intermolecular responsável pela solvatação em cada uma das seguintes soluções:
- as soluções na Figura
- metanol, CH 3 OH, dissolvido em etanol, C 2 H 5 OH
- metano, CH 4, dissolvido em benzeno, C 6 H 6
- o halocarbono polar CF 2 Cl 2 dissolvido no halocarbono polar CF 2 ClCFCl 2
- O 2 (l) em N 2 (l)
S11.3.7
(a) dipolo de íons; (b) ligações de hidrogênio; (c) forças de dispersão; (d) atrações de dipolo-dipolo; (e) forças de dispersão
11.4: Solubilidade
Q11.4.1
Suponha que você receba uma solução transparente de tiossulfato de sódio, Na 2 S 2 O 3. Como você pode determinar se a solução está insaturada, saturada ou supersaturada?
S11.4.1
Adicione um pequeno cristal de\(Na_2S_2O_3\). Ele se dissolverá em uma solução insaturada, permanecerá aparentemente inalterado em uma solução saturada ou iniciará a precipitação em uma solução supersaturada.
Q11.4.2
As soluções supersaturadas da maioria dos sólidos em água são preparadas pelo resfriamento de soluções saturadas. As soluções supersaturadas da maioria dos gases na água são preparadas aquecendo soluções saturadas. Explique os motivos da diferença nos dois procedimentos.
S11.4.2
A solubilidade dos sólidos geralmente diminui com o resfriamento de uma solução, enquanto a solubilidade dos gases geralmente diminui com o aquecimento.
Q11.4.3
Sugira uma explicação para as observações de que o etanol, C 2 H 5 OH, é completamente miscível com água e que o etanotiol, C 2 H 5 SH, é solúvel apenas na extensão de 1,5 g por 100 mL de água.
S11.4.3
As ligações de hidrogênio entre a água e C 2 H 5 OH são muito mais fortes do que as atrações intermoleculares entre a água e C 2 H 5 SH.
Q11.4.4
Calcule a porcentagem em massa de KBr em uma solução saturada de KBr em água a 10 °C usando a figura a seguir para obter dados úteis e reporte a porcentagem calculada para um dígito significativo.

Este gráfico mostra como a solubilidade de vários sólidos muda com a temperatura.
S11.4.4
A 10 °C, a solubilidade do KBr em água é de aproximadamente 60 g por 100 g de água.
\[\%\; KBr =\dfrac{60\; g\; KBr}{(60+100)\;g\; solution} = 40\%\]
Q11.4.5
Espera-se que qual dos seguintes gases seja mais solúvel em água? Explique seu raciocínio.
- CH 4
- CCl 4
- CHCl 3
S 11.4.5
(c) Espera-se que o CHCl 3 seja mais solúvel em água. Dos três gases, apenas este é polar e, portanto, capaz de experimentar uma atração dipolo-dipolo relativamente forte por moléculas de água.
Q11.4.6
A 0 °C e 1,00 atm, até 0,70 g de O 2 podem se dissolver em 1 L de água. A 0 °C e 4,00 atm, quantos gramas de O 2 se dissolvem em 1 L de água?
S11.4.6
Esse problema requer a aplicação da lei de Henry. A equação governante é\(C_g = kP_g\).
\[k=\dfrac{C_g}{P_g}=\dfrac{0.70\;g}{1.00\; atm} =0.70\;g\; atm^{−1}\]
Sob as novas condições,\(C_g=0.70\;g\;atm^{−1} \times 4.00\; atm = 2.80\; g\).
Q11.4.7
Consulte a figura a seguir para as três perguntas a seguir:

- Como a concentração de CO 2 dissolvido na bebida mudou quando a garrafa foi aberta?
- O que causou essa mudança?
- A bebida é insaturada, saturada ou supersaturada com CO 2?
S11.4.7
(a) Diminuiu à medida que parte do gás CO 2 saiu da solução (evidenciada pela efervescência). (b) A abertura da garrafa liberou o gás CO 2 de alta pressão acima da bebida. A pressão reduzida do gás CO 2, de acordo com a lei de Henry, diminui a solubilidade do CO 2. (c) A concentração de CO 2 dissolvido continuará a diminuir lentamente até que o equilíbrio seja restabelecido entre a bebida e a pressão muito baixa do gás CO 2 na garrafa aberta. Imediatamente após a abertura, a bebida, portanto, contém CO 2 dissolvido em uma concentração maior que sua solubilidade, uma condição de não equilíbrio, e é considerada supersaturada.
Q11.4.8
A constante da lei de Henry para CO 2 está\(3.4 \times 10^{−2}\; M/atm\) a 25 °C. Qual pressão de dióxido de carbono é necessária para manter uma concentração de CO 2 de 0,10 M em uma lata de refrigerante de limão e limão?
S11.4.8
\[P_g=\dfrac{C_g}{k}=\dfrac{0.10\; M}{3.4 \times 10^{−2}\;M/atm} =2.9\; atm\]
Q11.4.9
A constante da lei de Henry para O 2 está\(1.3\times 10^{−3}\; M/atm\) a 25 °C. Qual massa de oxigênio seria dissolvida em um aquário de 40 L a 25 °C, assumindo uma pressão atmosférica de 1,00 atm, e que a pressão parcial de O 2 é de 0,21 atm?
S 11.4.9
Comece com a lei de Henry
\[C_g=kP_g\]
e aplique-o a\(O_2\)
\[C(O_2)=(1.3 \times 10^{−3}\; M/atm) (0.21\;atm)=2.7 \times 10^{−4}\;mol/L\]
A quantidade total é\ ((2.7\ times 10^ {−4}\; mol/L) (40\; L=1,08\ times 10^ {−2}\; mol\]
A massa de oxigênio é\((1.08 \times 10^{−2}\; mol)(32.0\; g/mol)=0.346\;g\)
ou, usando dois números significativos,\(0.35\; g\).
Q11.4.10
Quantos litros de gás HCl, medidos a 30,0 °C e 745 torr, são necessários para preparar 1,25 L de uma solução de 3,20 M de ácido clorídrico?
S11.4.10
Primeiro, calcule os moles de HCl necessários. Em seguida, use a lei do gás ideal para encontrar o volume necessário.
M = mol L−1
3,20 m = xmol 1,25 L
x = 4,00 mol de HCl
Antes de usar a lei do gás ideal, altere a pressão para atmosferas e converta a temperatura de °C para kelvin.
\ [1\; atmx = 760 torr745 torr
x = 0,9803 atm
V = nRTP = (4.000 molCl) (0,08206 Latmk−1 mol−1) (303,15 K) 0,9803 atm = 102 L HCl
102 L de HCl
mais http://cnx.org/contents/ 2488FW6w @2 /Solubility
11.5: Propriedades coligativas
Q11.5.1
O que é/fazem parte do domínio macroscópico das soluções e o que é/fazem parte do domínio microscópico: elevação do ponto de ebulição, lei de Henry, ligação de hidrogênio, atração ião-dipolo, molaridade, não eletrólito, composto não estequiométrico, osmose, íon solvatado?
Q11.5.2
Qual é a explicação microscópica para o comportamento macroscópico ilustrado em [link]?
S11.5.2
A força das ligações entre moléculas semelhantes é mais forte do que a força entre moléculas diferentes. Portanto, existirão algumas regiões nas quais as moléculas de água excluirão as moléculas de óleo e outras regiões nas quais as moléculas de óleo excluirão as moléculas de água, formando uma região heterogênea.
Q11.5.3
Esboce um gráfico qualitativo da pressão versus tempo do vapor de água acima de uma amostra de água pura e uma solução de açúcar, à medida que os líquidos evaporam até a metade do volume original.
Q11.5.4
Uma solução de nitrato de potássio, um eletrólito e uma solução de glicerina (C 3 H 5 (OH) 3), um não eletrólito, fervem a 100,3 °C. Quais outras propriedades físicas das duas soluções são idênticas?
S 11.5.4
Ambos formam soluções homogêneas; suas elevações do ponto de ebulição são as mesmas, assim como a redução das pressões de vapor. A pressão osmótica e a redução do ponto de congelamento também são as mesmas para ambas as soluções.
Q11.5.5
Quais são as frações molares de H 3 PO 4 e água em uma solução de 14,5 g de H 3 PO 4 em 125 g de água?
Q11.5.6
Quais são as frações molares de HNO 3 e água em uma solução concentrada de ácido nítrico (68,0% de HNO 3 em massa)?
S 11.5.6
- Encontre o número de moles de HNO 3 e H 2 O em 100 g da solução. Encontre as frações molares dos componentes.
- A fração molar do HNO 3 é 0,378. A fração molar de H 2 O é 0,622.
Q11.5.7
Calcule a fração molar de cada soluto e solvente:
- 583 g de H 2 SO 4 em 1,50 kg de água — a solução ácida usada em uma bateria de automóvel
- 0,86 g de NaCl em 1,00 × 10 2 g de água — uma solução de cloreto de sódio para injeção intravenosa
- 46,85 g de codeína, C 18 H 21 NO 3, em 125,5 g de etanol, C 2 H 5 OH
- 25 g de I 2 em 125 g de etanol, C 2 H 5 OH
S 11.5.7
uma.\(583\:g\:\ce{H2SO4}\times\dfrac{1\:mole\:\ce{H2SO4}}{98.08\:g\:\ce{H2SO4}}=5.94\:mole\:\ce{H2SO4}\)\(\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\)\(1.50\:kg\:\ce{H2O}\times\dfrac{1000\:g}{1\:kg}\times\dfrac{1\:mole\:\ce{H2O}}{18.02\:g\:\ce{H2O}}=83.2\:moles\:\ce{H2O}\)
Q11.5.8
Calcule a fração molar de cada soluto e solvente:
- 0,710 kg de carbonato de sódio (soda de lavagem), Na 2 CO 3, em 10,0 kg de água — uma solução saturada a 0 °C
- 125 g de NH 4 NO 3 em 275 g de água — uma mistura usada para fazer uma bolsa de gelo instantânea
- 25 g de Cl 2 em 125 g de diclorometano, CH 2 Cl 2
- 0,372 g de histamina, C 5 H 9 N, em 125 g de clorofórmio, CHCl 3
S 11.5.8
- \(X_\mathrm{Na_2CO_3}=0.0119\);\(X_\mathrm{H_2O}=0.988\);
- \(X_\mathrm{NH_4NO_3}=0.9927\);\(X_\mathrm{H_2O}=0.907\);
- \(X_\mathrm{Cl_2}=0.192\);\(X_\mathrm{CH_2CI_2}=0.808\);
- \(X_\mathrm{C_5H_9N}=0.00426\);\(X_\mathrm{CHCl_3}=0.997\)
Q11.5.9
Calcule as frações molares de metanol, CH 3 OH; etanol, C 2 H 5 OH; e água em uma solução que é 40% de metanol, 40% de etanol e 20% de água em massa. (Suponha que os dados sejam bons para dois números significativos.)
Q11.5.10
Qual é a diferença entre uma solução de 1 M e uma solução de 1 m?
S 11.5.10
Em uma solução de 1 M, a toupeira está contida em exatamente 1 L de solução. Em uma solução de 1 m, a toupeira está contida em exatamente 1 kg de solvente.
Q11.5.11
Qual é a molalidade do ácido fosfórico, H 3 PO 4, em uma solução de 14,5 g de H 3 PO 4 em 125 g de água?
Q11.5.12
Qual é a molalidade do ácido nítrico em uma solução concentrada de ácido nítrico (68,0% de HNO 3 em massa)?
S 11.5.12
(a) Determine a massa molar do HNO 3. Determine o número de moles de ácido na solução. A partir do número de moles e da massa do solvente, determine a molalidade. (b) 33,7 mm
Q11.5.13
Calcule a molalidade de cada uma das seguintes soluções:
- 583 g de H 2 SO 4 em 1,50 kg de água — a solução ácida usada em uma bateria de automóvel
- 0,86 g de NaCl em 1,00 × 10 2 g de água — uma solução de cloreto de sódio para injeção intravenosa
- 46,85 g de codeína, C 18 H 21 NO 3, em 125,5 g de etanol, C 2 H 5 OH
- 25 g de I 2 em 125 g de etanol, C 2 H 5 OH
Q11.5.14
Calcule a molalidade de cada uma das seguintes soluções:
- 0,710 kg de carbonato de sódio (refrigerante de lavagem), Na 2 CO 3, em 10,0 kg de água — uma solução saturada a 0°C
- 125 g de NH 4 NO 3 em 275 g de água — uma mistura usada para fazer uma bolsa de gelo instantânea
- 25 g de Cl 2 em 125 g de diclorometano, CH 2 Cl 2
- 0,372 g de histamina, C 5 H 9 N, em 125 g de clorofórmio, CHCl 3
S 11.5.14
(a) 6,70 × 10 −1 m; (b) 5,67 m; (c) 2,8 m; (d) 0,0358 m
Q11.5.15
A concentração de glicose, C 6 H 12 O 6, no fluido espinhal normal é\(\mathrm{\dfrac{75\:mg}{100\:g}}\). Qual é a molalidade da solução?
Q11.5.16
Uma solução de 13,0% de K 2 CO 3 em massa tem uma densidade de 1,09 g/cm 3. Calcule a molalidade da solução.
S 11.5.16
1,08 m
Q11.5.17
- Por que 1 mol de cloreto de sódio deprime o ponto de congelamento de 1 kg de água quase duas vezes mais do que 1 mol de glicerina?
- Qual é o ponto de ebulição de uma solução de 115,0 g de sacarose, C 12 H 22 O 11, em 350,0 g de água?
S 11.5.17
- Determine a massa molar da sacarose; determine o número de moles de sacarose na solução; converta a massa do solvente em unidades de quilogramas; a partir do número de moles e da massa do solvente, determine a molalidade; determine a diferença entre o ponto de ebulição da água e o ponto de ebulição do solução; determine o novo ponto de ebulição.
- 100,5 °C
Q11.5.18
Qual é o ponto de ebulição de uma solução de 9,04 g de I 2 em 75,5 g de benzeno, assumindo que o I 2 não é volátil?
Q11.5.19
Qual é a temperatura de congelamento de uma solução de 115,0 g de sacarose, C 12 H 22 O 11, em 350,0 g de água, que congela a 0,0 °C quando pura?
S11.5.19
(a) Determine a massa molar da sacarose; determine o número de moles de sacarose na solução; converta a massa do solvente em unidades de quilogramas; a partir do número de moles e da massa do solvente, determine a molalidade; determine a diferença entre a temperatura de congelamento da água e o congelamento temperatura da solução; determine a nova temperatura de congelamento. (b) −1,8 °C
Q11.5.20
Qual é o ponto de congelamento de uma solução de 9,04 g de I 2 em 75,5 g de benzeno?
Q11.5.21
Qual é a pressão osmótica de uma solução aquosa de 1,64 g de Ca (NO 3) 2 em água a 25 °C? O volume da solução é 275 mL.
S 11.5.21
(a) Determine a massa molar de Ca (NO 3) 2; determine o número de moles de Ca (NO 3) 2 na solução; determine o número de moles de íons na solução; determine a molaridade dos íons e, em seguida, a pressão osmótica. (b) 2,67 atm
Q11.5.22
Qual é a pressão osmótica de uma solução de insulina bovina (massa molar, 5700 g mol −1) a 18 °C se 100,0 mL da solução contém 0,103 g da insulina?
Q11.5.23
Qual é a massa molar de uma solução de 5,00 g de um composto em 25,00 g de tetracloreto de carbono (bp 76,8 °C; K b = 5,02 °C/ m) que ferve a 81,5 °C a 1 atm?
S 11.5.24
(a) Determine a concentração molal a partir da mudança no ponto de ebulição e K b; determine os moles de soluto na solução a partir da concentração molal e da massa do solvente; determine a massa molar a partir do número de moles e da massa do soluto. (b) 2,1 × 10 2 g mol −1
Q11.5.25
Uma amostra de um composto orgânico (um não eletrólito) pesando 1,35 g reduziu o ponto de congelamento de 10,0 g de benzeno em 3,66 °C. Calcule a massa molar do composto.
Q11.5.26
Uma solução de 1,0 m de HCl em benzeno tem um ponto de congelamento de 0,4 °C. O HCl é um eletrólito no benzeno? Explique.
S 11.5.26
Não. O benzeno puro congela a 5,5 °C e, portanto, o ponto de congelamento observado desta solução é deprimido por ΔT f = 5,5 − 0,4 = 5,1 °C. O valor calculado, assumindo que não há ionização de HCl, é ΔT f = (1,0 m) (5,14 °C/ m) = 5,1 °C. Concordância desses valores apoia a suposição de que o HCl não é ionizado.
Q11.5.27
Uma solução contém 5,00 g de ureia, CO (NH 2) 2, um composto não volátil, dissolvido em 0,100 kg de água. Se a pressão de vapor da água pura a 25 °C for de 23,7 torr, qual é a pressão de vapor da solução?
Q11.5.28
Uma amostra de 12,0 g de um não eletrólito é dissolvida em 80,0 g de água. A solução congela a −1,94 °C. Calcule a massa molar da substância.
S 11.5.28
144 g mol −1
Q11.5.29
Organize as seguintes soluções em ordem de acordo com seus pontos de congelamento decrescentes: 0,1 m Na 3 PO 4, 0,1 m C 2 H 5 OH, 0,01 m CO 2, 0,15 m NaCl e 0,2 m CaCl 2.
Q11.5.30
Calcule a elevação do ponto de ebulição de 0,100 kg de água contendo 0,010 mol de NaCl, 0,020 mol de Na 2 SO 4 e 0,030 mol de MgCl 2, assumindo a dissociação completa desses eletrólitos.
S 11.5.30
0,870 °C
Q11.5.31
Como você poderia preparar uma solução aquosa de 3,08 m de glicerina, C 3 H 8 O 3? Qual é o ponto de congelamento dessa solução?
Q11.5.32
Uma amostra de enxofre pesando 0,210 g foi dissolvida em 17,8 g de dissulfeto de carbono, CS 2 (K b = 2,43 °C/ m). Se a elevação do ponto de ebulição foi de 0,107° C, qual é a fórmula de uma molécula de enxofre no dissulfeto de carbono?
S11.5.32
S 8
Q11.5.33
Em um experimento significativo realizado há muitos anos, 5.6977 g de iodeto de cádmio em 44,69 g de água elevaram o ponto de ebulição de 0,181 °C. O que isso sugere sobre a natureza de uma solução de CDi 2?
Q11.5.34
A lisozima é uma enzima que corta as paredes celulares. Uma amostra de 0,100 L de uma solução de lisozima que contém 0,0750 g da enzima exibe uma pressão osmótica de 1,32 × 10 −3 atm a 25 °C. Qual é a massa molar da lisozima?
S 11.5.34
1,39 × 10 x 4 g mol −1
Q11.5.35
A pressão osmótica de uma solução contendo 7,0 g de insulina por litro é de 23 torr a 25 °C. Qual é a massa molar da insulina?
Q11.5.36
A pressão osmótica do sangue humano é de 7,6 atm a 37 °C. Qual massa de glicose, C 6 H 12 O 6, é necessária para produzir 1,00 L de solução aquosa para alimentação intravenosa se a solução deve ter a mesma pressão osmótica do sangue à temperatura corporal, 37 °C?
S 11.5.36
54 g
Q11.5.37
Qual é o ponto de congelamento de uma solução de dibromobenzeno, C 6 H 4 Br 2, em 0,250 kg de benzeno, se a solução ferve a 83,5 °C?
Q11.5.38
Qual é o ponto de ebulição de uma solução de NaCl em água se a solução congelar a −0,93 °C?
S 11.5.38
100,26 °C
Q11.5.39
O açúcar frutose contém 40,0% de C, 6,7% de H e 53,3% de O em massa. Uma solução de 11,7 g de frutose em 325 g de etanol tem um ponto de ebulição de 78,59 °C. O ponto de ebulição do etanol é 78,35 °C e K b para o etanol é 1,20 °C/ m. Qual é a fórmula molecular da frutose?
Q11.5.40
A pressão de vapor do metanol, CH 3 OH, é de 94 torr a 20 °C. A pressão de vapor do etanol, C 2 H 5 OH, é de 44 torr na mesma temperatura.
- Calcular a fração molar de metanol e etanol em uma solução de 50,0 g de metanol e 50,0 g de etanol.
- O etanol e o metanol formam uma solução que se comporta como uma solução ideal. Calcular a pressão de vapor do metanol e do etanol acima da solução a 20 °C.
- Calcule a fração molar do metanol e do etanol no vapor acima da solução.
S 11.5.40
(a)\(X_\mathrm{CH_3OH}=0.590\);\(X_\mathrm{C_2H_5OH}=0.410\); (b) As pressões de vapor são: CH 3 OH: 55 torr; C 2 H 5 OH: 18 torr; (c) CH 3 OH: 0,75; C 2 H 5 OH: 0,25
Q11.5.41
O ponto triplo da água sem ar é definido como 273,15 K. Por que é importante que a água esteja livre de ar?
Q11.5.42
A carne pode ser classificada como fresca (não congelada), embora seja armazenada a −1 °C. Por que a carne não congelaria nessa temperatura?
S 11.5.42
Os íons e compostos presentes na água da carne bovina reduzem o ponto de congelamento da carne abaixo de -1° C.
Q11.5.43
Um composto orgânico tem uma composição de 93,46% C e 6,54% de H em massa. Uma solução de 0,090 g deste composto em 1,10 g de cânfora derrete a 158,4 °C. O ponto de fusão da cânfora pura é 178,4 °C. K f para cânfora é 37,7 °C/ m. Qual é a fórmula molecular do soluto? Mostre seus cálculos.
Q11.5.44
Uma amostra de HgCl 2 pesando 9,41 g é dissolvida em 32,75 g de etanol, C 2 H 5 OH (K b = 1,20 °C/ m). A elevação do ponto de ebulição da solução é de 1,27 °C. O HgCl 2 é um eletrólito em etanol? Mostre seus cálculos.
S 11.5.44
\(\mathrm{Δbp}=K_\ce{b}m=(1.20\:°\ce C/m)\mathrm{\left(\dfrac{9.41\:g×\dfrac{1\:mol\: HgCl_2}{271.496\:g}}{0.03275\:kg}\right)=1.27\:°\ce C}\)
A mudança observada é igual à mudança teórica; portanto, nenhuma dissociação ocorre.
Q11.5.45
Sabe-se que um sal é um fluoreto de metal alcalino. Uma rápida determinação aproximada do ponto de congelamento indica que 4 g do sal dissolvido em 100 g de água produzem uma solução que congela a cerca de −1,4 °C. Qual é a fórmula do sal? Mostre seus cálculos.
11.6: Colóides
Q11.6.1
Identifique a fase dispersa e o meio de dispersão em cada um dos seguintes sistemas coloidais: dispersão de amido, fumaça, neblina, pérola, chantilly, sabonete flutuante, geleia, leite e rubi.
S11.6.1
| Sistema coloidal | Fase dispersa | Meio de dispersão |
|---|---|---|
| dispersão de amido | amido | água |
| fumaça | partículas sólidas | ar |
| neblina | água | ar |
| pérola | água | carbonato de cálcio (CaCO 3) |
| chantilly | ar | creme |
| sabonete flutuante | ar | sabonete |
| água-viva | suco de frutas | gel de pectina |
| leite | gordura da manteiga | água |
| rubi | óxido de cromo (III) (Cr 2 O 3) | óxido de alumínio (Al 2 O 3) |
Q11.6.2
Faça a distinção entre métodos de dispersão e métodos de condensação para preparar sistemas coloidais.
S11.6.2
Os métodos de dispersão usam um dispositivo de moagem ou algum outro meio para provocar a subdivisão de partículas maiores. Os métodos de condensação unem unidades menores para formar uma unidade maior. Por exemplo, moléculas de água no estado de vapor se juntam para formar gotículas muito pequenas que vemos como nuvens.
Q11.6.3
Como os coloides diferem das soluções em relação ao tamanho e homogeneidade das partículas dispersas?
S11.6.3
As dispersões coloidais consistem em partículas que são muito maiores do que os solutos das soluções típicas. As partículas coloidais são moléculas muito grandes ou agregados de espécies menores que geralmente são grandes o suficiente para dispersar a luz. Os colóides são homogêneos em uma escala macroscópica (visual), enquanto as soluções são homogêneas em uma escala microscópica (molecular).
Q11.6.4
Explique a ação de limpeza do sabonete.
S 11.6.4
As moléculas de sabão têm uma extremidade hidrofóbica e uma hidrofílica. A extremidade carregada (hidrofílica), geralmente associada a um íon de metal alcalino, garante a solubilidade em água. A extremidade hidrofóbica permite a atração por óleo, graxa e outras substâncias não polares similares que normalmente não se dissolvem na água, mas são puxadas para a solução pelas moléculas de sabão.
Q11.6.5
Como se pode demonstrar que as partículas coloidais são carregadas eletricamente?
S 11.6.5
Se forem colocadas em uma célula eletrolítica, as partículas dispersas se moverão em direção ao eletrodo que carrega uma carga oposta à sua própria carga. Nesse eletrodo, as partículas carregadas serão neutralizadas e coagularão como um precipitado.


