11.5: Colóides
- Page ID
- 184851
- Descreva a composição e as propriedades das dispersões coloidais
- Listar e explicar várias aplicações tecnológicas dos colóides
Quando criança, você pode ter feito suspensões como misturas de lama e água, farinha e água ou uma suspensão de pigmentos sólidos em água, conhecida como tinta de têmpera. Essas suspensões são misturas heterogêneas compostas por partículas relativamente grandes que são visíveis (ou que podem ser vistas com uma lupa). Eles ficam turvos e as partículas em suspensão se depositam após a mistura. Por outro lado, quando fazemos uma solução, preparamos uma mistura homogênea na qual não ocorre sedimentação e na qual as espécies dissolvidas são moléculas ou íons. As soluções apresentam um comportamento completamente diferente das suspensões. Uma solução pode ser colorida, mas é transparente, as moléculas ou íons são invisíveis e não se depositam em pé. Um grupo de misturas chamadas coloides (ou dispersões coloidais) exibem propriedades intermediárias entre as de suspensões e soluções (Figura\(\PageIndex{1}\)). As partículas em um colóide são maiores do que a maioria das moléculas simples; no entanto, as partículas coloidais são pequenas o suficiente para não se depositarem ao ficarem em pé.

As partículas em um colóide são grandes o suficiente para dispersar a luz, um fenômeno chamado efeito Tyndall. Isso pode fazer com que as misturas coloidais pareçam turvas ou opacas, como os feixes de holofotes mostrados na Figura\(\PageIndex{2}\). As nuvens são misturas coloidais. Eles são compostos por gotículas de água que são muito maiores que as moléculas, mas que são pequenas o suficiente para não se depositarem.

O termo “colóide” — das palavras gregas kolla, que significa “cola”, e eidos, que significa “gostar” — foi usado pela primeira vez em 1861 por Thomas Graham para classificar misturas como amido em água e gelatina. Muitas partículas coloidais são agregados de centenas ou milhares de moléculas, mas outras (como proteínas e moléculas de polímero) consistem em uma única molécula extremamente grande. As moléculas de proteína e polímero sintético que formam colóides podem ter massas moleculares que variam de alguns milhares a muitos milhões de unidades de massa atômica.
De forma análoga à identificação dos componentes da solução como “soluto” e “solvente”, os componentes de um colóide também são classificados de acordo com suas quantidades relativas. O componente particulado normalmente presente em uma quantidade relativamente pequena é chamado de fase dispersa e a substância ou solução por toda a qual a partícula é dispersa é chamada de meio de dispersão. Os coloides podem envolver praticamente qualquer combinação de estados físicos (gás em líquido, líquido em sólido, sólido em gás, etc.), conforme ilustrado pelos exemplos de sistemas coloidais apresentados na Tabela\(\PageIndex{1}\).
| Fase dispersa | Meio de dispersão | Exemplos comuns | Nome |
|---|---|---|---|
| sólido | gás | fumaça, poeira | — |
| sólido | líquido | amido na água, algumas tintas, tintas, leite de magnésia | sol |
| sólido | sólido | algumas gemas coloridas, algumas ligas | — |
| líquido | gás | nuvens, nevoeiros, névoas, sprays | aerosol |
| líquido | líquido | leite, maionese, manteiga | emulsão |
| líquido | sólido | geleias, géis, pérola, opala (H 2 O em SiO 2) | gel |
| gás | líquido | espumas, chantilly, clara de ovo batida | espuma |
| gás | sólido | pedra-pomes, sabonetes flutuantes | — |
Preparação de sistemas coloidais
Podemos preparar um sistema coloidal produzindo partículas de dimensões coloidais e distribuindo essas partículas por um meio de dispersão. Partículas de tamanho coloidal são formadas por dois métodos:
- Métodos de dispersão: ou seja, quebrando partículas maiores. Por exemplo, os pigmentos de tinta são produzidos pela dispersão de partículas grandes por moagem em moinhos especiais.
- Métodos de condensação: ou seja, crescimento a partir de unidades menores, como moléculas ou íons. Por exemplo, as nuvens se formam quando as moléculas de água se condensam e formam gotículas muito pequenas.
Algumas substâncias sólidas, quando colocadas em contato com a água, se dispersam espontaneamente e formam sistemas coloidais. Gelatina, cola, amido e leite em pó desidratado se comportam dessa maneira. As partículas já são de tamanho coloidal; a água simplesmente as dispersa. Partículas de leite em pó de tamanho coloidal são produzidas pela desidratação do spray de leite. Alguns atomizadores produzem dispersões coloidais de um líquido no ar.
Podemos preparar uma emulsão agitando juntos ou misturando dois líquidos imiscíveis. Isso quebra um líquido em gotículas de tamanho coloidal, que então se dispersam por todo o outro líquido. Os derramamentos de óleo no oceano podem ser difíceis de limpar, em parte porque a ação das ondas pode fazer com que o óleo e a água formem uma emulsão. Em muitas emulsões, no entanto, a fase dispersa tende a se aglutinar, formar grandes gotas e se separar. Portanto, as emulsões geralmente são estabilizadas por um agente emulsificante, uma substância que inibe a coalescência do líquido disperso. Por exemplo, um pouco de sabão estabilizará uma emulsão de querosene na água. O leite é uma emulsão de gordura de manteiga em água, com a proteína caseína como agente emulsificante. A maionese é uma emulsão de óleo em vinagre, com componentes de gema de ovo como agentes emulsionantes.
Os métodos de condensação formam partículas coloidais por agregação de moléculas ou íons. Se as partículas crescerem além da faixa de tamanho coloidal, gotas ou precipitados se formarão e nenhum sistema coloidal resultará. As nuvens se formam quando as moléculas de água se agregam e formam partículas do tamanho de coloides. Se essas partículas de água se fundirem para formar gotas de água líquida adequadamente grandes ou cristais de água sólida, elas se depositam no céu como chuva, granizo ou neve. Muitos métodos de condensação envolvem reações químicas. Podemos preparar uma suspensão coloidal vermelha de hidróxido de ferro (III) misturando uma solução concentrada de cloreto de ferro (III) com água quente:
\[\mathrm{Fe^{3+}}_{(aq)}+\mathrm{3Cl^-}_{(aq)}+\mathrm{6H_2O}_{(l)}⟶\mathrm{Fe(OH)}_{3(s)}+\mathrm{H_3O^+}_{(aq)}+\mathrm{3Cl^-}_{(aq)} \label{11.6.1} \]
Um sol de ouro coloidal resulta da redução de uma solução muito diluída de cloreto de ouro (III) por um agente redutor, como formaldeído, cloreto de estanho (II) ou sulfato de ferro (II):
\[\ce{Au}^{3+}+ \ce{3e}^− \rightarrow \ce{Au} \label{11.6.2} \]
Alguns solos de ouro preparados em 1857 ainda estão intactos (as partículas não se uniram e não se depositaram), ilustrando a estabilidade a longo prazo de muitos coloides.
Sabões e detergentes
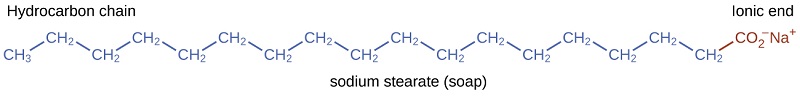
Os pioneiros fabricavam sabão fervendo gorduras com uma solução fortemente básica feita pela lixiviação de carbonato de potássio\(\ce{K_2CO_3}\), a partir de cinzas de madeira com água quente. As gorduras animais contêm poliésteres de ácidos graxos (ácidos carboxílicos de cadeia longa). Quando as gorduras animais são tratadas com uma base como carbonato de potássio ou hidróxido de sódio, formam-se glicerol e sais de ácidos graxos, como ácido palmítico, oleico e esteárico. Os sais dos ácidos graxos são chamados de sabonetes. O sal de sódio do ácido esteárico, estearato de sódio, tem a fórmula\(\ce{C_{17}H_{35}CO_2Na}\) e contém uma cadeia de hidrocarboneto não polar não carregada, a\(\mathrm{C_{17}H_{35}-}\) unidade, e um grupo carboxilato iônico, a\(-\mathrm{\sideset{ }{_{2}^{-}}{CO}}\) unidade (Figura\(\PageIndex{3}\)).
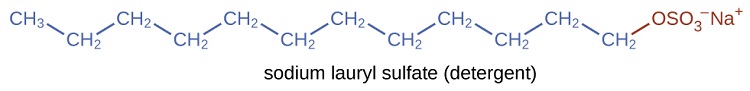
Os detergentes (substitutos do sabão) também contêm cadeias de hidrocarbonetos não polares\(\mathrm{C_{12}H_{25}—}\), como, e um grupo iônico, como um sulfato\(—\mathrm{\sideset{ }{_{3}^{-}}{OSO}}\) ou um sulfonato\(—\mathrm{\sideset{ }{_{3}^{-}}{SO}}\) (Figura\(\PageIndex{4}\)). Os sabonetes formam compostos insolúveis de cálcio e magnésio em água dura; os detergentes formam produtos solúveis em água — uma vantagem definitiva para os detergentes.
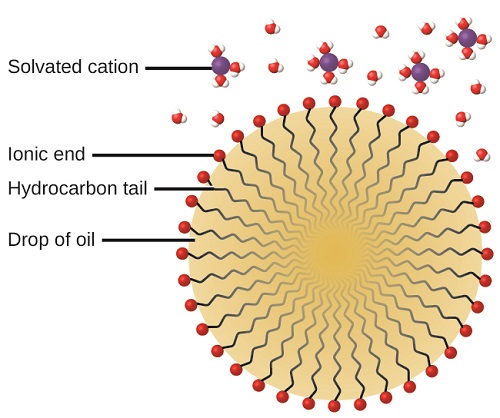
A ação de limpeza de sabonetes e detergentes pode ser explicada em termos das estruturas das moléculas envolvidas. A extremidade hidrocarboneta (não polar) de uma molécula de sabão ou detergente se dissolve ou é atraída por substâncias não polares, como óleo, graxa ou partículas de sujeira. A extremidade iônica é atraída pela água (polar), ilustrada na Figura\(\PageIndex{5}\). Como resultado, as moléculas de sabão ou detergente se orientam na interface entre as partículas de sujeira e a água, de modo que atuam como uma espécie de ponte entre dois tipos diferentes de matéria, a apolar e a polar. Moléculas como essa são denominadas anfifílicas, pois têm uma parte hidrofóbica (“temente a água”) e uma parte hidrofílica (“amante da água”). Como consequência, as partículas de sujeira ficam suspensas como partículas coloidais e são facilmente lavadas.
A explosão da plataforma de perfuração de petróleo Deepwater Horizon, em 20 de abril de 2010, no Golfo do México, perto do Mississippi, deu início ao maior vazamento de óleo marinho na história do petróleo. Nos 87 dias após a explosão, cerca de 4,9 milhões de barris (210 milhões de galões) de óleo fluíram do poço rompido 5000 pés abaixo da superfície da água. O poço foi finalmente declarado lacrado em 19 de setembro de 2010.
O petróleo bruto é imiscível e menos denso que a água, então o óleo derramado subiu à superfície da água. Barcos flutuantes, navios skimmer e queimaduras controladas foram usados para remover o óleo da superfície da água na tentativa de proteger praias e áreas úmidas ao longo da costa do Golfo. Além da remoção do óleo, também foram feitas tentativas para diminuir seu impacto ambiental, tornando-o “solúvel” (no sentido vago do termo) e, assim, permitindo que seja diluído para níveis esperançosamente menos nocivos pelo grande volume de água do oceano. Essa abordagem usou 1,84 milhão de galões do dispersante de óleo Corexit 9527, a maioria dos quais foi injetada debaixo d'água no local do vazamento, com pequenas quantidades sendo pulverizadas sobre o derramamento. O Corexit 9527 contém 2-butoxietanol (C 6 H 14 O 2), uma molécula anfifílica cujas extremidades polares e não polares são úteis para emulsificar o óleo em pequenas gotículas, aumentando a área da superfície do óleo e tornando-o mais disponível para digestão de bactérias marinhas (Figura \(\PageIndex{6}\)). Embora essa abordagem evite muitos dos riscos imediatos que o petróleo a granel representa para os ecossistemas marinhos e costeiros, ela introduz a possibilidade de efeitos de longo prazo resultantes da introdução dos componentes complexos e potencialmente tóxicos do petróleo na cadeia alimentar do oceano. Várias organizações estão envolvidas no monitoramento do impacto estendido desse derramamento de óleo, incluindo a Administração Nacional Oceânica e Atmosférica.

Propriedades elétricas de partículas coloidais
As partículas coloidais dispersas geralmente são carregadas eletricamente. Uma partícula coloidal de hidróxido de ferro (III), por exemplo, não contém íons hidróxido suficientes para compensar exatamente as cargas positivas nos íons ferro (III). Assim, cada partícula coloidal individual carrega uma carga positiva, e a dispersão coloidal consiste em partículas coloidais carregadas e alguns íons hidróxido livres, que mantêm a dispersão eletricamente neutra. A maioria dos coloides de hidróxido de metal tem cargas positivas, enquanto a maioria dos metais e sulfetos metálicos formam dispersões carregadas negativamente. Todas as partículas coloidais em qualquer sistema têm cargas do mesmo sinal. Isso ajuda a mantê-los dispersos porque partículas contendo cargas semelhantes se repelem.
Podemos aproveitar a carga nas partículas coloidais para removê-las de uma variedade de misturas. Se colocarmos uma dispersão coloidal em um recipiente com eletrodos carregados, partículas carregadas positivamente, como partículas de hidróxido de ferro (III), se moverão para o eletrodo negativo. Lá, as partículas coloidais perdem a carga e coagulam como um precipitado.
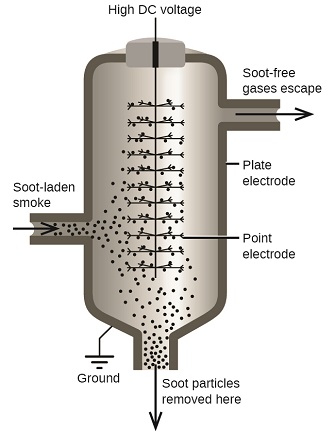
As partículas de carbono e poeira na fumaça são frequentemente dispersas coloidalmente e carregadas eletricamente. As partículas carregadas são atraídas por eletrodos altamente carregados, onde são neutralizadas e depositadas como poeira (Figura\(\PageIndex{7}\). Esse é um dos métodos importantes usados para limpar a fumaça de uma variedade de processos industriais. O processo também é importante na recuperação de produtos valiosos da fumaça e do pó de combustão de fundições, fornos e fornos. Também existem filtros de ar iônicos projetados para uso doméstico para melhorar a qualidade do ar interno.
Géis
Quando fazemos gelatina, como gelatina, estamos fazendo um tipo de colóide (Figura\(\PageIndex{8}\)). A gelatina é resfriada porque a mistura aquosa quente de gelatina coagula à medida que esfria e toda a massa, incluindo o líquido, se transforma em um corpo extremamente viscoso conhecido como gel, um colóide no qual o meio de dispersão é sólido e a fase dispersa é líquida. Parece que as fibras do meio dispersante formam uma complexa rede tridimensional, sendo os interstícios preenchidos com o meio líquido ou com uma solução diluída do meio dispersante. Como a formação de um gel é acompanhada pela absorção de água ou algum outro solvente, diz-se que o gel está hidratado ou solvatado.

A pectina, um carboidrato dos sucos de frutas, é uma substância formadora de gel importante na fabricação de geleias. O gel de sílica, uma dispersão coloidal de dióxido de silício hidratado, é formado quando o ácido clorídrico diluído é adicionado a uma solução diluída de silicato de sódio. Canned Heat é um gel feito pela mistura de álcool e uma solução aquosa saturada de acetato de cálcio.
Resumo
Os coloides são misturas nas quais uma ou mais substâncias são dispersas como partículas sólidas relativamente grandes ou gotículas líquidas em um meio sólido, líquido ou gasoso. As partículas de um colóide permanecem dispersas e não se depositam devido à gravidade, e geralmente são carregadas eletricamente. Os colóides são difundidos na natureza e estão envolvidos em muitas aplicações tecnológicas.
Glossário
- anfifílico
- moléculas que possuem partes hidrofóbicas (não polares) e hidrofílicas (polares)
- colóide
- (também, dispersão coloidal) mistura na qual partículas sólidas ou líquidas relativamente grandes são dispersas uniformemente por um gás, líquido ou sólido
- meio de dispersão
- sólido, líquido ou gás no qual partículas coloidais são dispersas
- fase dispersa
- substância presente como partículas sólidas ou líquidas relativamente grandes em um colóide
- agente emulsionante
- substância anfifílica usada para estabilizar as partículas de algumas emulsões
- emulsão
- colóide formado a partir de líquidos imiscíveis
- gel
- dispersão coloidal de um líquido em um sólido
- Efeito Tyndall
- dispersão da luz visível por uma dispersão coloidal


