9.3: Estequiometria de substâncias gasosas, misturas e reações
- Page ID
- 185439
‣
- Use a lei do gás ideal para calcular densidades de gás e massas molares
- Realizar cálculos estequiométricos envolvendo substâncias gasosas
- Indique a lei de Dalton sobre pressões parciais e use-a em cálculos envolvendo misturas gasosas
O estudo do comportamento químico dos gases foi parte da base talvez da revolução química mais fundamental da história. O nobre francês Antoine Lavoisier, amplamente considerado como o “pai da química moderna”, mudou a química de uma ciência qualitativa para uma quantitativa por meio de seu trabalho com gases. Ele descobriu a lei da conservação da matéria, descobriu o papel do oxigênio nas reações de combustão, determinou a composição do ar, explicou a respiração em termos de reações químicas e muito mais. Ele foi vítima da Revolução Francesa, guilhotinada em 1794. Sobre sua morte, o matemático e astrônomo Joseph-Louis Lagrange disse: “A multidão levou apenas um momento para remover sua cabeça; um século não será suficiente para reproduzi-la”.
Conforme descrito em um capítulo anterior deste texto, podemos recorrer à estequiometria química para obter respostas a muitas das perguntas que perguntam “Quanto?” Podemos responder à pergunta com massas de substâncias ou volumes de soluções. No entanto, também podemos responder a essa pergunta de outra forma: com volumes de gases. Podemos usar a equação ideal do gás para relacionar a pressão, o volume, a temperatura e o número de moles de um gás. Aqui, combinaremos a equação do gás ideal com outras equações para encontrar a densidade do gás e a massa molar. Vamos lidar com misturas de diferentes gases e calcular quantidades de substâncias em reações envolvendo gases. Esta seção não apresentará nenhum material ou ideia nova, mas fornecerá exemplos de aplicações e formas de integrar conceitos que já discutimos.
Densidade de um gás
Lembre-se de que a densidade de um gás é sua relação massa/volume,\(ρ=\dfrac{m}{V}\). Portanto, se pudermos determinar a massa de algum volume de um gás, obteremos sua densidade. A densidade de um gás desconhecido pode ser usada para determinar sua massa molar e, assim, auxiliar em sua identificação. A lei do gás ideal, PV = nRt, nos fornece um meio de derivar essa fórmula matemática para relacionar a densidade de um gás com seu volume na prova mostrada no Exemplo\(\PageIndex{1}\).
Use PV = NrT para derivar uma fórmula para a densidade do gás em g/L
Solução SS
\[PV = nRT \nonumber \]
Reorganize para obter (mol/L):
\[\dfrac{n}{v}=\dfrac{P}{RT} \nonumber \]
Multiplique cada lado da equação pela massa molar,. Quando os moles são multiplicados por em g/mol, g são obtidos:
\[(ℳ)\left(\dfrac{n}{V}\right)=\left(\dfrac{P}{RT}\right)(ℳ) \nonumber \]
\[ℳ/V=ρ=\dfrac{Pℳ}{RT} \nonumber \]
Verificou-se que um gás tem uma densidade de 0,0847 g/L a 17,0 °C e uma pressão de 760 torr. Qual é sua massa molar? O que é o gás?
- Responda
-
\[ρ=\dfrac{Pℳ}{RT} \nonumber \]
\[\mathrm{0.0847\:g/L=760\cancel{torr}×\dfrac{1\cancel{atm}}{760\cancel{torr}}×\dfrac{\mathit{ℳ}}{0.0821\: L\cancel{atm}/mol\: K}×290\: K} \nonumber \]
= 2,02 g/mol; portanto, o gás deve ser hidrogênio (H 2, 2,02 g/mol)
Devemos especificar a temperatura e a pressão de um gás ao calcular sua densidade, porque o número de moles de um gás (e, portanto, a massa do gás) em um litro muda com a temperatura ou a pressão. As densidades do gás são frequentemente relatadas no STP.
Usando a Lei do Gás Ideal e a Densidade de um Gás Ciclopropano, um gás antes usado com oxigênio como anestésico geral, é composto por 85,7% de carbono e 14,3% de hidrogênio em massa. Encontre a fórmula empírica. Se 1,56 g de ciclopropano ocupar um volume de 1,00 L a 0,984 atm e 50 °C, qual é a fórmula molecular do ciclopropano?
Solução
Estratégia:
Primeiro, resolva o problema da fórmula empírica usando os métodos discutidos anteriormente. Suponha 100 g e converta a porcentagem de cada elemento em gramas. Determine o número de moles de carbono e hidrogênio na amostra de 100 g de ciclopropano. Divida pelo menor número de moles para relacionar o número de moles de carbono com o número de moles de hidrogênio. Na última etapa, perceba que a menor proporção de números inteiros é a fórmula empírica:
\[\mathrm{85.7\: g\: C×\dfrac{1\: mol\: C}{12.01\: g\: C}=7.136\: mol\: C\hspace{20px}\dfrac{7.136}{7.136}=1.00\: mol\: C} \nonumber \]
\[\mathrm{14.3\: g\: H×\dfrac{1\: mol\: H}{1.01\: g\: H}=14.158\: mol\: H\hspace{20px}\dfrac{14.158}{7.136}=1.98\: mol\: H} \nonumber \]
A fórmula empírica é CH 2 [massa empírica (EM) de 14,03 g/unidade empírica].
Em seguida, use a equação de densidade relacionada à lei do gás ideal para determinar a massa molar:
\[d=\dfrac{Pℳ}{RT}\hspace{20px}\mathrm{\dfrac{1.56\: g}{1.00\: L}=0.984\: atm×\dfrac{ℳ}{0.0821\: L\: atm/mol\: K}×323\: K} \nonumber \]
= 42,0 g/mol\(\dfrac{ℳ}{Eℳ}=\dfrac{42.0}{14.03}=2.99\), então (3) (CH 2) = C 3 H 6 (fórmula molecular)
O acetileno, um combustível usado nas tochas de solda, é composto por 92,3% de C e 7,7% de H em massa. Encontre a fórmula empírica. Se 1,10 g de acetileno ocupar um volume de 1,00 L a 1,15 atm e 59,5° C, qual é a fórmula molecular do acetileno?
- Responda
-
Fórmula empírica, CH; Fórmula molecular, C 2 H 2
Massa molar de um gás
Outra aplicação útil da lei do gás ideal envolve a determinação da massa molar. Por definição, a massa molar de uma substância é a razão entre sua massa em gramas, m, e sua quantidade em moles, n:
\[ℳ=\mathrm{\dfrac{grams\: of\: substance}{moles\: of\: substance}}=\dfrac{m}{n} \nonumber \]
A equação do gás ideal pode ser reorganizada para isolar n:
\[n=\dfrac{PV}{RT} \nonumber \]
e então combinado com a equação da massa molar para produzir:
\[ℳ=\dfrac{mRT}{PV} \nonumber \]
Essa equação pode ser usada para derivar a massa molar de um gás a partir de medições de sua pressão, volume, temperatura e massa.
A massa molar aproximada de um líquido volátil pode ser determinada por:
- Aquecer uma amostra do líquido em um frasco com um pequeno orifício na parte superior, que converte o líquido em gás que pode escapar pelo orifício
- Removendo o frasco do calor no instante em que o último pedaço de líquido se torna gás, momento em que o frasco será preenchido apenas com amostra gasosa à pressão ambiente
- Selar o frasco e permitir que a amostra gasosa se condense em líquido e, em seguida, pesando o frasco para determinar a massa da amostra (Figura\(\PageIndex{1}\))

Usando este procedimento, uma amostra de gás clorofórmio pesando 0,494 g é coletada em um frasco com um volume de 129 cm 3 a 99,6 °C quando a pressão atmosférica é 742,1 mm Hg. Qual é a massa molar aproximada do clorofórmio?
Solução
Desde
\[ℳ=\dfrac{m}{n} \nonumber \]
e
\[n=\dfrac{PV}{RT} \nonumber \]
substituindo e reorganizando dá
\[ℳ=\dfrac{mRT }{PV} \nonumber \]
depois
\[ℳ=\dfrac{mRT}{PV}=\mathrm{\dfrac{(0.494\: g)×0.08206\: L⋅atm/mol\: K×372.8\: K}{0.976\: atm×0.129\: L}=120\:g/mol} \nonumber \]
Uma amostra de fósforo que pesa 3,243 × 10 −2 g exerce uma pressão de 31,89 kPa em um bulbo de 56,0 mL a 550 °C. Quais são a massa molar e a fórmula molecular do vapor de fósforo?
- Responda
-
124 g/mol P 4
A pressão de uma mistura de gases: Lei de Dalton
A menos que eles reajam quimicamente uns com os outros, os gases individuais em uma mistura de gases não afetam a pressão um do outro. Cada gás individual em uma mistura exerce a mesma pressão que exerceria se estivesse presente sozinho no recipiente (Figura\(\PageIndex{2}\)). A pressão exercida por cada gás individual em uma mistura é chamada de pressão parcial. Essa observação é resumida pela lei das pressões parciais de Dalton: A pressão total de uma mistura de gases ideais é igual à soma das pressões parciais dos gases componentes:
\[P_{Total}=P_A+P_B+P_C+...=\sum_iP_i \nonumber \]
Na equação P Total é a pressão total de uma mistura de gases, P A é a pressão parcial do gás A; P B é a pressão parcial do gás B; P C é a pressão parcial do gás C; e assim por diante.

A pressão parcial do gás A está relacionada à pressão total da mistura gasosa por meio de sua fração molar (X), uma unidade de concentração definida como o número de moles de um componente de uma solução dividido pelo número total de moles de todos os componentes:
\[P_A=X_A×P_{Total}\hspace{20px}\ce{where}\hspace{20px}X_A=\dfrac{n_A}{n_{Total}} \nonumber \]
onde P A, X A e n A são a pressão parcial, a fração molar e o número de moles de gás A, respectivamente, e n Total é o número de moles de todos os componentes da mistura.
Um recipiente de 10,0 L contém 2,50 × 10 −3 mol de H 2, 1,00 × 10 −3 mol de He e 3,00 × 10 −4 mol de Ne a 35 °C.
- Quais são as pressões parciais de cada um dos gases?
- Qual é a pressão total nas atmosferas?
Solução
Os gases se comportam de forma independente, então a pressão parcial de cada gás pode ser determinada a partir da equação ideal do gás, usando\(P=\dfrac{nRT}{V}\):
\[P_\mathrm{H_2}=\mathrm{\dfrac{(2.50×10^{−3}\:mol)(0.08206\cancel{L}atm\cancel{mol^{−1}\:K^{−1}})(308\cancel{K})}{10.0\cancel{L}}=6.32×10^{−3}\:atm} \nonumber \]
\[P_\ce{He}=\mathrm{\dfrac{(1.00×10^{−3}\cancel{mol})(0.08206\cancel{L}atm\cancel{mol^{−1}\:K^{−1}})(308\cancel{K})}{10.0\cancel{L}}=2.53×10^{−3}\:atm} \nonumber \]
\[P_\ce{Ne}=\mathrm{\dfrac{(3.00×10^{−4}\cancel{mol})(0.08206\cancel{L}atm\cancel{mol^{−1}\:K^{−1}})(308\cancel{K})}{10.0\cancel{L}}=7.58×10^{−4}\:atm} \nonumber \]
A pressão total é dada pela soma das pressões parciais:
\[P_\ce{T}=P_\mathrm{H_2}+P_\ce{He}+P_\ce{Ne}=\mathrm{(0.00632+0.00253+0.00076)\:atm=9.61×10^{−3}\:atm} \nonumber \]
Um frasco de 5,73 L a 25 °C contém 0,0388 mol de N 2, 0,147 mol de CO e 0,0803 mol de H 2. Qual é a pressão total no frasco em atmosferas?
- Responda
-
1,137 atm
Aqui está outro exemplo desse conceito, mas lidando com cálculos de fração molar.
Uma mistura gasosa usada para anestesia contém 2,83 mol de oxigênio, O 2 e 8,41 mol de óxido nitroso, N 2 O. A pressão total da mistura é de 192 kPa.
- Quais são as frações molares de O 2 e N 2 O?
- Quais são as pressões parciais de O 2 e N 2 O?
Solução
A fração molar é dada por
\[X_A=\dfrac{n_A}{n_{Total}} \nonumber \]
e a pressão parcial é
\[P_A = X_A \times P_{Total} \nonumber \]
Para O 2,
\[X_{O_2}=\dfrac{n_{O_2}}{n_{Total}}=\mathrm{\dfrac{2.83 mol}{(2.83+8.41)\:mol}=0.252} \nonumber \]
e
\[P_{O_2}=X_{O_2}×P_{Total}=\mathrm{0.252×192\: kPa=48.4\: kPa} \nonumber \]
Para N 2 O,
\[X_{N_2O}=\dfrac{n_{N_2O}}{n_{Total}}=\mathrm{\dfrac{8.41\: mol}{(2.83+8.41)\:mol}=0.748} \nonumber \]
e
\[P_{N_2O}=X_{N_2O}×P_{Total}=\mathrm{(0.748)×192\: kPa = 143.6 \: kPa} \nonumber \]
Qual é a pressão de uma mistura de 0,200 g de H 2, 1,00 g de N 2 e 0,820 g de Ar em um recipiente com volume de 2,00 L a 20 °C?
- Responda
-
1,87 atm
Coleta de gases sobre a água
Uma forma simples de coletar gases que não reagem com a água é capturá-los em uma garrafa que foi enchida com água e invertida em um prato cheio de água. A pressão do gás dentro da garrafa pode ser igualada à pressão do ar externo elevando ou abaixando a garrafa. Quando o nível da água é o mesmo dentro e fora da garrafa (Figura\(\PageIndex{3}\)), a pressão do gás é igual à pressão atmosférica, que pode ser medida com um barômetro.
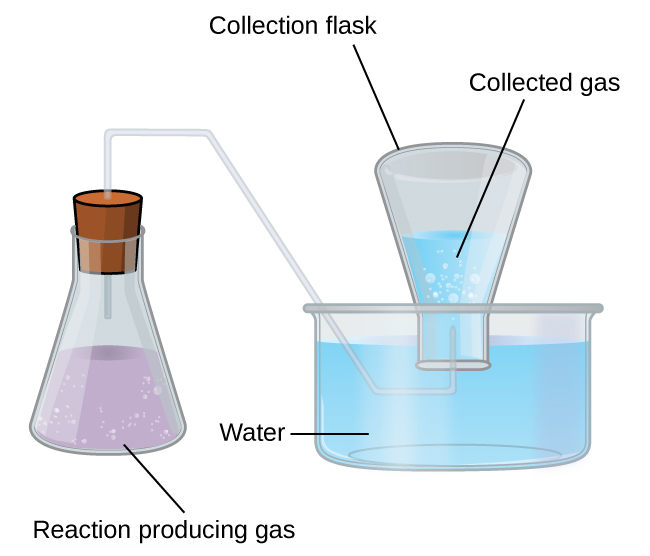
No entanto, há outro fator que devemos considerar ao medir a pressão do gás por esse método. A água evapora e sempre há água gasosa (vapor de água) acima de uma amostra de água líquida. Quando um gás é coletado sobre a água, ele fica saturado com vapor de água e a pressão total da mistura é igual à pressão parcial do gás mais a pressão parcial do vapor de água. A pressão do gás puro é, portanto, igual à pressão total menos a pressão do vapor de água — isso é chamado de pressão do gás “seco”, ou seja, somente a pressão do gás, sem vapor de água.
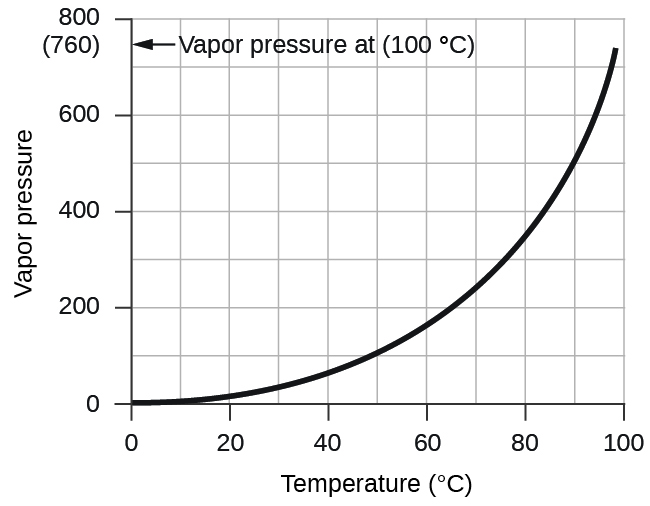
A pressão de vapor da água, que é a pressão exercida pelo vapor de água em equilíbrio com a água líquida em um recipiente fechado, depende da temperatura (Figura\(\PageIndex{4}\)); informações mais detalhadas sobre a dependência da temperatura do vapor de água podem ser encontradas na Tabela\(\PageIndex{1}\), e vapor a pressão será discutida com mais detalhes no próximo capítulo sobre líquidos.
| Temperatura (°C) | Pressão (torr) | Temperatura (°C) | Pressão (torr) | Temperatura (°C) | Pressão (torr) | ||
|---|---|---|---|---|---|---|---|
| —10 | 1,95 | 18 | 15,5 | 30 | 31,8 | ||
| —5 | 3,0 | 19 | 16,5 | 35 | 42.2 | ||
| —2 | 3.9 | 20 | 17,5 | 40 | 55,3 | ||
| 0 | 4.6 | 21 | 18,7 | 50 | 92,5 | ||
| 2 | 5.3 | 22 | 19,8 | 60 | 149,4 | ||
| 4 | 6.1 | 23 | 21.1 | 70 | 233,7 | ||
| 6 | 7.0 | 24 | 22.4 | 80 | 355.1 | ||
| 8 | 8.0 | 25 | 23,8 | 90 | 525,8 | ||
| 10 | 9.2 | 26 | 25,2 | 95 | 633,9 | ||
| 12 | 10,5 | 27 | 26,7 | 99 | 733,2 | ||
| 14 | 12,0 | 28 | 28.3 | 100,0 | 760,0 | ||
| 16 | 13,6 | 29 | 30,0 | 101,0 | 787,6 |
Se 0,200 L de argônio for coletado sobre a água a uma temperatura de 26° C e uma pressão de 750 torr em um sistema como o mostrado na Figura\(\PageIndex{3}\), qual é a pressão parcial do argônio?
Solução
De acordo com a lei de Dalton, a pressão total na garrafa (750 torr) é a soma da pressão parcial do argônio e da pressão parcial da água gasosa:
\[P_\ce{T}=P_\ce{Ar}+P_\mathrm{H_2O} \nonumber \]
Reorganizar essa equação para resolver a pressão do argônio fornece:
\[P_\ce{Ar}=P_\ce{T}−P_\mathrm{H_2O} \nonumber \]
A pressão do vapor de água acima de uma amostra de água líquida a 26 °C é de 25,2 torr (Apêndice E), então:
\[P_\ce{Ar}=\mathrm{750\:torr−25.2\:torr=725\:torr} \nonumber \]
Uma amostra de oxigênio coletada sobre a água a uma temperatura de 29,0 °C e uma pressão de 764 torr tem um volume de 0,560 L. Qual volume o oxigênio seco teria nas mesmas condições de temperatura e pressão?
- Responda
-
0,583 L
Estequiometria química e gases
A estequiometria química descreve as relações quantitativas entre reagentes e produtos em reações químicas. Anteriormente, medimos quantidades de reagentes e produtos usando massas para sólidos e volumes em conjunto com a molaridade das soluções; agora também podemos usar volumes de gás para indicar quantidades. Se soubermos o volume, a pressão e a temperatura de um gás, podemos usar a equação ideal do gás para calcular quantos moles do gás estão presentes. Se soubermos quantos moles de um gás estão envolvidos, podemos calcular o volume de um gás em qualquer temperatura e pressão.
Lei de Avogadro revisitada
Às vezes, podemos aproveitar uma característica simplificadora da estequiometria de gases que sólidos e soluções não apresentam: todos os gases que apresentam comportamento ideal contêm o mesmo número de moléculas no mesmo volume (na mesma temperatura e pressão). Assim, as proporções dos volumes de gases envolvidos em uma reação química são dadas pelos coeficientes na equação da reação, desde que os volumes de gás sejam medidos na mesma temperatura e pressão.
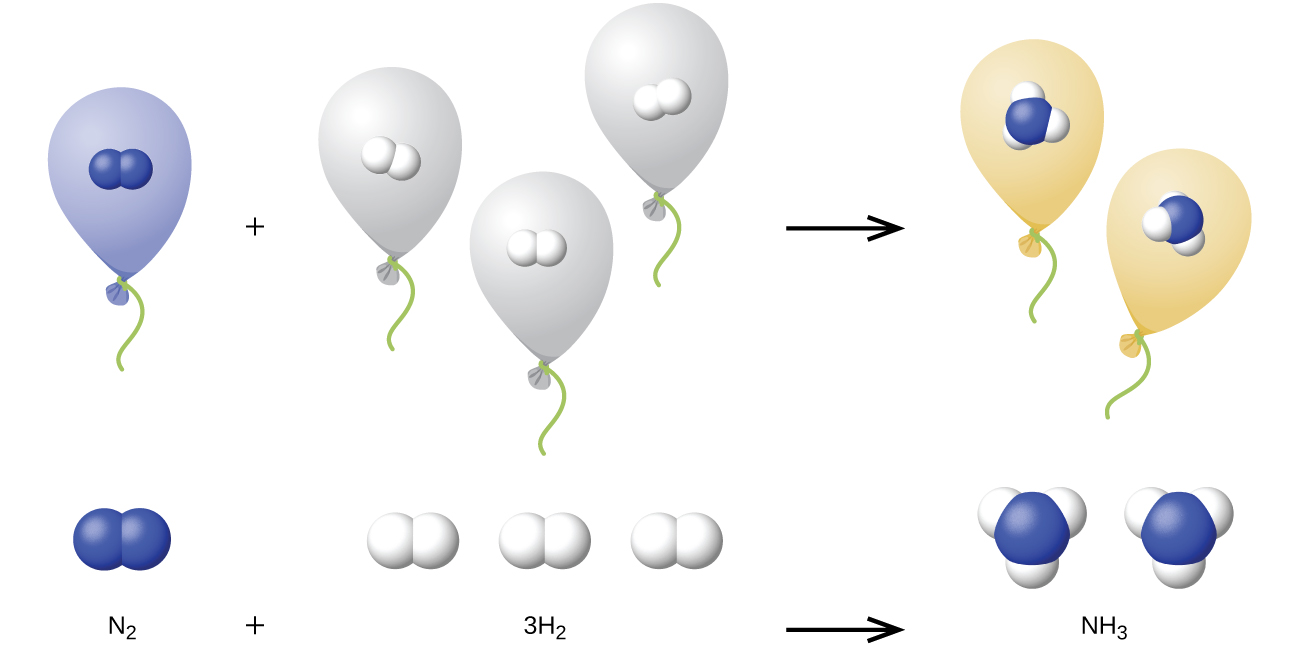
Podemos estender a lei de Avogadro (que o volume de um gás é diretamente proporcional ao número de moles do gás) às reações químicas com gases: os gases se combinam ou reagem em proporções definidas e simples por volume, desde que todos os volumes de gás sejam medidos na mesma temperatura e pressão. Por exemplo, uma vez que os gases nitrogênio e hidrogênio reagem para produzir gás amônia de acordo com
\[\ce{N2}(g)+\ce{3H2}(g)⟶\ce{2NH3}(g) \nonumber \]
um determinado volume de gás nitrogênio reage com três vezes esse volume de gás hidrogênio para produzir duas vezes esse volume de gás amônia, se a pressão e a temperatura permanecerem constantes.
A explicação para isso é ilustrada na Figura\(\PageIndex{4}\). De acordo com a lei de Avogadro, volumes iguais de N 2, H 2 e NH 3 gasosos, na mesma temperatura e pressão, contêm o mesmo número de moléculas. Como uma molécula de N 2 reage com três moléculas de H 2 para produzir duas moléculas de NH 3, o volume de H 2 necessário é três vezes o volume de N 2 e o volume de NH 3 produzido é duas vezes o volume de N 2.
O propano, C 3 H 8 (g), é usado em churrasqueiras a gás para fornecer calor para cozinhar. Qual volume de O 2 (g) medido a 25 °C e 760 torr é necessário para reagir com 2,7 L de propano medido nas mesmas condições de temperatura e pressão? Suponha que o propano sofra combustão completa.
Solução
A razão dos volumes de C 3 H 8 e O 2 será igual à razão de seus coeficientes na equação balanceada para a reação:
\ [\ begin {align}
&\ ce {C3H8} (g) +\ ce {5O2} (g) ⟶ &&\ ce {3CO2} (g) +\ ce {4H2O} (l)\\
\ ce {&1\: volume + 5\: volumes &&3\: volumes + 4\: volumes}
\ end {align}\ nonumber\]
A partir da equação, vemos que um volume de C 3 H 8 reagirá com cinco volumes de O 2:
\[\mathrm{2.7\cancel{L\:C_3H_8}×\dfrac{5\: L\:\ce{O2}}{1\cancel{L\:C_3H_8}}=13.5\: L\:\ce{O2}} \nonumber \]
Será necessário um volume de 13,5 L de O 2 para reagir com 2,7 L de C 3 H 8.
Um tanque de acetileno para uma tocha de solda de oxiacetileno fornece 9340 L de gás acetileno, C 2 H 2, a 0 °C e 1 atm. Quantos tanques de oxigênio, cada um fornecendo 7,00 × 10 3 L de O 2 a 0 °C e 1 atm, serão necessários para queimar o acetileno?
\[\ce{2C2H2 + 5O2⟶4CO2 + 2H2O} \nonumber \]
- Responda
-
3,34 tanques (2,34 × 10 4 L)
A amônia é um importante fertilizante e produto químico industrial. Suponha que um volume de 683 bilhões de pés cúbicos de amônia gasosa, medido a 25 °C e 1 atm, tenha sido fabricado. Qual volume de H 2 (g), medido nas mesmas condições, foi necessário para preparar essa quantidade de amônia por reação com N 2?
\[\ce{N2}(g)+\ce{3H2}(g)⟶\ce{2NH3}(g) \nonumber \]
Solução
Como volumes iguais de H 2 e NH 3 contêm números iguais de moléculas e cada três moléculas de H 2 que reagem produzem duas moléculas de NH 3, a proporção dos volumes de H 2 e NH 3 será igual a 3:2. Dois volumes de NH 3, neste caso em unidades de bilhões de pés 3, serão formados a partir de três volumes de H 2:
\[\mathrm{683\cancel{billion\:ft^3\:NH_3}×\dfrac{3\: billion\:ft^3\:H_2}{2\cancel{billion\:ft^3\:NH_3}}=1.02×10^3\:billion\:ft^3\:H_2} \nonumber \]
A fabricação de 683 bilhões de pés 3 de NH 3 exigiu 1020 bilhões de pés 3 de H 2. (A 25 °C e 1 atm, esse é o volume de um cubo com um comprimento de borda de aproximadamente 1,9 milhas.)
Qual volume de O 2 (g) medido a 25 °C e 760 torr é necessário para reagir com 17,0 L de etileno, C 2 H 4 (g), medido nas mesmas condições de temperatura e pressão? Os produtos são CO 2 e vapor de água.
- Responda
-
51,0 L
Qual volume de hidrogênio a 27 °C e 723 torr pode ser preparado pela reação de 8,88 g de gálio com um excesso de ácido clorídrico?
\[\ce{2Ga}(s)+\ce{6HCl}(aq)⟶\ce{2GaCl3}(aq)+\ce{3H2}(g) \nonumber \]
Leilão individual
Para converter da massa de gálio para o volume de H 2 (g), precisamos fazer algo assim:
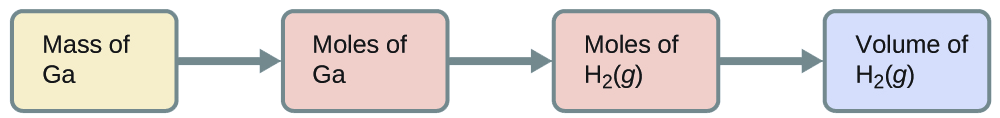
As duas primeiras conversões são:
\[\mathrm{8.88\cancel{g\: Ga}×\dfrac{1\cancel{mol\: Ga}}{69.723\cancel{g\: Ga}}×\dfrac{3\: mol\:H_2}{2\cancel{mol\: Ga}}=0.191\:mol\: H_2} \nonumber \]
Finalmente, podemos usar a lei do gás ideal:
\[V_\mathrm{H_2}=\left(\dfrac{nRT}{P}\right)_\mathrm{H_2}=\mathrm{\dfrac{0.191\cancel{mol}×0.08206\: L\cancel{atm\:mol^{−1}\:K^{−1}}×300\: K}{0.951\:atm}=4.94\: L} \nonumber \]
O dióxido de enxofre é um intermediário na preparação do ácido sulfúrico. Qual volume de SO 2 a 343 °C e 1,21 atm é produzido pela queima de 0,00 kg de enxofre em oxigênio?
- Responda
-
1,30 × 10 3 L
A fina pele da nossa atmosfera impede que a Terra seja um planeta gelado e a torna habitável. Na verdade, isso se deve a menos de 0,5% das moléculas de ar. Da energia do sol que chega à Terra, quase\(\dfrac{1}{3}\) é refletida de volta ao espaço, com o restante absorvido pela atmosfera e pela superfície da terra. Parte da energia que a Terra absorve é reemitida como radiação infravermelha (IR), uma parte da qual passa de volta pela atmosfera para o espaço. No entanto, a maior parte dessa radiação infravermelha é absorvida por certas substâncias na atmosfera, conhecidas como gases de efeito estufa, que reemitem essa energia em todas as direções, retendo parte do calor. Isso mantém condições de vida favoráveis — sem atmosfera, a temperatura média global média de 14 °C (57 °F) seria de cerca de —19 °C (—2 °F). Os principais gases de efeito estufa (GEE) são vapor de água, dióxido de carbono, metano e ozônio. Desde a Revolução Industrial, a atividade humana tem aumentado as concentrações de GEE, que mudaram o balanço energético e estão alterando significativamente o clima da Terra (Figura\(\PageIndex{6}\)).
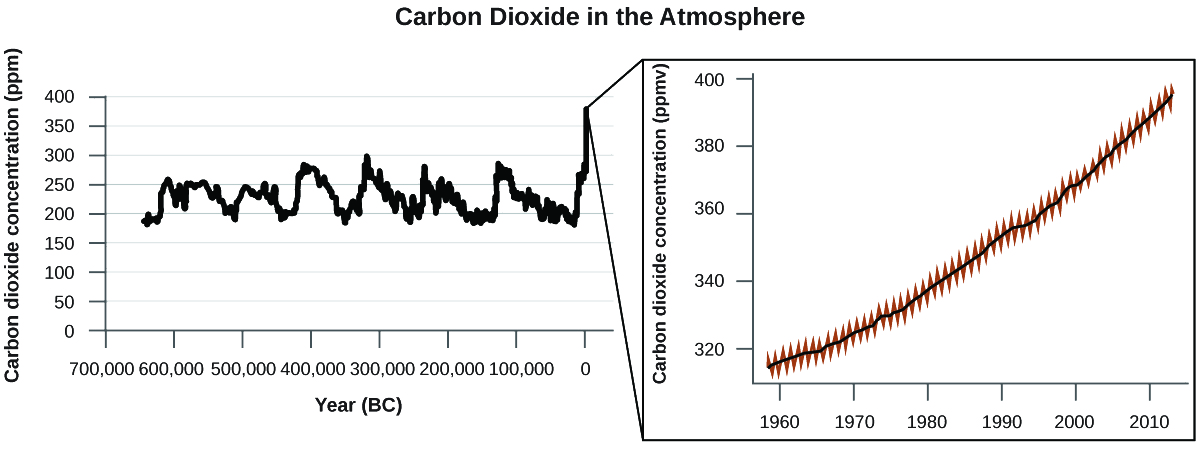
Há fortes evidências de várias fontes de que níveis atmosféricos mais altos de CO 2 são causados pela atividade humana, com a queima de combustíveis fósseis sendo responsável por cerca\(\dfrac{3}{4}\) do recente aumento de CO 2. Dados confiáveis de núcleos de gelo revelam que a concentração de CO 2 na atmosfera está no nível mais alto nos últimos 800.000 anos; outras evidências indicam que ela pode estar em seu nível mais alto em 20 milhões de anos. Nos últimos anos, a concentração de CO 2 aumentou de níveis históricos abaixo de 300 ppm para quase 400 ppm hoje (Figura\(\PageIndex{7}\)).
Resumo
A lei do gás ideal pode ser usada para derivar uma série de equações convenientes que relacionam quantidades diretamente medidas com propriedades de interesse para substâncias e misturas gasosas. O rearranjo apropriado da equação ideal do gás pode ser feito para permitir o cálculo das densidades e massas molares do gás. A lei de Dalton das pressões parciais pode ser usada para relacionar as pressões de gás medidas para misturas gasosas com suas composições. A lei de Avogadro pode ser usada em cálculos estequiométricos para reações químicas envolvendo reagentes ou produtos gasosos.
Equações-chave
- P Total = P A + P B + P C +... = i P i
- P A = X A P Total
- \(X_A=\dfrac{n_A}{n_{Total}}\)
Notas de pé
- “Quotations by Joseph-Louis Lagrange”, última modificação em fevereiro de 2006, acessado em 10 de fevereiro de 2015, www-history.mcs.st-andrews.ac... /Lagrange.html
Resumo
- Lei das pressões parciais de Dalton
- a pressão total de uma mistura de gases ideais é igual à soma das pressões parciais dos gases componentes.
- fração molar (X)
- unidade de concentração definida como a razão entre a quantidade molar de um componente da mistura e o número total de moles de todos os componentes da mistura
- pressão parcial
- pressão exercida por um gás individual em uma mistura
- pressão de vapor da água
- pressão exercida pelo vapor de água em equilíbrio com a água líquida em um recipiente fechado a uma temperatura específica


