8.4: Teoria Molecular do Orbital
- Page ID
- 184696
- Descreva a abordagem mecânica quântica básica para derivar orbitais moleculares de orbitais atômicos
- Descreva características de orbitais moleculares de ligação e antiligação
- Calcular ordens de ligação com base em configurações de elétrons moleculares
- Escreva configurações de elétrons moleculares para moléculas diatômicas de primeira e segunda fileiras
- Relacione essas configurações eletrônicas com as estabilidades e propriedades magnéticas das moléculas
Para quase todas as moléculas covalentes existentes, agora podemos desenhar a estrutura de Lewis, prever a geometria do par de elétrons, prever a geometria molecular e chegar perto de prever os ângulos de ligação. No entanto, uma das moléculas mais importantes que conhecemos, a molécula de oxigênio O 2, apresenta um problema em relação à sua estrutura de Lewis. Nós escreveríamos a seguinte estrutura de Lewis para O 2:
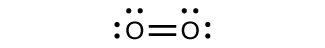
Essa estrutura eletrônica segue todas as regras que regem a teoria de Lewis. Há uma ligação dupla O = O e cada átomo de oxigênio tem oito elétrons ao redor. No entanto, essa imagem está em desacordo com o comportamento magnético do oxigênio. Por si só, O 2 não é magnético, mas é atraído por campos magnéticos. Assim, quando despejamos oxigênio líquido por um ímã forte, ele se acumula entre os pólos do ímã e desafia a gravidade. Essa atração por um campo magnético é chamada de paramagnetismo e surge em moléculas que têm elétrons desemparelhados. No entanto, a estrutura de Lewis de O 2 indica que todos os elétrons estão emparelhados. Como contabilizamos essa discrepância?
A suscetibilidade magnética mede a força experimentada por uma substância em um campo magnético. Quando comparamos o peso de uma amostra com o peso medido em um campo magnético (Figura\(\PageIndex{1}\)), as amostras paramagnéticas que são atraídas pelo ímã parecerão mais pesadas devido à força exercida pelo campo magnético. Podemos calcular o número de elétrons desemparelhados com base no aumento de peso.
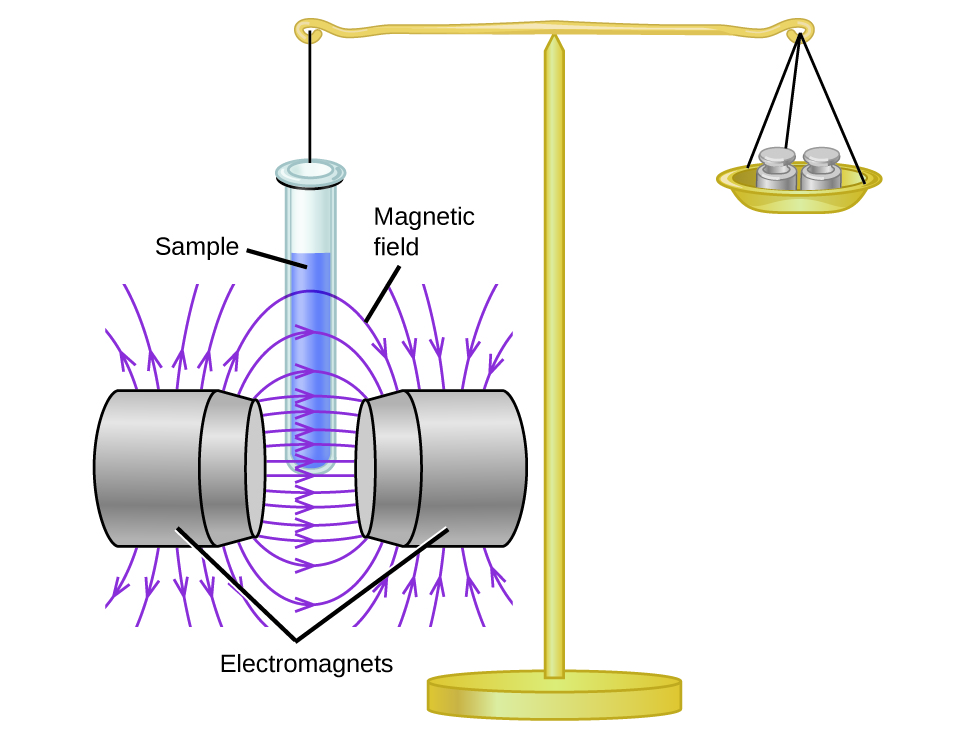
Experimentos mostram que cada molécula de O 2 tem dois elétrons desemparelhados. O modelo de estrutura de Lewis não prevê a presença desses dois elétrons desemparelhados. Ao contrário do oxigênio, o peso aparente da maioria das moléculas diminui ligeiramente na presença de um campo magnético não homogêneo. Os materiais nos quais todos os elétrons estão emparelhados são diamagnéticos e repelem fracamente um campo magnético. Materiais paramagnéticos e diamagnéticos não atuam como ímãs permanentes. Somente na presença de um campo magnético aplicado eles demonstram atração ou repulsão.
A teoria orbital molecular (teoria MO) fornece uma explicação da ligação química que explica o paramagnetismo da molécula de oxigênio. Também explica a ligação em várias outras moléculas, como violações da regra do octeto e mais moléculas com ligações mais complicadas (além do escopo deste texto) que são difíceis de descrever com estruturas de Lewis. Além disso, fornece um modelo para descrever as energias dos elétrons em uma molécula e a provável localização desses elétrons. Ao contrário da teoria da ligação de valência, que usa orbitais híbridos atribuídos a um átomo específico, a teoria MO usa a combinação de orbitais atômicos para produzir orbitais moleculares que são deslocalizados em toda a molécula, em vez de serem localizados em seus átomos constituintes. A teoria do MO também nos ajuda a entender por que algumas substâncias são condutores elétricos, outras são semicondutores e outras ainda são isolantes. A tabela\(\PageIndex{1}\) resume os principais pontos das duas teorias complementares de ligação. Ambas as teorias fornecem maneiras diferentes e úteis de descrever a estrutura molecular.
| Teoria de Valence Bond | Teoria Orbital Molecular |
|---|---|
| considera ligações localizadas entre um par de átomos | considera elétrons deslocalizados em toda a molécula |
| cria ligações a partir da sobreposição de orbitais atômicos (s, p, d...) e orbitais híbridos (sp, sp 2, sp 3...) | combina orbitais atômicos para formar orbitais moleculares (σ, σ*, π, π) |
| forma ligações σ ou π | cria interações de ligação e antiligação com base nas quais orbitais são preenchidos |
| prevê a forma molecular com base no número de regiões de densidade eletrônica | prevê a disposição dos elétrons nas moléculas |
| precisa de várias estruturas para descrever a ressonância |
A teoria orbital molecular descreve a distribuição de elétrons nas moléculas da mesma forma que a distribuição de elétrons nos átomos é descrita usando orbitais atômicos. Usando a mecânica quântica, o comportamento de um elétron em uma molécula ainda é descrito por uma função de onda,, análoga ao comportamento em um átomo. Assim como os elétrons ao redor de átomos isolados, os elétrons ao redor dos átomos nas moléculas são limitados a energias discretas (quantizadas). A região do espaço na qual é provável que um elétron de valência em uma molécula seja encontrado é chamada de orbital molecular (2). Como um orbital atômico, um orbital molecular está cheio quando contém dois elétrons com rotação oposta.
Consideraremos os orbitais moleculares em moléculas compostas por dois átomos idênticos (H 2 ou Cl 2, por exemplo). Essas moléculas são chamadas de moléculas diatômicas homonucleares. Nessas moléculas diatômicas, vários tipos de orbitais moleculares ocorrem.
O processo matemático de combinar orbitais atômicos para gerar orbitais moleculares é chamado de combinação linear de orbitais atômicos (LCAO). A função de onda descreve as propriedades ondulatórias de um elétron. Orbitais moleculares são combinações de funções de ondas orbitais atômicas. A combinação de ondas pode levar à interferência construtiva, na qual os picos se alinham com os picos, ou interferência destrutiva, na qual os picos se alinham com os vales (Figura\(\PageIndex{2}\)). Em orbitais, as ondas são tridimensionais e combinadas com ondas em fase produzindo regiões com maior probabilidade de densidade de elétrons e ondas fora de fase produzindo nós, ou regiões sem densidade eletrônica.

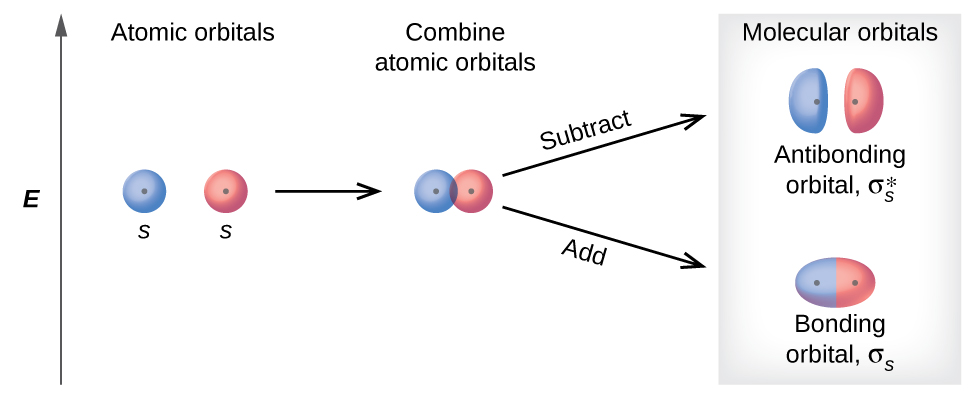
Existem dois tipos de orbitais moleculares que podem se formar a partir da sobreposição de dois orbitais s atômicos em átomos adjacentes. Os dois tipos são ilustrados na Figura\(\PageIndex{3}\). A combinação em fase produz um orbital molecular σ s de menor energia (lido como “sigma-s”) no qual a maior parte da densidade eletrônica está diretamente entre os núcleos. A adição fora de fase (que também pode ser considerada como subtração das funções de onda) produz um orbital molecular orbital\(σ^∗_s\) m olecular de maior energia (lido como “sigma-s-star”) no qual há um nó entre os núcleos. O asterisco significa que o orbital é um orbital antiligação. Os elétrons em um orbital σ s são atraídos por ambos os núcleos ao mesmo tempo e são mais estáveis (de menor energia) do que seriam nos átomos isolados. Adicionar elétrons a esses orbitais cria uma força que mantém os dois núcleos juntos, então chamamos esses orbitais de ligação de orbitais. Os elétrons nos\(σ^∗_s\) orbitais estão localizados bem longe da região entre os dois núcleos. A força atrativa entre os núcleos e esses elétrons separa os dois núcleos. Portanto, esses orbitais são chamados de orbitais antiligação. Os elétrons preenchem o orbital de ligação de baixa energia antes do orbital antiligação de alta energia, assim como preenchem os orbitais atômicos de baixa energia antes de preencher os orbitais atômicos de alta energia.
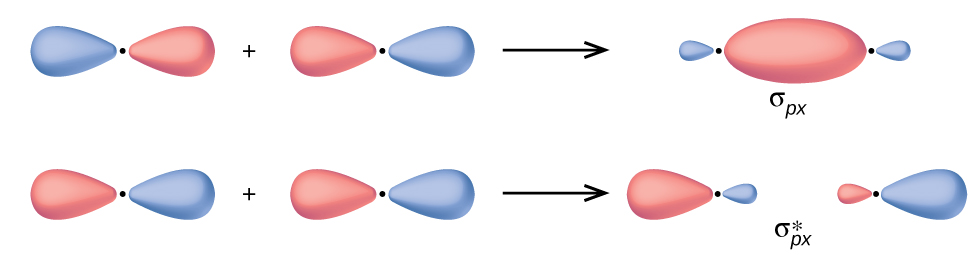
Em orbitais p, a função de onda dá origem a dois lóbulos com fases opostas, análoga a como uma onda bidimensional tem ambas as partes acima e abaixo da média. Indicamos as fases sombreando os lobos orbitais em cores diferentes. Quando os lóbulos orbitais da mesma fase se sobrepõem, a interferência construtiva das ondas aumenta a densidade eletrônica. Quando regiões de fase oposta se sobrepõem, a interferência destrutiva da onda diminui a densidade eletrônica e cria nós. Quando os orbitais p se sobrepõem de ponta a ponta, eles criam orbitais σ e σ* (Figura\(\PageIndex{4}\)). Se dois átomos estiverem localizados ao longo do eixo x em um sistema de coordenadas cartesianas, os dois orbitais p x se sobrepõem de ponta a ponta e formam σ px (ligação) e\(σ^∗_{px}\) (antiligação) (lidos como “sigma-p-x” e “estrela sigma-p-x”, respectivamente). Assim como na sobreposição orbital s, o asterisco indica o orbital com um nó entre os núcleos, que é um orbital antiligação de maior energia.
The side-by-side overlap of two p orbitals gives rise to a pi (\(π\)) bonding molecular orbital and a \(π^*\) antibonding molecular orbital, as shown in Figure \(\PageIndex{5}\). In valence bond theory, we describe π bonds as containing a nodal plane containing the internuclear axis and perpendicular to the lobes of the p orbitals, with electron density on either side of the node. In molecular orbital theory, we describe the π orbital by this same shape, and a π bond exists when this orbital contains electrons. Electrons in this orbital interact with both nuclei and help hold the two atoms together, making it a bonding orbital. For the out-of-phase combination, there are two nodal planes created, one along the internuclear axis and a perpendicular one between the nuclei.
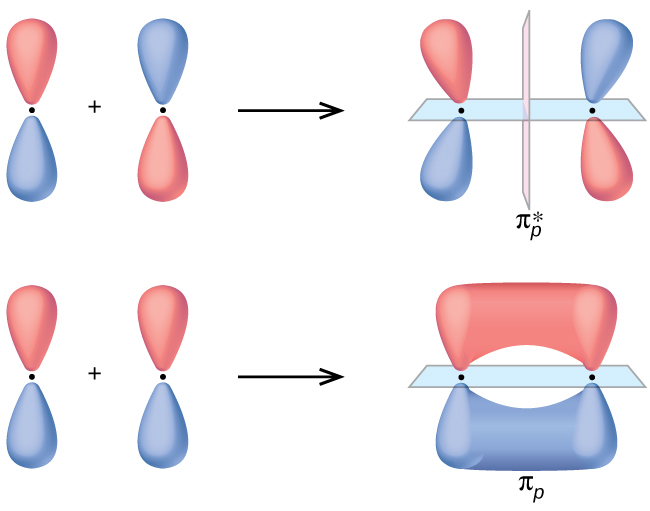
In the molecular orbitals of diatomic molecules, each atom also has two sets of p orbitals oriented side by side (py and pz), so these four atomic orbitals combine pairwise to create two π orbitals and two \(π^*\) orbitals. The \(π_{py}\) and \(π^∗_{py}\) orbitals are oriented at right angles to the \(π_{pz}\) and \(π^∗_{pz}\) orbitals. Except for their orientation, the πpy and πpz orbitals are identical and have the same energy; they are degenerate orbitals. The \(π^∗_{py}\) and \(π^∗_{pz}\) antibonding orbitals are also degenerate and identical except for their orientation. A total of six molecular orbitals results from the combination of the six atomic p orbitals in two atoms: \(σ_{px}\) and \(σ^∗_{px}\), \(π_{py}\) and \(π^∗_{py}\), \(π_{pz}\) and \(π^∗_{pz}\).
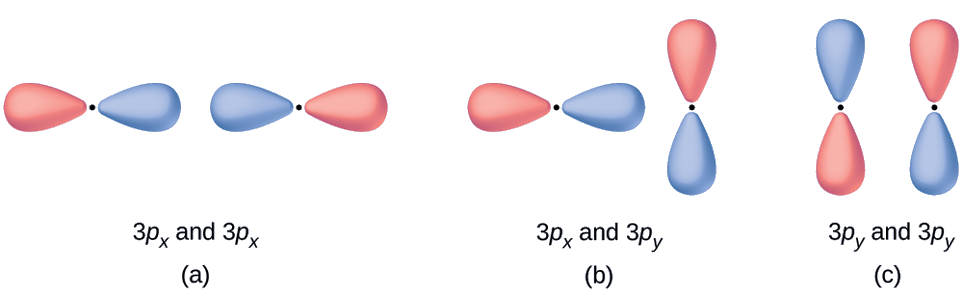
Predict what type (if any) of molecular orbital would result from adding the wave functions so each pair of orbitals shown overlap. The orbitals are all similar in energy.
Solução
- Esta é uma combinação em fase, resultando em um orbital σ 3 p
- Isso não resultará em um novo orbital porque o componente em fase (inferior) e o componente fora de fase (superior) se cancelam. Somente orbitais com o alinhamento correto podem se combinar.
- Essa é uma combinação fora de fase, resultando em um\(π^∗_{3p}\) orbital.
Identifique o orbital molecular mostrado como\(σ\) ou\(π\), ligação ou antiligação e indique onde o nodo ocorre.

- Responda
-
O orbital está localizado ao longo do eixo internuclear, então é um\(σ\) orbital. Há um nó dividindo o eixo internuclear, então é um orbital antiligação.
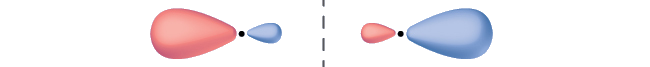
Dois orbitais são mostrados de ponta a ponta. Cada um tem um lado ampliado e um pequeno. Os lados pequenos estão voltados um para o outro e separados por uma linha pontilhada vertical.
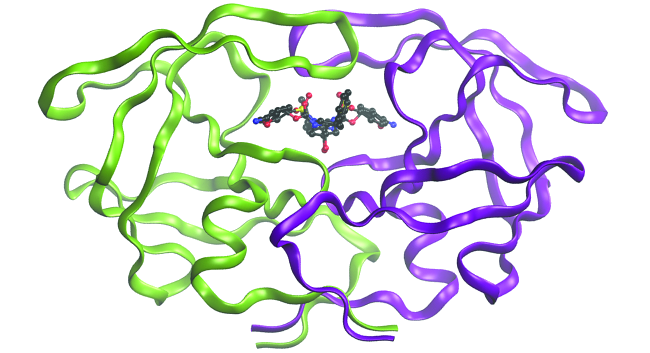
Embora as descrições de vínculo descritas neste capítulo envolvam muitos conceitos teóricos, elas também têm muitas aplicações práticas no mundo real. Por exemplo, o design de medicamentos é um campo importante que usa nossa compreensão da ligação química para desenvolver produtos farmacêuticos. Essa área de estudo interdisciplinar usa a biologia (compreensão das doenças e como elas operam) para identificar alvos específicos, como um sítio de ligação envolvido na via da doença. Ao modelar as estruturas do sítio de ligação e os possíveis medicamentos, os químicos computacionais podem prever quais estruturas podem se encaixar e com que eficácia elas se ligarão (Figura\(\PageIndex{6}\)). Milhares de candidatos em potencial podem ser reduzidos a alguns dos candidatos mais promissores. Essas moléculas candidatas são então cuidadosamente testadas para determinar os efeitos colaterais, a eficácia com que podem ser transportadas pelo corpo e outros fatores. Dezenas de novos produtos farmacêuticos importantes foram descobertos com a ajuda da química computacional, e novos projetos de pesquisa estão em andamento.
Diagramas de energia orbital molecular
Os níveis de energia relativa dos orbitais atômicos e moleculares são normalmente mostrados em um diagrama orbital molecular (Figura\(\PageIndex{7}\)). Para uma molécula diatômica, os orbitais atômicos de um átomo são mostrados à esquerda e os do outro átomo são mostrados à direita. Cada linha horizontal representa um orbital que pode conter dois elétrons. Os orbitais moleculares formados pela combinação dos orbitais atômicos são mostrados no centro. Linhas tracejadas mostram quais orbitais atômicos se combinam para formar os orbitais moleculares. Para cada par de orbitais atômicos que se combinam, um orbital molecular de baixa energia (ligação) e um orbital de maior energia (antiligação) resultam. Assim, podemos ver que a combinação dos seis orbitais atômicos de 2 p resulta em três orbitais de ligação (um σ e dois π) e três orbitais antiligação (um σ* e dois π).
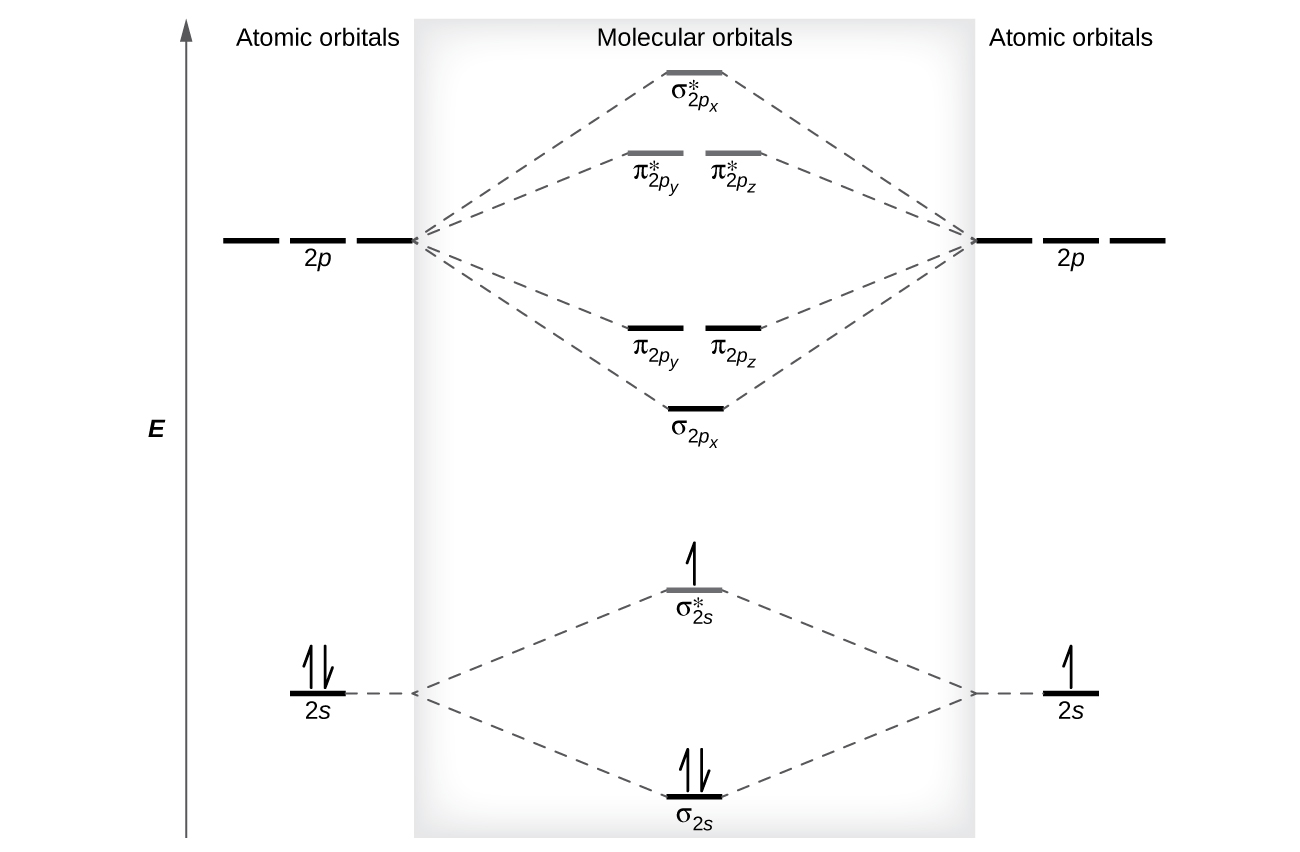
Prevemos a distribuição de elétrons nesses orbitais moleculares preenchendo os orbitais da mesma forma que preenchemos os orbitais atômicos, pelo princípio de Aufbau. Os orbitais de baixa energia são preenchidos primeiro, os elétrons se espalham entre os orbitais degenerados antes do emparelhamento e cada orbital pode conter no máximo dois elétrons com giros opostos (Figura\(\PageIndex{7}\)). Assim como escrevemos configurações de elétrons para átomos, podemos escrever a configuração eletrônica molecular listando os orbitais com sobrescritos indicando o número de elétrons presentes. Para maior clareza, colocamos parênteses em torno de orbitais moleculares com a mesma energia. Nesse caso, cada orbital tem uma energia diferente, então os parênteses separam cada orbital. Assim, esperaríamos que uma molécula diatômica ou íon contendo sete elétrons (como\(\ce{Be2+}\)) tivesse a configuração de elétrons moleculares\((σ_{1s})^2(σ^∗_{1s})^2(σ_{2s})^2(σ^∗_{2s})^1\). É comum omitir os elétrons centrais dos diagramas e configurações orbitais moleculares e incluir apenas os elétrons de valência.
Ordem de caução
O diagrama orbital molecular preenchido mostra o número de elétrons nos orbitais moleculares de ligação e antiligação. A contribuição líquida dos elétrons para a força de ligação de uma molécula é identificada pela determinação da ordem de ligação que resulta do preenchimento dos orbitais moleculares por elétrons.
Ao usar estruturas de Lewis para descrever a distribuição de elétrons nas moléculas, definimos a ordem de ligação como o número de pares de elétrons de ligação entre dois átomos. Assim, um título único tem uma ordem de vínculo de 1, um título duplo tem uma ordem de vínculo de 2 e um título triplo tem uma ordem de vínculo de 3. Definimos a ordem de ligação de forma diferente quando usamos a descrição orbital molecular da distribuição de elétrons, mas a ordem de ligação resultante geralmente é a mesma. A técnica MO é mais precisa e pode lidar com casos em que o método de estrutura de Lewis falha, mas ambos os métodos descrevem o mesmo fenômeno.
No modelo orbital molecular, um elétron contribui para uma interação de ligação se ocupa um orbital de ligação e contribui para uma interação de antiligação se ocupa um orbital de antiligação. A ordem de ligação é calculada subtraindo os elétrons desestabilizadores (antiligação) dos elétrons estabilizadores (de ligação). Como uma ligação consiste em dois elétrons, dividimos por dois para obter a ordem da ligação. Podemos determinar a ordem da ligação com a seguinte equação:
\[\textrm{bond order}=\dfrac{(\textrm{number of bonding electrons})−(\textrm{number of antibonding electrons})}{2} \nonumber \]
A ordem de uma ligação covalente é um guia para sua força; uma ligação entre dois átomos dados se torna mais forte à medida que a ordem da ligação aumenta. Se a distribuição de elétrons nos orbitais moleculares entre dois átomos for tal que a ligação resultante tenha uma ordem de ligação de zero, uma ligação estável não se forma. A seguir, veremos alguns exemplos específicos de diagramas de MO e ordens de títulos.
Ligação em moléculas diatômicas
Uma molécula de dihidrogênio (H 2) se forma a partir de dois átomos de hidrogênio. Quando os orbitais atômicos dos dois átomos se combinam, os elétrons ocupam o orbital molecular de menor energia, o orbital de ligação σ 1 s. Uma molécula de dihidrogênio, H 2, se forma facilmente porque a energia de uma molécula de H 2 é menor do que a de dois átomos de H. O orbital σ 1 s que contém os dois elétrons tem menor energia do que qualquer um dos dois orbitais atômicos de 1 s.
Um orbital molecular pode conter dois elétrons, então ambos os elétrons na molécula H 2 estão no orbital de ligação σ 1 s; a configuração eletrônica é\((σ_{1s})^2\). Representamos essa configuração por meio de um diagrama de energia orbital molecular (Figura\(\PageIndex{8}\)) no qual uma única seta para cima indica um elétron em um orbital e duas setas (para cima e para baixo) indicam dois elétrons de rotação oposta.
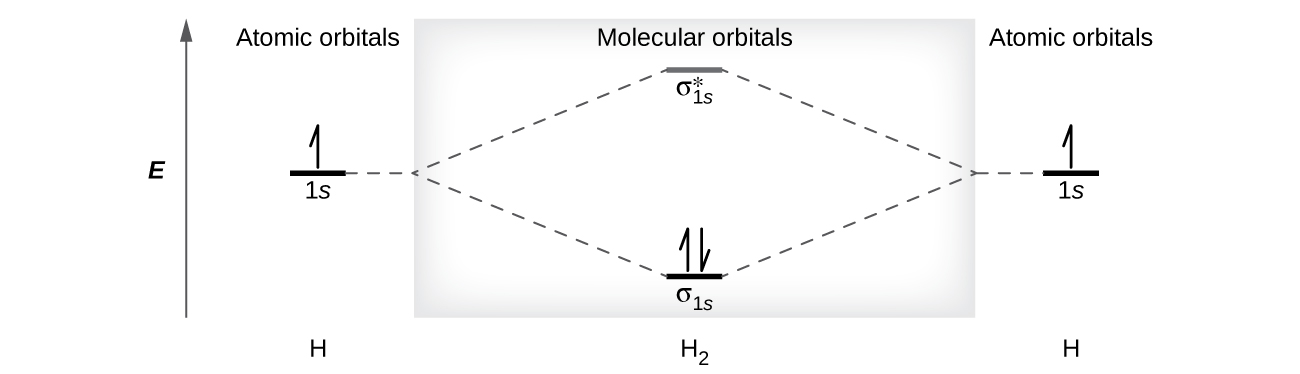
Uma molécula de dihidrogênio contém dois elétrons de ligação e nenhum elétron de antiligação, então temos
\[\ce{bond\: order\: in\: H2}=\dfrac{(2−0)}{2}=1 \nonumber \]
Como a ordem de ligação para a ligação H—H é igual a 1, a ligação é uma ligação única.
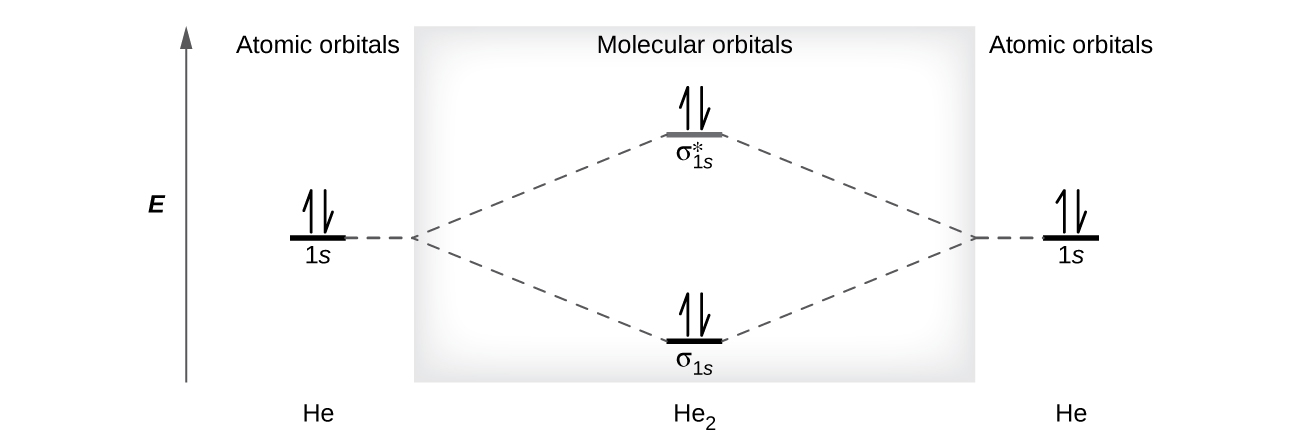
Um átomo de hélio tem dois elétrons, ambos em seu orbital de 1 s. Dois átomos de hélio não se combinam para formar uma molécula de dihélio, He 2, com quatro elétrons, porque o efeito estabilizador dos dois elétrons no orbital de ligação de baixa energia seria compensado pelo efeito desestabilizador dos dois elétrons no orbital molecular antiligação de alta energia. Escreveríamos a configuração eletrônica hipotética de He 2\((σ_{1s})^2(σ^∗_{1s})^2\) como na Figura\(\PageIndex{9}\). A mudança de energia líquida seria zero, então não há força motriz para que os átomos de hélio formem a molécula diatômica. Na verdade, o hélio existe como átomos discretos e não como moléculas diatômicas. A ordem de ligação em uma molécula hipotética de diélio seria zero.
\[\ce{bond\: order\: in\: He2}=\dfrac{(2−2)}{2}=0 \nonumber \]
Uma ordem de ligação zero indica que nenhuma ligação é formada entre dois átomos.
As moléculas diatômicas do segundo período
Oito possíveis moléculas diatômicas homonucleares podem ser formadas pelos átomos do segundo período da tabela periódica: Li 2, Be 2, B 2, C 2, N 2, O 2, F 2 e Ne 2. No entanto, podemos prever que a molécula Be 2 e a molécula Ne 2 não seriam estáveis. Podemos ver isso considerando as configurações de elétrons moleculares (Tabela\(\PageIndex{1}\)).
| Molécula | Configuração eletrônica | Ordem de caução |
|---|---|---|
| Lábio 2 | \((σ_{2s})^2\) | 1 |
| Seja 2 (instável) | \((σ_{2s})^2(σ^∗_{2s})^2\) | 0 |
| B 2 | \((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^2\) | 1 |
| C 2 | \((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4\) | 2 |
| N 2 | \((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4(σ_{2px})^2\) | 3 |
| OU 2 | \((σ_{2s})^2(σ^∗_{2s})^2(σ_{2px})^2(π_{2py},\:π_{2pz})^4(π^∗_{2py},π^∗_{2pz})^2\) | 2 |
| F 2 | \((σ_{2s})^2(σ^∗_{2s})^2(σ_{2px})^2(π_{2py},\:π_{2pz})^4(π^∗_{2py},\:π^∗_{2pz})^4\) | 1 |
| Ne 2 (instável) | \((σ_{2s})^2(σ^∗_{2s})^2(σ_{2px})^2(π_{2py},\:π_{2pz})^4(π^∗_{2py},π^∗_{2pz})^4(σ^∗_{2px})^2\) | 0 |
Prevemos as configurações de elétrons orbitais moleculares de valência, assim como prevemos as configurações eletrônicas dos átomos. Os elétrons de valência são atribuídos a orbitais moleculares de valência com as energias mais baixas possíveis. Consistente com a regra de Hund, sempre que há dois ou mais orbitais moleculares degenerados, os elétrons preenchem cada orbital desse tipo individualmente antes que qualquer emparelhamento de elétrons ocorra.
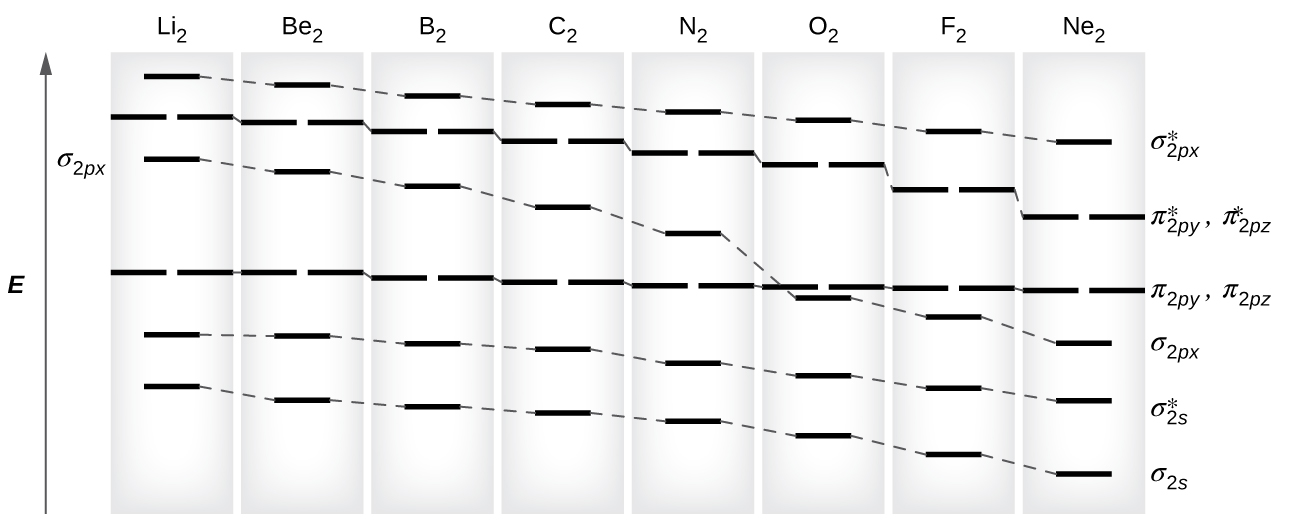
Como vimos na teoria da ligação de valência, as ligações σ são geralmente mais estáveis do que as ligações π formadas a partir de orbitais atômicos degenerados. Da mesma forma, na teoria dos orbitais moleculares, os orbitais σ são geralmente mais estáveis do que os orbitais π. No entanto, esse nem sempre é o caso. Os MoS para os orbitais de valência do segundo período são mostrados na Figura\(\PageIndex{10}\). Observando os orbitais moleculares de Ne 2, vemos que a ordem é consistente com o diagrama genérico mostrado na seção anterior. No entanto, para átomos com três ou menos elétrons nos orbitais p (Li a N), observamos um padrão diferente, no qual o orbital σ p tem maior energia do que o conjunto π p. Obtenha o diagrama orbital molecular para um íon diatômico homonuclear adicionando ou subtraindo elétrons do diagrama da molécula neutra.
Essa mudança na ordenação orbital ocorre devido a um fenômeno chamado mistura s-p. A mistura s-p não cria novos orbitais; ela apenas influencia as energias dos orbitais moleculares existentes. A função de onda σ s combina matematicamente com a função de onda σ p, com o resultado de que o orbital σ s se torna mais estável e o orbital σ p se torna menos estável (Figura\(\PageIndex{11}\)). Da mesma forma, os orbitais de antiligação também sofrem mistura s-p, com o σ s * se tornando mais estável e o σ p * se tornando menos estável.
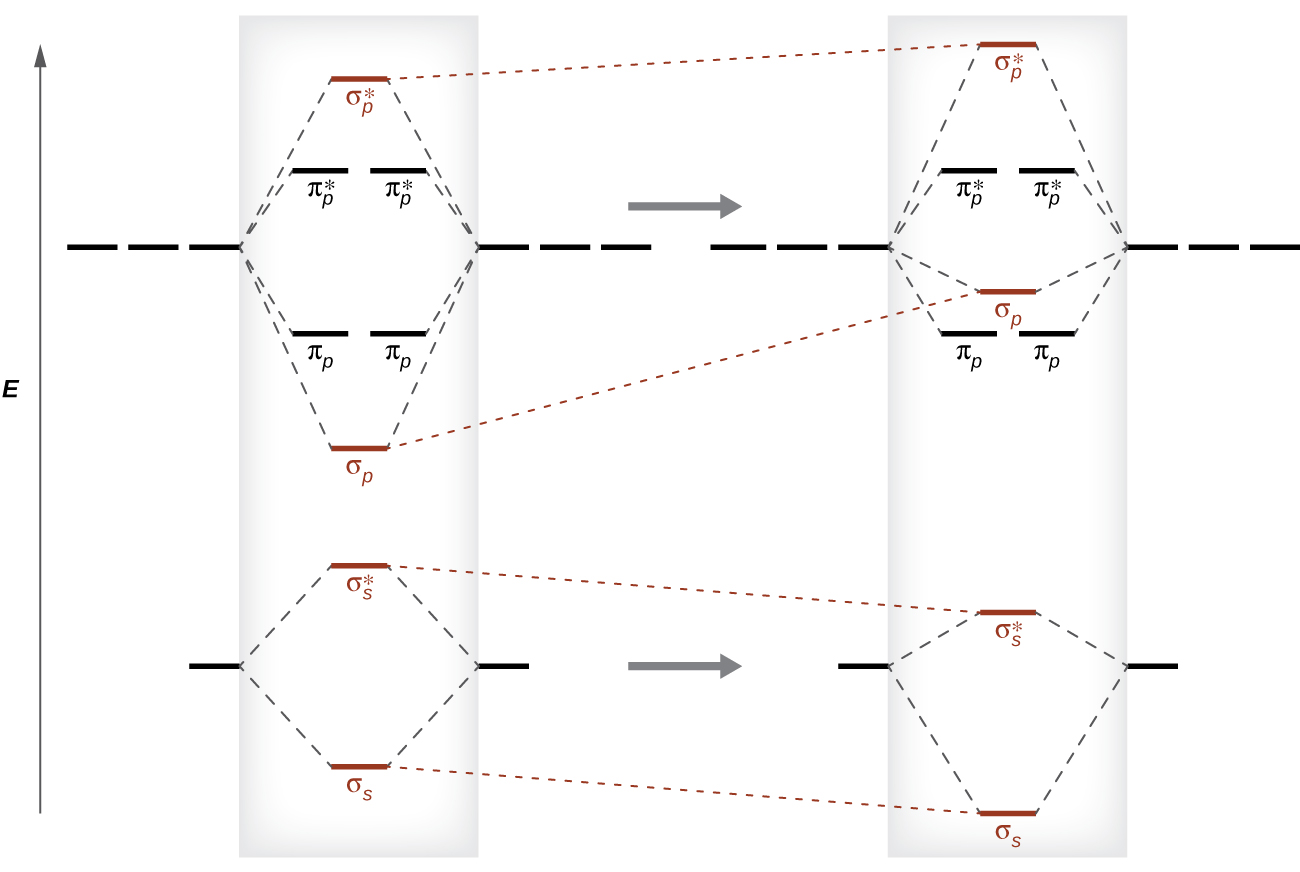
a mistura s-p ocorre quando os orbitais s e p têm energias similares. A diferença de energia entre orbitais de 2 s e 2 p em O, F e Ne é maior do que em Li, Be, B, C e N. Por causa disso, O 2, F 2 e Ne exibem uma mistura s-p insignificante (não suficiente para alterar a ordem de energia), e seus diagramas de MO seguem o padrão normal, conforme mostrado na Figura\(\PageIndex{7}\). Todas as outras moléculas diatômicas do período 2 têm mistura s-p, o que leva ao padrão em que o orbital σ p é elevado acima do conjunto π p.
Usando os diagramas de MO mostrados na Figura\(\PageIndex{11}\), podemos adicionar os elétrons e determinar a configuração molecular do elétron e a ordem de ligação para cada uma das moléculas diatômicas. Conforme mostrado na Tabela\(\PageIndex{1}\), as moléculas Be 2 e Ne 2 teriam uma ordem de ligação de 0, e essas moléculas não existem.
A combinação de dois átomos de lítio para formar uma molécula de lítio, Li 2, é análoga à formação de H 2, mas os orbitais atômicos envolvidos são os orbitais de valência 2 s. Cada um dos dois átomos de lítio tem um elétron de valência. Portanto, temos dois elétrons de valência disponíveis para o orbital molecular de ligação σ 2 s. Como os dois elétrons de valência estariam em um orbital de ligação, preveríamos que a molécula de Li 2 seria estável. A molécula está, de fato, presente em uma concentração apreciável no vapor de lítio em temperaturas próximas ao ponto de ebulição do elemento. Todas as outras moléculas na Tabela\(\PageIndex{1}\) com uma ordem de ligação maior que zero também são conhecidas.
A molécula O 2 tem elétrons suficientes para preencher pela metade o\((π^∗_{2py},\:π^∗_{2pz})\) nível. Esperamos que os dois elétrons que ocupam esses dois orbitais degenerados não estejam emparelhados, e essa configuração eletrônica molecular para O 2 está de acordo com o fato de que a molécula de oxigênio tem dois elétrons desemparelhados (Figura\(\PageIndex{10}\)). A presença de dois elétrons não pareados provou ser difícil de explicar usando estruturas de Lewis, mas a teoria orbital molecular explica isso muito bem. Na verdade, os elétrons desemparelhados da molécula de oxigênio fornecem um forte suporte para a teoria orbital molecular.
Quando dois orbitais atômicos idênticos em átomos diferentes se combinam, dois orbitais moleculares resultam (por exemplo,\(H_2\) na Figura\(\PageIndex{8}\)). O orbital de ligação tem menos energia do que os orbitais atômicos originais porque os orbitais atômicos estão em fase no orbital molecular. O orbital de antiligação tem mais energia do que os orbitais atômicos originais porque os orbitais atômicos estão fora de fase.
De uma forma sólida, coisas semelhantes acontecem, mas em uma escala muito maior. Lembre-se de que, mesmo em uma pequena amostra, há um grande número de átomos (normalmente > 10 23 átomos) e, portanto, um grande número de orbitais atômicos que podem ser combinados em orbitais moleculares. Quando orbitais atômicos de valência N, todos da mesma energia e cada um contendo um (1) elétron, são combinados, orbitais de ligação N/2 (preenchidos) e orbitais de antiligação N/2 (vazios) resultarão. Cada orbital de ligação mostrará uma redução de energia, pois os orbitais atômicos estão principalmente em fase, mas cada um dos orbitais de ligação será um pouco diferente e terá energias ligeiramente diferentes. Os orbitais de antiligação mostrarão um aumento na energia, pois os orbitais atômicos estão em sua maioria fora de fase, mas cada um dos orbitais de antiligação também será um pouco diferente e terá energias ligeiramente diferentes. Os níveis de energia permitidos para todos os orbitais de ligação estão tão próximos que formam uma banda, chamada banda de valência. Da mesma forma, todos os orbitais de antiligação estão muito próximos e formam uma banda, chamada banda de condução. A Figura\(\PageIndex{12}\)) mostra as bandas para três classes importantes de materiais: isoladores, semicondutores e condutores.
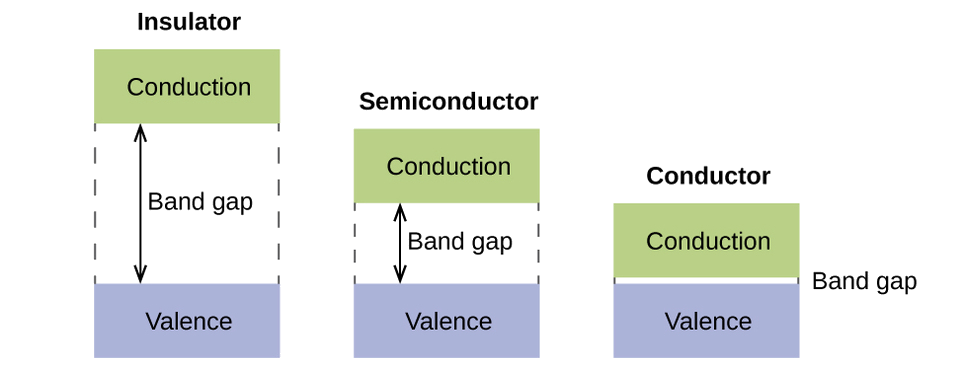
Para conduzir eletricidade, os elétrons devem se mover da banda de valência preenchida para a banda de condução vazia, onde podem se mover por todo o sólido. O tamanho do intervalo de banda, ou a diferença de energia entre a parte superior da banda de valência e a parte inferior da banda de condução, determina a facilidade de mover elétrons entre as bandas. Somente uma pequena quantidade de energia é necessária em um condutor porque a diferença de banda é muito pequena. Essa pequena diferença de energia é “fácil” de superar, então eles são bons condutores de eletricidade. Em um isolador, a diferença de banda é tão “grande” que poucos elétrons se movem para a banda de condução; como resultado, os isoladores são maus condutores de eletricidade. Os semicondutores conduzem eletricidade quando quantidades “moderadas” de energia são fornecidas para mover os elétrons da banda de valência para a banda de condução. Semicondutores, como o silício, são encontrados em muitos eletrônicos.
Os semicondutores são usados em dispositivos como computadores, smartphones e células solares. As células solares produzem eletricidade quando a luz fornece a energia para mover os elétrons para fora da banda de valência. A eletricidade gerada pode então ser usada para alimentar uma luz ou ferramenta, ou pode ser armazenada para uso posterior carregando uma bateria. Em dezembro de 2014, até 46% da energia solar poderia ser convertida em eletricidade usando células solares.
Desenhe o diagrama orbital molecular da molécula de oxigênio, O 2. A partir deste diagrama, calcule a ordem de ligação para O 2. Como esse diagrama explica o paramagnetismo de O 2?
Solução
Desenhamos um diagrama de energia orbital molecular semelhante ao mostrado na Figura\(\PageIndex{7}\). Cada átomo de oxigênio contribui com seis elétrons, então o diagrama aparece conforme mostrado na Figura\(\PageIndex{7}\).
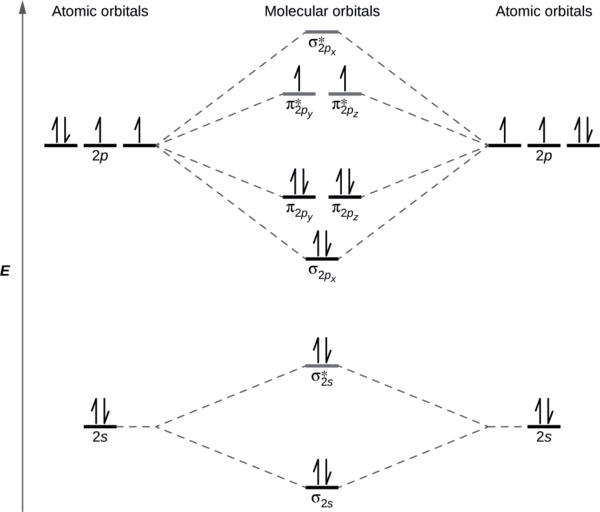
Calculamos a ordem do título como
\[\ce{O2}=\dfrac{(8−4)}{2}=2 \nonumber \]
O paramagnetismo do oxigênio é explicado pela presença de dois elétrons não pareados nos orbitais moleculares (π 2 py, π 2 pz) *.
O principal componente do ar é o N 2. A partir do diagrama orbital molecular de N 2, preveja sua ordem de ligação e se ela é diamagnética ou paramagnética.
- Responda
-
N 2 tem uma ordem de ligação de 3 e é diamagnético.
Dê a configuração orbital molecular para os elétrons de valência em\(\ce{C2^2-}\). Esse íon será estável?
Solução
Observando o diagrama MO apropriado, vemos que os orbitais π são mais baixos em energia do que o orbital σ p. A configuração eletrônica de valência para C 2 é
\((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4\).
Adicionar mais dois elétrons para gerar o\(\ce{C2^2-}\) ânion fornecerá uma configuração eletrônica de valência de
\((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4(σ_{2px})^2\)
Como isso tem seis elétrons de ligação a mais do que antiligação, a ordem de ligação será 3 e o íon deve ser estável.
Quantos elétrons não pareados estariam presentes em um\(\ce{Be2^2-}\) íon? Seria paramagnético ou diamagnético?
- Responda
-
dois, paramagnético
Conceitos principais e resumo
A teoria do orbital molecular (MO) descreve o comportamento dos elétrons em uma molécula em termos de combinações das funções das ondas atômicas. Os orbitais moleculares resultantes podem se estender por todos os átomos da molécula. Os orbitais moleculares de ligação são formados por combinações em fase de funções de ondas atômicas, e os elétrons nesses orbitais estabilizam uma molécula. Os orbitais moleculares de antiligação resultam de combinações fora de fase das funções das ondas atômicas e os elétrons nesses orbitais tornam a molécula menos estável. Orbitais moleculares localizados ao longo de um eixo internuclear são chamados de σ MoS. Eles podem ser formados a partir de orbitais s ou de orbitais p orientados de ponta a ponta. Orbitais moleculares formados a partir de orbitais p orientados lado a lado têm densidade de elétrons em lados opostos do eixo internuclear e são chamados de orbitais π.
Podemos descrever a estrutura eletrônica das moléculas diatômicas aplicando a teoria orbital molecular aos elétrons de valência dos átomos. Os elétrons preenchem os orbitais moleculares seguindo as mesmas regras que se aplicam ao preenchimento de orbitais atômicos; a regra de Hund e o princípio de Aufbau nos dizem que orbitais de baixa energia serão preenchidos primeiro, elétrons se espalharão antes de se emparelharem e cada orbital pode conter no máximo dois elétrons com spins opostos. Materiais com elétrons não pareados são paramagnéticos e atraídos por um campo magnético, enquanto aqueles com elétrons totalmente emparelhados são diamagnéticos e repelidos por um campo magnético. Prever corretamente as propriedades magnéticas das moléculas é uma vantagem da teoria orbital molecular sobre as estruturas de Lewis e a teoria da ligação de valência.


