8.1: Teoria do vínculo de valência
- Page ID
- 184674
- Descreva a formação de ligações covalentes em termos de sobreposição orbital atômica
- Defina e dê exemplos de ligações σ e π
Como sabemos, uma teoria científica é uma explicação fortemente apoiada para leis naturais observadas ou grandes conjuntos de dados experimentais. Para que uma teoria seja aceita, ela deve explicar dados experimentais e ser capaz de prever o comportamento. Por exemplo, a teoria VSEPR ganhou ampla aceitação porque prevê formas moleculares tridimensionais que são consistentes com dados experimentais coletados para milhares de moléculas diferentes. No entanto, a teoria VSEPR não fornece uma explicação da ligação química.
Existem teorias bem-sucedidas que descrevem a estrutura eletrônica dos átomos. Podemos usar a mecânica quântica para prever as regiões específicas ao redor de um átomo onde é provável que os elétrons estejam localizados: uma forma esférica para um orbital s, uma forma de haltere para um orbital p e assim por diante. No entanto, essas previsões descrevem apenas os orbitais ao redor dos átomos livres. Quando os átomos se ligam para formar moléculas, os orbitais atômicos não são suficientes para descrever as regiões onde os elétrons estarão localizados na molécula. Uma compreensão mais completa das distribuições de elétrons requer um modelo que possa explicar a estrutura eletrônica das moléculas. Uma teoria popular afirma que uma ligação covalente se forma quando um par de elétrons é compartilhado por dois átomos e é atraído simultaneamente pelos núcleos de ambos os átomos. Nas seções a seguir, discutiremos como essas ligações são descritas pela teoria da ligação de valência e hibridização.
A teoria da ligação de valência descreve uma ligação covalente como a sobreposição de orbitais atômicos meio preenchidos (cada um contendo um único elétron) que produzem um par de elétrons compartilhados entre os dois átomos ligados. Dizemos que orbitais em dois átomos diferentes se sobrepõem quando uma porção de um orbital e uma porção de um segundo orbital ocupam a mesma região do espaço. De acordo com a teoria da ligação de valência, uma ligação covalente resulta quando duas condições são atendidas:
- um orbital em um átomo se sobrepõe a um orbital em um segundo átomo e
- os elétrons individuais em cada orbital se combinam para formar um par de elétrons.
A atração mútua entre esse par de elétrons com carga negativa e os núcleos carregados positivamente dos dois átomos serve para ligar fisicamente os dois átomos por meio de uma força que definimos como uma ligação covalente. A força de uma ligação covalente depende da extensão da sobreposição dos orbitais envolvidos. Orbitais que se sobrepõem extensivamente formam ligações mais fortes do que aquelas que têm menos sobreposição.
A energia do sistema depende da sobreposição dos orbitais. A figura\(\PageIndex{1}\) ilustra como a soma das energias de dois átomos de hidrogênio (a curva colorida) muda à medida que eles se aproximam. Quando os átomos estão distantes, não há sobreposição e, por convenção, definimos a soma das energias em zero. Conforme os átomos se movem juntos, seus orbitais começam a se sobrepor. Cada elétron começa a sentir a atração do núcleo no outro átomo. Além disso, os elétrons começam a se repelir, assim como os núcleos. Enquanto os átomos ainda estão amplamente separados, as atrações são um pouco mais fortes do que as repulsões e a energia do sistema diminui. (Um vínculo começa a se formar.) À medida que os átomos se aproximam, a sobreposição aumenta, então a atração dos núcleos pelos elétrons continua aumentando (assim como as repulsões entre os elétrons e entre os núcleos). Em alguma distância específica entre os átomos, que varia de acordo com os átomos envolvidos, a energia atinge seu valor mais baixo (mais estável). Essa distância ideal entre os dois núcleos ligados é a distância de ligação entre os dois átomos. A ligação é estável porque, nesse ponto, as forças atrativas e repulsivas se combinam para criar a menor configuração de energia possível. Se a distância entre os núcleos diminuísse ainda mais, as repulsões entre os núcleos e as repulsões à medida que os elétrons estão confinados mais próximos um do outro se tornariam mais fortes do que as forças atrativas. A energia do sistema então aumentaria (tornando o sistema desestabilizado), conforme mostrado na extremidade esquerda da Figura\(\PageIndex{1}\).
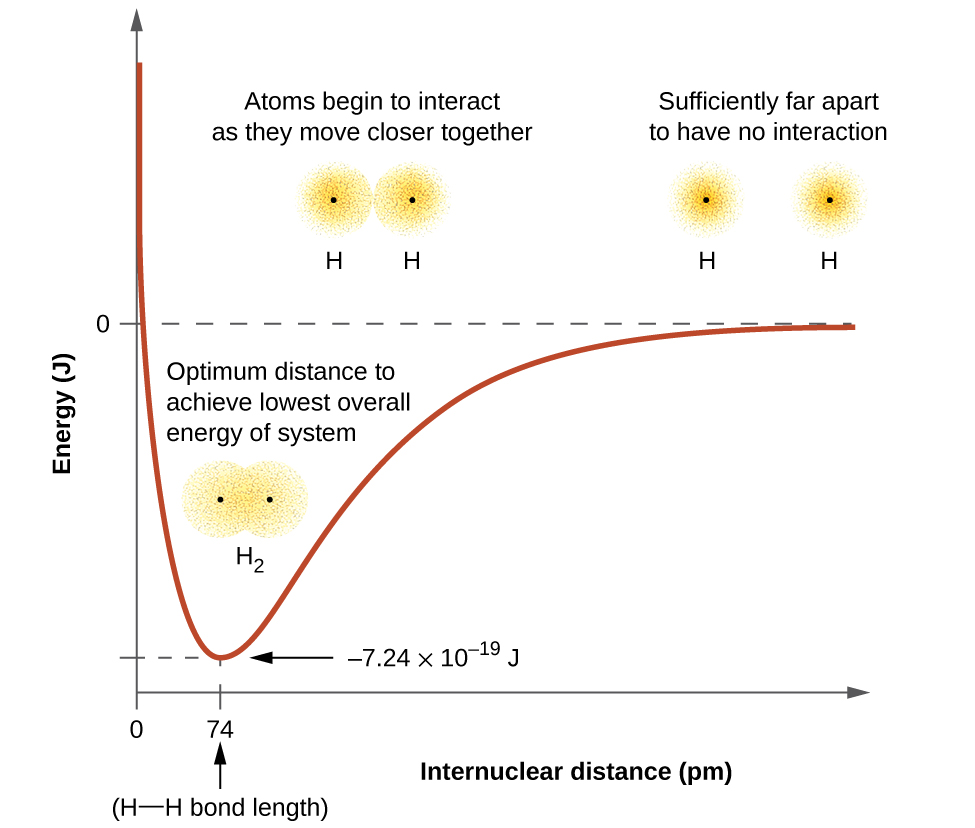
A energia de ligação é a diferença entre a energia mínima (que ocorre na distância da ligação) e a energia dos dois átomos separados. Essa é a quantidade de energia liberada quando a ligação é formada. Por outro lado, a mesma quantidade de energia é necessária para romper a ligação. Para a\(H_2\) molécula mostrada na Figura\(\PageIndex{1}\), na distância de ligação de 74 pm, o sistema tem\(7.24 \times 10^{−19}\, J\) menos energia do que os dois átomos de hidrogênio separados. Isso pode parecer um número pequeno. No entanto, sabemos por nossa descrição anterior da termoquímica que as energias de ligação são frequentemente discutidas por mol. Por exemplo, é\(7.24 \times 10^{−19}\; J\) necessário quebrar uma ligação H-H, mas é preciso\(4.36 \times 10^5\; J\) quebrar 1 mol de ligações H-H. Uma comparação de alguns comprimentos e energias de ligação é mostrada na Tabela\(\PageIndex{1}\). Podemos encontrar muitas dessas ligações em uma variedade de moléculas, e esta tabela fornece valores médios. Por exemplo, romper a primeira ligação C—H em CH4 requer 439,3 kJ/mol, enquanto a quebra da primeira ligação C—H\(\ce{H–CH2C6H5}\) (um diluente de tinta comum) requer 375,5 kJ/mol.
| Bond | Duração (pm) | Energia (kJ/mol) | Bond | Duração (pm) | Energia (kJ/mol) | |
|---|---|---|---|---|---|---|
| H — H | 74 | 436 | C—O | 140,1 | 358 | |
| H — C | 106,8 | 413 | \(\mathrm{C=O}\) | 119,7 | 745 | |
| H—N | 101,5 | 391 | \(\mathrm{C≡O}\) | 13,7 | 1072 | |
| H—O | 97,5 | 467 | H — Cl | 127,5 | 431 | |
| C—C | 150,6 | 347 | H—Br | 141,4 | 366 | |
| \(\mathrm{C=C}\) | 133,5 | 614 | H—I | 160,9 | 298 | |
| \(\mathrm{C≡C}\) | 120,8 | 839 | O—O | 148 | 146 | |
| C—N | 142,1 | 305 | \(\mathrm{O=O}\) | 120,8 | 498 | |
| \(\mathrm{C=N}\) | 130,0 | 615 | F—F | 141,2 | 159 | |
| \(\mathrm{C≡N}\) | 116,1 | 891 | Cl — Cl | 198,8 | 243 |
Além da distância entre dois orbitais, a orientação dos orbitais também afeta sua sobreposição (exceto para dois orbitais s, que são esfericamente simétricos). Uma maior sobreposição é possível quando os orbitais são orientados de forma que se sobreponham em uma linha direta entre os dois núcleos. \(\PageIndex{2}\)A figura ilustra isso para dois orbitais p de átomos diferentes; a sobreposição é maior quando os orbitais se sobrepõem de ponta a ponta, em vez de em um ângulo.
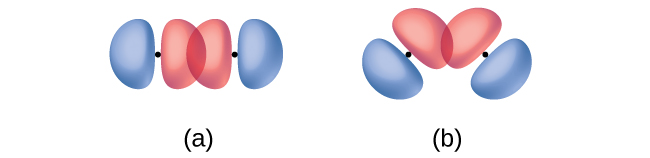
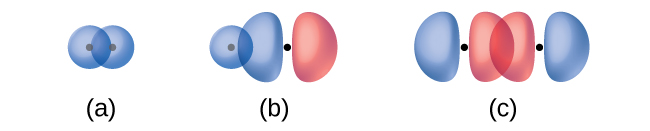
A sobreposição de dois orbitais s (como em H 2), a sobreposição de um orbital s e um orbital p (como em HCl) e a sobreposição de ponta a ponta de dois orbitais p (como em Cl 2) produzem ligações sigma (ligações σ), conforme ilustrado na Figura \(\PageIndex{3}\). Uma ligação σ é uma ligação covalente na qual a densidade eletrônica está concentrada na região ao longo do eixo internuclear; ou seja, uma linha entre os núcleos passaria pelo centro da região de sobreposição. Ligações simples em estruturas de Lewis são descritas como ligações σ na teoria da ligação de valência.
Uma ligação pi (ligação π) é um tipo de ligação covalente que resulta da sobreposição lado a lado de dois orbitais p, conforme ilustrado na Figura\(\PageIndex{4}\). Em uma ligação π, as regiões de sobreposição orbital estão em lados opostos do eixo internuclear. Ao longo do próprio eixo, há um nó, ou seja, um plano sem probabilidade de encontrar um elétron.
 “style="largura: 325 px; altura: 115 px;” width="325px” height="115px” src=”/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg “>
“style="largura: 325 px; altura: 115 px;” width="325px” height="115px” src=”/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg “>
Enquanto todas as ligações simples são ligações σ, as ligações múltiplas consistem em ligações σ e π. Como as estruturas de Lewis sugerem, O 2 contém uma ligação dupla e N 2 contém uma ligação tripla. A ligação dupla consiste em uma ligação σ e uma ligação π, e a ligação tripla consiste em uma ligação σ e duas ligações π. Entre quaisquer dois átomos, a primeira ligação formada sempre será uma ligação σ, mas só pode haver uma ligação σ em qualquer local. Em qualquer ligação múltipla, haverá uma ligação σ e as outras uma ou duas ligações serão ligações π. Esses vínculos são descritos com mais detalhes posteriormente neste capítulo.
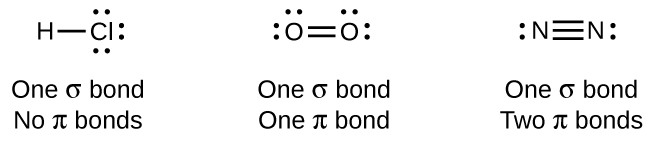
Conforme visto na Tabela\(\PageIndex{1}\), uma ligação simples carbono-carbono média é 347 kJ/mol, enquanto em uma ligação dupla carbono-carbono, a ligação π aumenta a força de ligação em 267 kJ/mol. Adicionar uma ligação π adicional causa um aumento adicional de 225 kJ/mol. Podemos ver um padrão semelhante quando comparamos outras ligações σ e π. Assim, cada ligação π individual é geralmente mais fraca do que uma ligação σ correspondente entre os mesmos dois átomos. Em uma ligação σ, há um maior grau de sobreposição orbital do que em uma ligação π.
O butadieno, C 4 H 6, é usado para fazer borracha sintética. Identifique o número de ligações σ e π contidas nessa molécula.
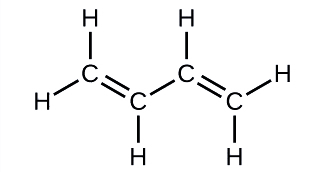
Solução
Existem seis ligações σ C—H e uma ligação σ C-C, totalizando sete das ligações simples. Existem duas ligações duplas, cada uma com uma ligação π além da ligação σ. Isso dá um total de nove ligações σ e duas π no total.
Identifique cada ilustração como representando uma ligação σ ou π:
- sobreposição lado a lado de um orbital de 4 p e um de 2 p
- sobreposição de ponta a ponta de um orbital de 4 p e 4 p
- sobreposição de ponta a ponta de um orbital de 4 p e um de 2 p
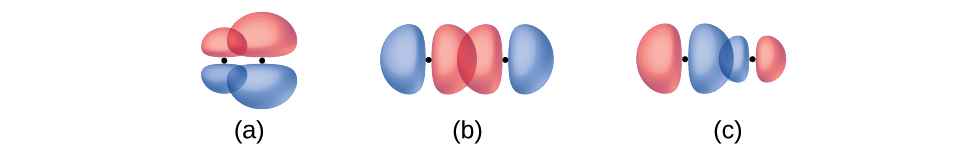
- Resposta
-
(a) é uma ligação π com um nó ao longo do eixo conectando os núcleos, enquanto (b) e (c) são ligações σ que se sobrepõem ao longo do eixo.
Resumo
A teoria da ligação de valência descreve a ligação como consequência da sobreposição de dois orbitais atômicos separados em átomos diferentes que criam uma região com um par de elétrons compartilhados entre os dois átomos. Quando os orbitais se sobrepõem ao longo de um eixo contendo os núcleos, eles formam uma ligação σ. Quando eles se sobrepõem de uma forma que cria um nó ao longo desse eixo, eles formam uma ligação π.
Glossário
- sobrepor
- coexistência de orbitais de dois átomos diferentes compartilhando a mesma região do espaço, levando à formação de uma ligação covalente
- nó
- plano que separa diferentes lóbulos de orbitais, onde a probabilidade de encontrar um elétron é zero
- ligação pi (ligação π)
- ligação covalente formada pela sobreposição lado a lado de orbitais atômicos; a densidade eletrônica é encontrada em lados opostos do eixo internuclear
- ligação sigma (ligação σ)
- ligação covalente formada pela sobreposição de orbitais atômicos ao longo do eixo internuclear
- teoria do vínculo de valência
- descrição da ligação que envolve orbitais atômicos sobrepostos para formar ligações σ ou π, dentro das quais pares de elétrons são compartilhados


