3.4: Outras unidades para concentrações de solução
- Page ID
- 184634
- Defina as unidades de concentração de porcentagem de massa, porcentagem de volume, porcentagem de volume de massa, partes por milhão (ppm) e partes por bilhão (ppb)
- Execute cálculos relacionando a concentração de uma solução e os volumes e/ou massas de seus componentes usando essas unidades
Na seção anterior, introduzimos a molaridade, uma unidade de medida muito útil para avaliar a concentração de soluções. No entanto, a molaridade é apenas uma medida de concentração. Nesta seção, apresentaremos algumas outras unidades de concentração que são comumente usadas em várias aplicações, seja por conveniência ou por convenção.
Porcentagem de massa
No início deste capítulo, introduzimos a composição percentual como uma medida da quantidade relativa de um determinado elemento em um composto. As porcentagens também são comumente usadas para expressar a composição de misturas, incluindo soluções. A porcentagem de massa de um componente da solução é definida como a razão entre a massa do componente e a massa da solução, expressa como uma porcentagem:
\[ \text{mass percentage} = \dfrac{\text{mass of component}}{\text{mass of solution}} \times100\% \label{3.5.1} \]
Geralmente, estamos mais interessados nas porcentagens de massa dos solutos, mas também é possível calcular a porcentagem de massa do solvente.
A porcentagem de massa também é conhecida por nomes semelhantes, como porcentagem de massa, porcentagem de peso, porcentagem de peso/peso e outras variações sobre esse tema. O símbolo mais comum para porcentagem de massa é simplesmente o sinal de porcentagem,%, embora símbolos mais detalhados sejam frequentemente usados, incluindo %massa, %peso e (w/w)%. O uso desses símbolos mais detalhados pode evitar a confusão de porcentagens de massa com outros tipos de porcentagens, como porcentagens de volume (a serem discutidas posteriormente nesta seção).
As porcentagens de massa são unidades de concentração populares para produtos de consumo. O rótulo de um frasco de alvejante líquido típico (Figura\(\PageIndex{1}\)) cita a concentração de seu ingrediente ativo, o hipoclorito de sódio (\(\ce{NaOCl}\)), como sendo de 7,4%. Uma amostra de 100,0 g de água sanitária, portanto, conteria 7,4 g de\(\ce{NaOCl}\).

Uma amostra de 5,0 g de líquido espinhal contém 3,75 mg (0,00375 g) de glicose. Qual é a porcentagem em massa de glicose no líquido espinhal?
Solução
A amostra de fluido espinhal contém aproximadamente 4 mg de glicose em 5000 mg de fluido, então a fração de massa de glicose deve ser um pouco menor que uma parte em 1000, ou cerca de 0,1%. Substituindo as massas dadas na equação que define a porcentagem de massa produz:
\[\mathrm{\%\,glucose=\dfrac{3.75\;mg \;glucose \times \frac{1\;g}{1000\; mg}}{5.0\;g \;spinal\; fluid}=0.075\%} \nonumber \]
A porcentagem de massa calculada concorda com nossa estimativa aproximada (é um pouco menos de 0,1%).
Observe que, embora qualquer unidade de massa possa ser usada para calcular uma porcentagem de massa (mg, g, kg, oz e assim por diante), a mesma unidade deve ser usada tanto para o soluto quanto para a solução para que as unidades de massa se cancelem, produzindo uma proporção adimensional. Nesse caso, convertemos as unidades de soluto no numerador de mg para g para coincidir com as unidades no denominador. Em vez disso, poderíamos facilmente ter convertido o denominador de g para mg. Desde que unidades de massa idênticas sejam usadas tanto para soluto quanto para solução, a porcentagem de massa calculada estará correta.
Um frasco de limpador de azulejos contém 135 g\(\ce{HCl}\) e 775 g de água. Qual é a porcentagem\(\ce{HCl}\) em massa desse limpador?
- Responda
-
14,8%
O ácido clorídrico “concentrado” é uma solução aquosa de 37,2%\(\ce{HCl}\) que é comumente usada como reagente de laboratório. A densidade dessa solução é 1,19 g/mL. Qual massa de\(\ce{HCl}\) está contida em 0,500 L dessa solução?
Solução
A concentração de HCl é próxima de 40%, então uma porção de 100 g dessa solução conteria cerca de 40 g de HCl. Como a densidade da solução não é muito diferente da da água (1 g/mL), uma estimativa razoável da massa de HCl em 500 g (0,5 L) da solução é cerca de cinco vezes maior do que em uma porção de 100 g, ou\(\mathrm{5 \times 40 = 200\: g}\). Para derivar a massa do soluto em uma solução a partir de sua porcentagem de massa, precisamos saber a massa correspondente da solução. Usando a densidade da solução fornecida, podemos converter o volume da solução em massa e, em seguida, usar a porcentagem de massa fornecida para calcular a massa do soluto. Essa abordagem matemática é descrita neste fluxograma:
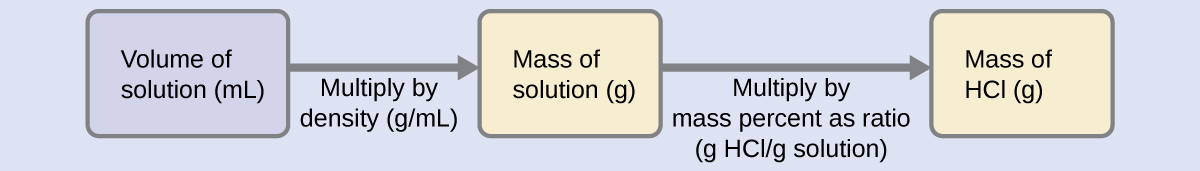
Para o cancelamento adequado da unidade, o volume de 0,500 L é convertido em 500 mL e a porcentagem de massa é expressa como uma proporção de 37,2 g de solução de HCl/g:
\[ \mathrm{500\; mL\; solution \left(\dfrac{1.19\;g \;solution}{mL \;solution}\right) \left(\dfrac{37.2\;g\; HCl}{100\;g \;solution}\right)=221\;g\; HCl} \nonumber \]
Essa massa de HCl é consistente com nossa estimativa aproximada de aproximadamente 200 g.
Qual volume de solução concentrada de HCl contém 125 g de HCl?
- Responda
-
282 mL
Porcentagem de volume
Os volumes de líquidos em uma ampla faixa de magnitudes são medidos convenientemente usando equipamentos de laboratório comuns e relativamente baratos. A concentração de uma solução formada pela dissolução de um soluto líquido em um solvente líquido é, portanto, frequentemente expressa como uma porcentagem de volume, %vol ou (v/v)%:
\[ \text{volume percentage} = \dfrac{\text{volume solute}}{\text{volume solution}} \times100\% \label{3.5.2} \]
O álcool isopropílico (isopropanol) geralmente é vendido como uma solução aquosa de 70% vol. Se a densidade do álcool isopropílico for 0,785 g/mL, quantos gramas de álcool isopropílico estão presentes em um frasco de 355 mL de álcool isopropílico?
Solução
De acordo com a definição da porcentagem de volume, o volume de isopropanol é 70% do volume total da solução. Multiplicando o volume de isopropanol por sua densidade, obtém-se a massa solicitada:
\[ \text {355 mL solution}(\frac{\text{70 mL isopropyl alcohol}}{\text{100 mL solution}})(\frac{\text{0.785 g isopropyl alcohol}}{\text{1 mL isopropyl alcohol}})=\text{195 g isopropyl alcohol} \nonumber \]
O vinho é aproximadamente 12% de etanol (\(\ce{CH_3CH_2OH}\)) por volume. O etanol tem uma massa molar de 46,06 g/mol e uma densidade de 0,789 g/mL. Quantos moles de etanol estão presentes em uma garrafa de vinho de 750 ml?
- Responda
-
1,5 mol de etanol
Porcentagem de massa e volume
Unidades percentuais “mistas”, derivadas da massa do soluto e do volume da solução, são populares para determinadas aplicações bioquímicas e médicas. Uma porcentagem de massa e volume é uma razão entre a massa de um soluto e o volume da solução expressa como uma porcentagem. As unidades específicas usadas para massa e volume de soluto podem variar, dependendo da solução. Por exemplo, a solução salina fisiológica, usada para preparar fluidos intravenosos, tem uma concentração de 0,9% massa/volume (m/v), indicando que a composição é de 0,9 g de soluto por 100 mL de solução. A concentração de glicose no sangue (comumente chamada de “açúcar no sangue”) também é normalmente expressa em termos de uma relação massa-volume. Embora não seja expressa explicitamente como uma porcentagem, sua concentração geralmente é dada em miligramas de glicose por decilitro (100 mL) de sangue (Figura\(\PageIndex{2}\)).

Partes por milhão e partes por bilhão
Concentrações muito baixas de soluto são frequentemente expressas usando unidades apropriadamente pequenas, como partes por milhão (ppm) ou partes por bilhão (ppb). Como unidades percentuais (“parte por cem”), ppm e ppb podem ser definidos em termos de massas, volumes ou unidades mistas de massa-volume. Também existem unidades de ppm e ppb definidas em relação ao número de átomos e moléculas.
As definições baseadas em massa de ppm e ppb são dadas aqui:
\[\text{ppm}=\dfrac{\text{mass solute}}{\text{mass solution}} \times 10^6\; \text{ppm} \label{3.5.3A} \]
\[\text{ppb}=\dfrac{\text{mass solute}}{\text{mass solution}} \times 10^9\; \text{ppb} \label{3.5.3B} \]
Tanto o ppm quanto o ppb são unidades convenientes para relatar as concentrações de poluentes e outros contaminantes vestigiais na água. As concentrações desses contaminantes são normalmente muito baixas em águas tratadas e naturais, e seus níveis não podem exceder limites de concentração relativamente baixos sem causar efeitos adversos na saúde e na vida selvagem. Por exemplo, a EPA identificou que o nível máximo seguro de íon flúor na água da torneira é de 4 ppm. Os filtros de água em linha são projetados para reduzir a concentração de flúor e vários outros contaminantes em nível de traço na água da torneira (Figura\(\PageIndex{3}\)).

De acordo com a EPA, quando a concentração de chumbo na água da torneira atinge 15 ppb, certas ações corretivas devem ser tomadas. Qual é essa concentração em ppm? Nessa concentração, qual massa de chumbo (μg) estaria contida em um copo típico de água (300 mL)?
Solução
As definições das unidades ppm e ppb podem ser usadas para converter a concentração dada de ppb em ppm. A comparação dessas duas definições de unidade mostra que ppm é 1000 vezes maior que ppb (1 ppm = 10 3 ppb). Assim:
\[ \mathrm{15\; \cancel{ppb} \times \dfrac{1\; ppm}{10^3\;\cancel{ppb}} =0.015\; ppm} \nonumber \]
A definição da unidade ppb pode ser usada para calcular a massa solicitada se a massa da solução for fornecida. No entanto, apenas o volume da solução (300 mL) é fornecido, então devemos usar a densidade para derivar a massa correspondente. Podemos supor que a densidade da água da torneira seja aproximadamente a mesma da água pura (~ 1,00 g/mL), uma vez que as concentrações de quaisquer substâncias dissolvidas não devem ser muito grandes. Reorganizar a equação que define a unidade ppb e substitui as quantidades dadas produz:
\[\text{ppb}=\dfrac{\text{mass solute}}{\text{mass solution}} ×10^9\; \text{ppb} \nonumber \]
\[\text{mass solute} = \dfrac{\text{ppb} \times \text{mass solution}}{10^9\;\text{ppb}} \nonumber \]
\[\text{mass solute}=\mathrm{\dfrac{15\:ppb×300\:mL×\dfrac{1.00\:g}{mL}}{10^9\:ppb}=4.5 \times 10^{-6}\;g} \nonumber \]
Finalmente, converta essa massa na unidade de microgramas solicitada:
\[\mathrm{4.5 \times 10^{−6}\;g \times \dfrac{1\; \mu g}{10^{−6}\;g} =4.5\; \mu g} \nonumber \]
Determinou-se que uma amostra de 50,0 g de águas residuais industriais continha 0,48 mg de mercúrio. Expresse a concentração de mercúrio da água residual em unidades de ppm e ppb.
- Responda
-
9,6 ppm, 9600 ppb
Resumo
Além da molaridade, várias outras unidades de concentração da solução são usadas em várias aplicações. Concentrações percentuais baseadas nas massas, volumes ou ambos dos componentes da solução são úteis para expressar concentrações relativamente altas, enquanto concentrações mais baixas são convenientemente expressas usando unidades de ppm ou ppb. Essas unidades são populares em áreas ambientais, médicas e outras, onde unidades baseadas em toupeiras, como a molaridade, não são tão comumente usadas.
Glossário
- porcentagem de massa
- razão entre a massa soluto e a solução expressa em porcentagem
- porcentagem de volume de massa
- razão entre a massa do soluto e o volume da solução, expressa em porcentagem
- partes por bilhão (ppb)
- razão entre a massa soluto e a solução multiplicada por 10 9
- partes por milhão (ppm)
- razão entre a massa soluto e a solução multiplicada por 10 6
- porcentagem de volume
- razão entre o volume soluto e a solução expressa em porcentagem


