3.2: Determinando fórmulas empíricas e moleculares
- Page ID
- 184653
- Calcule a composição percentual de um composto
- Determine a fórmula empírica de um composto
- Determine a fórmula molecular de um composto
Na seção anterior, discutimos a relação entre a massa total de uma substância e o número de átomos ou moléculas que ela contém (moles). Dada a fórmula química da substância, conseguimos determinar a quantidade da substância (moles) a partir de sua massa e vice-versa. Mas e se a fórmula química de uma substância for desconhecida? Nesta seção, exploraremos como aplicar esses mesmos princípios para derivar as fórmulas químicas de substâncias desconhecidas a partir de medições experimentais de massa.
Composição percentual
A composição elementar de um composto define sua identidade química, e as fórmulas químicas são a forma mais sucinta de representar essa composição elementar. Quando a fórmula de um composto é desconhecida, medir a massa de cada um de seus elementos constituintes costuma ser a primeira etapa no processo de determinação experimental da fórmula. Os resultados dessas medições permitem o cálculo da composição percentual do composto, definida como a porcentagem em massa de cada elemento no composto. Por exemplo, considere um composto gasoso composto exclusivamente de carbono e hidrogênio. A composição percentual desse composto pode ser representada da seguinte forma:
\[\mathrm{\%H=\dfrac{mass\: H}{mass\: compound}\times100\%} \nonumber \]
\[\mathrm{\%C=\dfrac{mass\: C}{mass\: compound}\times100\%} \nonumber \]
Se a análise de uma amostra de 10,0 g desse gás mostrasse que ele contém 2,5 g H e 7,5 g C, a composição percentual seria calculada em 25% H e 75% C:
\[\mathrm{\%H=\dfrac{2.5\:g\: H}{10.0\:g\: compound}\times100\%=25\%} \nonumber \]
\[\mathrm{\%C=\dfrac{7.5\:g\: C}{10.0\:g\: compound}\times100\%=75\%} \nonumber \]
A análise de uma amostra de 12,04 g de um composto líquido composto de carbono, hidrogênio e nitrogênio mostrou que ele contém 7,34 g C, 1,85 g H e 2,85 g N. Qual é a composição percentual desse composto?
Solução
Para calcular a composição percentual, dividimos a massa derivada experimentalmente de cada elemento pela massa total do composto e, em seguida, convertemos em uma porcentagem:
\[\mathrm{\%C=\dfrac{7.34\:g\: C}{12.04\:g\: compound}\times100\%=61.0\%} \nonumber \]
\[\mathrm{\%H=\dfrac{1.85\:g\: H}{12.04\:g\: compound}\times100\%=15.4\%} \nonumber \]
\[\mathrm{\%N=\dfrac{2.85\:g\: N}{12.04\:g\: compound}\times100\%=23.7\%} \nonumber \]
Os resultados da análise indicam que o composto tem 61,0% de C, 15,4% de H e 23,7% de N em massa.
Determina-se que uma amostra de 24,81 g de um composto gasoso contendo apenas carbono, oxigênio e cloro contém 3,01 g de C, 4,00 g O e 17,81 g de Cl. Qual é a composição percentual desse composto?
- Resposta
-
12,1% C, 16,1% O, 71,8% Cl
Determinando a composição percentual da massa da
A composição percentual também é útil para avaliar a abundância relativa de um determinado elemento em diferentes compostos de fórmulas conhecidas. Como exemplo, considere os fertilizantes comuns contendo nitrogênio amônia (NH 3), nitrato de amônio (NH 4 NO 3) e uréia (CH 4 N 2 O). O elemento nitrogênio é o ingrediente ativo para fins agrícolas, portanto, a porcentagem em massa de nitrogênio no composto é uma preocupação prática e econômica para os consumidores escolherem entre esses fertilizantes. Para esses tipos de aplicações, a composição percentual de um composto é facilmente derivada de sua massa de fórmula e das massas atômicas de seus elementos constituintes. Uma molécula de NH 3 contém um átomo de N pesando 14,01 amu e três átomos de H pesando um total de (3 × 1,008 amu) = 3,024 amu. A massa da fórmula da amônia é, portanto, (14,01 amu + 3,024 amu) = 17,03 amu, e sua composição percentual é:
\[\mathrm{\%N=\dfrac{14.01\:amu\: N}{17.03\:amu\:NH_3}\times100\%=82.27\%} \nonumber \]
\[\mathrm{\%H=\dfrac{3.024\:amu\: N}{17.03\:amu\:NH_3}\times100\%=17.76\%} \nonumber \]
Essa mesma abordagem pode ser adotada considerando um par de moléculas, uma dúzia de moléculas ou um mol de moléculas, etc. A última quantidade é mais conveniente e envolveria simplesmente o uso de massas molares em vez de massas atômicas e de fórmula, conforme demonstrado no exemplo\(\PageIndex{2}\). Desde que saibamos a fórmula química da substância em questão, podemos facilmente derivar a composição percentual da massa da fórmula ou massa molar.
A aspirina é um composto com a fórmula molecular C 9 H 8 O 4. Qual é sua composição percentual?
Solução
Para calcular a composição percentual, precisamos conhecer as massas de C, H e O em uma massa conhecida de C 9 H 8 O 4. É conveniente considerar 1 mol de C 9 H 8 O 4 e usar sua massa molar (180,159 g/mol, determinada a partir da fórmula química) para calcular as porcentagens de cada um de seus elementos:
\ [\ begin {align*}
\%\ ce C&=\ mathrm {\ dfrac {9\ :mol\: C\ times molar\: massa\: C} {molar\: massa\:\ ce {C9H18O4}}\ times100=\ dfrac {9\ times12.01\ :g/mol}\ nonumber {180,159\ :g/mol}\ times100=\ dfrac {108,09\ :g/mol} {180,159\ :g/mol}\ times100}\ nonumber\
\%\ ce C&=\ mathrm {60,00\,\%\, C}\ nonumber
\ end {align*}\ nonumber\]
\ [\ begin {align*}
\%\ ce H&=\ mathrm {\ dfrac {8\ :mol\: H\ times molar\: massa\: H} {molar\: massa\:\ ce {C9H18O4}}\ times 100=\ dfrac {8\ times 1.008\ :g/mol}\ nonumber {180.159\ ::::g/mol}\ times 100=\ dfrac {8.064\ :g/mol} {180.159\ :g/mol}\ times 100}\ nonumber\
\%\ ce H&=4,476\,\%\,\ ce H\ nonumber
\ end {align*}\ nonumber\]
\ [\ begin {align*}
\%\ ce O&=\ mathrm {\ dfrac {4\ :mol\: O\ times molar\: massa\: O} {molar\: massa\:\ ce {C9H18O4}}\ times 100=\ dfrac {4\ times 16.00\ :g/mol}\ nonumber {180,159\ :g/g/mol}\ nonumber {180,159\ :g/g/g/mol} mol}\ times 100=\ dfrac {64,00\ :g/mol} {180,159\ :g/mol}\ times 100}\ nonumber
\\%\ ce O&=35,52\%\ nonumber
\ end {align*}\ nonumber\]
Observe que essas porcentagens somam 100,00% quando adequadamente arredondadas.
Para três dígitos significativos, qual é a porcentagem de massa de ferro no composto\(Fe_2O_3\)?
- Resposta
-
Taxa de 69,9%
Determinação de fórmulas empíricas
Conforme mencionado anteriormente, a abordagem mais comum para determinar a fórmula química de um composto é primeiro medir as massas de seus elementos constituintes. No entanto, devemos ter em mente que as fórmulas químicas representam os números relativos, não as massas, dos átomos na substância. Portanto, qualquer dado derivado experimentalmente envolvendo massa deve ser usado para derivar o número correspondente de átomos no composto. Para fazer isso, podemos usar massas molares para converter a massa de cada elemento em vários moles. Em seguida, consideramos os moles de cada elemento em relação um ao outro, convertendo esses números em uma proporção de números inteiros que pode ser usada para derivar a fórmula empírica da substância. Considere uma amostra de composto determinado como contendo 1,71 g C e 0,287 g H. Os números correspondentes de átomos (em moles) são:
\[\mathrm{1.71\:g\: C\times \dfrac{1\:mol\: C}{12.01\:g\: C}=0.142\:mol\: C} \nonumber \]
\[\mathrm{0.287\:g\: H\times \dfrac{1\:mol\: H}{1.008\:g\: H}=0.284\:mol\: H} \nonumber \]
Assim, podemos representar com precisão esse composto com a fórmula C 0,142 H 0,284. Obviamente, de acordo com a convenção aceita, as fórmulas contêm assinaturas de números inteiros, o que pode ser obtido dividindo cada subscrito pelo menor subscrito:
\[\ce C_{\Large{\frac{0.142}{0.142}}}\:\ce H_{\Large{\frac{0.284}{0.142}}}\ce{\:or\:CH2} \nonumber \]
(Lembre-se de que os subscritos de “1” não são escritos, mas sim assumidos se nenhum outro número estiver presente.)
A fórmula empírica para este composto é, portanto, CH 2. Essa também pode ser ou não a fórmula molecular do composto; no entanto, precisaríamos de informações adicionais para fazer essa determinação (conforme discutido posteriormente nesta seção).
Considere como outro exemplo uma amostra de composto determinado como contendo 5,31 g de Cl e 8,40 g O. Seguindo a mesma abordagem, obtém-se uma fórmula empírica provisória de:
\[\mathrm{Cl_{0.150}O_{0.525}=Cl_{\Large{\frac{0.150}{0.150}}}\: O_{\Large{\frac{0.525}{0.150}}}=ClO_{3.5}} \nonumber \]
Nesse caso, dividir pelo menor subscrito ainda nos deixa com um subscrito decimal na fórmula empírica. Para converter isso em um número inteiro, devemos multiplicar cada um dos subscritos por dois, mantendo a mesma proporção de átomos e produzindo Cl 2 O 7 como a fórmula empírica final.
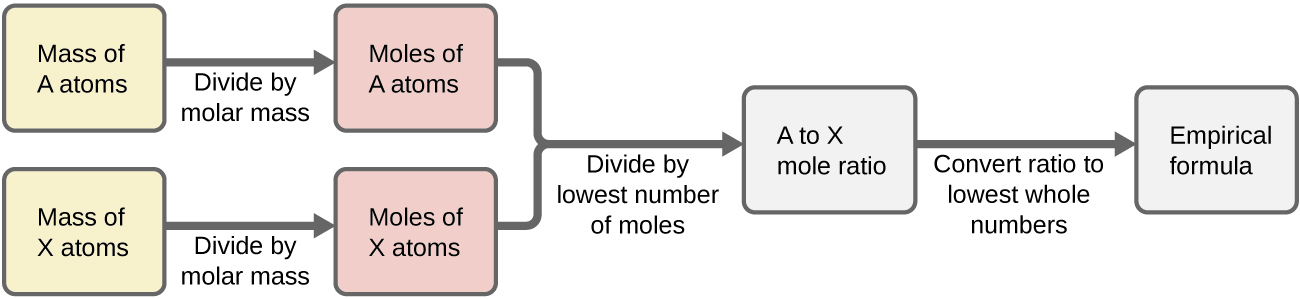
Em resumo, as fórmulas empíricas são derivadas de massas de elementos medidas experimentalmente por:
- Derivando o número de moles de cada elemento de sua massa
- Dividindo a quantidade molar de cada elemento pela menor quantidade molar para produzir subscritos para uma fórmula empírica provisória
- Multiplicando todos os coeficientes por um número inteiro, se necessário, para garantir que a menor proporção de números inteiros de assinaturas seja obtida
A figura\(\PageIndex{1}\) descreve esse procedimento em forma de fluxograma para uma substância contendo os elementos A e X.
Uma amostra do mineral negro hematita (Figura\(\PageIndex{2}\)), um óxido de ferro encontrado em muitos minérios de ferro, contém 34,97 g de ferro e 15,03 g de oxigênio. Qual é a fórmula empírica da hematita?

Solução
Para esse problema, recebemos a massa em gramas de cada elemento. Comece encontrando as toupeiras de cada um:
\ [\ begin {align*}
\ mathrm {34,97\ :g\: Fe\ left (\ dfrac {mol\: Fe} {55,85\ :g}\ right)} &=\ mathrm {0,6261\ :mol\: Fe}\ nonumber\\\ nonumber\
\\ mathrm {15.03\ :g\: O\ left (\ dfrac {mol\: O} {16.00\ :g}\ right)} &=\ mathrm {0,9394\ :mol\: O}\ nonumber
\ end {align*}\ nonumber\]
Em seguida, obtenha a razão molar ferro/oxigênio dividindo pelo menor número de moles:
\[\mathrm{\dfrac{0.6261}{0.6261}=1.000\:mol\: Fe} \nonumber \]
\[\mathrm{\dfrac{0.9394}{0.6261}=1.500\:mol\: O} \nonumber \]
A proporção é de 1.000 mol de ferro para 1.500 mol de oxigênio (Fe 1 O 1,5). Finalmente, multiplique a proporção por dois para obter o menor número inteiro possível de assinaturas e, ao mesmo tempo, manter a proporção correta de ferro-oxigênio:
\[\mathrm{2(Fe_1O_{1.5})=Fe_2O_3} \nonumber \]
A fórmula empírica é\(Fe_2O_3\).
Qual é a fórmula empírica de um composto se uma amostra contém 0,130 g de nitrogênio e 0,370 g de oxigênio?
- Resposta
-
\(N_2O_5\)
Vídeo\(\PageIndex{1}\): Outros exemplos trabalhados que ilustram a derivação de fórmulas empíricas são apresentados no breve videoclipe.
Derivando fórmulas empíricas da composição percentual
Finalmente, com relação à derivação de fórmulas empíricas, considere os casos em que a composição percentual de um composto está disponível em vez das massas absolutas dos elementos constituintes do composto. Nesses casos, a composição percentual pode ser usada para calcular as massas de elementos presentes em qualquer massa conveniente de composto; essas massas podem então ser usadas para derivar a fórmula empírica da maneira usual.
A fermentação bacteriana do grão para produzir etanol forma um gás com uma composição percentual de 27,29% C e 72,71% O (Figura\(\PageIndex{3}\)). Qual é a fórmula empírica desse gás?

Solução
Como a escala para porcentagens é 100, é mais conveniente calcular a massa dos elementos presentes em uma amostra pesando 100 g. O cálculo é “mais conveniente” porque, de acordo com a definição da composição percentual, a massa de um determinado elemento em gramas é numericamente equivalente à massa do elemento porcentagem. Essa equivalência numérica resulta da definição da unidade “percentual”, cujo nome é derivado da frase latina por centum que significa “por cem”. Considerando essa definição, as porcentagens de massa fornecidas podem ser mais convenientemente expressas como frações:
\ [\ begin {align*}
27.29\,\%\,\ ce C&=\ mathrm {\ dfrac {27.29\ :g\: C} {100\ :g\: composto}}\ nonumber\\\ nonumber\\
72.71\,\%\,\ ce O&=\ mathrm {\ dfrac {72.71\ :g\: O} {100\ :g\: composto}}\ nonumber
\ end {align*}\ nonumber\]
As quantidades molares de carbono e hidrogênio em uma amostra de 100 g são calculadas dividindo a massa de cada elemento por sua massa molar:
\ [\ begin {align*}
\ mathrm {27.29\ :g\: C\ left (\ dfrac {mol\: C} {12.01\ :g}\ right)} &=\ mathrm {2.272\ :mol\: C}\ nonumber\\\ nonumber\\
\ mathrm {72.71\ :g\: O\ left (\ left\ frac {mol\: O} {16.00\ :g}\ right)} &=\ mathrm {4.544\ :mol\: O}\ nonumber
\ end {align*}\ nonumber\]
Os coeficientes para a fórmula empírica provisória são derivados da divisão de cada quantidade molar pela menor das duas:
\[\mathrm{\dfrac{2.272\:mol\: C}{2.272}=1} \nonumber \]
\[\mathrm{\dfrac{4.544\:mol\: O}{2.272}=2} \nonumber \]
Como a proporção resultante é de um carbono para dois átomos de oxigênio, a fórmula empírica é CO 2.
Qual é a fórmula empírica de um composto contendo 40,0% de C, 6,71% de H e 53,28% de O?
- Resposta
-
\(CH_2O\)
Derivação de fórmulas moleculares
Lembre-se de que as fórmulas empíricas são símbolos que representam os números relativos dos elementos de um composto. Determinar o número absoluto de átomos que compõem uma única molécula de um composto covalente requer conhecimento de sua fórmula empírica e de sua massa molecular ou massa molar. Essas quantidades podem ser determinadas experimentalmente por várias técnicas de medição. A massa molecular, por exemplo, é frequentemente derivada do espectro de massa do composto (veja a discussão dessa técnica no capítulo anterior sobre átomos e moléculas). A massa molar pode ser medida por vários métodos experimentais, muitos dos quais serão introduzidos em capítulos posteriores deste texto.
As fórmulas moleculares são derivadas da comparação da massa molecular ou molar do composto com sua massa de fórmula empírica. Como o nome sugere, a massa de uma fórmula empírica é a soma das massas atômicas médias de todos os átomos representados em uma fórmula empírica. Se soubermos a massa molecular (ou molar) da substância, podemos dividi-la pela massa da fórmula empírica para identificar o número de unidades de fórmula empírica por molécula, que designamos como n:
\[\mathrm{\dfrac{molecular\: or\: molar\: mass\left(amu\: or\:\dfrac{g}{mol}\right)}{empirical\: formula\: mass\left(amu\: or\:\dfrac{g}{mol}\right)}= \mathit n\: formula\: units/molecule} \nonumber \]
A fórmula molecular é então obtida multiplicando cada subscrito na fórmula empírica por n, conforme mostrado pela fórmula empírica genérica A x B y:
\[\mathrm{(A_xB_y)_n=A_{nx}B_{nx}} \nonumber \]
Por exemplo, considere um composto covalente cuja fórmula empírica é determinada como CH 2 O. A massa da fórmula empírica para esse composto é de aproximadamente 30 amu (a soma de 12 amu para um átomo de C, 2 amu para dois átomos de H e 16 amu para um átomo de O). Se a massa molecular do composto for determinada em 180 amu, isso indica que as moléculas desse composto contêm seis vezes o número de átomos representados na fórmula empírica:
\[\mathrm{\dfrac{180\:amu/molecule}{30\:\dfrac{amu}{formula\: unit}}=6\:formula\: units/molecule} \nonumber \]
As moléculas desse composto são então representadas por fórmulas moleculares cujos subscritos são seis vezes maiores do que os da fórmula empírica:
\[\ce{(CH2O)6}=\ce{C6H12O6} \nonumber \]
Observe que essa mesma abordagem pode ser usada quando a massa molar (g/mol) em vez da massa molecular (amu) é usada. Nesse caso, estamos apenas considerando um mol de unidades e moléculas de fórmulas empíricas, em oposição a unidades e moléculas únicas.
A nicotina, um alcalóide da família das plantas beladonas que é a principal responsável pela natureza viciante dos cigarros, contém 74,02% de C, 8,710% de H e 17,27% N. Se 40,57 g de nicotina contêm 0,2500 mol de nicotina, qual é a fórmula molecular?
Solução
A determinação da fórmula molecular a partir dos dados fornecidos exigirá a comparação da massa da fórmula empírica do composto com sua massa molar. Como primeira etapa, use a composição percentual para derivar a fórmula empírica do composto. Supondo que seja conveniente, uma amostra de 100 g de nicotina produz as seguintes quantidades molares de seus elementos:
\ [\ begin {alignat} {2}
&\ mathrm {(74,02\ :g\: C)\ left (\ dfrac {1\ :mol\: C} {12,01\ :g\: C}\ direita)} &&=\:\ mathrm {6.163\ :mol\: C}\\
&\ mathrm {(8.710\ :g\: H)\ esquerda (\ dfrac {1\ :mol\: H} {1,01\ :g\: H}\ direita)} &&=\:\ mathrm {8.624\ :mol\: H}\\
&\ mathrm {(17,27\ :g\ : N)\ left (\ dfrac {1\ :mol\: N} {14.01\ :g\: N}\ right)} &&=\:\ mathrm {1.233\ :mol\: N}
\ end {alignat}\ nonumber\]
Em seguida, calculamos as razões molares desses elementos em relação ao elemento menos abundante,\(\ce{N}\).
\(6.163 \: \text{mol} \: \ce{C}\)/\(1.233 \: \text{mol} \: \ce{N}\)= 5
\(8.264 \: \text{mol} \: \ce{H}\)/\(1.233 \: \text{mol} \: \ce{N}\)= 7
\(1.233 \: \text{mol} \: \ce{N}\)/\(1.233\: \text{mol} \: \ce{N}\)= 1
1,233/1,233 =\(1.000 \: \text{mol} \: \ce{N}\)
6,163/1,233 =\(4.998 \: \text{mol} \: \ce{C}\)
8,624/1,233 =\(6.994 \: \text{mol} \: \ce{H}\)
As razões molares C para N e H para N estão adequadamente próximas dos números inteiros e, portanto, a fórmula empírica é C 5 H 7 N. A massa da fórmula empírica para este composto é, portanto, 81,13 unidade amu/fórmula, ou 81,13 g/mol unidade de fórmula.
Calculamos a massa molar da nicotina a partir da massa dada e da quantidade molar do composto:
\[\mathrm{\dfrac{40.57\:g\: nicotine}{0.2500\:mol\: nicotine}=\dfrac{162.3\:g}{mol}} \nonumber \]
Comparar a massa molar e a massa da fórmula empírica indica que cada molécula de nicotina contém duas unidades de fórmula:
\[\mathrm{\dfrac{162.3\:g/mol}{81.13\:\dfrac{g}{formula\: unit}}=2\:formula\: units/molecule} \nonumber \]
Assim, podemos derivar a fórmula molecular da nicotina a partir da fórmula empírica multiplicando cada subscrito por dois:
\[\ce{(C5H7N)2}=\ce{C10H14N2} \nonumber \]
Qual é a fórmula molecular de um composto com uma composição percentual de 49,47% C, 5,10% H, 28,84% N e 16,48% O e uma massa molecular de 194,2 amu?
- Resposta
-
C 8 H 10 N 4 O 2
Resumo
A identidade química de uma substância é definida pelos tipos e números relativos de átomos que compõem suas entidades fundamentais (moléculas no caso de compostos covalentes, íons no caso de compostos iônicos). A composição percentual de um composto fornece a porcentagem de massa de cada elemento no composto e geralmente é determinada experimentalmente e usada para derivar a fórmula empírica do composto. A massa da fórmula empírica de um composto covalente pode ser comparada à massa molecular ou molar do composto para derivar uma fórmula molecular.
Equações chave
- \(\mathrm{\%X=\dfrac{mass\: X}{mass\: compound}\times100\%}\)
- \(\mathrm{\dfrac{molecular\: or\: molar\: mass\left(amu\: or\:\dfrac{g}{mol}\right)}{empirical\: formula\: mass\left(amu\: or\:\dfrac{g}{mol}\right)}=\mathit n\: formula\: units/molecule}\)
- (A x B y) n = A nx B ny
Glossário
- composição percentual
- porcentagem em massa dos vários elementos em um composto
- massa da fórmula empírica
- soma das massas atômicas médias de todos os átomos representados em uma fórmula empírica


