19.2: Química de coordenação de metais de transição
- Page ID
- 195529
≡
- Listar as características definidoras dos compostos de coordenação
- Descreva as estruturas de complexos contendo ligantes monodentados e polidentados
- Use regras de nomenclatura padrão para nomear compostos de coordenação
- Explique e forneça exemplos de isomerismo geométrico e óptico
- Identificar várias ocorrências naturais e tecnológicas de compostos de coordenação
A hemoglobina no sangue, a clorofila nas plantas verdes, a vitamina\(B_{12}\) e o catalisador usado na fabricação do polietileno contêm compostos de coordenação. Os íons dos metais, especialmente os metais de transição, provavelmente formarão complexos. Muitos desses compostos são altamente coloridos (Figura\(\PageIndex{1}\)). No restante deste capítulo, consideraremos a estrutura e a ligação desses compostos notáveis.

Lembre-se de que na maioria dos compostos de elementos do grupo principal, os elétrons de valência dos átomos isolados se combinam para formar ligações químicas que satisfazem a regra do octeto. Por exemplo, os quatro elétrons de valência do carbono se sobrepõem aos elétrons de quatro átomos de hidrogênio para formar CH 4. O elétron de uma valência deixa o sódio e se soma aos sete elétrons de valência do cloro para formar a unidade de fórmula iônica NaCl (Figura\(\PageIndex{2}\)). Metais de transição normalmente não se ligam dessa maneira. Eles formam principalmente ligações covalentes coordenadas, uma forma de interação ácido-base de Lewis na qual ambos os elétrons na ligação são contribuídos por um doador (base de Lewis) para um aceitador de elétrons (ácido de Lewis). O ácido de Lewis em complexos de coordenação, muitas vezes chamado de íon metálico central (ou átomo), é frequentemente um metal de transição ou metal de transição interno, embora os elementos do grupo principal também possam formar compostos de coordenação. Os doadores da base de Lewis, chamados ligantes, podem ser uma grande variedade de substâncias químicas — átomos, moléculas ou íons. O único requisito é que eles tenham um ou mais pares de elétrons, que podem ser doados ao metal central. Na maioria das vezes, isso envolve um átomo doador com um único par de elétrons que pode formar uma ligação coordenada com o metal.
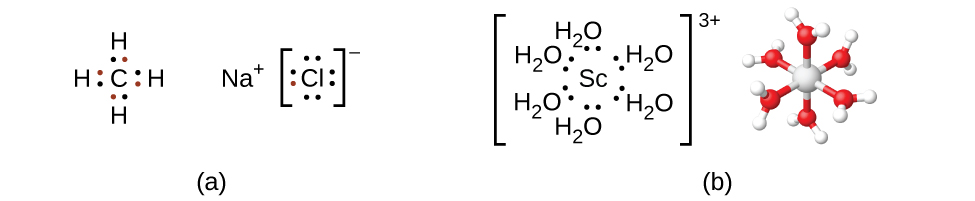
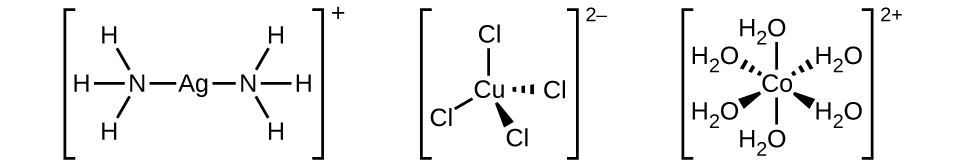
A esfera de coordenação consiste no íon ou átomo central do metal mais seus ligantes conectados. Os colchetes em uma fórmula envolvem a esfera de coordenação; espécies fora dos colchetes não fazem parte da esfera de coordenação. O número de coordenação do íon ou átomo metálico central é o número de átomos doadores ligados a ele. O número de coordenação do íon prata em [Ag (NH 3) 2] + é dois (Figura\(\PageIndex{3}\)). Para o íon cobre (II) em [CuCl 4] 2−, o número de coordenação é quatro, enquanto para o íon cobalto (II) em [Co (H 2 O) 6] 2+ o número de coordenação é seis. Cada um desses ligantes é monodentado, do grego para “um dente”, o que significa que eles se conectam com o metal central por meio de apenas um átomo. Nesse caso, o número de ligantes e o número de coordenação são iguais.
Muitos outros ligantes se coordenam com o metal de formas mais complexas. Ligantes bidentados são aqueles em que dois átomos se coordenam com o centro do metal. Por exemplo, a etilenodiamina (en, H 2 NCH 2 CH 2 NH 2) contém dois átomos de nitrogênio, cada um com um par solitário e pode servir como base de Lewis (Figura\(\PageIndex{4}\)). Ambos os átomos podem se coordenar em um único centro de metal. No complexo [Co (en) 3] 3+, existem três ligantes bidentados e o número de coordenação do íon cobalto (III) é seis. Os números de coordenação mais comuns são dois, quatro e seis, mas exemplos de todos os números de coordenação de 1 a 15 são conhecidos.
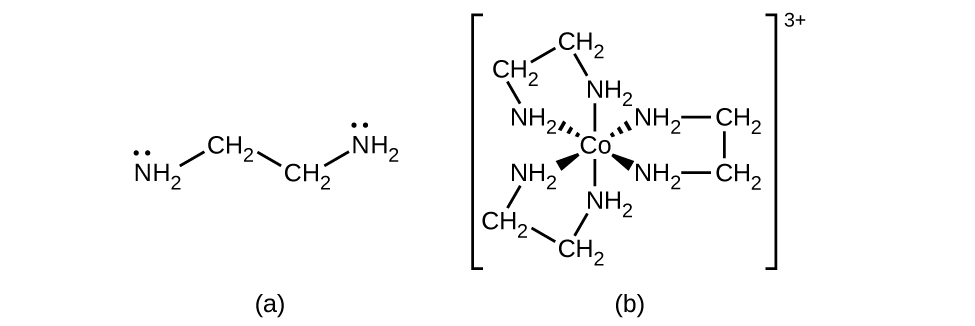
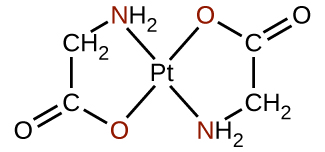
Qualquer ligante que se liga a um íon metálico central por mais de um átomo doador é um ligante polidentado (ou “muitos dentes”) porque pode penetrar no centro do metal com mais de uma ligação. O termo quelato (pronunciado “chave-late”) do grego para “garra” também é usado para descrever esse tipo de interação. Muitos ligantes polidentados são ligantes quelantes, e um complexo que consiste em um ou mais desses ligantes e um metal central é um quelato. Um ligante quelante também é conhecido como agente quelante. Um ligante quelante retém o íon metálico como uma garra de caranguejo seguraria uma bola de gude. A figura\(\PageIndex{4}\) mostra um exemplo de quelato e o complexo heme na hemoglobina é outro exemplo importante (Figura\(\PageIndex{5}\)). Ele contém um ligante polidentado com quatro átomos doadores que se coordenam com ferro.
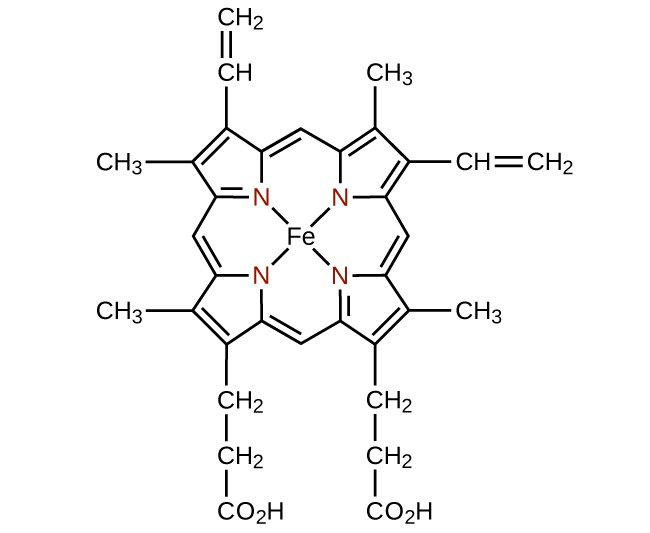
Ligantes polidentados às vezes são identificados com prefixos que indicam o número de átomos doadores no ligante. Como vimos, ligantes com um átomo doador, como NH 3, Cl − e H 2 O, são ligantes monodentados. Ligantes com dois grupos de doadores são ligantes bidentados. Etilenodiamina, H 2 NCH 2 CH 2 NH 2 e o ânion da glicina ácida\(\ce{NH2CH2CO2-}\) (Figura\(\PageIndex{6}\)) são exemplos de ligantes bidentados. Ligantes tridentados, ligantes tetradentados, ligantes pentadentados e ligantes hexadentados contêm três, quatro, cinco e seis átomos doadores, respectivamente. O ligante heme (Figura\(\PageIndex{5}\)) é um ligante tetradentado.
A nomenclatura de complexos
A nomenclatura dos complexos segue o padrão de um sistema sugerido por Alfred Werner, químico suíço e ganhador do Prêmio Nobel, cujo excelente trabalho, há mais de 100 anos, lançou as bases para uma compreensão mais clara desses compostos. As cinco regras a seguir são usadas para nomear complexos:
- Se um composto de coordenação for iônico, nomeie primeiro o cátion e o ânion em segundo, de acordo com a nomenclatura usual.
- Nomeie os ligantes primeiro, seguido pelo metal central. Nomeie os ligantes em ordem alfabética. Ligantes negativos (ânions) têm nomes formados pela adição de - o ao nome do caule do grupo (por exemplo, Tabela\(\PageIndex{1}\). Para a maioria dos ligantes neutros, o nome da molécula é usado. As quatro exceções comuns são aqua (H 2 O), amina (NH 3), carbonil (CO) e nitrosil (NO). Por exemplo, nomeie [Pt (NH 3) 2 Cl 4] como diaminetetracloroplatina (IV).
- Se mais de um ligante de um determinado tipo estiver presente, o número é indicado pelos prefixos di - (para dois), tri - (para três), tetra - (para quatro), penta - (para cinco) e hexa - (para seis). Às vezes, os prefixos bis - (para dois), tris - (para três) e tetrakis - (para quatro) são usados quando o nome do ligante já inclui di -, tri - ou tetra -, ou quando o nome do ligante começa com uma vogal. Por exemplo, o íon bis (bipiridil) ósmio (II) usa bis- para significar que existem dois ligantes ligados a Os, e cada ligante bipiridil contém dois grupos de piridina (C 5 H 4 N).
| Ligante aniônico | Nome |
|---|---|
| F − | flúor |
| Cl − | cloro |
| Br − | vassoura |
| I − | iodo |
| CN − | ciano |
| \(\ce{NO3-}\) | nitrato |
| AH − | hidroxo |
| O 2— | boi |
| \(\ce{C2O4^2-}\) | oxalato |
| \(\ce{CO2^2-}\) | carbonato |
Quando o complexo é um cátion ou uma molécula neutra, o nome do átomo central de metal é escrito exatamente como o nome do elemento e é seguido por um número romano entre parênteses para indicar seu estado de oxidação (Tabelas\(\PageIndex{2}\),\(\PageIndex{3}\), e\(\PageIndex{3}\)). Quando o complexo é um ânion, o sufixo -ate é adicionado à haste do nome do metal, seguido pela designação do número romano de seu estado de oxidação.
| Exemplos em que o complexo é cátion | |
| [Co (NH 36)] Cl 3 | cloreto de hexaamina-cobalto (III) |
| [Pt (NH 34) Cl 2] 2+ | íon tetraamina-dicloroplatina (IV) |
| [Idade (NH 32)] + | íon diamina/prata (I) |
| [Cr (H 2 O) 4 Cl 2] Cl | cloreto de tetraaquadiclorocrómio (III) |
| [Co (H 2 polegadas 2 CH 2 NH 23) 2] (SO 43) | sulfato de tris (etilenodiamina) cobalto (III) |
| Exemplos em que o complexo é neutro | |
| [Pt (NH 32) Cl 4] | diaminetetracloroplatina (IV) |
| [Ni (H 2 polegadas 2 CH 2 NH 22) Cl 2] | diclorobis (etilenodiamina) níquel (II) |
| Exemplos em que o complexo é um ânion | |
| [PtCl 6] 2− | íon hexacloroplatinato (IV) |
| Na 2 [S NCl 6] | hexaclorostanato de sódio (IV) |
Às vezes, o nome latino do metal é usado quando o nome em inglês é desajeitado. Por exemplo, ferrato é usado em vez de ferro, plumbato em vez de chumbo e estanato em vez de tinato. O estado de oxidação do metal é determinado com base nas cargas de cada ligante e na carga geral do composto de coordenação. Por exemplo, em [Cr (H 2 O) 4 Cl 2] Br, a esfera de coordenação (entre parênteses) tem uma carga de 1+ para equilibrar o íon brometo. Os ligantes da água são neutros e os ligantes do cloreto são aniônicos com uma carga de 1− cada. Para determinar o estado de oxidação do metal, definimos a carga geral igual à soma dos ligantes e do metal: +1 = −2 + x, então o estado de oxidação (x) é igual a 3+.
Determine o nome dos seguintes complexos e forneça o número de coordenação do átomo central de metal.
- Na 2 [PtCl 6]
- K 3 [Fe (C 2 O 4) 3]
- [Co (NH 35) Cl] Cl 2
Solução
- Existem dois íons Na +, então a esfera de coordenação tem duas cargas negativas: [PtCl 6] 2−. Existem seis ligantes de cloreto aniônico, então −2 = −6 + x, e o estado de oxidação da platina é 4+. O nome do complexo é hexacloroplatinato de sódio (IV) e o número de coordenação é seis.
- A esfera de coordenação tem uma carga de 3− (com base no potássio) e cada um dos ligantes do oxalato tem uma carga de 2−, então o estado de oxidação do metal é dado por −3 = −6 + x, e este é um complexo de ferro (III). O nome é trisoxalatoferrato de potássio (III) (observe que tris é usado em vez de tri porque o nome do ligante começa com uma vogal). Como o oxalato é um ligante bidentado, esse complexo tem um número de coordenação de seis.
- Neste exemplo, a esfera de coordenação tem uma carga catiônica de 2+. O ligante NH 3 é neutro, mas o ligante cloro tem uma carga de 1−. O estado de oxidação é encontrado por +2 = −1 + x e é 3+, então o complexo é cloreto de pentaamineclorocobalto (III) e o número de coordenação é seis.
O complexo dicianoargenato de potássio (I) é usado para fazer compostos antissépticos. Forneça a fórmula e o número de coordenação.
- Resposta
-
K [Ag (CN) 2]; coordenação número dois
As estruturas dos complexos
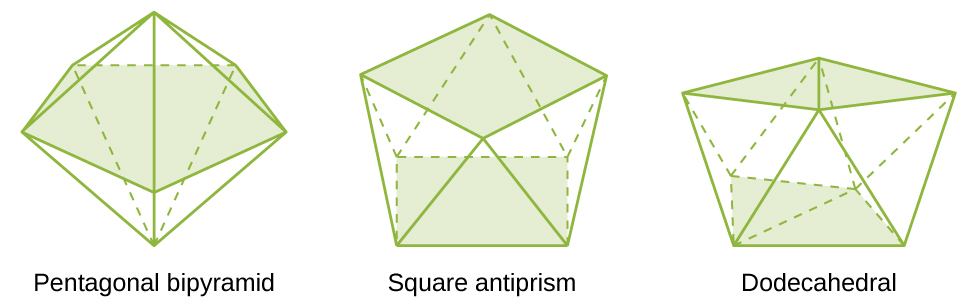
As estruturas mais comuns dos complexos em compostos de coordenação são octaédricas, tetraédricas e quadradas planares (Figura\(\PageIndex{7}\)). Para complexos de metais de transição, o número de coordenação determina a geometria em torno do íon metálico central. A tabela\(\PageIndex{3}\) compara os números de coordenação com a geometria molecular:
| Número de coordenação | Geometria molecular | Exemplo |
|---|---|---|
| 2 | linear | [Idade (NH 32)] + |
| 3 | plano trigonal | [Copa (CN) 3] 2− |
| 4 | tetraédrico (d 0 ou d 10), baixos estados de oxidação para M | [Não (CO) 4] |
| 4 | quadrado plano (d 8) | [NiCl 42] − |
| 5 | trigonal bipiramidal | [CoCl 52] − |
| 5 | quadrado piramidal | [VO (CN) 4] 2− |
| 6 | octaédrico | [CoCl 63] − |
| 7 | bipirâmide pentagonal | [ZrF 7] − |
| 8 | antiprisma quadrado | [ReF 8] 2− |
| 8 | dodecaedro | [Mo (CN) 8] − |
| 9 e acima | estruturas mais complicadas | [RH 92] − |
Ao contrário dos átomos do grupo principal, nos quais os elétrons ligados e não ligados determinam a forma molecular, os elétrons d não ligados não alteram a disposição dos ligantes. Os complexos octaédricos têm um número de coordenação de seis, e os seis átomos doadores estão dispostos nos cantos de um octaedro ao redor do íon metálico central. Os exemplos são mostrados na Figura\(\PageIndex{8}\). Os ânions cloreto e nitrato em [Co (H 2 O) 6] Cl 2 e [Cr (en) 3] (NO 3) 3, e os cátions potássio em K 2 [PtCl 6], estão fora dos suportes e não estão ligados ao íon metálico.

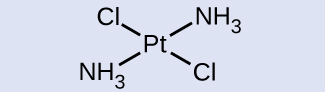
Para metais de transição com um número de coordenação de quatro, duas geometrias diferentes são possíveis: tetraédrica ou plana quadrada. Ao contrário dos elementos do grupo principal, onde essas geometrias podem ser previstas a partir da teoria VSEPR, uma discussão mais detalhada sobre orbitais de metais de transição (discutida na seção sobre Teoria do Campo Cristalino) é necessária para prever quais complexos serão tetraédricos e quais serão planos quadrados. Em complexos tetraédricos como [Zn (CN) 4] 2− (Figura\(\PageIndex{9}\)), cada um dos pares de ligantes forma um ângulo de 109,5°. Em complexos planos quadrados, como [Pt (NH 3) 2 Cl 2], cada ligante tem dois outros ligantes em ângulos de 90° (chamados de posições cis) e um ligante adicional em um ângulo de 180°, na posição trans.

Isomerismo em complexos
Isômeros são espécies químicas diferentes que têm a mesma fórmula química. Metais de transição geralmente formam isômeros geométricos, nos quais os mesmos átomos são conectados por meio dos mesmos tipos de ligações, mas com diferenças em sua orientação no espaço. Complexos de coordenação com dois ligantes diferentes nas posições cis e trans de um ligante de interesse formam isômeros. Por exemplo, o íon octaédrico [Co (NH 3) 4 Cl 2] + tem dois isômeros. Na configuração cis, os dois ligantes de cloreto são adjacentes um ao outro (Figura\(\PageIndex{1}\)). O outro isômero, a configuração trans, tem os dois ligantes de cloreto diretamente um em frente ao outro.
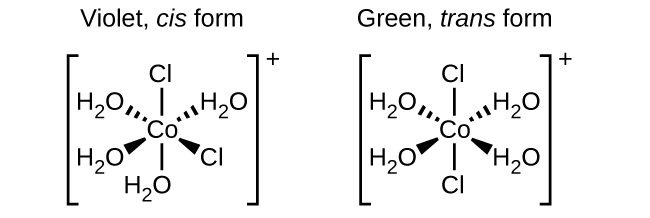
Diferentes isômeros geométricos de uma substância são compostos químicos diferentes. Eles exibem propriedades diferentes, embora tenham a mesma fórmula. Por exemplo, os dois isômeros de [Co (NH 3) 4 Cl 2] NO 3 diferem na cor; a forma cis é violeta e a forma trans é verde. Além disso, esses isômeros têm diferentes momentos de dipolo, solubilidades e reatividades. Como exemplo de como o arranjo no espaço pode influenciar as propriedades moleculares, considere a polaridade dos dois isômeros [Co (NH 3) 4 Cl 2] NO 3. Lembre-se de que a polaridade de uma molécula ou íon é determinada pelos dipolos de ligação (que são devidos à diferença na eletronegatividade dos átomos de ligação) e sua disposição no espaço. Em um isômero, os ligantes de cloreto cis causam mais densidade eletrônica em um lado da molécula do que no outro, tornando-a polar. Para o isômero trans, cada ligante está diretamente em frente a um ligante idêntico, então os dipolos de ligação se cancelam e a molécula é apolar.
Identifique qual isômero geométrico de [Pt (NH 3) 2 Cl 2] é mostrado na Figura\(\PageIndex{9}\) b. Desenhe o outro isômero geométrico e dê seu nome completo.
Solução
Na Figura\(\PageIndex{9}\) b, os dois ligantes de cloro ocupam posições cis. O outro formulário é mostrado abaixo. Ao nomear isômeros específicos, o descritor é listado na frente do nome. Portanto, esse complexo é trans -diaminedicloroplatina (II).
O isômero trans de [Pt (NH 3) 2 Cl 2] tem cada ligante diretamente em frente a um ligante adjacente.
Desenhe o íon trans -diaqua- trans -dibromo- trans -diclorocobalto (II).
- Resposta
-
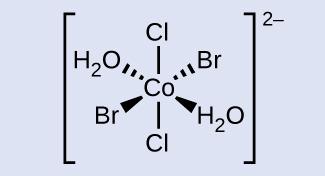
O cobalto está localizado no centro, com as cunhas esquerda e direita conectadas ao bromo e H 2 O, respectivamente. As linhas tracejadas esquerda e direita estão conectadas a H 2 O e bromo, respectivamente. Apontando diretamente para cima e para baixo, opostos um ao outro, está o cloro. Toda a fórmula estrutural está entre colchetes com um sobrescrito de 2 negativos.
Outro tipo importante de isômeros são os isômeros ópticos, ou enantiômeros, nos quais dois objetos são imagens espelhadas exatas um do outro, mas não podem ser alinhados para que todas as partes correspondam. Isso significa que os isômeros ópticos são imagens espelhadas não sobrepostas. Um exemplo clássico disso é um par de mãos, nas quais a mão direita e a esquerda são imagens espelhadas uma da outra, mas não podem ser sobrepostas. Os isômeros ópticos são muito importantes em matéria orgânica e bioquímica porque os sistemas vivos geralmente incorporam um isômero óptico específico e não o outro. Diferentemente dos isômeros geométricos, os pares de isômeros ópticos têm propriedades idênticas (ponto de ebulição, polaridade, solubilidade, etc.). Os isômeros ópticos diferem apenas na forma como afetam a luz polarizada e como reagem com outros isômeros ópticos. Para complexos de coordenação, muitos compostos de coordenação, como [M (en) 3] n+ [em que M n+ é um íon metálico central, como ferro (III) ou cobalto (II)], formam enantiômeros, conforme mostrado na Figura\(\PageIndex{11}\). These two isomers will react differently with other optical isomers. For example, DNA helices are optical isomers, and the form that occurs in nature (right-handed DNA) will bind to only one isomer of [M(en)3]n+ and not the other.
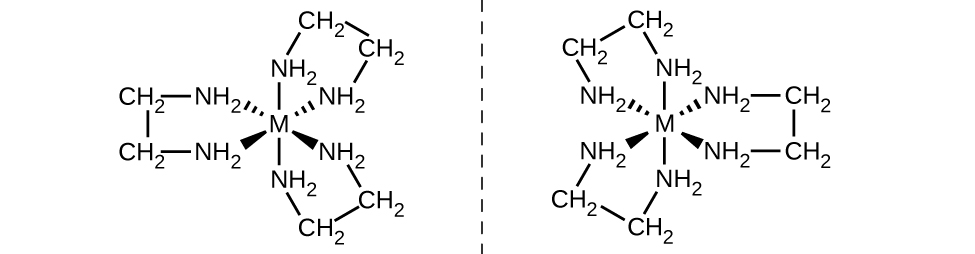
The [Co(en)2Cl2]+ ion exhibits geometric isomerism (cis/trans), and its cis isomer exists as a pair of optical isomers (Figure \(\PageIndex{12}\)).

Linkage isomers occur when the coordination compound contains a ligand that can bind to the transition metal center through two different atoms. For example, the CN ligand can bind through the carbon atom (cyano) or through the nitrogen atom (isocyano). Similarly, SCN− can be bound through the sulfur or nitrogen atom, affording two distinct compounds ([Co(NH3)5SCN]2+ or [Co(NH3)5NCS]2+).
Ionization isomers (or coordination isomers) occur when one anionic ligand in the inner coordination sphere is replaced with the counter ion from the outer coordination sphere. A simple example of two ionization isomers are [CoCl6][Br] and [CoCl5Br][Cl].
Coordination Complexes in Nature and Technology
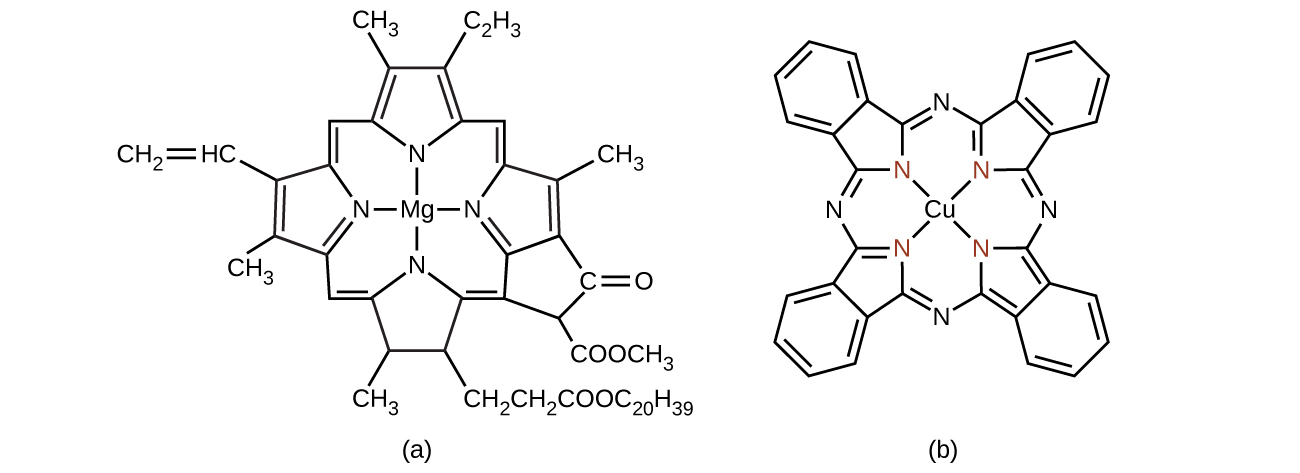
Chlorophyll, the green pigment in plants, is a complex that contains magnesium (Figure \(\PageIndex{13}\)). This is an example of a main group element in a coordination complex. Plants appear green because chlorophyll absorbs red and purple light; the reflected light consequently appears green. The energy resulting from the absorption of light is used in photosynthesis.
Transition Metal Catalysts
One of the most important applications of transition metals is as industrial catalysts. As you recall from the chapter on kinetics, a catalyst increases the rate of reaction by lowering the activation energy and is regenerated in the catalytic cycle. Over 90% of all manufactured products are made with the aid of one or more catalysts. The ability to bind ligands and change oxidation states makes transition metal catalysts well suited for catalytic applications. Vanadium oxide is used to produce 230,000,000 tons of sulfuric acid worldwide each year, which in turn is used to make everything from fertilizers to cans for food. Plastics are made with the aid of transition metal catalysts, along with detergents, fertilizers, paints, and more (Figure \(\PageIndex{14}\)). Very complicated pharmaceuticals are manufactured with catalysts that are selective, reacting with one specific bond out of a large number of possibilities. Catalysts allow processes to be more economical and more environmentally friendly. Developing new catalysts and better understanding of existing systems are important areas of current research.

Many other coordination complexes are also brightly colored. The square planar copper(II) complex phthalocyanine blue (from Figure \(\PageIndex{13}\)) is one of many complexes used as pigments or dyes. This complex is used in blue ink, blue jeans, and certain blue paints.
The structure of heme (Figure \(\PageIndex{15}\)), the iron-containing complex in hemoglobin, is very similar to that in chlorophyll. In hemoglobin, the red heme complex is bonded to a large protein molecule (globin) by the attachment of the protein to the heme ligand. Oxygen molecules are transported by hemoglobin in the blood by being bound to the iron center. When the hemoglobin loses its oxygen, the color changes to a bluish red. Hemoglobin will only transport oxygen if the iron is Fe2+; oxidation of the iron to Fe3+ prevents oxygen transport.
Complexing agents often are used for water softening because they tie up such ions as Ca2+, Mg2+, and Fe2+, which make water hard. Many metal ions are also undesirable in food products because these ions can catalyze reactions that change the color of food. Coordination complexes are useful as preservatives. For example, the ligand EDTA, (HO2CCH2)2NCH2CH2N(CH2CO2H)2, coordinates to metal ions through six donor atoms and prevents the metals from reacting (Figure \(\PageIndex{16}\)). This ligand also is used to sequester metal ions in paper production, textiles, and detergents, and has pharmaceutical uses.
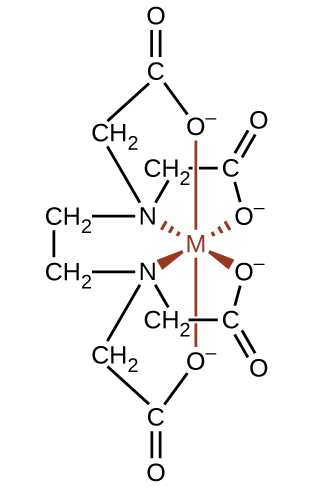
Complexing agents that tie up metal ions are also used as drugs. British Anti-Lewisite (BAL), HSCH2CH(SH)CH2OH, is a drug developed during World War I as an antidote for the arsenic-based war gas Lewisite. BAL is now used to treat poisoning by heavy metals, such as arsenic, mercury, thallium, and chromium. The drug is a ligand and functions by making a water-soluble chelate of the metal; the kidneys eliminate this metal chelate (Figure \(\PageIndex{17}\)). Another polydentate ligand, enterobactin, which is isolated from certain bacteria, is used to form complexes of iron and thereby to control the severe iron buildup found in patients suffering from blood diseases such as Cooley’s anemia, who require frequent transfusions. As the transfused blood breaks down, the usual metabolic processes that remove iron are overloaded, and excess iron can build up to fatal levels. Enterobactin forms a water-soluble complex with excess iron, and the body can safely eliminate this complex.

Ligands like BAL and enterobactin are important in medical treatments for heavy metal poisoning. However, chelation therapies can disrupt the normal concentration of ions in the body, leading to serious side effects, so researchers are searching for new chelation drugs. One drug that has been developed is dimercaptosuccinic acid (DMSA), shown in Figure \(\PageIndex{18}\). Identify which atoms in this molecule could act as donor atoms.
Solution
All of the oxygen and sulfur atoms have lone pairs of electrons that can be used to coordinate to a metal center, so there are six possible donor atoms. Geometrically, only two of these atoms can be coordinated to a metal at once. The most common binding mode involves the coordination of one sulfur atom and one oxygen atom, forming a five-member ring with the metal.
Some alternative medicine practitioners recommend chelation treatments for ailments that are not clearly related to heavy metals, such as cancer and autism, although the practice is discouraged by many scientific organizations.1 Identify at least two biologically important metals that could be disrupted by chelation therapy.
- Answer
-
Ca, Fe, Zn, and Cu
Ligands are also used in the electroplating industry. When metal ions are reduced to produce thin metal coatings, metals can clump together to form clusters and nanoparticles. When metal coordination complexes are used, the ligands keep the metal atoms isolated from each other. It has been found that many metals plate out as a smoother, more uniform, better-looking, and more adherent surface when plated from a bath containing the metal as a complex ion. Thus, complexes such as [Ag(CN)2]− and [Au(CN)2]− are used extensively in the electroplating industry.
In 1965, scientists at Michigan State University discovered that there was a platinum complex that inhibited cell division in certain microorganisms. Later work showed that the complex was cis-diaminedichloroplatinum(II), [Pt(NH3)2(Cl)2], and that the trans isomer was not effective. The inhibition of cell division indicated that this square planar compound could be an anticancer agent. In 1978, the US Food and Drug Administration approved this compound, known as cisplatin, for use in the treatment of certain forms of cancer. Since that time, many similar platinum compounds have been developed for the treatment of cancer. In all cases, these are the cis isomers and never the trans isomers. The diamine (NH3)2 portion is retained with other groups, replacing the dichloro [(Cl)2] portion. The newer drugs include carboplatin, oxaliplatin, and satraplatin.
Summary
The transition elements and main group elements can form coordination compounds, or complexes, in which a central metal atom or ion is bonded to one or more ligands by coordinate covalent bonds. Ligands with more than one donor atom are called polydentate ligands and form chelates. The common geometries found in complexes are tetrahedral and square planar (both with a coordination number of four) and octahedral (with a coordination number of six). Cis and trans configurations are possible in some octahedral and square planar complexes. In addition to these geometrical isomers, optical isomers (molecules or ions that are mirror images but not superimposable) are possible in certain octahedral complexes. Coordination complexes have a wide variety of uses including oxygen transport in blood, water purification, and pharmaceutical use.
Footnotes
- National Council against Health Fraud, NCAHF Policy Statement on Chelation Therapy, (Peabody, MA, 2002).
Glossary
- bidentate ligand
- ligand that coordinates to one central metal through coordinate bonds from two different atoms
- central metal
- ion or atom to which one or more ligands is attached through coordinate covalent bonds
- chelate
- complex formed from a polydentate ligand attached to a central metal
- chelating ligand
- ligand that attaches to a central metal ion by bonds from two or more donor atoms
- cis configuration
- configuration of a geometrical isomer in which two similar groups are on the same side of an imaginary reference line on the molecule
- coordination compound
- substance consisting of atoms, molecules, or ions attached to a central atom through Lewis acid-base interactions
- coordination number
- number of coordinate covalent bonds to the central metal atom in a complex or the number of closest contacts to an atom in a crystalline form
- coordination sphere
- central metal atom or ion plus the attached ligands of a complex
- donor atom
- atom in a ligand with a lone pair of electrons that forms a coordinate covalent bond to a central metal
- ionization isomer
- (or coordination isomer) isomer in which an anionic ligand is replaced by the counter ion in the inner coordination sphere
- ligand
- ion or neutral molecule attached to the central metal ion in a coordination compound
- linkage isomer
- coordination compound that possesses a ligand that can bind to the transition metal in two different ways (CN− vs. NC−)
- monodentate
- ligand that attaches to a central metal through just one coordinate covalent bond
- optical isomer
- (also, enantiomer) molecule that is a nonsuperimposable mirror image with identical chemical and physical properties, except when it reacts with other optical isomers
- polydentate ligand
- ligand that is attached to a central metal ion by bonds from two or more donor atoms, named with prefixes specifying how many donors are present (e.g., hexadentate = six coordinate bonds formed)
- trans configuration
- configuration of a geometrical isomer in which two similar groups are on opposite sides of an imaginary reference line on the molecule


