19.1: Propriedades dos metais de transição e seus compostos
- Page ID
- 195530
- Descreva a abordagem geral para o isolamento de metais de transição de fontes naturais
- Descreva as propriedades físicas e químicas típicas dos metais de transição
- Identifique classes de compostos simples para metais de transição e descreva suas propriedades químicas
Temos contato diário com muitos metais de transição. O ferro ocorre em todos os lugares, desde os anéis do caderno espiral e os talheres da cozinha até automóveis, navios, prédios e na hemoglobina do sangue. O titânio é útil na fabricação de produtos leves e duráveis, como quadros de bicicletas, quadris artificiais e joias. O cromo é útil como revestimento protetor em encanamentos e detalhes automotivos.
Metais de transição são definidos como aqueles elementos que têm (ou facilmente formam) orbitais d parcialmente preenchidos. Conforme mostrado na Figura\(\PageIndex{2}\), os elementos do bloco d nos grupos 3—11 são elementos de transição. Os elementos do bloco f, também chamados de metais de transição interna (lantanídeos e actinídeos), também atendem a esse critério porque o orbital d está parcialmente ocupado antes dos orbitais f. Os orbitais d são preenchidos com a família do cobre (grupo 11); por esse motivo, a próxima família (grupo 12) tecnicamente não são elementos de transição. No entanto, os elementos do grupo 12 exibem algumas das mesmas propriedades químicas e são comumente incluídos nas discussões sobre metais de transição. Alguns químicos tratam os elementos do grupo 12 como metais de transição.

Os elementos do bloco d são divididos na primeira série de transição (os elementos Sc a Cu), a segunda série de transição (os elementos Y a Ag) e a terceira série de transição (o elemento La e os elementos Hf a Au). Actinium, Ac, é o primeiro membro da quarta série de transição, que também inclui Rf a Rg.
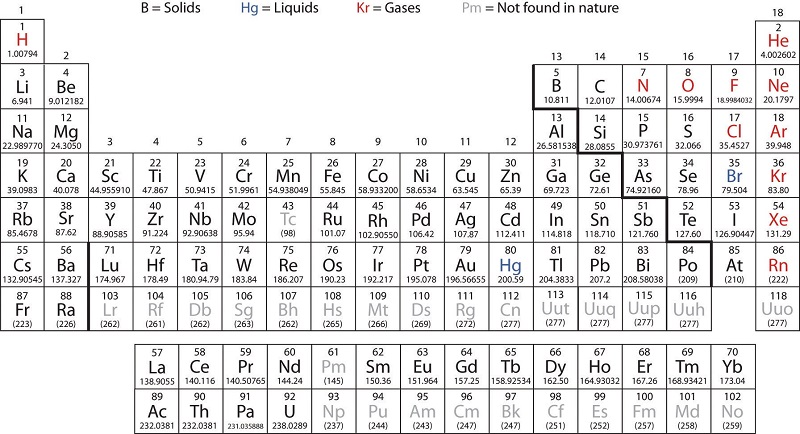
Os elementos do bloco f são os elementos Ce a Lu, que constituem a série dos lantanídeos (ou série dos lantanóides), e os elementos Th a Lr, que constituem a série dos actinídeos (ou série dos actinóides). Como o lantânio se comporta de forma muito semelhante aos elementos lantanídeos, ele é considerado um elemento lantanídeo, embora sua configuração eletrônica o torne o primeiro membro da terceira série de transição. Da mesma forma, o comportamento do actínio significa que ele faz parte da série de actinídeos, embora sua configuração eletrônica o torne o primeiro membro da quarta série de transição.
Analise como escrever configurações eletrônicas, abordadas no capítulo sobre estrutura eletrônica e propriedades periódicas dos elementos. Lembre-se de que, para os metais de transição e de transição interna, é necessário remover os elétrons s antes dos elétrons d ou f. Então, para cada íon, forneça a configuração eletrônica:
- cério (III)
- chumbo (II)
- Até 2 +
- Tenho mais de 3 anos
- Pd 2 +
Para os exemplos que são metais de transição, determine a qual série eles pertencem.
Solução
Para íons, os elétrons de valência s são perdidos antes dos elétrons d ou f.
- Ce 3 + [Xe] 4 f 1; Ce 3 + é um elemento de transição interno na série dos lantanídeos.
- Pb 2 + [Xe] 6 s 2 5 d 10 4 f 14; os elétrons são perdidos do orbital p. Esse é um elemento principal do grupo.
- titânio (II) [Ar] 3 d 2; primeira série de transição
- Camerício (III) [Rn] 5 de 6; actinídeo
- paládio (II) [Kr] 4 d 8; segunda série de transição
Verifique seu aprendizado Dê um exemplo de um íon da primeira série de transição sem elétrons d.
- Resposta
-
V 5+ é uma possibilidade. Outros exemplos incluem Sc 3 +, Ti 4 +, Cr 6 + e Mn 7 +.
Os lantanídeos (elementos 57—71) são bastante abundantes na crosta terrestre, apesar de sua caracterização histórica como elementos de terras raras. O túlio, o lantanóide natural mais raro, é mais comum na crosta terrestre do que a prata (4,5 × 10 −5% versus 0,79 × 10 −5% em massa). Existem 17 elementos de terras raras, consistindo de 15 lantanóides mais escândio e ítrio. Eles são chamados de raros porque antes eram difíceis de extrair economicamente, então era raro ter uma amostra pura; devido a propriedades químicas semelhantes, é difícil separar qualquer lantanídeo dos outros. No entanto, métodos de separação mais recentes, como resinas de troca iônica semelhantes às encontradas em amaciadores de água domésticos, tornam a separação desses elementos mais fácil e econômica. A maioria dos minérios que contêm esses elementos tem baixas concentrações de todos os elementos de terras raras misturados.
As aplicações comerciais dos lantanídeos estão crescendo rapidamente. Por exemplo, o európio é importante em telas de tela plana encontradas em monitores de computador, telefones celulares e televisores. O neodímio é útil em discos rígidos de laptops e nos processos que convertem petróleo bruto em gasolina (Figura\(\PageIndex{3}\)). O hólmio é encontrado em equipamentos odontológicos e médicos. Além disso, muitas tecnologias alternativas de energia dependem fortemente dos lantanóides. O neodímio e o disprósio são os principais componentes dos motores de veículos híbridos e dos ímãs usados em turbinas eólicas.

Como a demanda por materiais lantanídeos aumentou mais rápido do que a oferta, os preços também aumentaram. Em 2008, o disprósio custou $110/kg; em 2014, o preço aumentou para $470/kg. Aumentar a oferta de elementos lantanóides é um dos desafios mais significativos enfrentados pelas indústrias que dependem das propriedades ópticas e magnéticas desses materiais.
Os elementos de transição têm muitas propriedades em comum com outros metais. Quase todos são sólidos duros e de alto ponto de fusão que conduzem bem o calor e a eletricidade. Eles prontamente formam ligas e perdem elétrons para formar cátions estáveis. Além disso, os metais de transição formam uma grande variedade de compostos de coordenação estáveis, nos quais o átomo ou íon central do metal atua como um ácido de Lewis e aceita um ou mais pares de elétrons. Muitas moléculas e íons diferentes podem doar pares solitários para o centro de metal, servindo como bases de Lewis. Neste capítulo, vamos nos concentrar principalmente no comportamento químico dos elementos da primeira série de transição.
Propriedades dos elementos de transição
Os metais de transição demonstram uma ampla gama de comportamentos químicos. Como pode ser visto em seus potenciais de redução (Tabela P1), alguns metais de transição são agentes redutores fortes, enquanto outros têm reatividade muito baixa. Por exemplo, todos os lantanídeos formam cátions aquosos estáveis com mais de 3 anos. A força motriz para essas oxidações é semelhante à dos metais alcalino-terrosos, como Be ou Mg, formando Be 2 + e Mg 2 +. Por outro lado, materiais como platina e ouro têm potenciais de redução muito maiores. Sua capacidade de resistir à oxidação os torna materiais úteis para a construção de circuitos e joias.
Os íons dos elementos mais leves do bloco d, como Cr 3 +, Fe 3 + e Co 2 +, formam íons hidratados coloridos que são estáveis na água. No entanto, os íons no período logo abaixo desses (Mo 3 +, Ru 3 + e Ir 2 +) são instáveis e reagem prontamente com o oxigênio do ar. A maioria dos íons simples e estáveis à água formados pelos elementos mais pesados do bloco d são oxiânions como\(\ce{MoO4^2-}\)\(\ce{ReO4-}\) e.
Rutênio, ósmio, ródio, irídio, paládio e platina são os metais de platina. Com dificuldade, eles formam cátions simples que são estáveis na água e, diferentemente dos elementos anteriores da segunda e terceira séries de transição, eles não formam oxiânions estáveis.
Os elementos do bloco d e f reagem com os não metais para formar compostos binários; o aquecimento geralmente é necessário. Esses elementos reagem com halogênios para formar uma variedade de haletos que variam em estado de oxidação de 1+ a 6+. No aquecimento, o oxigênio reage com todos os elementos de transição, exceto paládio, platina, prata e ouro. Os óxidos desses últimos metais podem ser formados usando outros reagentes, mas eles se decompõem com o aquecimento. Os elementos do bloco f, os elementos do grupo 3 e os elementos da primeira série de transição, exceto o cobre, reagem com soluções aquosas de ácidos, formando gás hidrogênio e soluções dos sais correspondentes.
Metais de transição podem formar compostos com uma ampla variedade de estados de oxidação. Alguns dos estados de oxidação observados dos elementos da primeira série de transição são mostrados na Figura\(\PageIndex{4}\). À medida que avançamos da esquerda para a direita na primeira série de transição, vemos que o número de estados comuns de oxidação aumenta no início até o máximo no meio da tabela e depois diminui. Os valores na tabela são valores típicos; existem outros valores conhecidos e é possível sintetizar novas adições. Por exemplo, em 2014, os pesquisadores tiveram sucesso em sintetizar um novo estado de oxidação do irídio (9+).
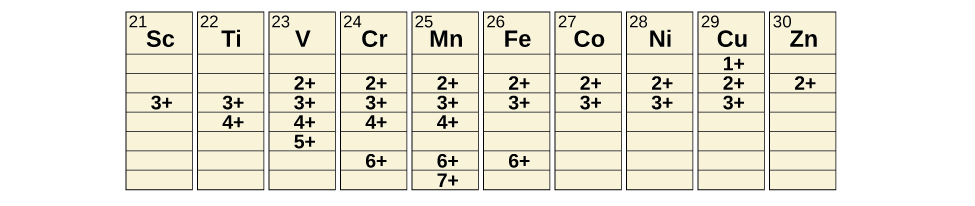
Para os elementos escândio a manganês (a primeira metade da primeira série de transição), o maior estado de oxidação corresponde à perda de todos os elétrons nos orbitais s e d de suas camadas de valência. O íon titânio (IV), por exemplo, é formado quando o átomo de titânio perde seus dois elétrons 3 d e dois 4 s. Esses estados de oxidação mais altos são as formas mais estáveis de escândio, titânio e vanádio. No entanto, não é possível continuar removendo todos os elétrons de valência dos metais à medida que continuamos na série. Sabe-se que o ferro forma estados de oxidação de 2+ a 6+, sendo o ferro (II) e o ferro (III) os mais comuns. A maioria dos elementos da primeira série de transição forma íons com uma carga de 2+ ou 3+ que são estáveis na água, embora os dos primeiros membros da série possam ser facilmente oxidados pelo ar.
Os elementos da segunda e terceira séries de transição geralmente são mais estáveis em estados de oxidação mais altos do que os elementos da primeira série. Em geral, o raio atômico aumenta em um grupo, o que faz com que os íons da segunda e terceira séries sejam maiores do que os da primeira série. Remover elétrons de orbitais localizados mais distantes do núcleo é mais fácil do que remover elétrons próximos ao núcleo. Por exemplo, o molibdênio e o tungstênio, membros do grupo 6, são limitados principalmente a um estado de oxidação de 6+ em solução aquosa. O cromo, o membro mais leve do grupo, forma íons Cr 3 + estáveis na água e, na ausência de ar, íons Cr 2 + menos estáveis. O sulfeto com o maior estado de oxidação para o cromo é Cr 2 S 3, que contém o íon Cr 3 +. O molibdênio e o tungstênio formam sulfetos nos quais os metais exibem estados de oxidação de 4+ e 6+.
Qual é o agente oxidante mais forte em solução ácida: íon dicromato, que contém cromo (VI), íon permanganato, que contém manganês (VII) ou dióxido de titânio, que contém titânio (IV)?
Solução
Primeiro, precisamos pesquisar as meias-reações de redução (Tabela P1) para cada óxido no estado de oxidação especificado:
\[\ce{Cr2O7^2- + 14H+ + 6e- ⟶ 2Cr^3+ + 7H2O} \hspace{20px} \mathrm{+1.33\: V} \nonumber \]
\[\ce{MnO4- + 8H+ + 5e- ⟶ Mn^2+ + H2O} \hspace{20px} \mathrm{+1.51\: V} \nonumber \]
\[\ce{TiO2 + 4H+ + 2e- ⟶ Ti^2+ + 2H2O} \hspace{20px} \mathrm{−0.50\: V} \nonumber \]
Um maior potencial de redução significa que é mais fácil reduzir o reagente. O permanganato, com o maior potencial de redução, é o oxidante mais forte nessas condições. O dicromato vem em seguida, seguido pelo dióxido de titânio como o agente oxidante mais fraco (o mais difícil de reduzir) desse conjunto.
Preveja qual reação (se houver) ocorrerá entre HCl e Co (s) e entre HBr e Pt (s). Você precisará usar os potenciais de redução padrão da (Tabela P1).
- Resposta
-
\(\ce{Co}(s)+\ce{2HCl}⟶\ce{H2}+\ce{CoCl2}(aq)\); nenhuma reação porque Pt (s) não será oxidado por H +
Preparação dos elementos de transição
Civilizações antigas conheciam ferro, cobre, prata e ouro. Os períodos da história da humanidade conhecidos como Idade do Bronze e Idade do Ferro marcam os avanços nos quais as sociedades aprenderam a isolar certos metais e usá-los para fabricar ferramentas e bens. Minérios naturais de cobre, prata e ouro podem conter altas concentrações desses metais na forma elementar (Figura\(\PageIndex{5}\)). O ferro, por outro lado, ocorre na Terra quase exclusivamente em formas oxidadas, como ferrugem (Fe 2 O 3). Os primeiros implementos de ferro conhecidos foram feitos de meteoritos de ferro. Artefatos de ferro sobreviventes que datam de aproximadamente 4000 a 2500 a.C., são raros, mas todos os exemplos conhecidos contêm ligas específicas de ferro e níquel que ocorrem somente em objetos extraterrestres, não na Terra. Foram necessários milhares de anos de avanços tecnológicos antes que as civilizações desenvolvessem a fundição de ferro, a capacidade de extrair um elemento puro de seus minérios naturais e fazer com que as ferramentas de ferro se tornassem comuns.

Geralmente, os elementos de transição são extraídos de minerais encontrados em uma variedade de minérios. No entanto, a facilidade de sua recuperação varia muito, dependendo da concentração do elemento no minério, da identidade dos outros elementos presentes e da dificuldade de reduzir o elemento ao metal livre.
Em geral, não é difícil reduzir os íons dos elementos do bloco d ao elemento livre. O carbono é um agente redutor suficientemente forte na maioria dos casos. No entanto, como os íons dos metais mais ativos do grupo principal, os íons dos elementos do bloco f devem ser isolados por eletrólise ou por redução com um metal ativo, como o cálcio.
Discutiremos os processos usados para o isolamento de ferro, cobre e prata porque esses três processos ilustram os principais meios de isolar a maioria dos metais do bloco d. Em geral, cada um desses processos envolve três etapas principais: tratamento preliminar, fundição e refino.
- Tratamento preliminar. Em geral, há um tratamento inicial dos minérios para torná-los adequados para a extração dos metais. Isso geralmente envolve triturar ou moer o minério, concentrar os componentes que contêm metal e, às vezes, tratar essas substâncias quimicamente para convertê-las em compostos que são mais fáceis de reduzir ao metal.
- Fundição. A próxima etapa é a extração do metal no estado fundido, um processo chamado fundição, que inclui a redução do composto metálico ao metal. As impurezas podem ser removidas pela adição de um composto que forma uma escória — uma substância com baixo ponto de fusão que pode ser facilmente separada do metal fundido.
- Refinando. A etapa final na recuperação de um metal é refinar o metal. Metais de baixo ponto de ebulição, como zinco e mercúrio, podem ser refinados por destilação. Quando fundidos em uma mesa inclinada, metais de baixo ponto de fusão, como o estanho, fluem para longe das impurezas de maior fusão. A eletrólise é outro método comum para refinar metais.
Isolamento do ferro
A aplicação precoce do ferro na fabricação de ferramentas e armas foi possível devido à ampla distribuição de minérios de ferro e à facilidade com que os compostos de ferro nos minérios poderiam ser reduzidos pelo carbono. Por muito tempo, o carvão vegetal foi a forma de carbono usada no processo de redução. A produção e o uso do ferro se tornaram muito mais difundidos por volta de 1620, quando o coque foi introduzido como agente redutor. O coque é uma forma de carbono formada pelo aquecimento do carvão na ausência de ar para remover as impurezas.
O primeiro passo na metalurgia do ferro geralmente é torrar o minério (aquecendo o minério no ar) para remover a água, decompor os carbonatos em óxidos e converter sulfetos em óxidos. Os óxidos são então reduzidos em um alto-forno de 80 a 100 pés de altura e cerca de 25 pés de diâmetro (Figura\(\PageIndex{6}\)), no qual o minério torrado, o coque e o calcário (CaCO 3 impuro) são introduzidos continuamente no topo. O ferro fundido e a escória são retirados na parte inferior. Todo o estoque em um forno pode pesar várias centenas de toneladas.

Perto do fundo de um forno, há bicos através dos quais o ar pré-aquecido é soprado para dentro do forno. Assim que o ar entra, o coque na região dos bicos é oxidado em dióxido de carbono com a liberação de uma grande quantidade de calor. O dióxido de carbono quente passa para cima através da camada sobrejacente de coque em brasa, onde é reduzido a monóxido de carbono:
\[\ce{CO2}(g)+\ce{C}(s)⟶\ce{2CO}(g) \nonumber \]
O monóxido de carbono serve como agente redutor nas regiões superiores do forno. As reações individuais estão indicadas na Figura\(\PageIndex{6}\).
Os óxidos de ferro são reduzidos na região superior do forno. Na região central, o calcário (carbonato de cálcio) se decompõe e o óxido de cálcio resultante se combina com sílica e silicatos no minério para formar escória. A escória é principalmente silicato de cálcio e contém a maioria dos componentes comercialmente sem importância do minério:
\[\ce{CaO}(s)+\ce{SiO2}(s)⟶\ce{CaSiO3}(l) \nonumber \]
Logo abaixo do meio do forno, a temperatura é alta o suficiente para derreter tanto o ferro quanto a escória. Eles se acumulam em camadas no fundo do forno; a escória menos densa flutua no ferro e o protege da oxidação. Várias vezes ao dia, a escória e o ferro fundido são retirados do forno. O ferro é transferido para máquinas de fundição ou para uma usina siderúrgica (Figura\(\PageIndex{7}\)).

Grande parte do ferro produzido é refinado e convertido em aço. O aço é feito de ferro removendo impurezas e adicionando substâncias como manganês, cromo, níquel, tungstênio, molibdênio e vanádio para produzir ligas com propriedades que tornam o material adequado para usos específicos. A maioria dos aços também contém porcentagens pequenas, mas definidas, de carbono (0,04% — 2,5%). No entanto, grande parte do carbono contido no ferro deve ser removida na fabricação do aço; caso contrário, o excesso de carbono tornaria o ferro quebradiço.
Isolamento de cobre
Os minérios de cobre mais importantes contêm sulfetos de cobre (como covelita, CuS), embora óxidos de cobre (como tenorita, CuO) e hidroxicarbonatos de cobre [como malaquita, Cu 2 (OH) 2 CO 3] às vezes sejam encontrados. Na produção de cobre metálico, o minério de sulfeto concentrado é torrado para remover parte do enxofre como dióxido de enxofre. A mistura restante, que consiste em Cu 2 S, FeS, FeO e SiO 2, é misturada com calcário, que serve como um fluxo (um material que auxilia na remoção de impurezas) e aquecida. A escória derretida se forma quando o ferro e a sílica são removidos pelas reações ácido-base de Lewis:
\[\ce{CaCO3}(s)+\ce{SiO2}(s)⟶\ce{CaSiO3}(l)+\ce{CO2}(g) \nonumber \]
\[\ce{FeO}(s)+\ce{SiO2}(s)⟶\ce{FeSiO3}(l) \nonumber \]
Nessas reações, o dióxido de silício se comporta como um ácido de Lewis, que aceita um par de elétrons da base de Lewis (o íon óxido).
A redução do Cu 2 S que permanece após a fundição é realizada pelo sopro de ar através do material fundido. O ar converte parte do Cu 2 S em Cu 2 O. Assim que o óxido de cobre (I) é formado, ele é reduzido pelo sulfeto de cobre (I) restante em cobre metálico:
\[\ce{2Cu2S}(l)+\ce{3O2}(g)⟶\ce{2Cu2O}(l)+\ce{2SO2}(g) \nonumber \]
\[\ce{2Cu2O}(l)+\ce{Cu2S}(l)⟶\ce{6Cu}(l)+\ce{SO2}(g) \nonumber \]
O cobre obtido dessa forma é chamado de cobre blister devido à sua aparência característica, que se deve às bolhas de ar que contém (Figura\(\PageIndex{8}\)). Esse cobre impuro é fundido em placas grandes, que são usadas como ânodos no refino eletrolítico do metal (descrito no capítulo sobre eletroquímica).

Isolamento da prata
Às vezes, a prata ocorre em pepitas grandes (Figura\(\PageIndex{9}\)), mas com mais frequência em veias e depósitos relacionados. Ao mesmo tempo, a panificação era um método eficaz de isolar pepitas de prata e ouro. Devido à sua baixa reatividade, esses metais, e alguns outros, ocorrem em depósitos como pepitas. A descoberta da platina se deve ao fato de exploradores espanhóis na América Central confundirem pepitas de platina com prata. Quando o metal não está na forma de pepitas, muitas vezes é útil empregar um processo chamado hidrometalurgia para separar a prata de seus minérios.

A hidrologia envolve a separação de um metal de uma mistura, primeiro convertendo-o em íons solúveis e depois extraindo-os e reduzindo-os para precipitar o metal puro. Na presença de ar, os cianetos de metais alcalinos formam facilmente o íon dicianoargentato (I) solúvel\(\ce{[Ag(CN)2]-}\), a partir de metal prateado ou compostos contendo prata, como Ag 2 S e AgCl. As equações representativas são:
\[\ce{4Ag}(s)+\ce{8CN-}(aq)+\ce{O2}(g)+\ce{2H2O}(l)⟶\ce{4[Ag(CN)2]-}(aq)+\ce{4OH-}(aq) \nonumber \]
\[\ce{2Ag2S}(s)+\ce{8CN-}(aq)+\ce{O2}(g)+\ce{2H2O}(l)⟶\ce{4[Ag(CN)2]-}(aq)+\ce{2S}(s)+\ce{4OH-}(aq) \nonumber \]
\[\ce{AgCl}(s)+\ce{2CN-}(aq)⟶\ce{[Ag(CN)2]-}(aq)+\ce{Cl-}(aq) \nonumber \]
A prata é precipitada da solução de cianeto pela adição de íons zinco ou ferro (II), que servem como agente redutor:
\[\ce{2[Ag(CN)2]-}(aq)+\ce{Zn}(s)⟶\ce{2Ag}(s)+\ce{[Zn(CN)4]^2-}(aq) \nonumber \]
Uma das etapas para refinar a prata envolve a conversão da prata em íons dicianoargenato (I):
\[\ce{4Ag}(s)+\ce{8CN-}(aq)+\ce{O2}(g)+\ce{2H2O}(l)⟶\ce{4[Ag(CN)2]-}(aq)+\ce{4OH-}(aq) \nonumber \]
Explique por que o oxigênio deve estar presente para realizar a reação. Por que a reação não ocorre como:
\[\ce{4Ag}(s)+\ce{8CN-}(aq)⟶\ce{4[Ag(CN)2]-}(aq)? \nonumber \]
Então, lução
As cargas, assim como os átomos, devem se equilibrar nas reações. O átomo de prata está sendo oxidado do estado de oxidação 0 para o estado 1+. Sempre que algo perde elétrons, algo também deve ganhar elétrons (ser reduzido) para equilibrar a equação. O oxigênio é um bom agente oxidante para essas reações porque pode ganhar elétrons para passar do estado de oxidação 0 para o estado 2−.
Durante o refino do ferro, o carbono deve estar presente no alto-forno. Por que o carbono é necessário para converter óxido de ferro em ferro?
- Resposta
-
O carbono é convertido em CO, que é o agente redutor que aceita elétrons para que o ferro (III) possa ser reduzido a ferro (0).
Compostos de metais de transição
A ligação nos compostos simples dos elementos de transição varia de iônica a covalente. Em seus estados de oxidação mais baixos, os elementos de transição formam compostos iônicos; em seus estados de oxidação mais altos, eles formam compostos covalentes ou íons poliatômicos. A variação nos estados de oxidação exibida pelos elementos de transição confere a esses compostos uma química de redução de oxidação baseada em metal. A química de várias classes de compostos contendo elementos da série de transição segue.
Haletos
Os haletos anidros de cada um dos elementos de transição podem ser preparados pela reação direta do metal com halogênios. Por exemplo:
\[\ce{2Fe}(s)+\ce{3Cl2}(g)⟶\ce{2FeCl3}(s) \nonumber \]
O aquecimento de um haleto metálico com metal adicional pode ser usado para formar um haleto do metal com um estado de oxidação mais baixo:
\[\ce{Fe}(s)+\ce{2FeCl3}(s)⟶\ce{3FeCl2}(s) \nonumber \]
A estequiometria do haleto metálico resultante da reação do metal com um halogênio é determinada pelas quantidades relativas de metal e halogênio e pela resistência do halogênio como agente oxidante. Geralmente, o flúor forma metais contendo flúor em seus estados de oxidação mais elevados. Os outros halogênios podem não formar compostos análogos.
Em geral, a preparação de soluções estáveis de água dos haletos dos metais da primeira série de transição ocorre pela adição de um ácido hidrohálico a carbonatos, hidróxidos, óxidos ou outros compostos que contêm ânions básicos. As reações de amostra são:
\[\ce{NiCO3}(s)+\ce{2HF}(aq)⟶\ce{NiF2}(aq)+\ce{H2O}(l)+\ce{CO2}(g) \nonumber \]
\[\ce{Co(OH)2}(s)+\ce{2HBr}(aq)⟶\ce{CoBr2}(aq)+\ce{2H2O}(l) \nonumber \]
A maioria dos metais da primeira série de transição também se dissolve em ácidos, formando uma solução de sal e gás hidrogênio. Por exemplo:
\[\ce{Cr}(s)+\ce{2HCl}(aq)⟶\ce{CrCl2}(aq)+\ce{H2}(g) \nonumber \]
A polaridade das ligações com metais de transição varia com base não apenas nas eletronegatividades dos átomos envolvidos, mas também no estado de oxidação do metal de transição. Lembre-se de que a polaridade da ligação é um espectro contínuo com elétrons sendo compartilhados uniformemente (ligações covalentes) em um extremo e elétrons sendo transferidos completamente (ligações iônicas) no outro. Nenhuma ligação é 100% iônica, e o grau em que os elétrons são distribuídos uniformemente determina muitas propriedades do composto. Halogenetos de metais de transição com baixos números de oxidação formam mais ligações iônicas. Por exemplo, o cloreto de titânio (II) e o cloreto de titânio (III) (TiCl 2 e TiCl 3) têm altos pontos de fusão que são característicos dos compostos iônicos, mas o cloreto de titânio (IV) (TiCl 4) é um líquido volátil, consistente com ligações covalentes de titânio-cloro. Todos os haletos dos elementos mais pesados do bloco D têm características covalentes significativas.
O comportamento covalente dos metais de transição com estados de oxidação mais altos é exemplificado pela reação dos tetrahaletos metálicos com a água. Como o tetracloreto de silício covalente, os tetrahaletos de titânio e vanádio reagem com a água para fornecer soluções contendo os ácidos hidrohálicos correspondentes e os óxidos metálicos:
\[\ce{SiCl4}(l)+\ce{2H2O}(l)⟶\ce{SiO2}(s)+\ce{4HCl}(aq) \nonumber \]
\[\ce{TiCl4}(l)+\ce{2H2O}(l)⟶\ce{TiO2}(s)+\ce{4HCl}(aq) \nonumber \]
Óxidos
Tal como acontece com os haletos, a natureza da ligação nos óxidos dos elementos de transição é determinada pelo estado de oxidação do metal. Óxidos com baixos estados de oxidação tendem a ser mais iônicos, enquanto aqueles com estados de oxidação mais altos são mais covalentes. Essas variações na ligação ocorrem porque as eletronegatividades dos elementos não são valores fixos. A eletronegatividade de um elemento aumenta com o aumento do estado de oxidação. Metais de transição em estados de baixa oxidação têm valores de eletronegatividade mais baixos do que o oxigênio; portanto, esses óxidos metálicos são iônicos. Metais de transição em estados de oxidação muito altos têm valores de eletronegatividade próximos aos do oxigênio, o que faz com que esses óxidos sejam covalentes.
Os óxidos da primeira série de transição podem ser preparados aquecendo os metais no ar. Esses óxidos são Sc 2 O 3, TiO 2, V 2 O 5, Cr 2 O 3, Mn 3 O 4, Fe 3 O 4, Co 3 O 4, NiO e CuO.
Alternativamente, esses óxidos e outros óxidos (com os metais em diferentes estados de oxidação) podem ser produzidos aquecendo os hidróxidos, carbonatos ou oxalatos correspondentes em uma atmosfera inerte. O óxido de ferro (II) pode ser preparado aquecendo o oxalato de ferro (II) e o óxido de cobalto (II) é produzido pelo aquecimento do hidróxido de cobalto (II):
\[\ce{FeC2O4}(s)⟶\ce{FeO}(s)+\ce{CO}(g)+\ce{CO2}(g) \nonumber \]
\[\ce{Co(OH)2}(s)⟶\ce{CoO}(s)+\ce{H2O}(g) \nonumber \]
Com exceção de CrO 3 e Mn 2 O 7, os óxidos de metais de transição não são solúveis em água. Eles podem reagir com ácidos e, em alguns casos, com bases. No geral, os óxidos de metais de transição com os estados de oxidação mais baixos são básicos (e reagem com ácidos), os intermediários são anfotéricos e os estados de oxidação mais altos são principalmente ácidos. Óxidos metálicos básicos em um estado de baixa oxidação reagem com ácidos aquosos para formar soluções de sais e água. Os exemplos incluem a reação do óxido de cobalto (II) aceitando prótons do ácido nítrico e do óxido de escândio (III) aceitando prótons do ácido clorídrico:
\[\ce{CoO}(s)+\ce{2HNO3}(aq)⟶\ce{Co(NO3)2}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{Sc2O3}(s)+\ce{6HCl}(aq)⟶\ce{2ScCl3}(aq)+\ce{3H2O}(l) \nonumber \]
Os óxidos de metais com estados de oxidação de 4+ são anfotéricos e a maioria não é solúvel em ácidos ou bases. O óxido de vanádio (V), o óxido de cromo (VI) e o óxido de manganês (VII) são ácidos. Eles reagem com soluções de hidróxidos para formar sais dos oxiânions\(\ce{VO4^3-}\)\(\ce{CrO4^2-}\),\(\ce{MnO4-}\) e. Por exemplo, a equação iônica completa para a reação do óxido de cromo (VI) com uma base forte é dada por:
\[\ce{CrO3}(s)+\ce{2Na+}(aq)+\ce{2OH-}(aq)⟶\ce{2Na+}(aq)+\ce{CrO4^2-}(aq)+\ce{H2O}(l) \nonumber \]
O óxido de cromo (VI) e o óxido de manganês (VII) reagem com a água para formar os ácidos H 2 CrO 4 e HMnO 4, respectivamente.
Hidróxidos
Quando um hidróxido solúvel é adicionado a uma solução aquosa de um sal de um metal de transição da primeira série de transição, forma-se um precipitado gelatinoso. Por exemplo, adicionar uma solução de hidróxido de sódio a uma solução de sulfato de cobalto produz um precipitado gelatinoso rosa ou azul de hidróxido de cobalto (II). A equação iônica líquida é:
\[\ce{Co^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Co(OH)2}(s) \nonumber \]
Neste e em muitos outros casos, esses precipitados são hidróxidos contendo o íon do metal de transição, íons hidróxido e água coordenados com o metal de transição. Em outros casos, os precipitados são óxidos hidratados compostos pelo íon metálico, íons óxido e água de hidratação:
\[\ce{4Fe^3+}(aq)+\ce{6OH-}(aq)+\ce{nH2O}(l)⟶\ce{2Fe2O3⋅(n + 3)H2O}(s) \nonumber \]
Essas substâncias não contêm íons hidróxido. No entanto, tanto os hidróxidos quanto os óxidos hidratados reagem com os ácidos para formar sais e água. Ao precipitar um metal da solução, é necessário evitar um excesso de íon hidróxido, pois isso pode levar à formação complexa de íons, conforme discutido posteriormente neste capítulo. Os hidróxidos metálicos precipitados podem ser separados para processamento adicional ou para descarte de resíduos.
Carbonatos
Muitos dos elementos da primeira série de transição formam carbonatos insolúveis. É possível preparar esses carbonatos pela adição de um sal de carbonato solúvel a uma solução de um sal de metal de transição. Por exemplo, o carbonato de níquel pode ser preparado a partir de soluções de nitrato de níquel e carbonato de sódio de acordo com a seguinte equação iônica líquida:
\[\ce{Ni^2+}(aq)+\ce{CO3^2-}⟶\ce{NiCO3}(s) \nonumber \]
As reações dos carbonatos de metais de transição são semelhantes às dos carbonatos de metais ativos. Eles reagem com ácidos para formar metais, sais, dióxido de carbono e água. Após o aquecimento, eles se decompõem, formando os óxidos de metais de transição.
Outros sais
Em muitos aspectos, o comportamento químico dos elementos da primeira série de transição é muito semelhante ao dos metais do grupo principal. Em particular, os mesmos tipos de reações usadas para preparar sais dos metais do grupo principal podem ser usados para preparar sais iônicos simples desses elementos.
Uma variedade de sais pode ser preparada a partir de metais que são mais ativos que o hidrogênio por reação com os ácidos correspondentes: o escândio metálico reage com o ácido bromídrico para formar uma solução de brometo de escândio:
\[\ce{2Sc}(s)+\ce{6HBr}(aq)⟶\ce{2ScBr3}(aq)+\ce{3H2}(g) \nonumber \]
Os compostos comuns que acabamos de discutir também podem ser usados para preparar sais. As reações envolvidas incluem as reações de óxidos, hidróxidos ou carbonatos com ácidos. Por exemplo:
\[\ce{Ni(OH)2}(s)+\ce{2H3O+}(aq)+\ce{2ClO4-}(aq)⟶\ce{Ni^2+}(aq)+\ce{2ClO4-}(aq)+\ce{4H2O}(l) \nonumber \]
Reações de substituição envolvendo sais solúveis podem ser usadas para preparar sais insolúveis. Por exemplo:
\[\ce{Ba^2+}(aq)+\ce{2Cl-}(aq)+\ce{2K+}(aq)+\ce{CrO4^2-}(aq)⟶\ce{BaCrO4}(s)+\ce{2K+}(aq)+\ce{2Cl-}(aq) \nonumber \]
Em nossa discussão sobre óxidos nesta seção, vimos que as reações dos óxidos covalentes dos elementos de transição com os hidróxidos formam sais que contêm oxiânions dos elementos de transição.
Supercondutores de alta temperatura
Um supercondutor é uma substância que conduz eletricidade sem resistência. Essa falta de resistência significa que não há perda de energia durante a transmissão de eletricidade. Isso levaria a uma redução significativa no custo da eletricidade.
Os materiais supercondutores comerciais mais usados atualmente, como NbTi e Nb 3 Sn, não se tornam supercondutores até serem resfriados abaixo de 23 K (−250 °C). Isso requer o uso de hélio líquido, que tem uma temperatura de ebulição de 4 K e é caro e difícil de manusear. O custo do hélio líquido impediu a ampla aplicação de supercondutores.
Uma das descobertas científicas mais empolgantes da década de 1980 foi a caracterização de compostos que exibem supercondutividade em temperaturas acima de 90 K. (Comparado ao hélio líquido, 90 K é uma temperatura alta). Entre os materiais supercondutores de alta temperatura, são os óxidos que contêm ítrio (ou um dos vários elementos de terras raras), bário e cobre na proporção de 1:2:3. A fórmula do composto iônico de ítrio é YbA 2 Cu 3 O 7.
Os novos materiais se tornam supercondutores em temperaturas próximas a 90 K (Figura\(\PageIndex{10}\)), temperaturas que podem ser alcançadas pelo resfriamento com nitrogênio líquido (temperatura de ebulição de 77 K). Não só os materiais refrigerados com nitrogênio líquido são mais fáceis de manusear, mas os custos de resfriamento também são cerca de 1000 vezes menores do que os do hélio líquido.
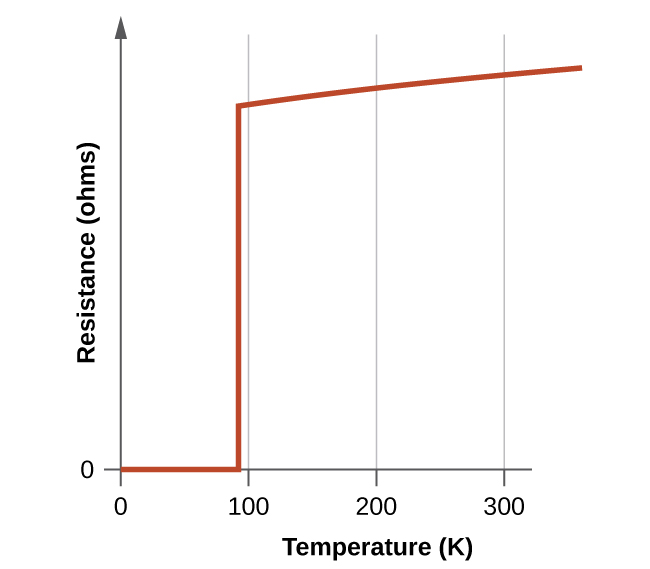
Embora a natureza frágil e frágil desses materiais atualmente dificulte suas aplicações comerciais, eles têm um enorme potencial que os pesquisadores estão trabalhando arduamente para melhorar seus processos para ajudar a realizar. As linhas de transmissão supercondutoras transportariam corrente por centenas de quilômetros sem perda de energia devido à resistência nos fios. Isso poderia permitir que as estações geradoras estivessem localizadas em áreas distantes dos centros populacionais e próximas aos recursos naturais necessários para a produção de energia. O primeiro projeto demonstrando a viabilidade da transmissão de energia supercondutora de alta temperatura foi estabelecido em Nova York em 2008.

Os pesquisadores também estão trabalhando no uso dessa tecnologia para desenvolver outras aplicações, como microchips menores e mais potentes. Além disso, supercondutores de alta temperatura podem ser usados para gerar campos magnéticos para aplicações como dispositivos médicos, trens de levitação magnética e campos de contenção para reatores de fusão nuclear (Figura\(\PageIndex{11}\)).
Resumo
Os metais de transição são elementos com orbitais d parcialmente preenchidos, localizados no bloco d da tabela periódica. A reatividade dos elementos de transição varia muito, desde metais muito ativos, como escândio e ferro, até elementos quase inertes, como os metais de platina. O tipo de química usado no isolamento dos elementos de seus minérios depende da concentração do elemento em seu minério e da dificuldade de reduzir os íons dos elementos aos metais. Metais mais ativos são mais difíceis de reduzir.
Os metais de transição apresentam um comportamento químico típico dos metais. Por exemplo, eles se oxidam no ar ao serem aquecidos e reagem com halogênios elementares para formar haletos. Os elementos que estão acima do hidrogênio na série de atividades reagem com os ácidos, produzindo sais e gás hidrogênio. Óxidos, hidróxidos e carbonatos de compostos de metais de transição em estados de baixa oxidação são básicos. Os haletos e outros sais geralmente são estáveis na água, embora o oxigênio deva ser excluído em alguns casos. A maioria dos metais de transição forma uma variedade de estados de oxidação estáveis, permitindo que eles demonstrem uma ampla gama de reatividade química.
Glossário
- série de actinídeos
- (também, série actinoide) actínio e os elementos na segunda linha ou no bloco f, números atômicos 89—103
- composto de coordenação
- composto estável no qual o átomo ou íon central do metal atua como um ácido de Lewis e aceita um ou mais pares de elétrons
- elemento de bloco d
- um dos elementos dos grupos 3—11 com elétrons de valência em orbitais d
- elemento de bloco f
- (também, elemento de transição interna), um dos elementos com números atômicos 58—71 ou 90—103 que têm elétrons de valência em orbitais f; eles são frequentemente mostrados deslocados abaixo da tabela periódica
- primeira série de transição
- elementos de transição no quarto período da tabela periódica (primeira linha do bloco d), números atômicos 21—29
- quarta série de transição
- elementos de transição no sétimo período da tabela periódica (quarta linha do bloco d), números atômicos 89 e 104—111
- hidrometalurgia
- processo no qual um metal é separado de uma mistura convertendo-o primeiro em íons solúveis, extraindo os íons e depois reduzindo os íons para precipitar o metal puro
- série de lantanídeos
- (também, série lantanóide) lantânio e os elementos na primeira linha ou no bloco f, números atômicos 57—71
- metais de platina
- grupo de seis metais de transição consistindo de rutênio, ósmio, ródio, irídio, paládio e platina que tendem a ocorrer nos mesmos minerais e demonstram propriedades químicas semelhantes
- elemento de terras raras
- coleção de 17 elementos, incluindo lantanídeos, escândio e ítrio, que geralmente ocorrem juntos e têm propriedades químicas semelhantes, dificultando a separação
- segunda série de transição
- elementos de transição no quinto período da tabela periódica (segunda linha do bloco d), números atômicos 39—47
- fundição
- processo de extração de um metal puro de um minério fundido
- aço
- material feito de ferro removendo as impurezas do ferro e adicionando substâncias que produzem ligas com propriedades adequadas para usos específicos
- supercondutor
- material que conduz eletricidade sem resistência
- terceira série de transição
- elementos de transição no sexto período da tabela periódica (terceira linha do bloco d), números atômicos 57 e 72—79


