18.2: Ocorrência e preparação dos metais representativos
- Page ID
- 194932
- Identifique fontes naturais de metais representativos
- Descreva os processos de redução eletrolítica e química usados para preparar esses elementos a partir de fontes naturais
Por causa de sua reatividade, não encontramos metais mais representativos como elementos livres na natureza. No entanto, os compostos que contêm íons da maioria dos metais representativos são abundantes. Nesta seção, consideraremos as duas técnicas comuns usadas para isolar os metais desses compostos: eletrólise e redução química.
Esses metais ocorrem principalmente em minerais, com lítio encontrado em minerais de silicato ou fosfato, e sódio e potássio encontrados em depósitos de sal devido à evaporação de mares antigos e em silicatos. Os metais alcalino-terrosos ocorrem como silicatos e, com exceção do berílio, como carbonatos e sulfatos. O berílio ocorre como o mineral berilo, Be 3 Al 2 Si 6 O 18, que, com certas impurezas, pode ser a pedra preciosa esmeralda ou água-marinha. O magnésio está na água do mar e, junto com os metais alcalino-terrosos mais pesados, ocorre como silicatos, carbonatos e sulfatos. O alumínio ocorre abundantemente em muitos tipos de argila e na bauxita, um hidróxido de óxido de alumínio impuro. O principal minério de estanho é o óxido de cassiterita, SnO 2, e os principais minérios de chumbo e tálio são os sulfetos ou os produtos do intemperismo dos sulfetos. Os metais representativos restantes ocorrem como impurezas em minérios de zinco ou alumínio.
Eletrólise
Os íons de metais dos grupos 1 e 2, junto com o alumínio, são muito difíceis de reduzir; portanto, é necessário preparar esses elementos por eletrólise, um processo importante discutido no capítulo sobre eletroquímica. Resumidamente, a eletrólise envolve o uso de energia elétrica para conduzir à conclusão de reações químicas desfavoráveis; é útil no isolamento de metais reativos em suas formas puras. Sódio, alumínio e magnésio são exemplos típicos.
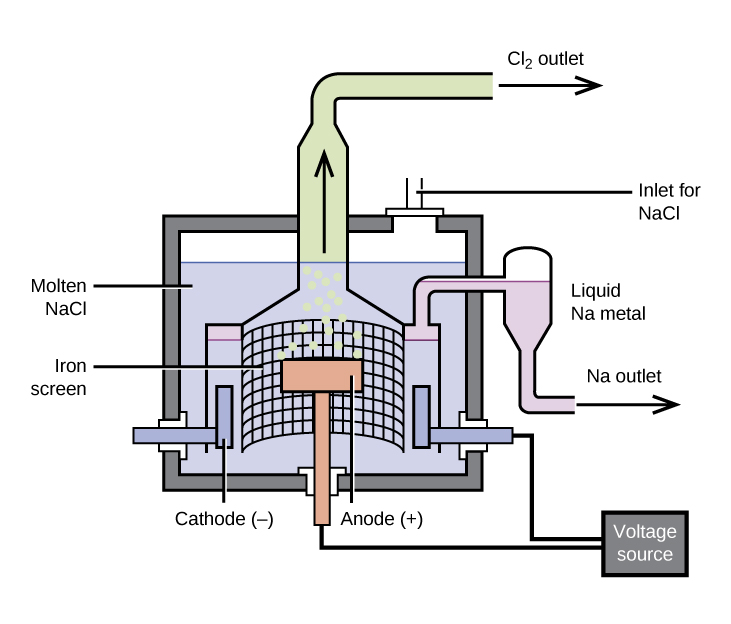
A preparação do sódio
O método mais importante para a produção de sódio é a eletrólise do cloreto de sódio fundido; a configuração é uma célula de Downs, mostrada na Figura\(\PageIndex{1}\). A reação envolvida nesse processo é:
\[\ce{2NaCl}(l)\:\mathrm{\underset{600\:°C}{\xrightarrow{electrolysis}}}\:\ce{2Na}(l)+\ce{Cl2}(g) \nonumber \]
A célula de eletrólise contém cloreto de sódio fundido (ponto de fusão 801° C), ao qual foi adicionado cloreto de cálcio para diminuir o ponto de fusão para 600° C (um efeito coligativo). A passagem de uma corrente contínua pela célula faz com que os íons de sódio migrem para o cátodo carregado negativamente e captem elétrons, reduzindo os íons a sódio metálico. Os íons cloreto migram para o ânodo carregado positivamente, perdem elétrons e sofrem oxidação em gás cloro. A reação celular geral vem da adição das seguintes reações:
\ [\ begin {align}
&\ textrm {no cátodo:}\ ce {2Na+} +\ ce {2e-} ⟶\ ce {2Na} (l)\\
&\ textrm {no ânodo:}\ ce {2Cl-} ⟶\ ce {Cl2} (g) +\ ce {2e-}\\
&\ textrm {mudança geral:}\ ce {2Na+} +\ ce {2Cl-} ⟶\ ce {2Na} (l) +\ ce {Cl2} (g)
\ end {align}\ nonumber\]
A separação do sódio e do cloro fundidos evita a recombinação. O sódio líquido, que é menos denso que o cloreto de sódio fundido, flutua até a superfície e flui para um coletor. O cloro gasoso vai para os tanques de armazenamento. O cloro também é um produto valioso.
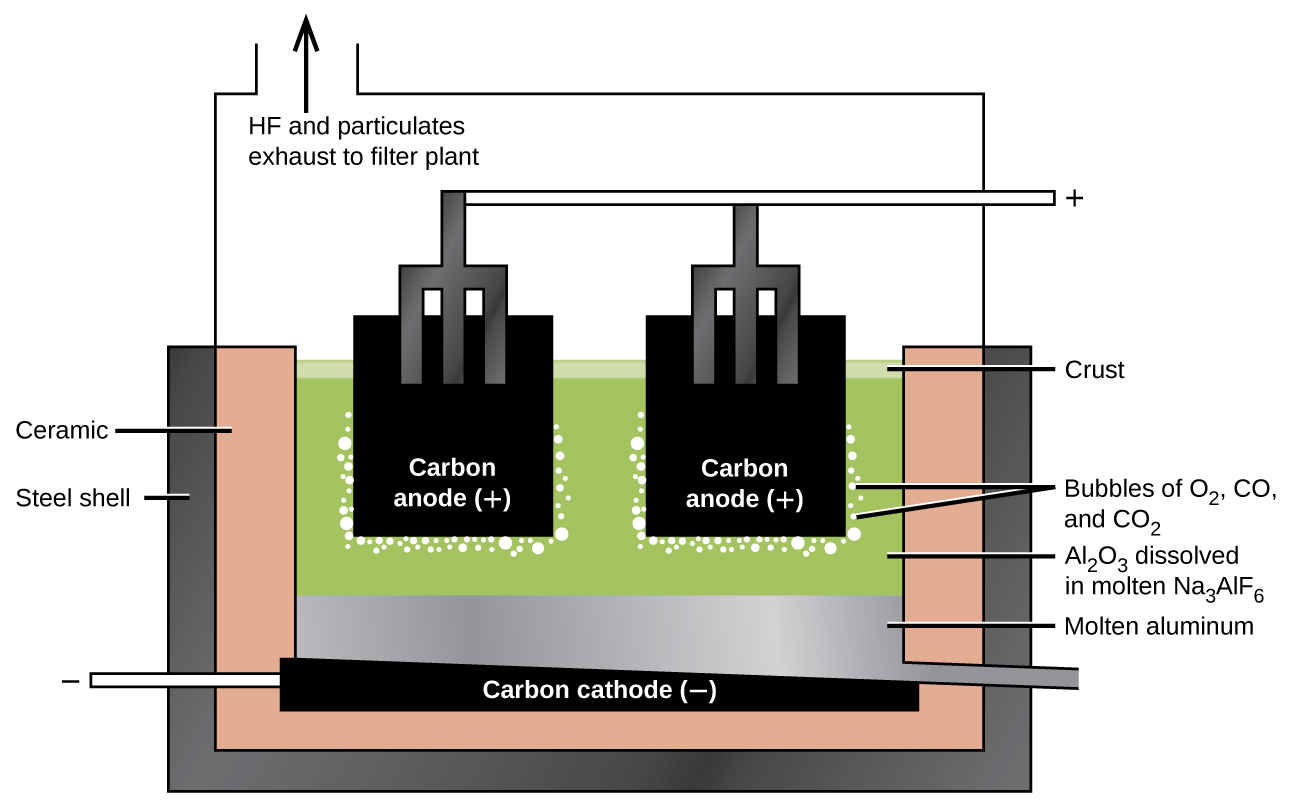
A preparação do alumínio
A preparação do alumínio utiliza um processo inventado em 1886 por Charles M. Hall, que começou a trabalhar no problema enquanto estudava no Oberlin College, em Ohio. Paul L. T. Héroult descobriu o processo de forma independente um ou dois meses depois na França. Em homenagem aos dois inventores, essa célula de eletrólise é conhecida como célula Hall-Héroult. A célula Hall—Héroult é uma célula de eletrólise para a produção de alumínio. A figura\(\PageIndex{2}\) ilustra a célula Hall-Héroult.
A produção de alumínio começa com a purificação da bauxita, a fonte mais comum de alumínio. A reação da bauxita, AlO (OH), com hidróxido de sódio quente forma aluminato de sódio solúvel, enquanto a argila e outras impurezas permanecem indissolvidas:
\[\ce{AlO(OH)}(s)+\ce{NaOH}(aq)+\ce{H2O}(l)⟶\ce{Na[Al(OH)4]}(aq) \nonumber \]
Após a remoção das impurezas por filtração, a adição de ácido ao aluminato leva à reprecipitação do hidróxido de alumínio:
\[\ce{Na[Al(OH)4]}(aq)+\ce{H3O+}(aq)⟶\ce{Al(OH)3}(s)+\ce{Na+}(aq)+\ce{2H2O}(l) \nonumber \]
O próximo passo é remover o hidróxido de alumínio precipitado por filtração. O aquecimento do hidróxido produz óxido de alumínio, Al 2 O 3, que se dissolve em uma mistura fundida de criolita, Na 3 AlF 6 e fluoreto de cálcio, CaF 2. A eletrólise dessa solução ocorre em uma célula como a mostrada na Figura\(\PageIndex{2}\). A redução dos íons de alumínio no metal ocorre no cátodo, enquanto oxigênio, monóxido de carbono e dióxido de carbono se formam no ânodo.
A preparação do magnésio
O magnésio é o outro metal que é isolado em grandes quantidades por eletrólise. A água do mar, que contém aproximadamente 0,5% de cloreto de magnésio, serve como a principal fonte de magnésio. A adição de hidróxido de cálcio à água do mar precipita o hidróxido de magnésio. A adição de ácido clorídrico ao hidróxido de magnésio, seguida pela evaporação da solução aquosa resultante, deixa o cloreto de magnésio puro. A eletrólise do cloreto de magnésio fundido forma magnésio líquido e cloro gasoso:
\[\ce{MgCl2}(aq)+\ce{Ca(OH)2}(aq)⟶\ce{Mg(OH)2}(s)+\ce{CaCl2}(aq) \nonumber \]
\[\ce{Mg(OH)2}(s)+\ce{2HCl}(aq)⟶\ce{MgCl2}(aq)+\ce{2H2O}(l) \nonumber \]
\[\ce{MgCl2}(l)⟶\ce{Mg}(l)+\ce{Cl2}(g) \nonumber \]
Algumas instalações de produção se afastaram completamente da eletrólise. Na próxima seção, veremos como o processo Pidgeon leva à redução química do magnésio.
Redução química
É possível isolar muitos dos metais representativos por redução química usando outros elementos como agentes redutores. Em geral, a redução química é muito mais barata do que a eletrólise e, por esse motivo, a redução química é o método de escolha para o isolamento desses elementos. Por exemplo, é possível produzir potássio, rubídio e césio por redução química, pois é possível reduzir os cloretos fundidos desses metais com metal sódico. Isso pode ser surpreendente, visto que esses metais são mais reativos que o sódio; no entanto, os metais formados são mais voláteis que o sódio e podem ser destilados para coleta. A remoção do vapor metálico leva a uma mudança no equilíbrio para produzir mais metal (através do princípio de Le Chatelier). A produção de magnésio, zinco e estanho fornecem exemplos adicionais de redução química.
A preparação do magnésio
O processo Pidgeon envolve a reação do óxido de magnésio com o silício elementar em altas temperaturas para formar magnésio puro:
\[\ce{Si}(s)+\ce{2MgO}(s)\xrightarrow{Δ}\ce{SiO2}(s)+\ce{2Mg}(g) \nonumber \]
Embora essa reação seja desfavorável em termos de termodinâmica, a remoção do vapor de magnésio produzido aproveita o princípio de Le Chatelier para continuar o progresso da reação. Mais de 75% da produção mundial de magnésio, principalmente na China, vem desse processo.
A preparação do zinco
Os minérios de zinco geralmente contêm sulfeto de zinco, óxido de zinco ou carbonato de zinco. Após a separação desses compostos dos minérios, o aquecimento no ar converte o minério em óxido de zinco por uma das seguintes reações:
\[\ce{2ZnS}(s)+\ce{3O2}(g)\xrightarrow{Δ}\ce{2ZnO}(s)+\ce{2SO2}(g) \nonumber \]
\[\ce{ZnCO3}(s)\xrightarrow{Δ}\ce{ZnO}(s)+\ce{CO2}(g) \nonumber \]
O carbono, na forma de carvão, reduz o óxido de zinco para formar vapor de zinco:
\[\ce{ZnO}(s)+\ce{C}(s)⟶\ce{Zn}(g)+\ce{CO}(g) \nonumber \]
O zinco pode ser destilado (ponto de ebulição de 907° C) e condensado. Este zinco contém impurezas de cádmio (767° C), ferro (2862° C), chumbo (1750° C) e arsênio (613° C). A redestilação cuidadosa produz zinco puro. O arsênico e o cádmio são destilados do zinco porque têm pontos de ebulição mais baixos. Em temperaturas mais altas, o zinco é destilado das outras impurezas, principalmente chumbo e ferro.
A preparação do estanho
A redução imediata do óxido de estanho (IV) pelas brasas de uma fogueira explica o conhecimento do estanho no mundo antigo. No processo moderno, a torrefação de minérios de estanho contendo SnO 2 remove contaminantes como arsênico e enxofre como óxidos voláteis. O tratamento do material restante com ácido clorídrico remove os óxidos de outros metais. O aquecimento do minério purificado com carbono a uma temperatura acima de 1000° C produz estanho:
\[\ce{SnO2}(s)+\ce{2C}(s)\xrightarrow{Δ}\ce{Sn}(s)+\ce{2CO}(g) \nonumber \]
O estanho derretido se acumula no fundo do forno e é retirado e fundido em blocos.
Resumo
Devido à sua reatividade química, é necessário produzir os metais representativos em suas formas puras por meio da redução de compostos que ocorrem naturalmente. A eletrólise é importante na produção de sódio, potássio e alumínio. A redução química é o principal método para o isolamento de magnésio, zinco e estanho. Procedimentos similares são importantes para os outros metais representativos.
Glossário
- redução química
- método de preparação de um metal representativo usando um agente redutor
- célula de Downs
- célula eletroquímica usada para a preparação comercial de sódio metálico (e cloro) a partir de cloreto de sódio fundido
- Célula Hall-Héroult
- aparelho de eletrólise usado para isolar metal de alumínio puro de uma solução de alumina em criolita fundida
- Processo Pidgeon
- processo de redução química usado para produzir magnésio através da reação térmica do óxido de magnésio com o silício


