18.1: Periodicidade
- Page ID
- 194909
- Classificar elementos
- Faça previsões sobre as propriedades de periodicidade dos elementos representativos
Começamos esta seção examinando o comportamento dos metais representativos em relação às suas posições na tabela periódica. O foco principal desta seção será a aplicação da periodicidade aos metais representativos.
É possível dividir elementos em grupos de acordo com suas configurações eletrônicas. Os elementos representativos são elementos em que os orbitais s e p estão se enchendo. Os elementos de transição são elementos em que os orbitais d (grupos 3—11 na tabela periódica) estão se enchendo, e os metais de transição internos são os elementos onde os orbitais f estão se enchendo. Os orbitais d são preenchidos com os elementos do grupo 11; portanto, os elementos do grupo 12 se qualificam como elementos representativos porque o último elétron entra em um orbital s. Os metais entre os elementos representativos estão os metais representativos. O caráter metálico resulta da capacidade de um elemento de perder seus elétrons de valência externa e resulta em alta condutividade térmica e elétrica, entre outras propriedades físicas e químicas. Existem 20 metais representativos não radioativos nos grupos 1, 2, 3, 12, 13, 14 e 15 da tabela periódica (os elementos sombreados em amarelo na Figura\(\PageIndex{1}\)). Os elementos radioativos copernicium, flerovium, polônio e livermorium também são metais, mas estão além do escopo deste capítulo.
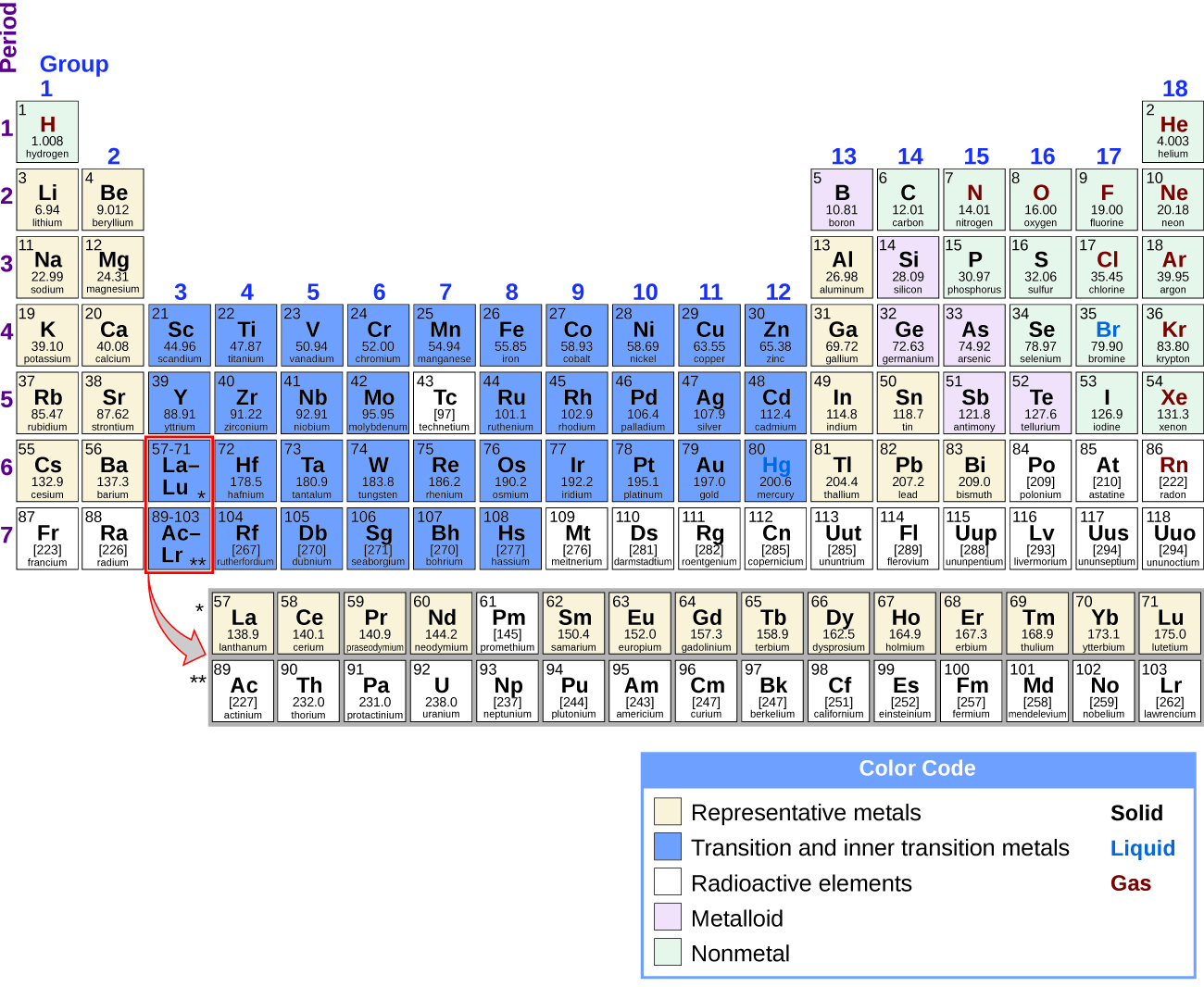
Além dos metais representativos, alguns dos elementos representativos são metalóides. Um metalóide é um elemento que tem propriedades que estão entre as de metais e não metais; esses elementos são tipicamente semicondutores. Os elementos representativos restantes são não metais. Ao contrário dos metais, que normalmente formam cátions e compostos iônicos (contendo ligações iônicas), os não metais tendem a formar ânions ou compostos moleculares. Em geral, a combinação de um metal e um não metal produz um sal. Um sal é um composto iônico que consiste em cátions e ânions.
Um sal é um composto iônico que consiste em cátions e ânions.
A maioria dos metais representativos não ocorre naturalmente em um estado não combinado porque eles reagem prontamente com a água e o oxigênio do ar. No entanto, é possível isolar os elementos de berílio, magnésio, zinco, cádmio, mercúrio, alumínio, estanho e chumbo de seus minerais naturais e usá-los porque eles reagem muito lentamente com o ar. Parte da razão pela qual esses elementos reagem lentamente é que esses elementos reagem com o ar para formar uma camada protetora. A formação desse revestimento protetor é passivação. O revestimento é uma película não reativa de óxido ou algum outro composto. Magnésio elementar, alumínio, zinco e estanho são importantes na fabricação de muitos itens familiares, incluindo arame, utensílios de cozinha, papel alumínio e muitos objetos domésticos e pessoais. Embora berílio, cádmio, mercúrio e chumbo estejam prontamente disponíveis, há limitações em seu uso devido à sua toxicidade.
Grupo 1: Os metais alcalinos
Os metais alcalinos lítio, sódio, potássio, rubídio, césio e frâncio constituem o grupo 1 da tabela periódica. Embora o hidrogênio esteja no grupo 1 (e também no grupo 17), ele não é metálico e merece consideração separada posteriormente neste capítulo. O nome metal alcalino se refere ao fato de que esses metais e seus óxidos reagem com a água para formar soluções muito básicas (alcalinas).
As propriedades dos metais alcalinos são semelhantes entre si, conforme o esperado para elementos da mesma família. Os metais alcalinos têm os maiores raios atômicos e a menor energia de primeira ionização em seus períodos. Essa combinação torna muito fácil remover o único elétron na camada externa (valência) de cada um. A fácil perda desse elétron de valência significa que esses metais facilmente formam cátions estáveis com uma carga de 1+. Sua reatividade aumenta com o aumento do número atômico devido à facilidade de perder o elétron de valência solitário (diminuição da energia de ionização). Como a oxidação é tão fácil, o inverso, a redução, é difícil, o que explica por que é difícil isolar os elementos. Os metais alcalinos sólidos são muito macios; o lítio, mostrado na Figura\(\PageIndex{2}\), tem a menor densidade de qualquer metal (0,5 g/cm 3).

Todos os metais alcalinos reagem vigorosamente com a água para formar gás hidrogênio e uma solução básica do hidróxido metálico. Isso significa que eles são mais fáceis de oxidar do que o hidrogênio. Como exemplo, a reação do lítio com a água é:
\[\ce{2Li}(s)+\ce{2H2O}(l)⟶\ce{2LiOH}(aq)+\ce{H2}(g) \nonumber \]
Os metais alcalinos reagem diretamente com todos os não metais (exceto os gases nobres) para produzir compostos iônicos binários contendo mais de 1 íons metálicos. Esses metais são tão reativos que é necessário evitar o contato com a umidade e o oxigênio do ar. Portanto, eles são armazenados em recipientes selados sob óleo mineral, conforme mostrado na Figura\(\PageIndex{3}\), para evitar o contato com o ar e a umidade. Os metais puros nunca existem livres (não combinados) na natureza devido à sua alta reatividade. Além disso, essa alta reatividade torna necessário preparar os metais por eletrólise de compostos de metais alcalinos.

Ao contrário de muitos outros metais, a reatividade e a maciez dos metais alcalinos tornam esses metais inadequados para aplicações estruturais. No entanto, existem aplicações em que a reatividade dos metais alcalinos é uma vantagem. Por exemplo, a produção de metais como titânio e zircônio depende, em parte, da capacidade do sódio de reduzir os compostos desses metais. A fabricação de muitos compostos orgânicos, incluindo certos corantes, medicamentos e perfumes, utiliza a redução por lítio ou sódio.
O sódio e seus compostos conferem uma cor amarela brilhante a uma chama, como visto na Figura\(\PageIndex{4}\). A passagem de uma descarga elétrica pelo vapor de sódio também produz essa cor. Em ambos os casos, este é um exemplo de espectro de emissão, conforme discutido no capítulo sobre estrutura eletrônica. Às vezes, as luzes da rua empregam luzes de vapor de sódio porque o vapor de sódio penetra na névoa melhor do que a maioria das outras luzes. Isso ocorre porque a névoa não dispersa tanto a luz amarela quanto a branca. Os outros metais alcalinos e seus sais também conferem cor à chama. O lítio cria uma cor vermelha brilhante, enquanto os outros criam uma cor violeta pálida.
Vídeo\(\PageIndex{1}\): Este vídeo demonstra as reações dos metais alcalinos com a água.
Grupo 2: Os metais alcalinos terrosos
Os metais alcalino-terrosos (berílio, magnésio, cálcio, estrôncio, bário e rádio) constituem o grupo 2 da tabela periódica. O nome metal alcalino vem do fato de que os óxidos dos membros mais pesados do grupo reagem com a água para formar soluções alcalinas. A carga nuclear aumenta ao passar do grupo 1 para o grupo 2. Por causa desse aumento de carga, os átomos dos metais alcalino-terrosos são menores e têm maiores energias de primeira ionização do que os metais alcalinos no mesmo período. A maior energia de ionização torna os metais alcalino-terrosos menos reativos do que os metais alcalinos; no entanto, eles ainda são elementos muito reativos. Sua reatividade aumenta, conforme esperado, com o aumento do tamanho e a diminuição da energia de ionização. Em reações químicas, esses metais perdem prontamente os dois elétrons de valência para formar compostos nos quais exibem um estado de oxidação de 2+. Devido à sua alta reatividade, é comum produzir metais alcalino-terrosos, como os metais alcalinos, por eletrólise. Embora as energias de ionização sejam baixas, os dois metais com as maiores energias de ionização (berílio e magnésio) formam compostos que exibem alguns caracteres covalentes. Como os metais alcalinos, os metais alcalino-terrosos mais pesados conferem cor a uma chama. Como no caso dos metais alcalinos, isso faz parte do espectro de emissão desses elementos. O cálcio e o estrôncio produzem tons de vermelho, enquanto o bário produz uma cor verde.
O magnésio é um metal branco prateado que é maleável e dúctil em altas temperaturas. A passivação diminui a reatividade do magnésio metálico. Após a exposição ao ar, uma camada fortemente aderente de oxicarbonato de magnésio se forma na superfície do metal e inibe novas reações. (O carbonato vem da reação do dióxido de carbono na atmosfera.) O magnésio é o mais leve dos metais estruturais amplamente usados, e é por isso que a maior parte da produção de magnésio é para ligas leves.
Magnésio (Figura\(\PageIndex{5}\)), cálcio, estrôncio e bário reagem com a água e o ar. À temperatura ambiente, o bário mostra a reação mais vigorosa. Os produtos da reação com a água são o hidrogênio e o hidróxido metálico. A formação do gás hidrogênio indica que os metais alcalino-terrosos mais pesados são melhores agentes redutores (mais facilmente oxidados) do que o hidrogênio. Como esperado, esses metais reagem com ácidos e não metais para formar compostos iônicos. Ao contrário da maioria dos sais dos metais alcalinos, muitos dos sais comuns dos metais alcalino-terrosos são insolúveis em água devido às altas energias de rede desses compostos, contendo um íon metálico divalente.

O potente poder redutor do magnésio quente é útil na preparação de alguns metais a partir de seus óxidos. De fato, a afinidade do magnésio pelo oxigênio é tão grande que a queima de magnésio reage com o dióxido de carbono, produzindo carbono elementar:
\[\ce{2Mg}(s)+\ce{CO2}(g)⟶\ce{2MgO}(s)+\ce{C}(s) \nonumber \]
Por esse motivo, um extintor de CO 2 não apagará um incêndio de magnésio. Além disso, a luz branca brilhante emitida pela queima de magnésio o torna útil em fogos de artifício e fogos de artifício.
Grupo 12: Metais
Os elementos do grupo 12 são elementos de transição; no entanto, o último elétron adicionado não é um elétron d, mas um elétron s. Como o último elétron adicionado é um elétron s, esses elementos se qualificam como metais representativos ou metais pós-transição. Os elementos do grupo 12 se comportam mais como metais alcalino-terrosos do que com metais de transição. O grupo 12 contém os quatro elementos zinco, cádmio, mercúrio e copernício. Cada um desses elementos tem dois elétrons em sua camada externa (ns 2). Quando os átomos desses metais formam cátions com uma carga de 2+, onde os dois elétrons externos são perdidos, eles têm configurações de elétrons gasosos pseudo-nobres. Às vezes, o mercúrio é uma exceção porque também exibe um estado de oxidação de 1+ em compostos que contêm um\(\ce{Hg2^2+}\) íon diatômico. Em suas formas elementares e em compostos, o cádmio e o mercúrio são tóxicos.
O zinco é o mais reativo no grupo 12 e o mercúrio é o menos reativo. (Isso é o inverso da tendência de reatividade dos metais dos grupos 1 e 2, na qual a reatividade aumenta em um grupo. O aumento da reatividade com o aumento do número atômico ocorre apenas para os metais nos grupos 1 e 2.) A diminuição da reatividade se deve à formação de íons com uma configuração de gás pseudo-nobre e a outros fatores que estão além do escopo desta discussão. Os comportamentos químicos do zinco e do cádmio são bastante semelhantes entre si, mas diferem do mercúrio.
O zinco e o cádmio têm um potencial de redução menor do que o hidrogênio e, como os metais alcalinos e os metais alcalino-terrosos, eles produzirão gás hidrogênio quando reagirem com os ácidos. A reação do zinco com o ácido clorídrico, mostrada na Figura\(\PageIndex{6}\), é:

O zinco é um metal prateado que rapidamente se mancha até obter uma aparência azul-acinzentada. Essa mudança de cor se deve a um revestimento aderente de um carbonato básico, Zn 2 (OH) 2 CO 3, que passiva o metal para inibir a corrosão adicional. As pilhas secas e alcalinas contêm um ânodo de zinco. Latão (Cu e Zn) e um pouco de bronze (Cu, Sn e às vezes Zn) são importantes ligas de zinco. Cerca de metade da produção de zinco serve para proteger o ferro e outros metais da corrosão. Essa proteção pode assumir a forma de um ânodo sacrificial (também conhecido como ânodo galvânico, que é um meio de fornecer proteção catódica para vários metais) ou como um revestimento fino no metal protegido. O aço galvanizado é o aço com uma camada protetora de zinco.
Anodos sacrificiais
Um ânodo sacrificial, ou ânodo galvânico, é um meio de fornecer proteção catódica de vários metais. A proteção catódica refere-se à prevenção da corrosão convertendo o metal corrosivo em um cátodo. Como cátodo, o metal resiste à corrosão, que é um processo de oxidação. A corrosão ocorre no ânodo sacrificial em vez de no cátodo.
A construção desse sistema começa com a fixação de um metal mais ativo (maior potencial de redução negativo) ao metal que precisa de proteção. A fixação pode ser direta ou por meio de um fio. Para completar o circuito, é necessária uma ponte de sal. Essa ponte de sal costuma ser água do mar ou subterrânea. Quando o circuito é concluído, a oxidação (corrosão) ocorre no ânodo e não no cátodo.
Os ânodos sacrificiais comumente usados são magnésio, alumínio e zinco. O magnésio tem o potencial de redução mais negativo dos três e serve melhor quando a ponte de sal é menos eficiente devido a uma baixa concentração de eletrólitos, como na água doce. O zinco e o alumínio funcionam melhor em água salgada do que o magnésio. O alumínio é mais leve que o zinco e tem uma capacidade maior; no entanto, um revestimento de óxido pode passivar o alumínio. Em casos especiais, outros materiais são úteis. Por exemplo, o ferro protegerá o cobre.
O mercúrio é muito diferente do zinco e do cádmio. O mercúrio é o único metal líquido a 25 °C. Muitos metais se dissolvem no mercúrio, formando soluções chamadas amálgamas (veja o artigo sobre Amálgamas), que são ligas de mercúrio com um ou mais outros metais. O mercúrio, mostrado na Figura\(\PageIndex{7}\), é um elemento não reativo que é mais difícil de oxidar do que o hidrogênio. Assim, ele não desloca o hidrogênio dos ácidos; no entanto, ele reagirá com ácidos oxidantes fortes, como o ácido nítrico:
\[\ce{Hg}(l)+\ce{HCl}(aq)⟶\textrm{no reaction} \nonumber \]
\[\ce{3Hg}(l)+\ce{8HNO3}(aq)⟶\ce{3Hg(NO3)2}(aq)+\ce{4H2O}(l)+\ce{2NO}(g) \nonumber \]
O NO transparente inicialmente formado rapidamente sofre uma oxidação adicional para o marrom avermelhado NO 2.

A maioria dos compostos de mercúrio se decompõe quando aquecidos. A maioria dos compostos de mercúrio contém mercúrio com um estado de oxidação 2+. Quando há um grande excesso de mercúrio, é possível formar compostos contendo o\(\ce{Hg2^2+}\) íon. Todos os compostos de mercúrio são tóxicos e é necessário ter muito cuidado em sua síntese.
Um amálgama é uma liga de mercúrio com um ou mais outros metais. Isso é semelhante a considerar o aço como uma liga de ferro com outros metais. A maioria dos metais formará uma amálgama com mercúrio, com as principais exceções sendo ferro, platina, tungstênio e tântalo. Devido a problemas de toxicidade com mercúrio, houve uma diminuição significativa no uso de amálgamas. Historicamente, as amálgamas eram importantes nas células eletrolíticas e na extração de ouro. As amálgamas dos metais alcalinos ainda são úteis porque são agentes redutores fortes e mais fáceis de manusear do que os metais alcalinos puros. Os garimpeiros tiveram um problema quando encontraram ouro finamente dividido. Eles aprenderam que adicionar mercúrio em suas panelas coletava o ouro no mercúrio para formar uma amálgama para facilitar a coleta. Infelizmente, as perdas de pequenas quantidades de mercúrio ao longo dos anos deixaram muitos riachos na Califórnia poluídos com mercúrio. Os dentistas usam amálgamas contendo prata e outros metais para preencher as cavidades. Existem vários motivos para usar um amálgama, incluindo baixo custo, facilidade de manipulação e longevidade em comparação com materiais alternativos. As amálgamas dentárias contêm aproximadamente 50% de mercúrio em peso, o que, nos últimos anos, se tornou uma preocupação devido à toxicidade do mercúrio.
Depois de analisar os melhores dados disponíveis, a Food and Drug Administration (FDA) considera os recheios à base de amálgama seguros para adultos e crianças com mais de seis anos de idade. Mesmo com vários obturações, os níveis de mercúrio nos pacientes permanecem muito abaixo dos níveis mais baixos associados a danos. Estudos clínicos não encontraram nenhuma ligação entre amálgamas dentárias e problemas de saúde. Os problemas de saúde podem não ser os mesmos em casos de crianças menores de seis anos ou mulheres grávidas. As conclusões da FDA estão de acordo com as opiniões da Agência de Proteção Ambiental (EPA) e dos Centros de Controle de Doenças (CDC). A única consideração de saúde observada é que algumas pessoas são alérgicas ao amálgama ou a um de seus componentes.
Grupo 13
O grupo 13 contém o metalóide boro e os metais alumínio, gálio, índio e tálio. O elemento mais leve, o boro, é semicondutor, e seus compostos binários tendem a ser covalentes e não iônicos. Os elementos restantes do grupo são metais, mas seus óxidos e hidróxidos mudam de caráter. Os óxidos e hidróxidos de alumínio e gálio apresentam comportamentos ácidos e básicos. Uma substância, como essas duas, que reagirá com ácidos e bases é anfotérica. Essa característica ilustra a combinação de comportamentos não metálicos e metálicos desses dois elementos. Óxidos e hidróxidos de índio e tálio apresentam apenas comportamento básico, de acordo com o caráter claramente metálico desses dois elementos. O ponto de fusão do gálio é excepcionalmente baixo (cerca de 30° C) e derreterá em sua mão.
O alumínio é anfotérico porque reage com ácidos e bases. Uma reação típica com um ácido é:
\[\ce{2Al}(s)+\ce{6HCl}(aq)⟶\ce{2AlCl3}(aq)+\ce{3H2}(g) \nonumber \]
Os produtos da reação do alumínio com uma base dependem das condições da reação, sendo a seguinte uma possibilidade:
\[\ce{2Al}(s)+\ce{2NaOH}(aq)+\ce{6H2O}(l)⟶\ce{2Na[Al(OH)4]}(aq)+\ce{3H2}(g) \nonumber \]
Com ácidos e bases, a reação com o alumínio gera gás hidrogênio.
Os elementos do grupo 13 têm uma configuração eletrônica da camada de valência de ns 2 np 1. O alumínio normalmente usa todos os seus elétrons de valência quando reage, fornecendo compostos nos quais tem um estado de oxidação de 3+. Embora muitos desses compostos sejam covalentes, outros, como AlF 3 e Al 2 (SO 4) 3, são iônicos. As soluções aquosas de sais de alumínio contêm o cátion\(\ce{[Al(H2O)6]^3+}\), abreviado como Al 3 + (aq). Gálio, índio e tálio também formam compostos iônicos contendo íons M 3+. Esses três elementos exibem não apenas o estado de oxidação esperado de 3+ dos três elétrons de valência, mas também um estado de oxidação (neste caso, 1+) que está dois abaixo do valor esperado. Esse fenômeno, o efeito do par inerte, refere-se à formação de um íon estável com um estado de oxidação dois abaixo do esperado para o grupo. O par de elétrons é a valência orbital desses elementos. Em geral, o efeito do par inerte é importante para os elementos inferiores do bloco p. Em uma solução aquosa, o íon Tl + (aq) é mais estável do que o Tl 3 + (aq). Em geral, esses metais reagem com o ar e a água para formar mais de 3 íons; no entanto, o tálio reage para dar derivados de tálio (I). Todos os metais do grupo 13 reagem diretamente com não metais, como enxofre, fósforo e halogênios, formando compostos binários.
Os metais do grupo 13 (Al, Ga, In e Tl) são todos reativos. No entanto, a passivação ocorre quando uma película dura, dura e fina do óxido metálico se forma após a exposição ao ar. A interrupção desse filme pode contrariar a passivação, permitindo que o metal reaja. Uma forma de interromper o filme é expor o metal passivado ao mercúrio. Parte do metal se dissolve no mercúrio para formar um amálgama, que libera a camada protetora de óxido para expor o metal a novas reações. A formação de um amálgama permite que o metal reaja com o ar e a água.
Vídeo\(\PageIndex{2}\): Embora seja facilmente oxidado, a passivação do alumínio o torna muito útil como um material de construção leve e forte. Devido à formação de uma amálgama, o mercúrio é corrosivo para materiais estruturais feitos de alumínio. Este vídeo demonstra como a integridade de uma viga de alumínio pode ser destruída pela adição de uma pequena quantidade de mercúrio elementar.
Os usos mais importantes do alumínio estão nas indústrias de construção e transporte e na fabricação de latas de alumínio e folhas de alumínio. Esses usos dependem da leveza, tenacidade e resistência do metal, bem como de sua resistência à corrosão. Como o alumínio é um excelente condutor de calor e resiste à corrosão, é útil na fabricação de utensílios de cozinha.
O alumínio é um agente redutor muito bom e pode substituir outros agentes redutores no isolamento de certos metais de seus óxidos. Embora seja mais caro do que a redução por carbono, o alumínio é importante no isolamento de Mo, W e Cr de seus óxidos.
Grupo 14
Os membros metálicos do grupo 14 são estanho, chumbo e fleróvio. O carbono é um não metal típico. Os demais elementos do grupo, silício e germânio, são exemplos de semimetais ou metalóides. Estanho e chumbo formam os cátions divalentes estáveis, Sn 2 + e Pb 2 +, com estados de oxidação dois abaixo do estado de oxidação do grupo de 4+. A estabilidade desse estado de oxidação é uma consequência do efeito inerte do par. O estanho e o chumbo também formam compostos covalentes com um estado formal de oxidação 4+. Por exemplo, o SnCl 4 e o PbCl 4 são líquidos covalentes de baixo ponto de ebulição.

O estanho reage prontamente com não metais e ácidos para formar compostos de estanho (II) (indicando que é mais facilmente oxidado que o hidrogênio) e com não metais para formar compostos de estanho (II) ou estanho (IV\(\PageIndex{8}\)) (Figura), dependendo da estequiometria e das condições de reação. O chumbo é menos reativo. É apenas um pouco mais fácil de oxidar do que o hidrogênio, e a oxidação normalmente requer um ácido concentrado quente.
Muitos desses elementos existem como alótropos. Os alótropos são duas ou mais formas do mesmo elemento no mesmo estado físico com propriedades químicas e físicas diferentes. Existem dois alótropos comuns de estanho. Esses alótropos são estanho cinza (quebradiço) e estanho branco. Como em outros alótropos, a diferença entre essas formas de estanho está na disposição dos átomos. O estanho branco é estável acima de 13,2° C e é maleável como outros metais. Em baixas temperaturas, o estanho cinza é a forma mais estável. O estanho cinza é quebradiço e tende a se decompor em pó. Consequentemente, artigos feitos de estanho se desintegrarão em climas frios, especialmente se o período de frio for longo. A mudança progride lentamente a partir do ponto de origem, e o estanho cinza formado pela primeira vez catalisa novas mudanças. De certa forma, esse efeito é semelhante à propagação de uma infecção no corpo de uma planta ou animal, levando as pessoas a chamarem esse processo de doença do estanho ou praga do estanho.
O principal uso do estanho é no revestimento de aço para formar chapa de ferro estanhado, que constitui o estanho em latas. Ligas de estanho importantes são bronze (Cu e Sn) e solda (Sn e Pb). O chumbo é importante nas baterias de armazenamento de chumbo nos automóveis.
Grupo 15
O bismuto, o membro mais pesado do grupo 15, é um metal menos reativo do que os outros metais representativos. Ele cede prontamente três de seus cinco elétrons de valência para não metais ativos para formar o íon tripositivo, Bi 3 +. Ele forma compostos com o estado de oxidação do grupo de 5+ somente quando tratado com agentes oxidantes fortes. A estabilidade do estado de oxidação 3+ é outro exemplo do efeito do par inerte.
Resumo
Esta seção se concentra na periodicidade dos elementos representativos. Esses são os elementos em que os elétrons estão entrando nos orbitais s e p. Os elementos representativos ocorrem nos grupos 1, 2 e 12—18. Esses elementos são metais representativos, metalóides e não metais. Os metais alcalinos (grupo 1) são muito reativos, facilmente formam íons com uma carga de 1+ para formar compostos iônicos que geralmente são solúveis em água e reagem vigorosamente com a água para formar gás hidrogênio e uma solução básica do hidróxido metálico. Os elétrons mais externos dos metais alcalino-terrosos (grupo 2) são mais difíceis de remover do que o elétron externo dos metais alcalinos, fazendo com que os metais do grupo 2 sejam menos reativos do que os do grupo 1. Esses elementos formam facilmente compostos nos quais os metais exibem um estado de oxidação de 2+. Zinco, cádmio e mercúrio (grupo 12) geralmente exibem o estado de oxidação do grupo de 2+ (embora o mercúrio também exiba um estado de oxidação de 1+ em compostos que contêm\(\ce{Hg2^2+}\)). Alumínio, gálio, índio e tálio (grupo 13) são mais fáceis de oxidar do que o hidrogênio. Alumínio, gálio e índio ocorrem com um estado de oxidação 3+ (no entanto, o tálio também ocorre comumente como o íon Tl +). O estanho e o chumbo formam cátions divalentes estáveis e compostos covalentes nos quais os metais exibem o estado de oxidação 4+.
Glossário
- metal alcalino-terroso
- qualquer um dos metais (berílio, magnésio, cálcio, estrôncio, bário e rádio) ocupando o grupo 2 da tabela periódica; eles são metais reativos e divalentes que formam óxidos básicos
- alótropos
- duas ou mais formas do mesmo elemento, no mesmo estado físico, com estruturas químicas diferentes
- bismuto
- membro mais pesado do grupo 15; um metal menos reativo do que outros metais representativos
- metal (representativo)
- átomos dos elementos metálicos dos grupos 1, 2, 12, 13, 14, 15 e 16, que formam compostos iônicos ao perder elétrons de seus orbitais s ou p externos
- metalóide
- elemento que tem propriedades que estão entre as de metais e não metais; esses elementos são tipicamente semicondutores
- passivação
- metais com uma película protetora não reativa de óxido ou outro composto que cria uma barreira para reações químicas; a remoção física ou química do filme passivante permite que os metais demonstrem sua reatividade química esperada
- elemento representativo
- elemento onde os orbitais s e p estão se enchendo
- metal representativo
- metal entre os elementos representativos


