10.5: O estado sólido da matéria
- Page ID
- 195160
- Definir e descrever a ligação e as propriedades de sólidos cristalinos de rede iônica, molecular, metálica e covalente
- Descreva os principais tipos de sólidos cristalinos: sólidos iônicos, sólidos metálicos, sólidos de rede covalente e sólidos moleculares
- Explicar as maneiras pelas quais os defeitos de cristal podem ocorrer em um sólido
Quando a maioria dos líquidos é resfriada, eles eventualmente congelam e formam sólidos cristalinos, sólidos nos quais os átomos, íons ou moléculas são organizados em um padrão de repetição definido. Também é possível que um líquido congele antes que suas moléculas se organizem em um padrão ordenado. Os materiais resultantes são chamados de sólidos amorfos ou sólidos não cristalinos (ou, às vezes, vidros). As partículas desses sólidos não possuem uma estrutura interna ordenada e estão dispostas aleatoriamente (Figura\(\PageIndex{1}\)).
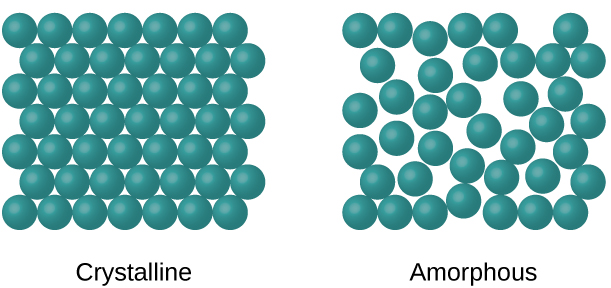
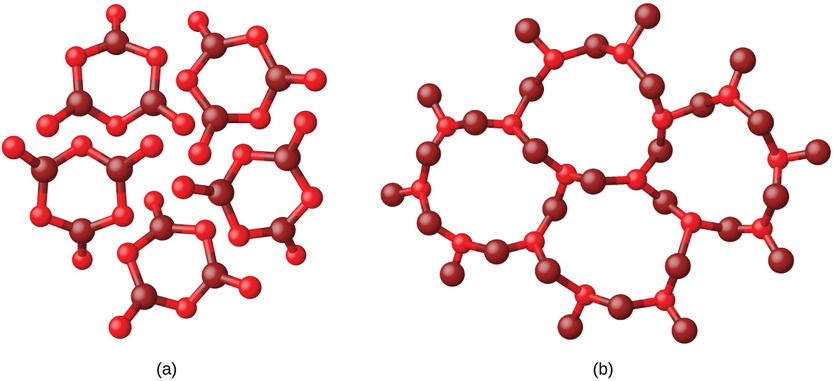
Metais e compostos iônicos normalmente formam sólidos cristalinos ordenados. Substâncias que consistem em moléculas grandes, ou uma mistura de moléculas cujos movimentos são mais restritos, geralmente formam sólidos amorfos. Por exemplo, ceras de vela são sólidos amorfos compostos por grandes moléculas de hidrocarbonetos. Algumas substâncias, como o óxido de boro (Figura\(\PageIndex{2}\)), podem formar sólidos cristalinos ou amorfos, dependendo das condições em que são produzidos. Além disso, sólidos amorfos podem passar por uma transição para o estado cristalino sob condições apropriadas.
Os sólidos cristalinos são geralmente classificados de acordo com a natureza das forças que mantêm suas partículas unidas. Essas forças são as principais responsáveis pelas propriedades físicas exibidas pelos sólidos a granel. As seções a seguir fornecem descrições dos principais tipos de sólidos cristalinos: iônicos, metálicos, de rede covalente e moleculares.
Sólidos iônicos
Os sólidos iônicos, como cloreto de sódio e óxido de níquel, são compostos por íons positivos e negativos que são mantidos juntos por atrações eletrostáticas, que podem ser bastante fortes (Figura\(\PageIndex{3}\)). Muitos cristais iônicos também têm altos pontos de fusão. Isso se deve às atrações muito fortes entre os íons — nos compostos iônicos, as atrações entre cargas completas são (muito) maiores do que aquelas entre as cargas parciais nos compostos moleculares polares. Isso será analisado com mais detalhes em uma discussão posterior sobre energias de rede. Embora sejam duros, eles também tendem a ser quebradiços e se estilhaçam em vez de dobrar. Os sólidos iônicos não conduzem eletricidade; no entanto, eles conduzem quando derretidos ou dissolvidos porque seus íons estão livres para se mover. Muitos compostos simples formados pela reação de um elemento metálico com um elemento não metálico são iônicos.

Sólidos metálicos
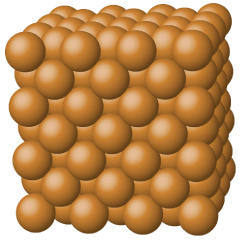
Sólidos metálicos, como cristais de cobre, alumínio e ferro, são formados por átomos de metal Figura\(\PageIndex{4}\). A estrutura dos cristais metálicos é frequentemente descrita como uma distribuição uniforme dos núcleos atômicos dentro de um “mar” de elétrons deslocalizados. Os átomos dentro desse sólido metálico são mantidos juntos por uma força única conhecida como ligação metálica, que dá origem a muitas propriedades úteis e variadas a granel. Todos apresentam alta condutividade térmica e elétrica, brilho metálico e maleabilidade. Muitos são muito duros e muito fortes. Devido à sua maleabilidade (capacidade de se deformar sob pressão ou martelamento), eles não se estilhaçam e, portanto, são materiais de construção úteis. Os pontos de fusão dos metais variam muito. O mercúrio é um líquido à temperatura ambiente e os metais alcalinos se fundem abaixo de 200 °C. Vários metais pós-transição também têm baixos pontos de fusão, enquanto os metais de transição se fundem a temperaturas acima de 1000 °C. Essas diferenças refletem diferenças nas forças de ligação metálica entre os metais.
Sólidos de rede covalentes
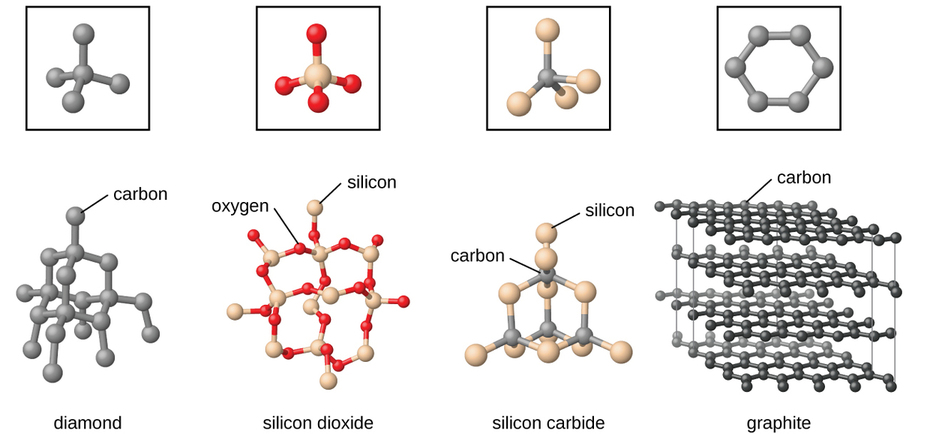
Os sólidos da rede covalente incluem cristais de diamante, silício, alguns outros não metais e alguns compostos covalentes, como dióxido de silício (areia) e carboneto de silício (carborundum, o abrasivo da lixa). Muitos minerais têm redes de ligações covalentes. Os átomos nesses sólidos são mantidos juntos por uma rede de ligações covalentes, conforme mostrado na Figura\(\PageIndex{5}\). Para quebrar ou derreter um sólido de rede covalente, as ligações covalentes devem ser quebradas. Como as ligações covalentes são relativamente fortes, os sólidos da rede covalente são normalmente caracterizados por dureza, resistência e altos pontos de fusão. Por exemplo, o diamante é uma das substâncias mais duras conhecidas e derrete acima de 3500 °C.
Sólidos moleculares
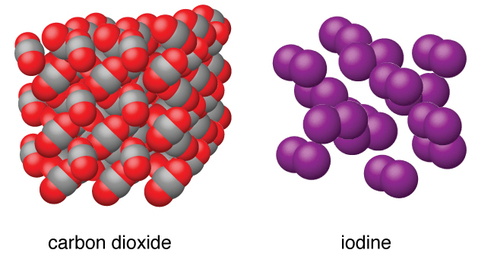
Os sólidos moleculares, como gelo, sacarose (açúcar de mesa) e iodo, conforme mostrado na Figura\(\PageIndex{6}\), são compostos por moléculas neutras. As forças de atração entre as unidades presentes em diferentes cristais variam muito, conforme indicado pelos pontos de fusão dos cristais. Pequenas moléculas simétricas (moléculas não polares), como H 2, N 2, O 2 e F 2, têm forças de atração fracas e formam sólidos moleculares com pontos de fusão muito baixos (abaixo de −200° C). Substâncias que consistem em moléculas não polares maiores têm forças de atração maiores e se fundem em temperaturas mais altas. Sólidos moleculares compostos por moléculas com momentos de dipolo permanente (moléculas polares) se fundem em temperaturas ainda mais altas. Os exemplos incluem gelo (ponto de fusão, 0 °C) e açúcar de mesa (ponto de fusão, 185 °C).
Propriedades dos sólidos
Um sólido cristalino, como os listados na Tabela,\(\PageIndex{1}\) tem uma temperatura de fusão precisa porque cada átomo ou molécula do mesmo tipo é mantido no lugar com as mesmas forças ou energia. Assim, todas as atrações entre as unidades que compõem o cristal têm a mesma força e requerem a mesma quantidade de energia para serem quebradas. O amolecimento gradual de um material amorfo difere dramaticamente da fusão distinta de um sólido cristalino. Isso resulta da não equivalência estrutural das moléculas no sólido amorfo. Algumas forças são mais fracas do que outras e, quando um material amorfo é aquecido, as atrações intermoleculares mais fracas se quebram primeiro. À medida que a temperatura aumenta ainda mais, as atrações mais fortes são interrompidas. Assim, os materiais amorfos amolecem em uma faixa de temperaturas.
| Tipo de sólido | Tipo de partículas | Tipo de atrações | Propriedades | Exemplos |
|---|---|---|---|---|
| iônico | íons | ligações iônicas | duro, quebradiço, conduz eletricidade como líquido, mas não como sólido, pontos de fusão altos a muito altos | NaCl, Al 2 ou 3 |
| metálico | átomos de elementos eletropositivos | ligações metálicas | brilhante, maleável, dúctil, conduz bem o calor e a eletricidade, dureza variável e temperatura de fusão | Copa, Fe, Ti, Pb, Reino Unido |
| rede covalente | átomos de elementos eletronegativos | ligações covalentes | pontos de fusão muito duros, não condutores, muito altos | C (diamante), SiO 2, SiC |
| molecular | moléculas (ou átomos) | FMI | dureza variável, fragilidade variável, não condutora, baixos pontos de fusão | H 2 O, CO 2, I 2, C 12 H 22 O 11 |
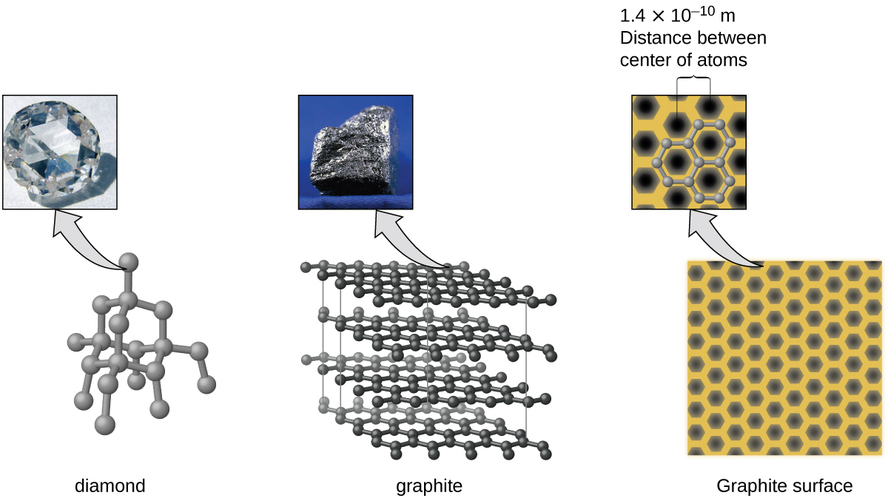
O carbono é um elemento essencial em nosso mundo. As propriedades únicas dos átomos de carbono permitem a existência de formas de vida baseadas em carbono, como nós mesmos. O carbono forma uma grande variedade de substâncias que usamos diariamente, incluindo as mostradas na Figura\(\PageIndex{7}\). Você pode estar familiarizado com diamante e grafite, os dois alótropos de carbono mais comuns. (Os alótropos são formas estruturais diferentes do mesmo elemento.) O diamante é uma das substâncias mais difíceis conhecidas, enquanto a grafite é macia o suficiente para ser usada como lápis. Essas propriedades muito diferentes derivam dos diferentes arranjos dos átomos de carbono nos diferentes alótropos.
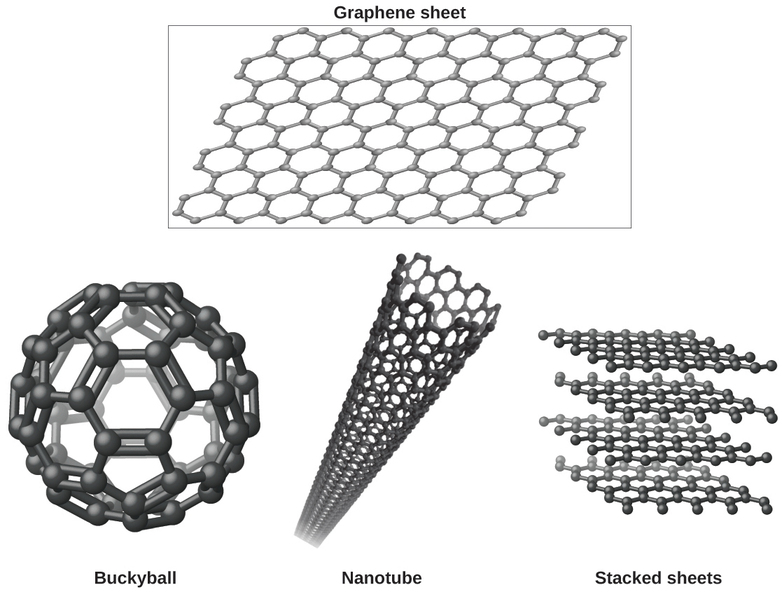
Talvez você esteja menos familiarizado com uma forma de carbono descoberta recentemente: o grafeno. O grafeno foi isolado pela primeira vez em 2004 usando fita adesiva para remover camadas cada vez mais finas do grafite. É essencialmente uma única folha (com um átomo de espessura) de grafite. O grafeno, ilustrado na Figura\(\PageIndex{8}\), não é apenas forte e leve, mas também é um excelente condutor de eletricidade e calor. Essas propriedades podem ser muito úteis em uma ampla gama de aplicações, como chips e circuitos de computador amplamente aprimorados, melhores baterias e células solares e materiais estruturais mais fortes e mais leves. O Prêmio Nobel de Física de 2010 foi concedido a Andre Geim e Konstantin Novoselov por seu trabalho pioneiro com grafeno.
Defeitos de crist
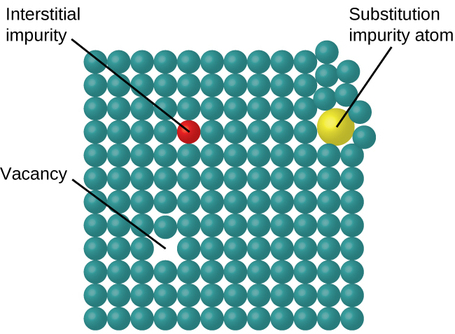
Em um sólido cristalino, os átomos, íons ou moléculas são organizados em um padrão de repetição definido, mas defeitos ocasionais podem ocorrer no padrão. Vários tipos de defeitos são conhecidos, conforme ilustrado na Figura\(\PageIndex{9}\). Vagas são defeitos que ocorrem quando posições que deveriam conter átomos ou íons estão vazias. Menos comumente, alguns átomos ou íons em um cristal podem ocupar posições, chamadas sítios intersticiais, localizadas entre as posições regulares dos átomos. Outras distorções são encontradas em cristais impuros, como, por exemplo, quando os cátions, ânions ou moléculas da impureza são grandes demais para caber nas posições regulares sem distorcer a estrutura. Às vezes, pequenas quantidades de impurezas são adicionadas a um cristal (um processo conhecido como doping) para criar defeitos na estrutura que produzem mudanças desejáveis em suas propriedades. Por exemplo, cristais de silício são dopados com quantidades variáveis de elementos diferentes para produzir propriedades elétricas adequadas para seu uso na fabricação de semicondutores e chips de computador.
Resumo
Algumas substâncias formam sólidos cristalinos que consistem em partículas em uma estrutura muito organizada; outras formam sólidos amorfos (não cristalinos) com uma estrutura interna não ordenada. Os principais tipos de sólidos cristalinos são sólidos iônicos, sólidos metálicos, sólidos de rede covalente e sólidos moleculares. As propriedades dos diferentes tipos de sólidos cristalinos são devidas aos tipos de partículas nas quais eles consistem, à disposição das partículas e às forças das atrações entre elas. Como suas partículas experimentam atrações idênticas, os sólidos cristalinos têm temperaturas de fusão distintas; as partículas nos sólidos amorfos experimentam uma variedade de interações, então eles amolecem gradualmente e derretem em uma faixa de temperaturas. Alguns sólidos cristalinos têm defeitos no padrão de repetição definido de suas partículas. Esses defeitos (que incluem vagas, átomos ou íons que não estão nas posições regulares e impurezas) alteram propriedades físicas, como a condutividade elétrica, que é explorada nos cristais de silício usados para fabricar chips de computador.
Glossário
- sólido amorfo
- (também, sólido não cristalino) sólido no qual as partículas não possuem uma estrutura interna ordenada
- sólido de rede covalente
- sólido cujas partículas são mantidas unidas por ligações covalentes
- sólido cristalino
- sólido no qual as partículas estão dispostas em um padrão de repetição definido
- sites intersticiais
- espaços entre as posições regulares das partículas em qualquer matriz de átomos ou íons
- sólido iônico
- sólido composto por íons positivos e negativos mantidos juntos por fortes atrações eletrostáticas
- sólido metálico
- sólido composto por átomos de metal
- sólido molecular
- sólido composto por moléculas neutras mantidas unidas por forças de atração intermoleculares
- vaga
- defeito que ocorre quando uma posição que deveria conter um átomo ou íon está vaga


