3.1: Energia eletromagnética
- Page ID
- 195499
- Explicar o comportamento básico das ondas, incluindo ondas itinerantes e ondas estacionárias
- Descreva a natureza ondulatória da luz
- Use equações apropriadas para calcular propriedades relacionadas à onda de luz, como período, frequência, comprimento de onda e energia
- Faça a distinção entre espectros de emissão contínua e linear
- Descreva a natureza das partículas da luz
A natureza da luz tem sido objeto de investigação desde a antiguidade. No século XVII, Isaac Newton realizou experimentos com lentes e prismas e conseguiu demonstrar que a luz branca consiste nas cores individuais do arco-íris combinadas. Newton explicou suas descobertas ópticas em termos de uma visão “corpuscular” da luz, na qual a luz era composta por fluxos de partículas extremamente pequenas viajando em altas velocidades de acordo com as leis do movimento de Newton. Outros no século XVII, como Christiaan Huygens, mostraram que fenômenos ópticos como reflexão e refração poderiam ser igualmente bem explicados em termos de luz como ondas viajando em alta velocidade através de um meio chamado “éter luminífero”, que se pensava permear todo o espaço. No início do século XIX, Thomas Young demonstrou que a luz passando por fendas estreitas e espaçadas produzia padrões de interferência que não podiam ser explicados em termos de partículas newtonianas, mas podiam ser facilmente explicados em termos de ondas. Mais tarde, no século XIX, depois que James Clerk Maxwell desenvolveu sua teoria da radiação eletromagnética e mostrou que a luz era a parte visível de um vasto espectro de ondas eletromagnéticas, a visão de partículas da luz ficou completamente desacreditada. No final do século XIX, os cientistas viam o universo físico como compreendendo aproximadamente dois domínios separados: matéria composta por partículas que se movem de acordo com as leis do movimento de Newton e radiação eletromagnética consistindo em ondas governadas pelas equações de Maxwell. Hoje, esses domínios são chamados de mecânica clássica e eletrodinâmica clássica (ou eletromagnetismo clássico). Embora houvesse alguns fenômenos físicos que não pudessem ser explicados dentro dessa estrutura, os cientistas da época estavam tão confiantes na solidez geral dessa estrutura que viam essas aberrações como paradoxos intrigantes que acabariam sendo resolvidos de alguma forma dentro dessa estrutura. Como veremos, esses paradoxos levaram a uma estrutura contemporânea que conecta intimamente partículas e ondas em um nível fundamental chamado dualidade onda-partícula, que substituiu a visão clássica.
A luz visível e outras formas de radiação eletromagnética desempenham papéis importantes na química, pois podem ser usadas para inferir as energias dos elétrons nos átomos e moléculas. Grande parte da tecnologia moderna é baseada na radiação eletromagnética. Por exemplo, ondas de rádio de um telefone celular, raios X usados por dentistas, a energia usada para cozinhar alimentos no micro-ondas, o calor radiante de objetos em brasa e a luz da tela da televisão são formas de radiação eletromagnética que exibem um comportamento ondulatório.
Ondas
Uma onda é uma oscilação ou movimento periódico que pode transportar energia de um ponto no espaço para outro. Exemplos comuns de ondas estão ao nosso redor. Agitar a ponta de uma corda transfere energia da sua mão para a outra ponta da corda, jogar uma pedra em um lago faz com que as ondas ondulem para fora ao longo da superfície da água, e a expansão do ar que acompanha um raio gera ondas sonoras (trovões) que podem viajar para fora por vários quilômetros. Em cada um desses casos, a energia cinética é transferida através da matéria (corda, água ou ar) enquanto a matéria permanece essencialmente no lugar. Um exemplo perspicaz de uma onda ocorre em estádios esportivos quando torcedores em uma região estreita de assentos se levantam simultaneamente e ficam de pé com os braços levantados por alguns segundos antes de se sentarem novamente, enquanto os torcedores nas seções vizinhas também se levantam e se sentam em sequência. Embora essa onda possa cercar rapidamente um grande estádio em alguns segundos, nenhum dos torcedores realmente viaja com a onda - todos ficam dentro ou acima de seus assentos.
As ondas não precisam se restringir a viajar pela matéria. Como Maxwell mostrou, as ondas eletromagnéticas consistem em um campo elétrico oscilando em sintonia com um campo magnético perpendicular, ambos perpendiculares à direção da viagem. Essas ondas podem viajar pelo vácuo a uma velocidade constante de 2.998 × 10 8 m/s, a velocidade da luz (indicada por c).
Todas as ondas, incluindo formas de radiação eletromagnética, são caracterizadas por um comprimento de onda (denotado por λ, a letra minúscula grega lambda), uma frequência (indicada por λ, a letra minúscula grega nu) e uma amplitude. Como pode ser visto na Figura\(\PageIndex{1}\), o comprimento de onda é a distância entre dois picos ou vales consecutivos em uma onda (medida em metros no sistema SI). Ondas eletromagnéticas têm comprimentos de onda que caem dentro de uma enorme faixa - comprimentos de onda de quilômetros (10 a 3 m) a picômetros (10 −12 m) foram observados. A frequência é o número de ciclos de onda que passam por um ponto específico no espaço em um determinado período de tempo (no sistema SI, isso é medido em segundos). Um ciclo corresponde a um comprimento de onda completo. A unidade de frequência, expressa como ciclos por segundo [s −1], é o hertz (Hz). Os múltiplos comuns desta unidade são megahertz (1 MHz = 1 × 10 6 Hz) e gigahertz (1 GHz = 1 × 10 9 Hz). A amplitude corresponde à magnitude do deslocamento da onda e, portanto, na Figura, isso corresponde à metade da altura entre os picos e vales. A amplitude está relacionada à intensidade da onda, que para a luz é o brilho e para o som é o volume.
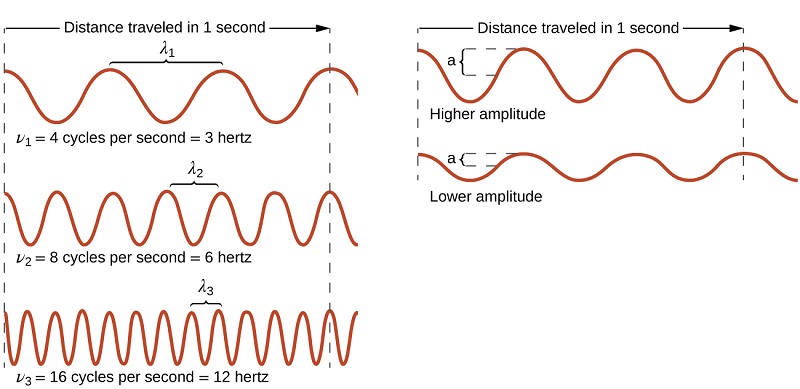
O produto do comprimento de onda de uma onda (λ) e de sua frequência (λ), λ, é a velocidade da onda. Assim, para radiação eletromagnética no vácuo:
\[c=\mathrm{2.998×10^8\,ms^{−1}}=λν \label{6.2.1} \]
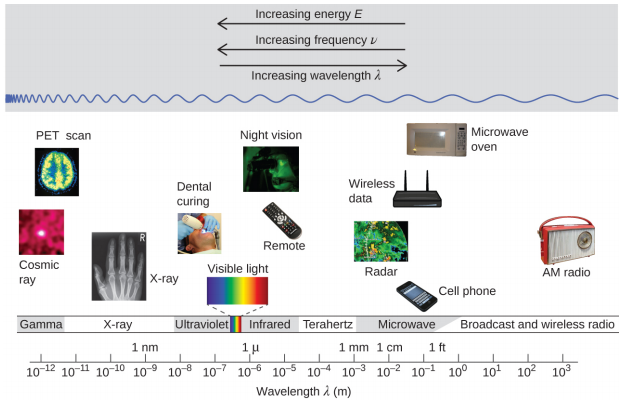
O comprimento de onda e a frequência são inversamente proporcionais: à medida que o comprimento de onda aumenta, a frequência diminui. A proporcionalidade inversa é ilustrada na Figura\(\PageIndex{2}\). Esta figura também mostra o espectro eletromagnético, a faixa de todos os tipos de radiação eletromagnética. Cada uma das várias cores da luz visível tem frequências e comprimentos de onda específicos associados a elas, e você pode ver que a luz visível constitui apenas uma pequena parte do espectro eletromagnético. Como as tecnologias desenvolvidas para funcionar em várias partes do espectro eletromagnético são diferentes, por razões de conveniência e legados históricos, unidades diferentes são normalmente usadas para diferentes partes do espectro. Por exemplo, as ondas de rádio geralmente são especificadas como frequências (normalmente em unidades de MHz), enquanto a região visível geralmente é especificada em comprimentos de onda (normalmente em unidades de nm ou angstroms).
Um poste de sódio emite luz amarela com um comprimento de onda de 589 nm (1 nm = 1 × 10 −9 m). Qual é a frequência dessa luz?
Solução
Podemos reorganizar a equação\ ref {6.2.1} para resolver a frequência:
\[ \nu=\dfrac{c}{λ} \nonumber \]
Como c é expresso em metros por segundo, também devemos converter 589 nm em metros.
\[ \nu=\mathrm{\left(\dfrac{2.998×10^8\:\cancel{m}s^{−1}}{589\cancel{nm}}\right)\left(\dfrac{1×10^9\cancel{nm}}{1\cancel{m}}\right)=5.09×10^{14}\,s^{−1}} \nonumber \]
Uma das frequências usadas para transmitir e receber sinais de telefone celular nos Estados Unidos é 850 MHz. Qual é o comprimento de onda em metros dessas ondas de rádio?
- Responda
-
0,353 m = 35,3 cm
Comunicação sem fio
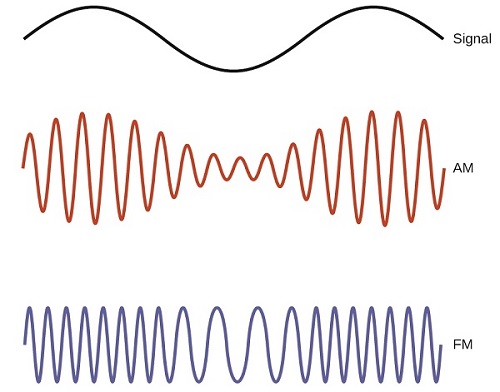
Muitas tecnologias valiosas operam na região de frequência de rádio (3 kHz-300 GHz) do espectro eletromagnético. Na extremidade de baixa frequência (baixa energia, comprimento de onda longo) dessa região estão os sinais de rádio AM (modulação de amplitude) (540-2830 kHz) que podem percorrer longas distâncias. Os sinais de rádio FM (modulação de frequência) são usados em frequências mais altas (87,5-108,0 MHz). No rádio AM, a informação é transmitida variando a amplitude da onda (Figura\(\PageIndex{5}\)). No rádio FM, por outro lado, a amplitude é constante e a frequência instantânea varia.

Outras tecnologias também operam na parte de ondas de rádio do espectro eletromagnético. Por exemplo, os sinais de telefone celular 4G têm aproximadamente 880 MHz, enquanto os sinais do Sistema de Posicionamento Global (GPS) operam a 1,228 e 1,575 GHz, as redes de tecnologia sem fio local (Wi-Fi) operam a 2,4 a 5 GHz e os sensores de pedágio rodoviário operam a 5,8 GHz. As frequências associadas a essas aplicações são convenientes porque essas ondas tendem a não ser muito absorvidas pelos materiais de construção comuns.
Um fenômeno particularmente característico das ondas ocorre quando duas ou mais ondas entram em contato: elas interferem umas nas outras. A figura\(\PageIndex{5}\) mostra os padrões de interferência que surgem quando a luz passa por fendas estreitas bem espaçadas em torno de um comprimento de onda. Os padrões de franja produzidos dependem do comprimento de onda, com as franjas sendo mais espaçadas para uma luz de menor comprimento de onda passando por um determinado conjunto de fendas. Quando a luz passa pelas duas fendas, cada fenda atua efetivamente como uma nova fonte, resultando em duas ondas bem espaçadas entrando em contato com o detector (neste caso, a câmera). As regiões escuras na Figura\(\PageIndex{5}\) correspondem às regiões onde os picos da onda de uma fenda coincidem com os vales da onda da outra fenda (interferência destrutiva), enquanto as regiões mais brilhantes correspondem às regiões onde os picos das duas ondas (ou seus dois vales) coincidem (interferência construtiva). Da mesma forma, quando duas pedras são jogadas juntas em um lago, os padrões de interferência são visíveis nas interações entre as ondas produzidas pelas pedras. Esses padrões de interferência não podem ser explicados por partículas que se movem de acordo com as leis da mecânica clássica.

Como os comprimentos de onda dos raios X (10 a 10.000 picômetros [pm]) são comparáveis ao tamanho dos átomos, os raios X podem ser usados para determinar a estrutura das moléculas. Quando um feixe de raios X passa por moléculas empacotadas em um cristal, os raios X colidem com os elétrons e se dispersam. A interferência construtiva e destrutiva desses raios X dispersos cria um padrão de difração específico. Calculando para trás a partir desse padrão, as posições de cada um dos átomos na molécula podem ser determinadas com muita precisão. Uma das pioneiras que ajudou a criar essa tecnologia foi Dorothy Crowfoot Hodgkin.
Ela nasceu no Cairo, Egito, em 1910, onde seus pais britânicos estavam estudando arqueologia. Mesmo quando jovem, ela era fascinada por minerais e cristais. Quando ela era estudante na Universidade de Oxford, ela começou a pesquisar como a cristalografia de raios-X poderia ser usada para determinar a estrutura das biomoléculas. Ela inventou novas técnicas que permitiram que ela e seus alunos determinassem as estruturas da vitamina B 12, da penicilina e de muitas outras moléculas importantes. O diabetes, uma doença que afeta 382 milhões de pessoas em todo o mundo, envolve o hormônio insulina. Hodgkin começou a estudar a estrutura da insulina em 1934, mas foram necessárias várias décadas de avanços na área antes que ela finalmente relatasse a estrutura em 1969. A compreensão da estrutura levou a uma melhor compreensão da doença e das opções de tratamento.
Nem todas as ondas são ondas itinerantes. As ondas estacionárias (também conhecidas como ondas estacionárias) permanecem restritas em alguma região do espaço. Como veremos, as ondas estacionárias desempenham um papel importante em nossa compreensão da estrutura eletrônica de átomos e moléculas. O exemplo mais simples de uma onda estacionária é uma onda unidimensional associada a uma corda vibratória que é mantida fixa em seus dois pontos finais. A figura\(\PageIndex{6}\) mostra as quatro ondas estacionárias de menor energia (a onda fundamental e os três harmônicos mais baixos) para uma corda vibrante em uma amplitude específica. Embora o movimento da corda esteja principalmente dentro de um plano, a onda em si é considerada unidimensional, pois está ao longo do comprimento da corda. O movimento dos segmentos das cordas em uma direção perpendicular ao comprimento da corda gera as ondas e, portanto, a amplitude das ondas é visível como o deslocamento máximo das curvas vistas na Figura\(\PageIndex{6}\). A principal observação da figura é que somente aquelas ondas com um número inteiro, n, de meio comprimento de onda entre os pontos finais podem se formar. Um sistema com pontos finais fixos como esse restringe o número e o tipo das formas de onda possíveis. Este é um exemplo de quantização, em que somente valores discretos de um conjunto mais geral de valores contínuos de alguma propriedade são observados. Outra observação importante é que as ondas harmônicas (aquelas ondas que exibem mais da metade do comprimento de onda) têm um ou mais pontos entre os dois pontos finais que não estão em movimento. Esses pontos especiais são nós. As energias das ondas estacionárias com uma determinada amplitude em uma corda vibratória aumentam com o número de meio-comprimentos de onda n. Como o número de nós é n — 1, pode-se dizer que a energia também depende do número de nós, geralmente aumentando à medida que o número de nós aumenta.

Um exemplo de ondas estacionárias bidimensionais é mostrado na Figura\(\PageIndex{7}\), que mostra os padrões vibracionais em uma superfície plana. Embora as amplitudes vibracionais não possam ser vistas como na corda vibratória, os nós se tornaram visíveis borrifando a superfície do tambor com um pó que se acumula nas áreas da superfície com deslocamento mínimo. Para ondas estacionárias unidimensionais, os nós eram pontos na linha, mas para ondas estacionárias bidimensionais, os nós são linhas na superfície (para ondas estacionárias tridimensionais, os nós são superfícies bidimensionais dentro do volume tridimensional). Devido à simetria circular da superfície do tambor, suas condições de contorno (a superfície do tambor sendo fortemente restrita à circunferência do tambor) resultam em dois tipos de nós: nós radiais que varrem todos os ângulos em raios constantes e, portanto, são vistos como círculos ao redor do centro e nós angulares que varrem todos os raios em ângulos constantes e, assim, são vistos como linhas passando pelo centro. A imagem superior esquerda na Figura\(\PageIndex{7}\) mostra dois nós radiais, enquanto a imagem no canto inferior direito mostra o padrão vibracional associado a três nós radiais e dois nós angulares.

Radiação de corpo negro e a catástrofe ultravioleta
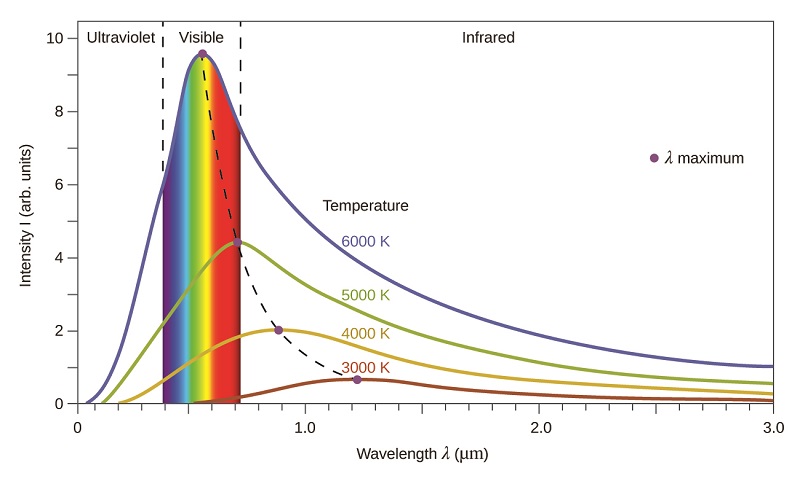
As últimas décadas do século XIX testemunharam uma intensa atividade de pesquisa na comercialização de iluminação elétrica recém-descoberta. Isso exigiu uma melhor compreensão das distribuições de luz emitida por várias fontes que estavam sendo consideradas. A iluminação artificial geralmente é projetada para imitar a luz solar natural dentro das limitações da tecnologia subjacente. Essa iluminação consiste em uma faixa de frequências amplamente distribuídas que formam um espectro contínuo. A figura\(\PageIndex{8}\) mostra a distribuição do comprimento de onda da luz solar. A radiação mais intensa está na região visível, com a intensidade diminuindo rapidamente para a luz ultravioleta (UV) de menor comprimento de onda e mais lentamente para a luz infravermelha (IR) de maior comprimento de onda.
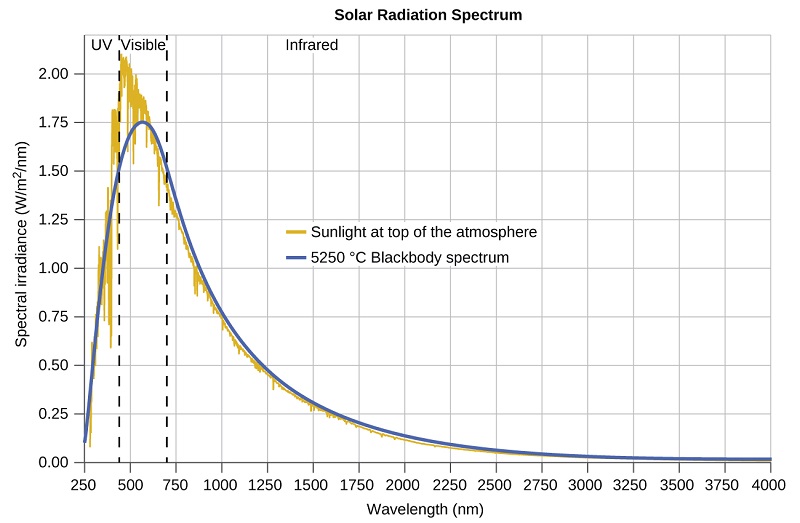
Na Figura\(\PageIndex{8}\), a distribuição solar é comparada a uma distribuição representativa, chamada espectro de corpo negro, que corresponde a uma temperatura de 5250 °C. O espectro de corpo negro corresponde muito bem ao espectro solar. Um corpo negro é um emissor conveniente e ideal que se aproxima do comportamento de muitos materiais quando aquecido. É “ideal” no mesmo sentido de que um gás ideal é uma representação simples e conveniente de gases reais que funcionam bem, desde que a pressão não seja muito alta nem a temperatura muito baixa. Uma boa aproximação de um corpo negro que pode ser usada para observar a radiação do corpo negro é um forno de metal que pode ser aquecido a temperaturas muito altas. O forno tem um pequeno orifício que permite que a luz emitida dentro do forno seja observada com um espectrômetro para que os comprimentos de onda e suas intensidades possam ser medidos. A figura\(\PageIndex{8}\) mostra as curvas resultantes para algumas temperaturas representativas. Cada distribuição depende apenas de um único parâmetro: a temperatura. Os máximos nas curvas do corpo negro, λ max, mudam para comprimentos de onda mais curtos à medida que a temperatura aumenta, refletindo a observação de que os metais sendo aquecidos a altas temperaturas começam a brilhar em um vermelho mais escuro que se torna mais brilhante à medida que a temperatura aumenta, eventualmente se tornando branco quente em temperaturas muito altas à medida que as intensidades de todos os comprimentos de onda visíveis se tornam apreciáveis. Essa observação comum estava no cerne do primeiro paradoxo que mostrou as limitações fundamentais da física clássica que examinaremos.
Os físicos derivaram expressões matemáticas para as curvas do corpo negro usando conceitos bem aceitos das teorias da mecânica clássica e do eletromagnetismo clássico. As expressões teóricas como funções de temperatura se ajustam bem às curvas experimentais observadas do corpo negro em comprimentos de onda mais longos, mas mostraram discrepâncias significativas em comprimentos de onda mais curtos. As curvas teóricas não apenas não mostraram um pico, elas mostraram absurdamente a intensidade se tornando infinitamente grande à medida que o comprimento de onda se tornava menor, o que implicaria que objetos do cotidiano em temperatura ambiente deveriam emitir grandes quantidades de luz ultravioleta. Isso ficou conhecido como a “catástrofe ultravioleta” porque ninguém conseguiu encontrar nenhum problema com o tratamento teórico que pudesse levar a um comportamento irreal de comprimento de onda curto. Finalmente, por volta de 1900, Max Planck derivou uma expressão teórica para a radiação de corpo negro que se encaixava exatamente nas observações experimentais (dentro do erro experimental). Planck desenvolveu seu tratamento teórico estendendo o trabalho anterior baseado na premissa de que os átomos que compunham o forno vibravam em frequências crescentes (ou comprimentos de onda decrescentes) à medida que a temperatura aumentava, com essas vibrações sendo a fonte da radiação eletromagnética emitida . Mas onde os tratamentos anteriores permitiram que os átomos vibrantes tivessem quaisquer valores de energia obtidos de um conjunto contínuo de energias (perfeitamente razoável, de acordo com a física clássica), Planck descobriu que, ao restringir as energias vibracionais a valores discretos para cada frequência, ele poderia derivar um expressão de radiação de corpo negro que corretamente teve a intensidade caindo rapidamente nos comprimentos de onda curtos na região UV.
\[E=nhν,\:n=1,2,3,\:. . . \nonumber \]
A quantidade h é uma constante agora conhecida como constante de Planck, em sua homenagem. Embora Planck estivesse satisfeito por ter resolvido o paradoxo da radiação do corpo negro, ele ficou preocupado porque, para fazer isso, ele precisava assumir que os átomos vibrantes exigiam energias quantizadas, o que ele não conseguiu explicar. O valor da constante de Planck é muito pequeno, 6,626 × 10 −34 joule segundos (J s), o que ajuda a explicar por que a quantização de energia não havia sido observada anteriormente em fenômenos macroscópicos.
O efeito fotoelétrico
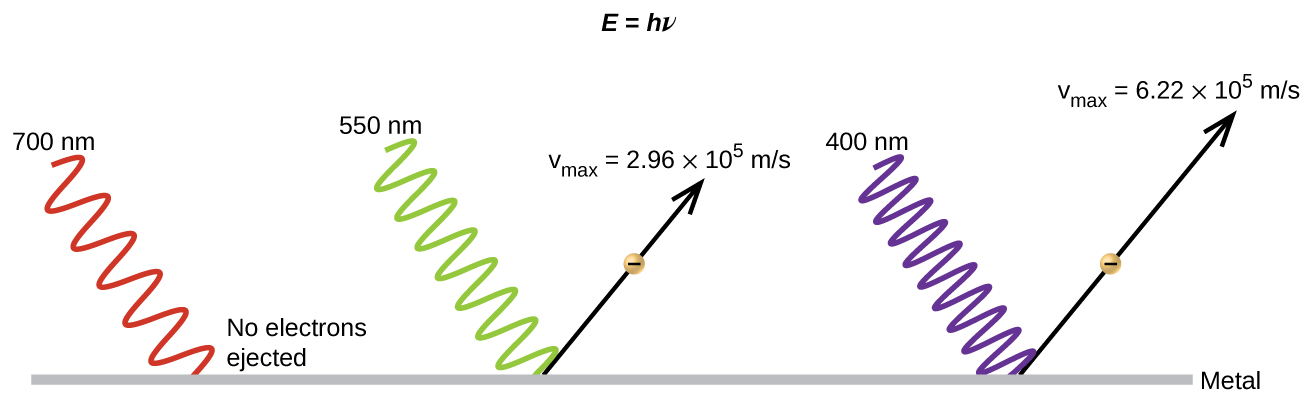
O próximo paradoxo na teoria clássica a ser resolvido diz respeito ao efeito fotoelétrico (Figura\(\PageIndex{10}\)). Foi observado que os elétrons podiam ser ejetados da superfície limpa de um metal quando a luz com uma frequência maior que alguma frequência limite brilhava sobre ele. Surpreendentemente, a energia cinética dos elétrons ejetados não dependia do brilho da luz, mas aumentava com o aumento da frequência da luz. Como os elétrons no metal tinham uma certa quantidade de energia de ligação mantendo-os lá, a luz incidente precisava ter mais energia para liberar os elétrons. De acordo com a teoria clássica das ondas, a energia de uma onda depende de sua intensidade (que depende de sua amplitude), não de sua frequência. Uma parte dessas observações foi que o número de elétrons ejetados em um determinado período de tempo aumentou à medida que o brilho aumentava. Em 1905, Albert Einstein conseguiu resolver o paradoxo incorporando as descobertas de quantização de Planck na visão desacreditada de partículas da luz (Einstein na verdade ganhou seu prêmio Nobel por esse trabalho, e não por suas teorias da relatividade, pelas quais ele é mais famoso).
Einstein argumentou que as energias quantizadas que Planck havia postulado em seu tratamento da radiação de corpo negro poderiam ser aplicadas à luz no efeito fotoelétrico, de modo que a luz que atinge a superfície do metal não deveria ser vista como uma onda, mas sim como um fluxo de partículas (mais tarde chamadas de fótons). ) cuja energia dependia de sua frequência, de acordo com a fórmula de Planck, E = h₂ (ou, em termos de comprimento de onda usando c = λ,\(E=\dfrac{hc}{λ}\)). Os elétrons foram ejetados quando atingidos por fótons com energia suficiente (uma frequência maior que o limite). Quanto maior a frequência, maior a energia cinética transmitida aos elétrons que escapam pelas colisões. Einstein também argumentou que a intensidade da luz não dependia da amplitude da onda de entrada, mas correspondia ao número de fótons atingindo a superfície em um determinado período de tempo. Isso explica por que o número de elétrons ejetados aumentou com o aumento do brilho, já que quanto maior o número de fótons recebidos, maior a probabilidade de eles colidirem com alguns dos elétrons.
Com as descobertas de Einstein, a natureza da luz adquiriu um novo ar de mistério. Embora muitos fenômenos de luz pudessem ser explicados em termos de ondas ou partículas, certos fenômenos, como os padrões de interferência obtidos quando a luz passava por uma fenda dupla, eram completamente contrários à visão de partículas da luz, enquanto outros fenômenos, como o efeito fotoelétrico, eram completamente contrário a uma visão ondulatória da luz. De alguma forma, em um nível fundamental profundo ainda não totalmente compreendido, a luz é ao mesmo tempo ondulatória e semelhante a uma partícula. Isso é conhecido como dualidade onda-partícula.
Quando vemos a luz de um signo de néon, observamos a radiação de átomos de néon excitados. Se essa radiação tem um comprimento de onda de 640 nm, qual é a energia do fóton que está sendo emitido?
Solução
Usamos a parte da equação de Planck que inclui o comprimento de onda, λ e convertemos unidades de nanômetros em metros para que as unidades de λ e c sejam as mesmas.
\[\begin{align*} E&=\dfrac{hc}{λ} \\[4pt] &=\mathrm{\dfrac{(6.626×10^{−34}\:J\cancel{s})(2.998×10^{8}\:m\cancel{s}^{−1})}{(640\cancel{nm})\left(\dfrac{1\:m}{10^9\cancel{nm}}\right)}}\\[4pt] &=\mathrm{3.10×10^{−19}\:J} \end{align*} \nonumber \]
As microondas em um forno têm uma frequência específica que aquece as moléculas de água contidas nos alimentos. (É por isso que a maioria dos plásticos e vidros não esquentam em um forno de microondas - eles não contêm moléculas de água.) Essa frequência é de cerca de 3 × 10 9 Hz. Qual é a energia de um fóton nessas microondas?
- Responda
-
2 × 10 −24 J
Identifique quais das seguintes afirmações são falsas e, quando necessário, altere a palavra ou frase em itálico para torná-las verdadeiras, de acordo com a explicação de Einstein sobre o efeito fotoelétrico.
- Aumentar o brilho da luz recebida aumenta a energia cinética dos elétrons ejetados.
- Aumentar o comprimento de onda da luz recebida aumenta a energia cinética dos elétrons ejetados.
- Aumentar o brilho da luz recebida aumenta o número de elétrons ejetados.
- Aumentar a frequência da luz recebida pode aumentar o número de elétrons ejetados.
Solução
- Falso. Aumentar o brilho da luz recebida não afeta a energia cinética dos elétrons ejetados. Somente a energia, não o número ou a amplitude, dos fótons influencia a energia cinética dos elétrons.
- Falso. Aumentar a frequência da luz recebida aumenta a energia cinética dos elétrons ejetados. A frequência é proporcional à energia e inversamente proporcional ao comprimento de onda. Frequências acima do valor limite transferem o excesso de energia para a energia cinética dos elétrons.
- Verdadeiro Como o número de colisões com fótons aumenta com a luz mais brilhante, o número de elétrons ejetados aumenta.
- Verdadeiro em relação à energia limite que liga os elétrons ao metal. Abaixo desse limite, os elétrons não são emitidos e acima dele eles são. Uma vez acima do valor limite, aumentar ainda mais a frequência não aumenta o número de elétrons ejetados
Calcule a energia limite em kJ/mol de elétrons em alumínio, considerando que o fóton de menor frequência para o qual o efeito fotoelétrico é observado é\(9.87 \times 10^{14}\; Hz\).
- Responda
-
\(3.94 \: kJ/mol\)
Espectros de linha
Outro paradoxo dentro da teoria eletromagnética clássica com a qual os cientistas lutaram no final do século XIX dizia respeito à luz emitida por átomos e moléculas. Quando sólidos, líquidos ou gases condensados são suficientemente aquecidos, eles irradiam parte do excesso de energia como luz. Os fótons produzidos dessa maneira têm uma faixa de energias e, portanto, produzem um espectro contínuo no qual uma série ininterrupta de comprimentos de onda está presente. A maior parte da luz gerada pelas estrelas (incluindo nosso sol) é produzida dessa maneira. Você pode ver todos os comprimentos de onda visíveis da luz presente na luz solar usando um prisma para separá-los. Como pode ser visto na Figura\(\PageIndex{8}\), a luz solar também contém luz UV (comprimentos de onda mais curtos) e luz infravermelha (comprimentos de onda mais longos) que podem ser detectadas usando instrumentos, mas que são invisíveis ao olho humano. Sólidos incandescentes (brilhantes), como filamentos de tungstênio em luzes incandescentes, também emitem luz que contém todos os comprimentos de onda da luz visível. Esses espectros contínuos geralmente podem ser aproximados por curvas de radiação de corpo negro em alguma temperatura apropriada, como as mostradas na Figura\(\PageIndex{9}\).
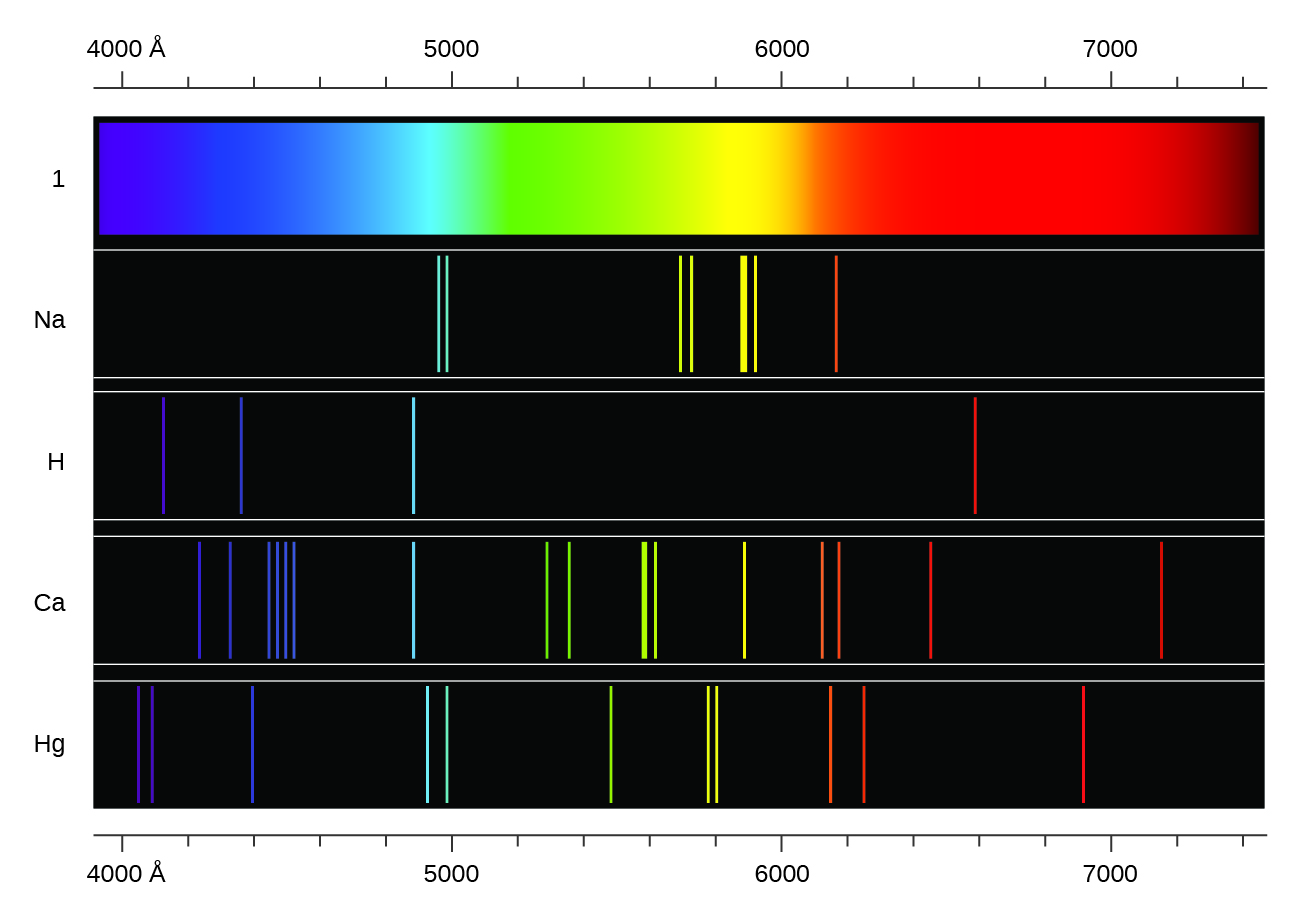
Em contraste com os espectros contínuos, a luz também pode ocorrer como espectros discretos ou de linha com larguras de linha muito estreitas intercaladas pelas regiões espectrais, como as mostradas na Figura\(\PageIndex{5}\). Excitando um gás em baixa pressão parcial usando uma corrente elétrica, ou aquecendo-o, produzirá espectros de linha. Lâmpadas fluorescentes e sinais de néon operam dessa maneira (Figura\(\PageIndex{11}\)). Cada elemento exibe seu próprio conjunto característico de linhas, assim como as moléculas, embora seus espectros sejam geralmente muito mais complicados.

Cada linha de emissão consiste em um único comprimento de onda de luz, o que implica que a luz emitida por um gás consiste em um conjunto de energias discretas. Por exemplo, quando uma descarga elétrica passa por um tubo contendo gás hidrogênio em baixa pressão, as moléculas de H 2 são divididas em átomos H separados e vemos uma cor azul-rosa. A passagem da luz por um prisma produz um espectro de linha, indicando que essa luz é composta por fótons de quatro comprimentos de onda visíveis, conforme mostrado na Figura\(\PageIndex{12}\).
A origem dos espectros discretos em átomos e moléculas foi extremamente intrigante para os cientistas no final do século XIX, pois, de acordo com a teoria eletromagnética clássica, somente espectros contínuos deveriam ser observados. Ainda mais intrigante, em 1885, Johann Balmer conseguiu derivar uma equação empírica que relacionava os quatro comprimentos de onda visíveis da luz emitida pelos átomos de hidrogênio a números inteiros. Essa equação é a seguinte, na qual k é uma constante:
\[\dfrac{1}{λ}=k\left(\dfrac{1}{4}−\dfrac{1}{n^2}\right),\:n=3,\:4,\:5,\:6 \nonumber \]
Outras linhas discretas para o átomo de hidrogênio foram encontradas nas regiões UV e IR. Johannes Rydberg generalizou o trabalho de Balmer e desenvolveu uma fórmula empírica que previa todas as linhas de emissão do hidrogênio, não apenas aquelas restritas à faixa visível, onde n 1 e n 2 são números inteiros, n 1 < n 2, e\(R_∞\) é a constante de Rydberg (1,097 × 10 7 m −1).
\[\dfrac{1}{λ}=R_∞\left(\dfrac{1}{n^2_1}−\dfrac{1}{n^2_2}\right) \nonumber \]
Mesmo no final do século XIX, a espectroscopia era uma ciência muito precisa e, portanto, os comprimentos de onda do hidrogênio foram medidos com altíssima precisão, o que implicava que a constante de Rydberg também poderia ser determinada com muita precisão. Que uma fórmula tão simples como a fórmula de Rydberg pudesse explicar medidas tão precisas parecia surpreendente na época, mas foi a eventual explicação para os espectros de emissão de Neils Bohr em 1913 que acabou convencendo os cientistas a abandonar a física clássica e estimulou o desenvolvimento de mecânica quântica moderna.
Resumo
A luz e outras formas de radiação eletromagnética se movem através de um vácuo com uma velocidade constante, c, de 2,998 × 10 8 m s −1. Essa radiação mostra um comportamento ondulatório, que pode ser caracterizado por uma frequência, ¾, e um comprimento de onda, λ, tal que c = λπ. A luz é um exemplo de onda viajante. Outros fenômenos ondulatórios importantes incluem ondas estacionárias, oscilações periódicas e vibrações. As ondas estacionárias exibem quantização, uma vez que seus comprimentos de onda são limitados a múltiplos inteiros discretos de alguns comprimentos característicos. A radiação eletromagnética que passa por duas fendas estreitas e espaçadas, com dimensões aproximadamente semelhantes ao comprimento de onda, mostrará um padrão de interferência resultante da interferência construtiva e destrutiva das ondas. A radiação eletromagnética também demonstra propriedades de partículas chamadas fótons. A energia de um fóton está relacionada à frequência (ou, alternativamente, ao comprimento de onda) da radiação como E = hπ (ou\(E=\dfrac{hc}{λ}\)), onde h é a constante de Planck. Essa luz demonstra um comportamento ondulatório e semelhante a uma partícula, conhecida como dualidade onda-partícula. Todas as formas de radiação eletromagnética compartilham essas propriedades, embora várias formas, incluindo raios X, luz visível, microondas e ondas de rádio, interajam de forma diferente com a matéria e tenham aplicações práticas muito diferentes. A radiação eletromagnética pode ser gerada pela excitação da matéria para energias mais altas, como por exemplo, aquecendo-a. A luz emitida pode ser contínua (fontes incandescentes como o sol) ou discreta (de tipos específicos de átomos excitados). Os espectros contínuos geralmente têm distribuições que podem ser aproximadas como radiação de corpo negro em alguma temperatura apropriada. O espectro de linha do hidrogênio pode ser obtido passando a luz de um tubo eletrificado de gás hidrogênio através de um prisma. Esse espectro de linha era simples o suficiente para que uma fórmula empírica chamada fórmula de Rydberg pudesse ser derivada do espectro. Três paradoxos historicamente importantes do final do século XIX e início do século XX que não podiam ser explicados dentro da estrutura existente da mecânica clássica e do eletromagnetismo clássico foram o problema do corpo negro, o efeito fotoelétrico e os espectros discretos dos átomos. A resolução desses paradoxos acabou resultando em teorias quânticas que substituíram as teorias clássicas.
Equações-chave
- c = λv/
- \(E=hν=\dfrac{hc}{λ}\), onde h = 6,626 × 10 −34 J s
- \(\dfrac{1}{λ}=R_∞\left(\dfrac{1}{n^2_1}−\dfrac{1}{n^2_2}\right)\)
Glossário
- amplitude
- extensão do deslocamento causado por uma onda (para ondas senoidais, é metade da diferença da altura do pico até a profundidade da calha, e a intensidade é proporcional ao quadrado da amplitude)
- corpo negro
- absorvedor perfeito idealizado de toda a radiação eletromagnética incidente; esses corpos emitem radiação eletromagnética em espectros contínuos característicos chamados radiação de corpo negro
- espectro contínuo
- radiação eletromagnética emitida em uma série ininterrupta de comprimentos de onda (por exemplo, luz branca do sol)
- radiação eletromagnética
- energia transmitida por ondas que têm um componente de campo elétrico e um componente de campo magnético
- espectro eletromagnético
- faixa de energias que a radiação eletromagnética pode compreender, incluindo rádio, microondas, infravermelho, visível, ultravioleta, raios X e raios gama; uma vez que a energia da radiação eletromagnética é proporcional à frequência e inversamente proporcional ao comprimento de onda, o espectro também pode ser especificado por faixas de frequências ou comprimentos de onda
- frequência (\(\nu\))
- número de ciclos de onda (picos ou vales) que passam por um ponto específico no espaço por unidade de tempo
- hertz (Hz)
- a unidade de frequência, que é o número de ciclos por segundo, s −1
- intensidade
- propriedade da energia propagada pela onda relacionada à amplitude da onda, como brilho da luz ou volume do som
- padrão de interferência
- padrão que consiste tipicamente em franjas claras e escuras alternadas; resulta da interferência construtiva e destrutiva das ondas
- espectro de linha
- radiação eletromagnética emitida em comprimentos de onda discretos por um átomo específico (ou átomos) em um estado excitado
- nó
- qualquer ponto de uma onda estacionária com amplitude zero
- fóton
- menor pacote possível de radiação eletromagnética, uma partícula de luz
- quantização
- ocorrendo somente em valores discretos específicos, não contínuos
- onda estacionária
- (também, onda estacionária) fenômeno de onda localizada caracterizado por comprimentos de onda discretos determinados pelas condições de contorno usadas para gerar as ondas; ondas estacionárias são inerentemente quantizadas
- onda
- oscilação que pode transportar energia de um ponto para outro no espaço
- comprimento de onda (λ)
- distância entre dois picos ou vales consecutivos em uma onda
- dualidade onda-partícula
- termo usado para descrever o fato de que partículas elementares, incluindo matéria, exibem propriedades tanto de partículas (incluindo posição localizada, momento) quanto de ondas (incluindo não localização, comprimento de onda, frequência)


