3.4: Proteínas
- Page ID
- 181913
Habilidades para desenvolver
- Descreva as funções que as proteínas desempenham na célula e nos tecidos
- Discuta a relação entre aminoácidos e proteínas
- Explicar os quatro níveis de organização de proteínas
- Descreva as maneiras pelas quais a forma e a função da proteína estão ligadas
As proteínas são uma das moléculas orgânicas mais abundantes nos sistemas vivos e têm a mais diversa gama de funções de todas as macromoléculas. As proteínas podem ser estruturais, regulatórias, contráteis ou protetoras; elas podem servir no transporte, armazenamento ou membranas; ou podem ser toxinas ou enzimas. Cada célula em um sistema vivo pode conter milhares de proteínas, cada uma com uma função única. Suas estruturas, assim como suas funções, variam muito. Eles são todos, no entanto, polímeros de aminoácidos, dispostos em uma sequência linear.
Tipos e funções das proteínas
As enzimas, que são produzidas pelas células vivas, são catalisadoras em reações bioquímicas (como a digestão) e geralmente são proteínas complexas ou conjugadas. Cada enzima é específica para o substrato (um reagente que se liga a uma enzima) sobre o qual atua. A enzima pode ajudar nas reações de degradação, rearranjo ou síntese. As enzimas que decompõem seus substratos são chamadas de enzimas catabólicas, as enzimas que constroem moléculas mais complexas a partir de seus substratos são chamadas de enzimas anabólicas e as enzimas que afetam a taxa de reação são chamadas de enzimas catalíticas. Deve-se notar que todas as enzimas aumentam a taxa de reação e, portanto, são consideradas catalisadoras orgânicas. Um exemplo de enzima é a amilase salivar, que hidrolisa seu substrato amilose, um componente do amido.
Os hormônios são moléculas de sinalização química, geralmente pequenas proteínas ou esteróides, secretadas pelas células endócrinas que agem para controlar ou regular processos fisiológicos específicos, incluindo crescimento, desenvolvimento, metabolismo e reprodução. Por exemplo, a insulina é um hormônio proteico que ajuda a regular o nível de glicose no sangue. Os principais tipos e funções das proteínas estão listados na Tabela\(\PageIndex{1}\).
| Tipo | Exemplos | Funções |
|---|---|---|
| Enzimas digesti | Amilase, lipase, pepsina, tripsina | Ajuda na digestão dos alimentos, catabolizando nutrientes em unidades monoméricas |
| Transporte | Hemoglobina, albumina | Transportar substâncias no sangue ou na linfa por todo o corpo |
| Estrutural | Actina, tubulina, queratina | Construa estruturas diferentes, como o citoesqueleto |
| Hormônios | Insulina, tiroxina | Coordene a atividade de diferentes sistemas corporais |
| Defesa | Imunoglobulinas | Proteja o corpo de patógenos estranhos |
| Contrátil | Actina, miosina | Efeito da contração muscular |
| Armazenamento | Proteínas de armazenamento de leguminosas, clara de ovo (albumina) | Fornecer nutrição no desenvolvimento inicial do embrião e da muda |
As proteínas têm formas e pesos moleculares diferentes; algumas proteínas têm formato globular, enquanto outras são de natureza fibrosa. Por exemplo, a hemoglobina é uma proteína globular, mas o colágeno, encontrado em nossa pele, é uma proteína fibrosa. A forma da proteína é fundamental para sua função, e essa forma é mantida por muitos tipos diferentes de ligações químicas. Mudanças na temperatura, no pH e na exposição a produtos químicos podem levar a mudanças permanentes na forma da proteína, levando à perda da função, conhecida como desnaturação. Todas as proteínas são compostas por diferentes arranjos dos mesmos 20 tipos de aminoácidos.
Aminoácidos
Os aminoácidos são os monômeros que compõem as proteínas. Cada aminoácido tem a mesma estrutura fundamental, que consiste em um átomo de carbono central, também conhecido como carbono alfa (α), ligado a um grupo amino (NH 2), um grupo carboxila (COOH) e a um átomo de hidrogênio. Cada aminoácido também tem outro átomo ou grupo de átomos ligado ao átomo central conhecido como grupo R (Figura\(\PageIndex{1}\)).
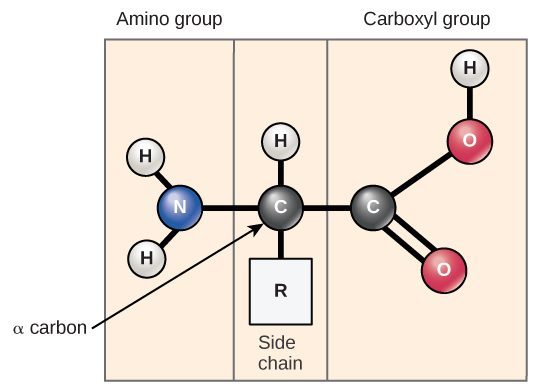
O nome “aminoácido” é derivado do fato de que eles contêm tanto o grupo amino quanto o grupo ácido carboxílico em sua estrutura básica. Conforme mencionado, existem 20 aminoácidos presentes nas proteínas. Dez deles são considerados aminoácidos essenciais em humanos porque o corpo humano não pode produzi-los e são obtidos da dieta. Para cada aminoácido, o grupo R (ou cadeia lateral) é diferente (Figura\(\PageIndex{2}\)).
Conexão artística
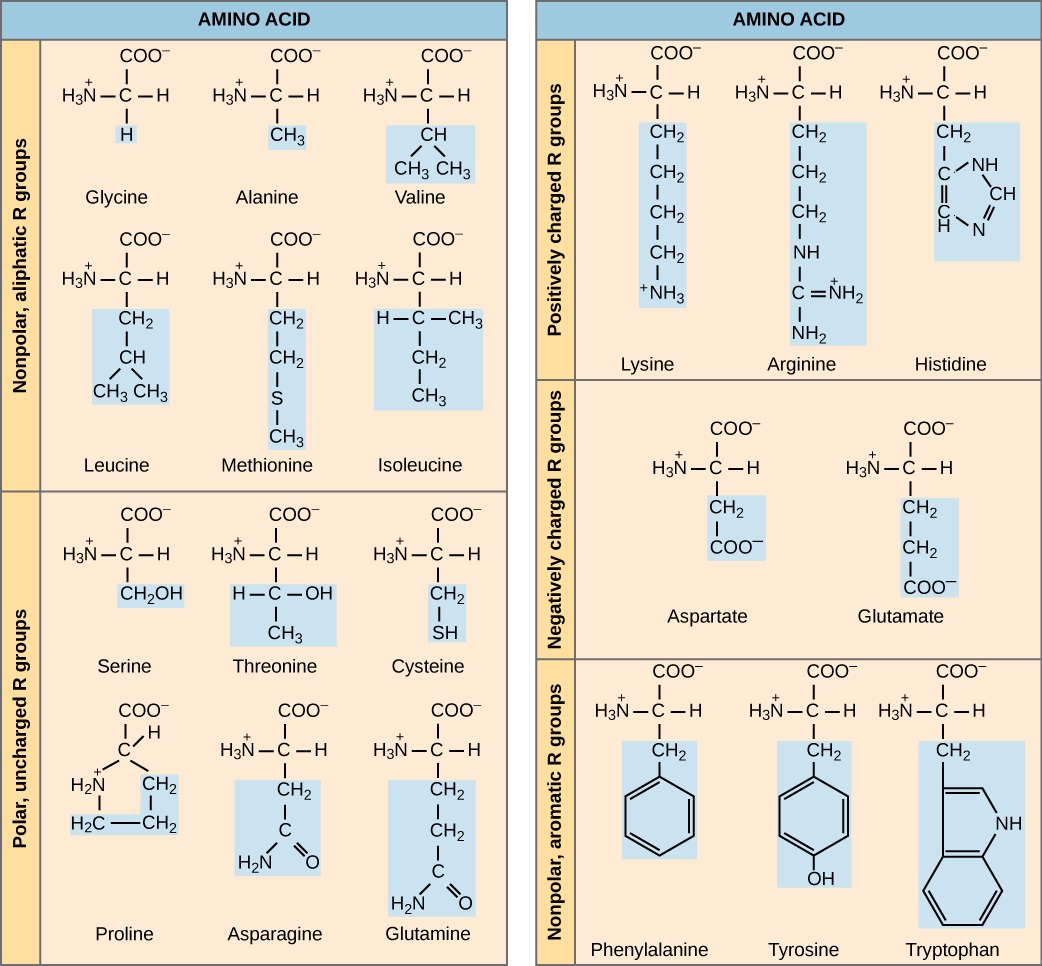
Quais categorias de aminoácidos você esperaria encontrar na superfície de uma proteína solúvel e quais você esperaria encontrar no interior? Que distribuição de aminoácidos você esperaria encontrar em uma proteína incorporada em uma bicamada lipídica?
A natureza química da cadeia lateral determina a natureza do aminoácido (ou seja, se ele é ácido, básico, polar ou não polar). Por exemplo, o aminoácido glicina tem um átomo de hidrogênio como o grupo R. Aminoácidos como valina, metionina e alanina são de natureza não polar ou hidrofóbica, enquanto aminoácidos como serina, treonina e cisteína são polares e têm cadeias laterais hidrofílicas. As cadeias laterais de lisina e arginina têm carga positiva e, portanto, esses aminoácidos também são conhecidos como aminoácidos básicos. A prolina tem um grupo R que está ligado ao grupo amino, formando uma estrutura em forma de anel. A prolina é uma exceção à estrutura padrão de um aminoácido, pois seu grupo amino não é separado da cadeia lateral (Figura\(\PageIndex{2}\)).
Os aminoácidos são representados por uma única letra maiúscula ou uma abreviatura de três letras. Por exemplo, a valina é conhecida pela letra V ou pelo símbolo de três letras val. Assim como alguns ácidos graxos são essenciais para uma dieta, alguns aminoácidos também são necessários. Eles são conhecidos como aminoácidos essenciais e, em humanos, incluem isoleucina, leucina e cisteína. Os aminoácidos essenciais referem-se aos necessários para a construção de proteínas no corpo, embora não sejam produzidos pelo corpo; quais aminoácidos são essenciais variam de organismo para organismo.
A sequência e o número de aminoácidos determinam, em última análise, a forma, o tamanho e a função da proteína. Cada aminoácido é ligado a outro aminoácido por uma ligação covalente, conhecida como ligação peptídica, que é formada por uma reação de desidratação. O grupo carboxila de um aminoácido e o grupo amino do aminoácido entrante se combinam, liberando uma molécula de água. A ligação resultante é a ligação peptídica (Figura\(\PageIndex{3}\)).
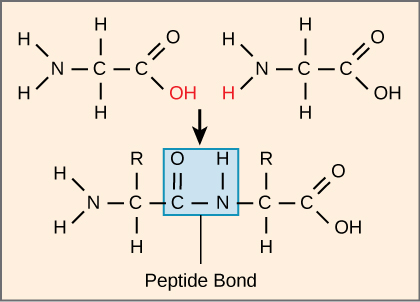
Os produtos formados por essas ligações são chamados de peptídeos. À medida que mais aminoácidos se juntam a essa cadeia crescente, a cadeia resultante é conhecida como polipeptídeo. Cada polipeptídeo tem um grupo amino livre em uma extremidade. Essa extremidade é chamada de terminal N, ou terminal amino, e a outra extremidade tem um grupo carboxila livre, também conhecido como terminal C ou carboxila. Embora os termos polipeptídeo e proteína às vezes sejam usados de forma intercambiável, um polipeptídeo é tecnicamente um polímero de aminoácidos, enquanto o termo proteína é usado para um polipeptídeo ou polipeptídeos que se combinaram, geralmente se unem a grupos protéticos não peptídicos, têm uma forma distinta e têm um função única. Após a síntese proteica (tradução), a maioria das proteínas é modificada. Elas são conhecidas como modificações pós-traducionais. Eles podem sofrer clivagem, fosforilação ou podem exigir a adição de outros grupos químicos. Somente após essas modificações a proteína é completamente funcional.
Conexão de evolução
O significado evolutivo do citocromo C O citocromo c é um componente importante da cadeia de transporte de elétrons, uma parte da respiração celular, e normalmente é encontrado na organela celular, a mitocôndria. Essa proteína tem um grupo protético heme, e o íon central do heme é alternadamente reduzido e oxidado durante a transferência de elétrons. Como o papel dessa proteína essencial na produção de energia celular é crucial, ela mudou muito pouco ao longo de milhões de anos. O sequenciamento de proteínas mostrou que há uma quantidade considerável de homologia da sequência de aminoácidos do citocromo c entre diferentes espécies; em outras palavras, o parentesco evolutivo pode ser avaliado medindo as semelhanças ou diferenças entre as sequências de DNA ou proteína de várias espécies.
Os cientistas determinaram que o citocromo c humano contém 104 aminoácidos. Para cada molécula do citocromo c de diferentes organismos que foi sequenciada até o momento, 37 desses aminoácidos aparecem na mesma posição em todas as amostras do citocromo c. Isso indica que pode ter havido um ancestral comum. Ao comparar as sequências de proteínas humanas e de chimpanzés, nenhuma diferença de sequência foi encontrada. Quando as sequências de humanos e macacos rhesus foram comparadas, a única diferença encontrada foi em um aminoácido. Em outra comparação, o sequenciamento entre humanos e leveduras mostra uma diferença na 44ª posição.
Estrutura proteica
Conforme discutido anteriormente, a forma de uma proteína é fundamental para sua função. Por exemplo, uma enzima pode se ligar a um substrato específico em um local conhecido como sítio ativo. Se esse sítio ativo for alterado devido a mudanças locais ou mudanças na estrutura geral da proteína, a enzima pode ser incapaz de se ligar ao substrato. Para entender como a proteína obtém sua forma ou conformação final, precisamos entender os quatro níveis da estrutura da proteína: primário, secundário, terciário e quaternário.
Estrutura primária
A sequência única de aminoácidos em uma cadeia polipeptídica é sua estrutura primária. Por exemplo, o hormônio pancreático insulina tem duas cadeias polipeptídicas, A e B, e elas estão ligadas entre si por ligações dissulfeto. O aminoácido terminal N da cadeia A é glicina, enquanto o aminoácido terminal C é asparagina (Figura
Resumo
As proteínas são uma classe de macromoléculas que desempenham uma gama diversificada de funções para a célula. Eles ajudam no metabolismo, fornecendo suporte estrutural e atuando como enzimas, transportadores ou hormônios. Os blocos de construção das proteínas (monômeros) são aminoácidos. Cada aminoácido tem um carbono central que está ligado a um grupo amino, um grupo carboxila, um átomo de hidrogênio e um grupo R ou cadeia lateral. Existem 20 aminoácidos comuns, cada um dos quais difere no grupo R. Cada aminoácido está ligado aos seus vizinhos por uma ligação peptídica. Uma longa cadeia de aminoácidos é conhecida como polipeptídeo.
As proteínas são organizadas em quatro níveis: primário, secundário, terciário e (opcional) quaternário. A estrutura primária é a sequência única de aminoácidos. O dobramento local do polipeptídeo para formar estruturas como a hélice α e a folha plissada β constitui a estrutura secundária. A estrutura tridimensional geral é a estrutura terciária. Quando dois ou mais polipeptídeos se combinam para formar a estrutura proteica completa, a configuração é conhecida como estrutura quaternária de uma proteína. A forma e a função da proteína estão intrinsecamente ligadas; qualquer alteração na forma causada por mudanças na temperatura ou no pH pode levar à desnaturação da proteína e à perda da função.
Conexões artísticas
Figura\(\PageIndex{2}\): Quais categorias de aminoácidos você esperaria encontrar na superfície de uma proteína solúvel e quais você esperaria encontrar no interior? Que distribuição de aminoácidos você esperaria encontrar em uma proteína incorporada em uma bicamada lipídica?
- Resposta
-
Resíduos de aminoácidos polares e carregados (o restante após a formação da ligação peptídica) têm maior probabilidade de serem encontrados na superfície de proteínas solúveis, onde podem interagir com a água, e os não polares (por exemplo, cadeias laterais de aminoácidos) são mais prováveis de serem encontrados no interior, onde são sequestrados da água. Nas proteínas de membrana, as cadeias laterais de aminoácidos não polares e hidrofóbicos se associam às caudas hidrofóbicas dos fosfolipídios, enquanto as cadeias laterais de aminoácidos polares e carregados interagem com os grupos da cabeça polar ou com a solução aquosa. No entanto, existem exceções. Às vezes, cadeias laterais de aminoácidos com carga positiva e negativa interagem umas com as outras no interior de uma proteína, e cadeias laterais de aminoácidos polares ou carregados que interagem com um ligante podem ser encontradas na bolsa de ligação do ligante.
Glossário
- estrutura alfa-hélice (α -hélice)
- tipo de estrutura secundária de proteínas formada pelo dobramento do polipeptídeo em forma de hélice com ligações de hidrogênio estabilizando a estrutura
- aminoácido
- monômero de uma proteína; tem um carbono central ou carbono alfa ao qual um grupo amino, um grupo carboxila, um hidrogênio e um grupo R ou cadeia lateral estão ligados; o grupo R é diferente para todos os 20 aminoácidos
- folha plissada beta (plissada β)
- estrutura secundária encontrada em proteínas nas quais as “pregas” são formadas pela ligação de hidrogênio entre átomos na espinha dorsal da cadeia polipeptídica
- acompanhante
- (também, chaperonina) proteína que ajuda a proteína nascente no processo de dobramento
- desnaturação
- perda de forma em uma proteína como resultado de mudanças na temperatura, pH ou exposição a produtos químicos
- enzima
- catalisador em uma reação bioquímica que geralmente é uma proteína complexa ou conjugada
- hormônio
- molécula de sinalização química, geralmente proteína ou esteróide, secretada pelas células endócrinas que agem para controlar ou regular processos fisiológicos específicos
- ligação peptídica
- ligação formada entre dois aminoácidos por uma reação de desidratação
- polipeptídeo
- cadeia longa de aminoácidos ligados por ligações peptídicas
- estrutura primária
- sequência linear de aminoácidos em uma proteína
- proteína
- macromolécula biológica composta por uma ou mais cadeias de aminoácidos
- estrutura quaternária
- associação de subunidades polipeptídicas discretas em uma proteína
- estrutura secundária
- estrutura regular formada por proteínas por ligação intramolecular de hidrogênio entre o átomo de oxigênio de um resíduo de aminoácido e o hidrogênio ligado ao átomo de nitrogênio de outro resíduo de aminoácido
- estrutura terciária
- conformação tridimensional de uma proteína, incluindo interações entre elementos estruturais secundários; formada a partir de interações entre cadeias laterais de aminoácidos


