4.E: A Segunda Lei da Termodinâmica (Exercício)
- Page ID
- 184591
Perguntas conceituais
4.2 Processos reversíveis e irreversíveis
1. Diga um exemplo de um processo que ocorre na natureza que seja o mais próximo possível de ser reversível.
4.3 Motores térmicos
2. Explique em termos práticos por que a eficiência é definida como\(\displaystyle W/Q_h\).
4.4 Refrigeradores e bombas de calor
3. Se a porta da geladeira ficar aberta, o que acontece com a temperatura da cozinha?
4. É possível que a eficiência de um motor reversível seja maior que 1,0? É possível que o coeficiente de desempenho de um refrigerador reversível seja menor que 1,0?
4.5 Declarações da Segunda Lei da Termodinâmica
5. No texto, mostramos que, se a declaração de Clausius for falsa, a declaração de Kelvin também deve ser falsa. Agora mostre o contrário, de forma que, se a declaração de Kelvin for falsa, segue-se que a declaração de Clausius é falsa.
6. Por que não operamos transatlânticos extraindo calor do oceano ou operamos aviões extraindo calor da atmosfera?
7. Discuta as vantagens e desvantagens práticas das bombas de calor e do aquecimento elétrico.
8. A produção de energia de uma bomba de calor é maior do que a energia usada para operar a bomba. Por que essa afirmação não viola a primeira lei da termodinâmica?
9. Especule por que as usinas nucleares são menos eficientes do que as usinas de combustíveis fósseis com base em argumentos de temperatura.
10. Um gás ideal vai de estado\(\displaystyle (p_i,V_i)\) para estado\(\displaystyle (p_f,V_f)\) quando é permitido se expandir livremente. É possível representar o processo real em um diagrama pV? Explique.
4.6 O ciclo de Carnot
11. Para aumentar a eficiência de um motor Carnot, a temperatura do reservatório quente deve ser aumentada ou diminuída? E o reservatório de frio?
12. Como você poderia projetar um motor Carnot com 100% de eficiência?
13. Que tipos de processos ocorrem em um ciclo de Carnot?
4.7 Entropia
14. A entropia de um motor Carnot aumenta a cada ciclo?
15. É possível que um sistema tenha uma mudança de entropia se ele não absorver nem emitir calor durante uma transição reversível? O que acontece se o processo for irreversível?
4.8 Entropia em escala microscópica
16. As mudanças de entropia dos sistemas nos seguintes processos são positivas ou negativas?
(a) vapor de água que se condensa em uma superfície fria;
(b) gás em um recipiente que vaza para a atmosfera circundante;
(c) um cubo de gelo que derrete em um copo de água morna;
(d) a água morna da parte (c);
(e) um verdadeiro motor térmico executando um ciclo; (f) alimentos resfriados em um refrigerador.
17. Discuta as mudanças de entropia nos sistemas da Pergunta 21.10 em termos de transtorno.
Problemas
4.2 Processos reversíveis e irreversíveis
18. Um tanque contém 111,0 g de gás cloro (\(\displaystyle Cl_2\)), que está à temperatura de 82,0° C e pressão absoluta\(\displaystyle 5.70×10^5Pa\). A temperatura do ar fora do tanque é de 20,0° C. A massa molar de\(\displaystyle Cl_2\) é 70,9 g/mol.
(a) Qual é o volume do tanque?
(b) Qual é a energia interna do gás?
(c) Qual é o trabalho realizado pelo gás se a temperatura e a pressão dentro do tanque caírem para 31,0° C e\(\displaystyle 3.80×10^5Pa\), respectivamente, devido a um vazamento?
19. Um mol de gás monoatômico ideal a 0°C e 1,00 atm é aquecido para se expandir isobaricamente e triplicar seu volume. Quanto calor é transferido durante o processo?
20. Um mol de um gás ideal na pressão de 4,00 atm e temperatura de 298 K se expande isotermicamente para dobrar seu volume. Qual é o trabalho feito pelo gás?
21. Após uma expansão livre para quadruplicar seu volume, uma mol de gás diatômico ideal é comprimida de volta ao seu volume original adiabaticamente e depois resfriada até a temperatura original. Qual é o mínimo de calor removido do gás na etapa final para restaurar seu estado?
4.3 Motores térmicos
22. Verificou-se que um motor tem uma eficiência de 0,40. Se ele faz 200 J de trabalho por ciclo, quais são as quantidades correspondentes de calor absorvidas e descarregadas?
23. Ao realizar 100,0 J de trabalho, um motor descarrega 50,0 J de calor. Qual é a eficiência do motor?
24. Um motor com uma eficiência de 0,30 absorve 500 J de calor por ciclo.
(a) Quanto trabalho ele realiza por ciclo?
(b) Quanto calor ele descarrega por ciclo?
25. Verificou-se que um motor descarrega 100,0 J enquanto absorve 125,0 J em cada ciclo de operação.
(a) Qual é a eficiência do motor?
(b) Quanto trabalho ele realiza por ciclo?
26. A temperatura do reservatório frio do motor é de 300 K. Tem uma eficiência de 0,30 e absorve 500 J de calor por ciclo.
(a) Quanto trabalho ele realiza por ciclo?
(b) Quanto calor ele descarrega por ciclo?
27. Um motor absorve três vezes mais calor do que descarrega. O trabalho realizado pelo motor por ciclo é de 50 J. Calcular
(a) a eficiência do motor,
(b) o calor absorvido por ciclo, e
(c) o calor descarregado por ciclo.
28. Uma usina a carvão consome 100.000 kg de carvão por hora e produz 500 MW de energia. Se o calor da combustão do carvão for de 30 MJ/kg, qual é a eficiência da usina?
4.4 Refrigeradores e bombas de calor
29. Um refrigerador tem um coeficiente de desempenho de 3,0.
(a) Se precisar de 200 J de trabalho por ciclo, quanto calor por ciclo ele remove o reservatório de frio?
(b) Quanto calor por ciclo é descartado no reservatório quente?
30. Durante um ciclo, um refrigerador remove 500 J de um reservatório frio e descarrega 800 J em seu reservatório quente.
(a) Qual é seu coeficiente de desempenho?
(b) Quanto trabalho por ciclo é necessário para operar?
31. Se um refrigerador descartar 80 J de calor por ciclo e seu coeficiente de desempenho for 6,0, o que são
(a) a quantidade de calor que ele remove por ciclo de um reservatório frio e
(b) a quantidade de trabalho por ciclo necessária para sua operação?
32. Um refrigerador tem um coeficiente de desempenho de 3,0.
(a) Se precisar de 200 J de trabalho por ciclo, quanto calor por ciclo ele remove o reservatório de frio?
(b) Quanto calor por ciclo é descartado no reservatório quente?
4.6 O ciclo de Carnot
33. A temperatura dos reservatórios frios e quentes entre os quais um refrigerador Carnot opera é de −73°C e 270°C, respectivamente. Qual é o seu coeficiente de desempenho?
34. Suponha que um refrigerador Carnot\(\displaystyle T_c\) opere entre\(\displaystyle T_h\) e. Calcule a quantidade de trabalho necessária para extrair 1,0 J de calor do reservatório frio se
(uma)\(\displaystyle T_c=7°, T_h=27°C;\)
(b)\(\displaystyle T_c=−73°C, T_h=27°C\);
(c)\(\displaystyle T_c=−173°C, T_h=27°C\); e
(d)\(\displaystyle T_c=−273°C, T_h=27°C\).
35. Um motor Carnot opera entre reservatórios a 600 e 300 K. Se o motor absorve 100 J por ciclo no reservatório quente, qual é sua potência de trabalho por ciclo?
36. Um motor de 500 W opera um refrigerador Carnot entre −5°C e 30°C.
(a) Qual é a quantidade de calor por segundo extraída do interior do refrigerador?
(b) Quanto calor é exaurido para o ar externo por segundo?
37. Desenhe um ciclo de Carnot em um diagrama de temperatura-volume.
38. Uma bomba de calor Carnot opera entre 0°C e 20°C. Quanto calor é expelido para o interior de uma casa para cada 1,0 J de trabalho realizado pela bomba?
39. Um motor operando entre reservatórios de calor a 20°C e 200°C extrai 1000 J por ciclo do reservatório quente.
(a) Qual é o trabalho máximo possível que o motor pode fazer por ciclo?
(b) Para esse trabalho máximo, quanto calor é expelido para o reservatório de frio por ciclo?
40. Suponha que um motor Carnot possa ser operado entre dois reservatórios como motor térmico ou refrigerador. Como o coeficiente de desempenho do refrigerador está relacionado à eficiência do motor térmico?
41. Um motor Carnot é usado para medir a temperatura de um reservatório de calor. O motor opera entre o reservatório de calor e um reservatório que consiste em água em seu ponto triplo.
(a) Se 400 J por ciclo forem removidos do reservatório de calor e 200 J por ciclo forem depositados no reservatório de três pontos, qual é a temperatura do reservatório de calor?
(b) Se 400 J por ciclo forem removidos do reservatório de três pontos enquanto 200 J por ciclo forem depositados no reservatório de calor, qual é a temperatura do reservatório de calor?
42. Qual é o trabalho mínimo exigido de um refrigerador para extrair 50 J por ciclo do interior de um freezer a −10° C e expelir o calor para o ar a 25° C?
4.7 Entropia
43. Duzentos joules de calor são removidos de um reservatório de calor a uma temperatura de 200 K. Qual é a mudança de entropia do reservatório?
44. Em uma expansão isotérmica reversível a 27°C, um gás ideal faz 20 J de trabalho. Qual é a mudança de entropia do gás?
45. Um gás ideal a 300 K é comprimido isotermicamente até um quinto do seu volume original. Determine a mudança de entropia por mol do gás.
46. Qual é a mudança de entropia de 10 g de vapor a 100°C quando ele se condensa em água na mesma temperatura?
47. Uma haste de metal é usada para conduzir calor entre dois reservatórios em temperaturas\(\displaystyle T_h\) e\(\displaystyle T_c\), respectivamente. Quando uma quantidade de calor Q flui através da haste do reservatório quente para o frio, qual é a mudança de entropia líquida da haste, do reservatório quente, do reservatório frio e do universo?
48. Para o ciclo de Carnot da Figura 4.12, qual é a mudança de entropia do reservatório quente, do reservatório frio e do universo?
49. Um pedaço de chumbo de 5,0 kg a uma temperatura de 600°C é colocado em um lago cuja temperatura é de 15°C. Determine a mudança de entropia de (a) a peça de chumbo, (b) o lago e (c) o universo.
50. Um mol de um gás ideal dobra seu volume em uma expansão isotérmica reversível.
(a) Qual é a mudança na entropia do gás?
(b) Se 1500 J de calor forem adicionados nesse processo, qual é a temperatura do gás?
51. Um mol de um gás monoatômico ideal está confinado a um recipiente rígido. Quando o calor é adicionado reversivelmente ao gás, sua temperatura muda de\(\displaystyle T_1\) para\(\displaystyle T_2\).
(a) Quanto calor é adicionado?
(b) Qual é a mudança na entropia do gás?
52. (a) Uma rocha de 5,0 kg a uma temperatura de 20° C é jogada em um lago raso também a 20° C de uma altura de\(\displaystyle 1.0×10^3m\). Qual é a mudança resultante na entropia do universo?
(b) Se a temperatura da rocha é de 100°C+100°C quando ela cai, qual é a mudança de entropia do universo? Suponha que o atrito do ar seja insignificante (não é uma boa suposição) e que C = 860J/kg⋅K é o calor específico da rocha.
4.8 Entropia em escala microscópica
53. Uma barra de cobre de área transversal\(\displaystyle 5.0cm^2\) e comprimento de 5,0 m conduz o calor de um reservatório de calor a 373 K para um a 273 K. Qual é a taxa temporal de mudança da entropia do universo para esse processo?
54. Cinquenta gramas de água a 20° C são aquecidas até se tornar vapor a 100° C. Calcule a mudança na entropia da água nesse processo.
55. Cinquenta gramas de água a 0°C são transformados em vapor a 100°C. Qual é a mudança na entropia da água nesse processo?
56. Em um processo isocórico, o calor é adicionado a 10 mol de gás monoatômico ideal cuja temperatura aumenta de 273 para 373 K. Qual é a mudança de entropia do gás?
57. Duzentos gramas de água a 0°C são colocados em contato com um reservatório de calor a 80°C. Depois que o equilíbrio térmico é alcançado, qual é a temperatura da água? Do reservatório? Quanto calor foi transferido no processo? Qual é a mudança de entropia da água? Do reservatório? Qual é a mudança de entropia do universo?
58. Suponha que a temperatura da água no problema anterior seja aumentada primeiro colocando-a em equilíbrio térmico com um reservatório a uma temperatura de 40° C e depois com um reservatório a 80° C. Calcule as mudanças de entropia de (a) cada reservatório, (b) da água e (c) do universo.
59. Duzentos gramas de água a 0° C são colocados em contato com o equilíbrio térmico sucessivamente com reservatórios a 20° C, 40° C, 60° C e 80° C.
(a) Qual é a mudança de entropia da água?
(b) Do reservatório?
(c) Qual é a mudança de entropia do universo?
60. (a) Dez gramas de\(\displaystyle H_2O\) começa como gelo a 0°C. O gelo absorve o calor do ar (um pouco acima de 0°C) até que tudo derreta. Calcule a mudança de entropia do\(\displaystyle H_2O\), do ar e do universo.
(b) Suponha que o ar na parte (a) esteja a 20° C em vez de 0° C e que o gelo absorva calor até se tornar água a 20° C. Calcule a mudança de entropia do\(\displaystyle H_2O\), do ar e do universo.
(c) Algum desses processos é reversível?
61. O ciclo de Carnot é representado pelo diagrama de entropia de temperatura mostrado abaixo.
(a) Quanto calor é absorvido por ciclo no reservatório de alta temperatura?
(b) Quanto calor é esgotado por ciclo no reservatório de baixa temperatura?
(c) Quanto trabalho é feito por ciclo pelo motor? (d) Qual é a eficiência do
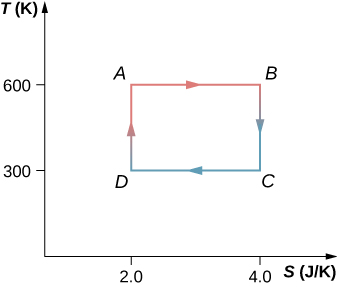
62. Um motor Carnot operando entre reservatórios de calor a 500 e 300 K absorve 1500 J por ciclo no reservatório de alta temperatura.
(a) Representar o ciclo do motor em um diagrama de entropia de temperatura.
(b) Quanto trabalho por ciclo é feito pelo motor?
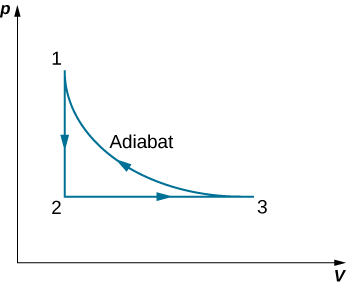
63. Um gás monoatômico ideal (n moles) passa por um processo cíclico mostrado abaixo. Encontre a mudança na entropia do gás em cada etapa e a mudança total da entropia ao longo de todo o ciclo.
64. Um motor Carnot tem uma eficiência de 0,60. Quando a temperatura do reservatório frio muda, a eficiência cai para 0,55. Se inicialmente\(\displaystyle T_c=27°C\), determine
(a) o valor constante de\(\displaystyle T_h\) e
(b) o valor final de\(\displaystyle T_c\).
65. Um motor Carnot executa 100 J de trabalho enquanto descarrega 200 J de calor a cada ciclo. Depois que a temperatura do reservatório quente é ajustada apenas, verifica-se que o motor agora faz 130 J de trabalho enquanto descarta a mesma quantidade de calor.
(a) Quais são as eficiências inicial e final do motor?
(b) Qual é a mudança fracionária na temperatura do reservatório quente?
66. Um refrigerador Carnot expele o calor para o ar, que está a uma temperatura de 25°C. Quanta energia é usada pela geladeira se ela congelar 1,5 g de água por segundo? Suponha que a água esteja a 0°C.
Problemas adicionais
67. Uma bomba de calor de 300 W opera entre o solo, cuja temperatura é de 0°C, e o interior de uma casa a 22°C. Qual é a quantidade máxima de calor por hora que a bomba de calor pode fornecer à casa?
68. Um engenheiro deve projetar um refrigerador que faça 300 J de trabalho por ciclo para extrair 2100 J de calor por ciclo de um freezer cuja temperatura seja −10°C. Qual é a temperatura máxima do ar para a qual essa condição pode ser atendida? Essa é uma condição razoável para impor ao design?
69. Um motor Carnot emprega 1,5 mol de gás nitrogênio como substância de trabalho, que é considerado um gás diatômico ideal com γ=7,5 nas temperaturas de trabalho do motor. O ciclo de Carnot segue o ciclo ABCDA, com AB sendo uma expansão isotérmica. O volume nos pontos A e C do ciclo é\(\displaystyle 5.0×10^{−3}m^3\) e 0,15 L, respectivamente. O motor opera entre dois banhos térmicos de temperatura de 500 K e 300 K.
(a) Encontre os valores do volume em B e D.
(b) Quanto calor é absorvido pelo gás na expansão isotérmica AB?
(c) Quanto trabalho é feito pelo gás na expansão isotérmica AB?
(d) Quanto calor é liberado pelo gás na expansão CDIsotérmica?
(e) Quanto trabalho é feito pelo gás na compressão isotérmica do CD?
(f) Quanto trabalho é feito pelo gás na expansão adiabática do BC?
(g) Quanto trabalho é feito pelo gás na compressão adiabática da?
(h) Encontre o valor da eficiência do motor com base na rede e na entrada de calor. Compare esse valor com a eficiência de um motor Carnot com base nas temperaturas dos dois banhos.
70. Um bloco de madeira de 5,0 kg começa com uma velocidade inicial de 8,0 m/s e desliza pelo chão até que o atrito o interrompa. Estime a mudança resultante na entropia do universo. Suponha que tudo permaneça a uma temperatura ambiente de 20°C.
71. Um sistema que consiste em 20,0 mol de um gás monoatômico ideal é resfriado a uma pressão constante de um volume de 50,0 L a 10,0 L. A temperatura inicial foi de 300 K. Qual é a mudança na entropia do gás?
72. Um copo de vidro de massa de 400 g contém 500 g de água a 27°C. O copo é aquecido reversivelmente para que a temperatura do copo e da água suba gradualmente até 57°C. Encontre a mudança na entropia do copo e da água juntos.
73. Um motor Carnot opera entre banhos de 550°C e 20°C e produz 300 kJ de energia em cada ciclo. Encontrou a mudança na entropia do (a) banho quente e (b) banho frio, em cada ciclo de Carnot?
74. Um gás ideal à temperatura T é armazenado na metade esquerda de um recipiente isolante de volume V usando uma partição de volume insignificante (veja abaixo). Qual é a mudança de entropia por mol do gás em cada um dos seguintes casos?
(a) A divisória é removida repentinamente e o gás enche rapidamente todo o recipiente.
(b) Um pequeno orifício é perfurado na divisória e, após um longo período, o gás atinge um estado de equilíbrio de forma que não haja fluxo líquido através do orifício.
(c) A divisória é movida muito lentamente e adiabaticamente até a parede direita para que o gás finalmente encha todo o recipiente.
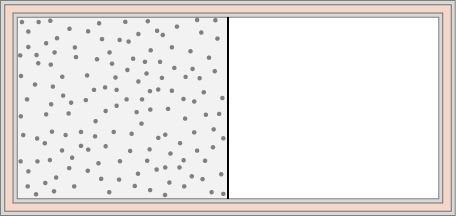
75. Um pedaço de alumínio de 0,50 kg a 250° C é jogado em 1,0 kg de água a 20° C. Depois que o equilíbrio é alcançado, qual é a mudança de entropia líquida do sistema?
76. Suponha que 20 g de gelo a 0°C sejam adicionados a 300 g de água a 60°C. Qual é a mudança total na entropia da mistura depois que ela atinge o equilíbrio térmico?
77. Um motor térmico opera entre duas temperaturas, de modo que a substância de trabalho do motor absorva 5000 J de calor do banho de alta temperatura e descarregue 3000 J no banho de baixa temperatura. O resto da energia é convertida em energia mecânica da turbina. Encontre
(a) a quantidade de trabalho produzido pelo motor e
(b) a eficiência do motor.
78. Um motor térmico produz 4 MJ de energia elétrica enquanto opera entre dois banhos térmicos de diferentes temperaturas. A substância de trabalho do motor descarrega 5 MJ de calor no banho de temperatura fria. Qual é a eficiência do motor?
79. Uma usina a carvão consome 100.000 kg de carvão por hora e produz 500 MW de energia. Se o calor da combustão do carvão for de 30 MJ/kg, qual é a eficiência da usina?
80. Um motor Carnot opera em um ciclo de Carnot entre uma fonte de calor a 550°C 550°C e um dissipador de calor a 20°C .20°C. Descubra a eficiência do motor Carnot.
81. Um motor Carnot trabalhando entre dois banhos de calor de temperaturas de 600 K e 273 K completa cada ciclo em 5 segundos. Em cada ciclo, o motor absorve 10 kJ de calor. Descubra a potência do motor.
82. Um ciclo de Carnot trabalhando entre 100°C e 30°C é usado para acionar um refrigerador entre −10°C e 30°C. Quanta energia o motor Carnot deve produzir por segundo para que o refrigerador possa descartar 10 J de energia por segundo?
Problemas de desafio
83. (a) Uma quantidade infinitesimal de calor é adicionada reversivelmente a um sistema. Combinando a primeira e a segunda lei, mostre isso\(\displaystyle dU=TdS−dW\). (b) Quando o calor é adicionado a um gás ideal, sua temperatura e volume mudam de\(\displaystyle T_1\)\(\displaystyle T_2\) e\(\displaystyle V_1\) para\(\displaystyle V_2\) e. Mostre que a mudança de entropia de n moles do gás é dada por\(\displaystyle ΔS=nC_v\ln\frac{T_2}{T_1}+nR\ln\frac{V_2}{V_1}\).
84. Usando o resultado do problema anterior, mostre que, para um gás ideal passando por um processo adiabático,\(\displaystyle TV^{γ−1}\) é constante.
85. Com a ajuda dos dois problemas anteriores, mostre que ΔS entre os estados 1 e 2 de n moles, um gás ideal é dado por\(\displaystyle ΔS=nC_p\ln\frac{T_2}{T_1}−nRln\frac{p_2}{p_1}\).
86. Um cilindro contém 500 g de hélio a 120 atm e 20°C. A válvula está vazando e todo o gás escapa lentamente isotermicamente para a atmosfera. Use os resultados do problema anterior para determinar a mudança resultante na entropia do universo.
87. Um gás ideal diatômico é trazido de um estado de equilíbrio inicial em\(\displaystyle p_1=0.50atm\) e\(\displaystyle T_1=300K\) para um estágio final com\(\displaystyle p_2=0.20atm\)\(\displaystyle T_1=500K\) e. Use os resultados do problema anterior para determinar a mudança de entropia por mol do gás.
88. O motor de combustão interna a gasolina opera em um ciclo composto por seis partes. Quatro dessas partes envolvem, entre outras coisas, atrito, troca de calor por meio de diferenças finitas de temperatura e acelerações do pistão; é irreversível. No entanto, é representado pelo ciclo Otto reversível ideal, ilustrado abaixo. A substância de trabalho do ciclo é considerada o ar. As seis etapas do ciclo Otto são as seguintes:
i. AVC por ingestão isobárica (OA). Uma mistura de gasolina e ar é aspirada para a câmara de combustão à pressão atmosférica à\(\displaystyle p_0\) medida que o pistão se expande, aumentando o volume do cilindro de zero para\(\displaystyle V_A\).
ii. Curso de compressão adiabática (AB). A temperatura da mistura aumenta à medida que o pistão a comprime adiabaticamente de um volume\(\displaystyle V_A\) para\(\displaystyle V_B\).
iii. Ignição em volume constante (BC). A mistura é inflamada por uma faísca. A combustão acontece tão rápido que essencialmente não há movimento do pistão. Durante esse processo, o calor adicionado\(\displaystyle Q_1\) faz com que a pressão aumente de\(\displaystyle p_B\)\(\displaystyle p_C\) PbtoPC em um volume constante\(\displaystyle V_B(=V_C)\).
iv. Expansão adiabática (CD). A mistura aquecida de gasolina e ar se expande contra o pistão, aumentando o volume de\(\displaystyle V_C\) para\(\displaystyle V_D\). Isso é chamado de curso de força, pois é a parte do ciclo que fornece a maior parte da potência ao virabrequim.
v. Exaustão de volume constante (DA). Quando a válvula de escape se abre, alguns dos produtos de combustão escapam. Quase não há movimento do pistão durante essa parte do ciclo, então o volume permanece constante em\(\displaystyle V_A(=V_D)\). A maior parte da energia disponível é perdida aqui, conforme representado pela exaustão de calor\(\displaystyle Q_2\).
vi. Compressão isobárica (AO). A válvula de escape permanece aberta e a compressão de\(\displaystyle V_A\) até zero expulsa os demais produtos de combustão.
(a) Usando (i)\(\displaystyle e=W/Q_1\); (ii)\(\displaystyle W=Q_1−Q_2\); e (iii)\(\displaystyle Q_1=nC_v(T_C−T_B), Q_2=nC_v(T_D−T_A)\), mostre isso\(\displaystyle e=1−\frac{T_D−T_A}{T_C−T_B}\). (b) Use o fato de que as etapas (ii) e (iv) são adiabáticas para mostrar que\(\displaystyle e=1−\frac{1}{r^{γ−1}}\), onde\(\displaystyle r=V_A/V_B\). A quantidade r é chamada de taxa de compressão do motor. (c) Na prática, r é mantido em menos de cerca de 7. Para valores maiores, a mistura gasolina-ar é comprimida a temperaturas tão altas que explode antes que a faísca cronometrada seja fornecida. Essa pré-ignição causa batidas no motor e perda de potência. Mostre que para r=6 e γ=1,4 (o valor do ar), e=0,51 ou uma eficiência de 51%. Por causa dos muitos processos irreversíveis, um motor de combustão interna real tem uma eficiência muito menor do que esse valor ideal. A eficiência típica de um motor ajustado é de cerca de 25% a 30%.
89. Um ciclo diesel ideal é mostrado abaixo. Este ciclo consiste em cinco traços. Nesse caso, somente o ar é aspirado para dentro da câmara durante o curso de admissão OA. O ar é então comprimido adiabaticamente do estado A para o estado B, elevando sua temperatura alta o suficiente para que, quando o combustível for adicionado durante o curso de força BC, ele acenda. Depois que a ignição termina em C, há mais um CD adiabático de curso de força. Finalmente, há um escape em volume constante à medida que a pressão cai de\(\displaystyle p_D\) para\(\displaystyle p_A\), seguido por um escape adicional quando o pistão comprime o volume da câmara até zero. (a) Use\(\displaystyle W=Q_1−Q_2, Q_1=nC_p(T_C−T_B),\) e\(\displaystyle Q_2=nC_v(T_D−T_A)\) mostre isso\(\displaystyle e=\frac{W}{Q_1}=1−\frac{T_D−T_A}{γ(T_C−T_B)}\). (b) Use o fato de que A→B e C→D são adiabáticos para mostrar que\(\displaystyle e=1−\frac{1}{γ}\frac{(\frac{V_C}{V_D})^γ−(\frac{V_B}{V_A})^γ}{(\frac{V_C}{V_D})−(\frac{V_B}{V_A})}\) (c) Como não há pré-ignição (lembre-se de que a câmara não contém combustível durante a compressão), a taxa de compressão pode ser maior do que a de um motor a gasolina. Normalmente,\(\displaystyle V_A/V_B=15\)\(\displaystyle V_D/V_C=5\) e. Para esses valores e γ=1,4, mostre que ε=0,56, ou uma eficiência de 56%. Na verdade, os motores a diesel operam com uma eficiência de cerca de 30% a 35%, em comparação com 25% a 30% para motores a gasolina.
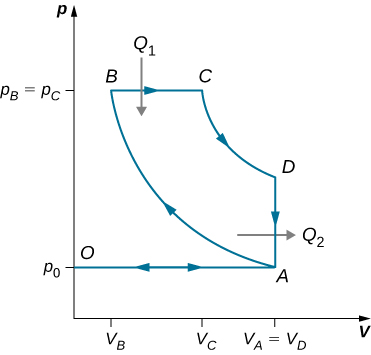
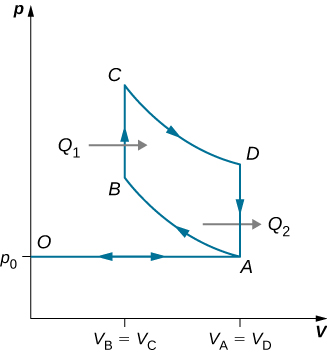
91. Derive uma fórmula para o coeficiente de desempenho de um refrigerador usando um gás ideal como substância de trabalho operando no ciclo mostrado abaixo em termos das propriedades dos três estados rotulados 1, 2 e 3.

92. Dois moles de gás nitrogênio, com γ=7/5 para gases diatômicos ideais, ocupam um volume de\(\displaystyle 10^{−2}m^3\) em um cilindro isolado a uma temperatura de 300 K. O gás é comprimido adiabaticamente e reversivelmente até um volume de 5 L. O pistão do cilindro é travado em seu lugar e o isolamento ao redor do o cilindro é removido. O cilindro condutor de calor é então colocado em um banho de 300 K. O calor do gás comprimido sai do gás e a temperatura do gás se torna 300 K novamente. O gás é então expandido lentamente na temperatura fixa de 300 K até que o volume do gás se torne\(\displaystyle 10^{−2}m^3\), formando assim um ciclo completo para o gás. Para todo o ciclo, calcule (a) o trabalho realizado pelo gás, (b) o calor dentro ou fora do gás, (c) a mudança na energia interna do gás e (d) a mudança na entropia do gás.
93. Um refrigerador Carnot, trabalhando entre 0° C e 30° C, é usado para resfriar um balde\(\displaystyle 10^{−2}m^3\) de água contendo água de 30° C a 5° C em 2 horas. Encontre a quantidade total de trabalho necessária.


