10.2: Propriedades dos núcleos
- Page ID
- 183141
Ao final desta seção, você poderá:
- Descreva a composição e o tamanho de um núcleo atômico
- Use um símbolo nuclear para expressar a composição de um núcleo atômico
- Explique por que o número de nêutrons é maior do que prótons em núcleos pesados
- Calcule a massa atômica de um elemento dados seus isótopos
O núcleo atômico é composto por prótons e nêutrons (Figura\(\PageIndex{1}\)). Prótons e nêutrons têm aproximadamente a mesma massa, mas os prótons carregam uma unidade de carga positiva (+e) e os nêutrons não carregam carga. Essas partículas são agrupadas em um espaço extremamente pequeno no centro de um átomo. De acordo com experimentos de dispersão, o núcleo tem formato esférico ou elipsoidal e tem cerca de 1/100.000 do tamanho de um átomo de hidrogênio. Se um átomo fosse do tamanho de um estádio da liga principal de beisebol, o núcleo teria aproximadamente o tamanho do beisebol. Prótons e nêutrons dentro do núcleo são chamados de nucleons.
Condes de Nucleons
O número de prótons no núcleo é dado pelo número atômico,\(Z\). O número de nêutrons no núcleo é o número de nêutrons,\(N\). O número total de nucleons é o número de massa,\(A\). Esses números são relacionados por
\[A = Z + N. \nonumber \]
Um núcleo é representado simbolicamente por
\[_Z^AX, \nonumber \]
onde\(X\) representa o elemento químico,\(A\) é o número de massa e\(Z\) é o número atômico. Por exemplo,\(_6^{12}C\) representa o núcleo de carbono com seis prótons e seis nêutrons (ou 12 nucleons).
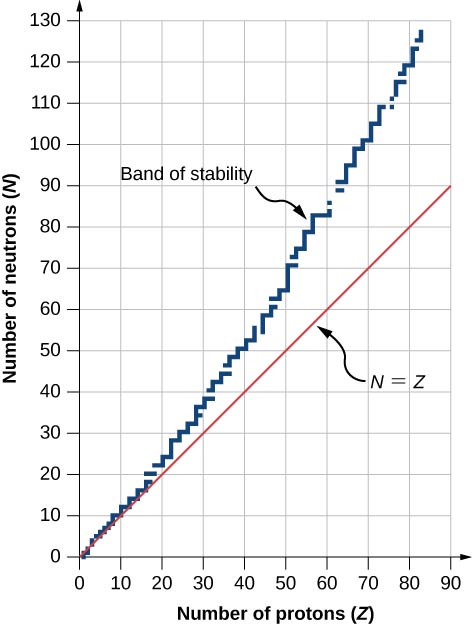
Um gráfico do número N de nêutrons versus o número\(Z\) de prótons para uma variedade de núcleos estáveis (nuclídeos s) é mostrado na Figura\(\PageIndex{2}\). Para um determinado valor de\(Z\), vários valores de\(N\) (pontos azuis) são possíveis. Para valores pequenos de\(Z\), o número de nêutrons é igual ao número de prótons\((N = P)\) e os dados caem na linha vermelha. Para valores grandes de\(Z\), o número de nêutrons é maior que o número de prótons\((N > P)\) e os pontos de dados ficam acima da linha vermelha. O número de nêutrons geralmente é maior do que o número de prótons para\(Z > 15\).
Um gráfico baseado nesse gráfico que fornece informações mais detalhadas sobre cada núcleo é fornecido na Figura\(\PageIndex{3}\). Esse gráfico é chamado de gráfico dos nuclídeos. Cada célula ou bloco representa um núcleo separado. Os núcleos estão dispostos em ordem ascendente de Z (na direção horizontal) e ascendente de N (na direção vertical).
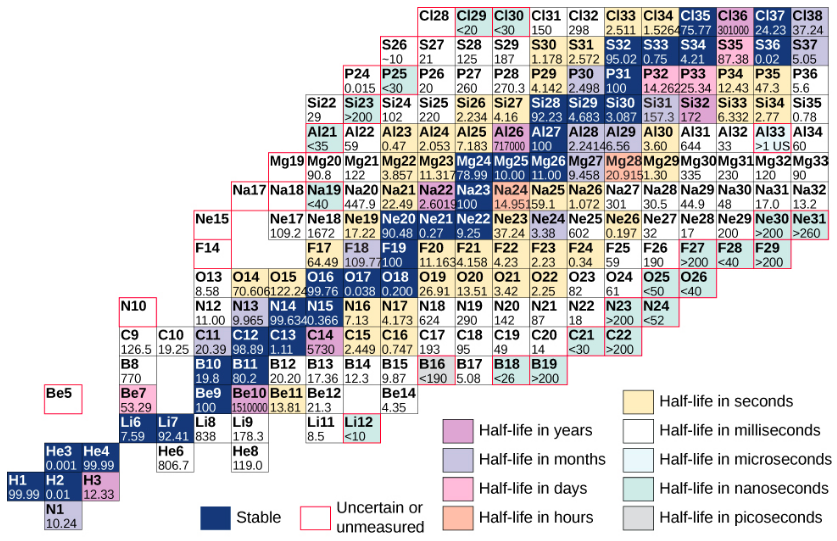 Figura\(\PageIndex{3}\): Gráfico parcial dos nuclídeos. Para núcleos estáveis (fundo azul escuro), os valores das células representam a porcentagem de núcleos encontrados na Terra com o mesmo número atômico (porcentagem de abundância). Para os núcleos instáveis, o número representa a meia-vida.
Figura\(\PageIndex{3}\): Gráfico parcial dos nuclídeos. Para núcleos estáveis (fundo azul escuro), os valores das células representam a porcentagem de núcleos encontrados na Terra com o mesmo número atômico (porcentagem de abundância). Para os núcleos instáveis, o número representa a meia-vida.
Átomos que contêm núcleos com o mesmo número de prótons (Z) e diferentes números de nêutrons (N) são chamados de isótopos. Por exemplo, o hidrogênio tem três isótopos: hidrogênio normal (1 próton, sem nêutrons), deutério (um próton e um nêutron) e trítio (um próton e dois nêutrons). Os isótopos de um determinado átomo compartilham as mesmas propriedades químicas, uma vez que essas propriedades são determinadas pelas interações entre os elétrons externos do átomo, e não os nucleons. Por exemplo, a água que contém deutério em vez de hidrogênio (“água pesada”) parece e tem gosto de água normal. A tabela a seguir mostra uma lista de isótopos comuns.
| Elemento | Símbolo | Número de massa | Massa (unidades de massa atômica) | Abundância percentual* | Meia-vida** |
|---|---|---|---|---|---|
| Hidrogênio | H | 1 | 1.0078 | 99,99 | estável |
| \(^2H\)ou D | 2 | 2.0141 | 0,01 | estável | |
| \(^3H\) | 3 | 3.0160 | - | 12,32 g | |
| Carbono | \(^{12}C\) | 12 | 12.000 | 98,91 | estável |
| \(^{13}C\) | 13 | 13.0034 | 1.1 | estável | |
| \(^{14}C\) | 14 | 14.0032 | - | 5730 g | |
| Azoto | \(^{14}N\) | 14 | 14.0031 | 0,6 | estável |
| \(^{15}N\) | 15 | 15.001 | 0,4 | estável | |
| \(^{16}N\) | 16 | 16.0061 | - | 7,13 s | |
| Oxigênio | \(^{16}O\) | 16 | 15.0040 | 99,76 | estável |
| \(^{17}O\) | 17 | 16.991 | 0,04 | estável | |
| \(^{18}O\) | 18 | 17.992 | 0,20 | estável | |
| \(^{19}O\) | 19 | 19.0035 | - | 26,46 s | |
| *Nenhuma entrada se for menor que 0,001 (valor do traço). **Estável se a meia-vida for > 10 segundos. | |||||
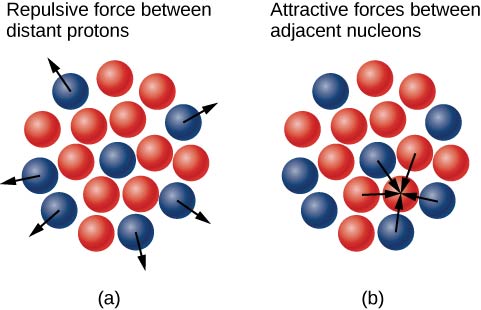
Por que os nêutrons superam os prótons em núcleos mais pesados (Figura\(\PageIndex{3}\))? A resposta a essa pergunta requer uma compreensão das forças dentro do núcleo com duas forças primárias em jogo:
- a força eletrostática de longo alcance (Coulomb) que faz com que os prótons carregados positivamente se repelam mutuamente; e
- a forte força nuclear de curto alcance que faz com que todos os nucleons do núcleo se atraiam.
Você também pode ter ouvido falar de uma força nuclear “fraca”. Essa força é responsável por alguns decaimentos nucleares, mas, como o nome indica, não desempenha um papel na estabilização do núcleo contra a forte repulsão de Coulomb que ele experimenta. Discutiremos a força nuclear forte com mais detalhes no próximo capítulo, quando abordaremos a física de partículas. A estabilidade nuclear ocorre quando as forças atrativas entre os nucleons compensam as forças eletrostáticas repulsivas de longo alcance entre todos os prótons no núcleo. Para núcleos pesados,\((Z > 15)\) o excesso de nêutrons é necessário para evitar que as interações eletrostáticas quebrem o núcleo, conforme mostrado na Figura\(\PageIndex{4}\).
Devido à existência de isótopos estáveis, devemos ter um cuidado especial ao citar a massa de um elemento. Por exemplo, o cobre (Cu) tem dois isótopos estáveis:
\[_{29}^{63} Cu ( 62.929595 \, g/mol) \, with \, an \, abundance \, of \, 69.09\% \nonumber \]
\[_{29}^{65} Cu ( 64.927786 \, g/mol) \, with \, an \, abundance \, of \, 30.91\% \nonumber \]
Dadas essas duas “versões” de Cu, qual é a massa desse elemento? A massa atômica de um elemento é definida como a média ponderada das massas de seus isótopos. Assim, a massa atômica de Cu é
\[m_{Cu} = (62.929595)(0.6909) + (64.927786)(0.3091) = 63.55 \, g/mol. \nonumber \]
A massa de um núcleo individual é frequentemente expressa na unidade de massa atômica s (u), onde\(u = 1.66054 \times 10^{-27} kg\). (Uma unidade de massa atômica é definida como 1/12 da massa de um\(^{12}C\) núcleo.) Em unidades de massa atômica, a massa de um núcleo de hélio (A = 4) é de aproximadamente 4 u. Um núcleo de hélio também é chamado de partícula alfa (α).
Tamanho nuclear
O modelo mais simples do núcleo é uma esfera densamente compactada de nucleons. O volume\(V\) do núcleo é, portanto, proporcional ao número de nucleons\(A\), expresso por
\[V = \dfrac{4}{3} \pi r^3 = kA, \nonumber \]
onde\(r\) é o raio de um núcleo e\(k\) é uma constante com unidades de volume. Resolvendo para\(r\), temos
\[r = r_0 A^{1/3} \label{radius} \]
onde\(r_0\) está uma constante. Para o hidrogênio\((A = 1)\),\(r_0\) corresponde ao raio de um único próton. Experimentos de dispersão apoiam essa relação geral para uma ampla gama de núcleos e implicam que os nêutrons têm aproximadamente o mesmo raio dos prótons. O valor medido experimentalmente para\(r_0\) é de aproximadamente 1,2 femtômetro (lembre-se disso\(1 \, fm = 10^{-15}m\)).
Encontre o raio (r) e a densidade aproximada\((\rho)\) de um núcleo Fe-56. Suponha que a massa do núcleo Fe-56 seja de aproximadamente 56 u.
Estratégia
- Encontrar o raio de\(^{56}Fe\) é uma aplicação direta de\(r = r_0A^{1/3}\), dado\(A = 56\).
- Para encontrar a densidade aproximada desse núcleo, suponha que o núcleo seja esférico. Calcule seu volume usando o raio encontrado na parte (a) e, em seguida, encontre sua densidade de\(\rho = m/V\).
Solução
- O raio de um núcleo é dado pela Equação\ ref {radius}. Substituindo os valores por\(r_0\) e A rendimentos\[\begin{align} r &= (1.2 \, fm)(56)^{1/3} \nonumber \\[4pt] &= (1.2 \, fm)(3.83) \nonumber \\[4pt] &= 4.6 \, fm.\nonumber \end{align} \nonumber \]
- A densidade é definida como sendo\(\rho = m/V\), que para uma esfera de raio r está\[\rho = \dfrac{m}{V} = \dfrac{m}{(4/3)\pi r^3}. \nonumber \] Substituindo valores conhecidos dá a\[\begin{align} \rho &= \dfrac{56 \, u}{(1.33)(3.14)(4.6 \, fm)^3} \nonumber \\[4pt] &= 0.138 \, u/fm^3. \nonumber \end{align} \nonumber \] conversão para unidades de\(kg/m^3\), encontramos\[\begin{align} \rho &= (0.138 \, u/fm^3)(1.66 \times 10^{-27} kg/u)\left(\frac{1 \, fm}{10^{-15}m}\right) \nonumber \\[4pt] &= 2.3 \times 10^{17} \, kg/m^3. \nonumber \end{align} \nonumber \]
Significância
- O raio do núcleo Fe-56 é de aproximadamente 5 fm, então seu diâmetro é de cerca de 10 fm, ou\(10^{-14} m\). Em discussões anteriores sobre os experimentos de dispersão de Rutherford, um núcleo de luz foi estimado\(10^{-15}m\) em diâmetro. Portanto, o resultado mostrado para um núcleo de tamanho médio é razoável.
- A densidade encontrada aqui pode parecer incrível. No entanto, é consistente com comentários anteriores sobre o núcleo contendo quase toda a massa do átomo em uma pequena região do espaço. Um metro cúbico de matéria nuclear tem a mesma massa de um cubo de água de 61 km de cada lado.
O núcleo X é duas vezes maior que o núcleo Y. Qual é a proporção de suas massas atômicas?
- Resposta
-
oito


