9.2: Tipos de ligações moleculares
- Page ID
- 182818
Ao final desta seção, você poderá:
- Faça a distinção entre os diferentes tipos de ligações moleculares
- Determine a energia de dissociação de uma molécula usando os conceitos energia de ionização, afinidade eletrônica e força de Coulomb
- Descreva a ligação covalente em termos de simetria de troca
- Explicar a estrutura física de uma molécula em termos do conceito de hibridização
A mecânica quântica tem sido extraordinariamente bem-sucedida em explicar a estrutura e a ligação nas moléculas e, portanto, é a base de toda a química. A química quântica, como às vezes é chamada, explica questões básicas como por que\(H_2O\) as moléculas existem, por que o ângulo de ligação entre os átomos de hidrogênio nessa molécula é precisamente 104,5° e por que essas moléculas se unem para formar água líquida em temperatura ambiente. Aplicar a mecânica quântica às moléculas pode ser muito difícil matematicamente, então nossa discussão será apenas qualitativa.
Ao estudarmos moléculas e depois sólidos, usaremos muitos modelos científicos diferentes. Em alguns casos, vemos uma molécula ou cristal como um conjunto de núcleos pontuais com elétrons girando pelo lado de fora em trajetórias bem definidas, como no modelo de Bohr. Em outros casos, empregamos nosso conhecimento completo da mecânica quântica para estudar esses sistemas usando funções de onda e o conceito de rotação de elétrons. É importante lembrar que estudamos física moderna com modelos e que modelos diferentes são úteis para diferentes propósitos. Nem sempre usamos o modelo mais poderoso, quando um modelo menos potente e mais fácil de usar fará o trabalho.
Tipos de títulos
As unidades químicas se formam por muitos tipos diferentes de ligações químicas. Uma ligação iônica se forma quando um elétron é transferido de um átomo para outro. Uma ligação covalente ocorre quando dois ou mais átomos compartilham elétrons. Uma ligação de van der Waals ocorre devido à atração de moléculas polarizadas por carga e é consideravelmente mais fraca do que as ligações iônicas ou covalentes. Também existem muitos outros tipos de vínculo. Muitas vezes, a ligação ocorre por meio de mais de um mecanismo. O foco desta seção é a ligação iônica e covalente.
Ligações iônicas
A ligação iônica é talvez o tipo de ligação mais fácil de entender. Isso explica a formação de compostos de sal, como cloreto de sódio\(\ce{NaCl}\). O átomo de sódio (símbolo Na) tem o mesmo arranjo de elétrons que um átomo de néon mais um elétron de 3 s. Apenas 5,14 eV de energia de ionização são necessários para remover esse elétron do átomo de sódio. Portanto, Na pode facilmente ceder ou doar esse elétron para um átomo adjacente (próximo), alcançando um arranjo mais estável de elétrons. O cloro (símbolo Cl) requer apenas um elétron para completar sua camada de valência, então ele aceita prontamente esse elétron se estiver próximo ao átomo de sódio. Portanto, dizemos que o cloro tem uma grande afinidade eletrônica, que é a energia associada a um elétron aceito. A energia liberada pelo átomo de cloro nesse processo é de 3,62 eV. Depois que o elétron é transferido do átomo de sódio para o átomo de cloro, o átomo de sódio se torna um íon positivo e o átomo de cloro se torna um íon negativo.
Essa reação é assim
\[\ce{Na(g) + Cl(g) -> Na^{+}(g) + Cl^{-}(g)} \label{rx1} \]
e a energia total necessária para essa transferência é dada por
\[E_{transfer} = 5.14 \,\text{eV} - 3.62 \,\text{eV} = 1.52 \,\text{eV}. \label{9.1} \]
O íon sódio positivo e o íon cloreto negativo experimentam uma força atraente de Coulomb. A energia potencial associada a essa força é dada por
\[U_{coul} = -\dfrac{ke^2}{r_0}, \nonumber \]
onde\(ke^2 = 1.440\, \text{eV-nm}\) e\(r_0\) é a distância entre os íons.
À medida que os íons sódio e cloreto se movem juntos (“descem a colina de energia potencial”), a força de atração entre os íons se torna mais forte. No entanto, se os íons ficarem muito próximos, as funções de onda elétron-núcleo nos dois íons começarão a se sobrepor. Devido ao princípio de exclusão, essa ação promove os elétrons centrais - e, portanto, toda a molécula - em um estado de energia superior.
\[\ce{ Na^{+}(g) + Cl^{-}(g) -> NaCl(g)} \label{rx2} \]
A distância de separação de equilíbrio (ou comprimento da ligação) entre os íons ocorre quando a molécula está em seu estado de menor energia. Para diatômica\(\ce{NaCl}\), essa distância é de 0,236 nm. A figura\(\PageIndex{1}\) mostra a energia total\(\ce{NaCl}\) de em função da distância de separação entre íons.
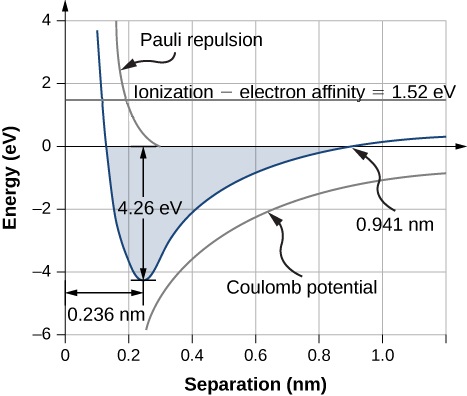
A energia total necessária para formar uma única unidade de sal a partir de\(\ce{Cl}\) átomos\(\ce{Na}\) e neutros é a soma das energias associadas à transferência de elétrons (Equação\ ref {rx1}) e combinação de íons (Equação\ ref {rx2}):
\[U_{form} = E_{transfer} + U_{coul} + U_{ex}, \nonumber \]
onde\(U_{ex}\) está a energia associada à repulsão entre os elétrons centrais devido ao princípio de exclusão de Pauli. O valor de\(U_{form}\) deve ser negativo para que a ligação se forme espontaneamente (caso contrário, é menor em energia a separação de espécies). A energia de dissociação é definida como a energia necessária para separar a unidade em seus íons constituintes, escrita
\[U_{diss} = -U_{form} \nonumber \]
Cada unidade de fórmula diatômica tem sua própria energia de dissociação característica e comprimento de separação de equilíbrio. Os valores da amostra são fornecidos na tabela\(\PageIndex{1}\).
As ligações podem ser quebradas simetricamente ou assimetricamente. A primeira é chamada de homólise e é a base da energia usual de dissociação da ligação (homolítica). Para a unidade de fórmula de sal (\(\ce{NaCl}\)), a reação homolítica associada seria
\[\ce{NaCl(g) -> Na (g) + Cl(g)} \label{homo} \]
A cisão assimétrica de uma ligação é chamada de heterólise (ou seja, energia de dissociação da ligação heterolítica). A reação heterolítica associada para\(\ce{ NaCl}\) seria
\[\ce{NaCl(g) -> Na^{+} (g) + Cl^{-}(g)} \label{hetero} \]
A diferença nas energias de dissociação de ligações homolíticas e heterolíticas é\(E_{transfer}\) dada apenas pela Equação\ ref {9.1}.
| Molécula | Energia de dissociação (eV) | Separação de equilíbrio (nm) (comprimento de ligação) |
|---|---|---|
| NaCl | 4.26 | 0,236 |
| NaF | 4,99 | 0,193 |
| NaBR | 3.8 | 0,250 |
| Ani | 3.1 | 0,271 |
| Não | 2,08 | 0,189 |
| LiCl | 4,86 | 0,202 |
| LiH | 2,47 | 0,239 |
| LiI | 3,67 | 0,238 |
| KCl | 4,43 | 0,267 |
| KBr | 3,97 | 0,282 |
| RbF | 5.12 | 0,227 |
| RBCl | 4,64 | 0,279 |
| CSi | 3,57 | 0,337 |
| H-H | 4.5 | 0,075 |
| N-N | 9.8 | 0,11 |
| O-O | 5.2 | 0,12 |
| F-F | 1.6 | 0,14 |
| Cl-Cl | 2,5 | 0,20 |
Qual é a energia de dissociação de uma unidade de fórmula de sal (NaCl)?
Estratégia
O cloreto de sódio (\(\ce{NaCl}\)) é um sal formado por ligações iônicas. A mudança de energia associada a essa ligação depende de três processos principais:
- a ionização de Na e a aceitação do elétron de um átomo de Na por um átomo de Cl; e
- Atração de Coulomb dos íons resultantes (\(\ce{Na^{+}}\)e\(\ce{Cl^{-}}\)).
- Se os íons se aproximarem demais, eles se repelem devido ao princípio de exclusão (0,32 eV).
A distância de separação de equilíbrio é\(r_0 = 0.236 \text{nm}\).
Solução
A mudança de energia associada à transferência de um elétron de Na para Cl é 1,52 eV (Equação\ ref {9.1}). Na separação de equilíbrio, os átomos estão\(r_0 = 0.236 \text{nm}\) separados. A energia potencial eletrostática dos átomos é
\[\begin{align*} U_{could} &= -\dfrac{ke^2}{r_0} \\[5pt] &= - \dfrac{1.44 \, \text{eV} \cdot nm}{0.236 \,nm} \\[5pt] &= - 6.10 \, \text{eV} . \end{align*} \nonumber \]
A diferença total de energia associada à formação de uma unidade de fórmula de NaCl é
\[\begin{align*}E_{form} &= E_{transfer} + U_{coul} + U_{ex} \\[5pt] &= 1.52 \, \text{eV} + (−6.10 eV) + 0.32\, \text{eV} \\[5pt] &= -4.26 eV \end{align*} \nonumber \]
Portanto, a energia de dissociação homolítica de\(\ce{NaCl}\) é 4,26 eV.
Significância
A formação de uma unidade de fórmula de NaCl por ligação iônica é energeticamente favorável. A energia de dissociação, ou energia necessária para separar a unidade de NaCl em\(Na\)\(Cl\) átomos, é de 4,26 eV, consistente com a Figura\(\PageIndex{1}\).
Por que a energia potencial associada ao princípio de exclusão é positiva no Exemplo\(\PageIndex{1}\)?
- Responda
-
Corresponde a uma força repulsiva entre os elétrons centrais nos íons.
A que\(\ce{Na}\)\(\ce{Cl}\) distância é energeticamente favorável que essa reação ocorra?
\[\ce{Na(g) + Cl(g) -> Na^{+}(g) + Cl^{-}(g)} \nonumber \]
- Responda
-
Isso acontece quando a energia potencial elétrica (\(U_{coul}\)) e a energia de repulsão de Pauli (\(U_{ex}\)) equacionam a energia para a transferência de elétrons (\(E_{transfer}\)), que é de 0,941 nm, conforme a Figura\(\PageIndex{1}\). Observe isso\(U_{ex} \approx 0\) a essa distância.
Para um íon sódio em um cristal de NaCl iônico, a expressão da energia potencial de Coulomb\(U_{could}\) deve ser modificada por um fator conhecido como constante de Madelung. Esse fator leva em consideração a interação do íon sódio com todos os íons cloreto e sódio próximos. A constante de Madelung para um cristal de NaCl é de cerca de 1,75. Esse valor implica uma distância de separação de equilíbrio entre\(Cl^-\) íons\(Na^+\) e de 0,280 nm — um pouco maior do que para o NaCl diatômico. Voltaremos a esse ponto novamente mais tarde.
Ligações covalentes
Em uma ligação iônica, um elétron é transferido de um átomo para outro. No entanto, em uma ligação covalente, um elétron é compartilhado entre dois átomos. O mecanismo de ligação iônica não pode explicar a existência de moléculas como\(H_2\),, e CO\(O_2\), uma vez que não existe uma distância de separação para a qual a energia potencial negativa de atração seja maior em magnitude do que a energia necessária para criar íons. Entender com precisão como essas moléculas estão ligadas covalentemente depende de uma compreensão mais profunda da mecânica quântica que vai além da cobertura deste livro, mas descreveremos qualitativamente os mecanismos na seção a seguir.
As ligações covalentes podem ser entendidas usando o exemplo simples de\(\ce{H_2^{+}}\) molécula, que consiste em um elétron no campo elétrico de dois prótons. Esse sistema pode ser modelado por um elétron em um poço quadrado duplo (Figura\(\PageIndex{2}\)). É igualmente provável que o elétron seja encontrado em cada poço, então a função de onda é simétrica ou antisimétrica em torno de um ponto a meio caminho entre os poços.
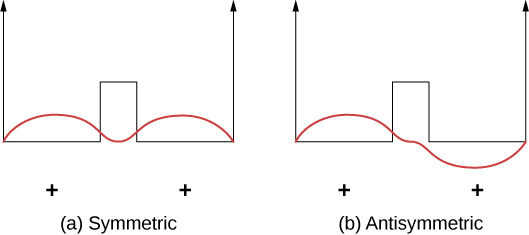
Agora imagine que os dois poços estão separados por uma grande distância. No estado fundamental, a função de onda existe em um dos dois estados possíveis: um único pico positivo (uma “protuberância” em forma de onda senoidal) em ambos os poços (caso simétrico) ou um pico positivo em um poço e um pico negativo no outro (caso antisimétrico). Esses estados têm a mesma energia. No entanto, quando os poços são reunidos, a função de onda simétrica se torna o estado fundamental e o estado antisimétrico se torna o primeiro estado excitado — em outras palavras, o nível de energia do elétron é dividido. Observe que o estado simétrico espacial se torna o estado energeticamente favorável (menor energia).
A mesma análise é apropriada para um elétron ligado a dois átomos de hidrogênio. Aqui, as formas das funções de onda do estado fundamental têm a forma\(e^{-r/a_0}\) ou\(e^{(-|x|/a_0)}\) em uma dimensão. O estado energeticamente favorável e simétrico espacial implica uma alta densidade de carga a meio caminho entre os prótons, onde os elétrons provavelmente juntarão os prótons carregados positivamente.
Se um segundo elétron for adicionado a esse sistema para formar uma\(H_2\) molécula, a função de onda deve descrever ambas as partículas, incluindo sua relação espacial e spins relativos. Essa função de onda também deve respeitar a indistinguibilidade dos elétrons. (“Se você viu um elétron, já viu todos.”) Em particular, trocar ou trocar os elétrons não deve produzir um efeito observável, uma propriedade chamada simetria de troca. A simetria de troca pode ser simétrica, não produzindo nenhuma alteração na função de onda, ou antisimétrica, produzindo uma mudança geral no sinal da função de onda — nenhuma das quais é observável.
Como discutiremos mais adiante, a função de onda total de dois elétrons deve ser antisimétrica na troca. Por exemplo, dois elétrons ligados a uma molécula de hidrogênio podem estar em um estado simétrico espacial com spins antiparalelos (↑ ↓) ou em um estado antisimétrico espacial com spins paralelos (↑). O estado com giros antiparalelos é energeticamente favorável e, portanto, usado na ligação covalente. No entanto, se os prótons estiverem muito próximos, a repulsão entre os prótons se torna importante. (Em outras moléculas, esse efeito é fornecido pelo princípio de exclusão.) Como resultado,\(H_2\) atinge uma separação de equilíbrio de cerca de 0,074 nm com uma energia de ligação de 4,52 eV.
Visite este tutorial e simulação interativa da PBS Learning Media para explorar as forças atrativas e repulsivas que atuam nas partículas atômicas e na ligação covalente em uma\(H_2\) molécula.
A mecânica quântica exclui muitos tipos de moléculas. Por exemplo, a molécula\(H_3\) não se forma, porque se um terceiro átomo H se aproxima do hidrogênio diatômico, a função de onda do elétron nesse átomo se sobrepõe aos elétrons nos outros dois átomos. Se todos os três elétrons estiverem nos estados fundamentais de seus respectivos átomos, um par de elétrons compartilha todos os mesmos números quânticos, o que é proibido pelo princípio de exclusão. Em vez disso, um dos elétrons é forçado a um estado de maior energia. Não existe separação entre três prótons para os quais a mudança total de energia desse processo seja negativa, ou seja, onde a ligação ocorre espontaneamente. Da mesma forma, não\(He_2\) está ligado covalentemente em condições normais, porque esses átomos não têm elétrons de valência para compartilhar. À medida que os átomos são reunidos, as funções de onda dos elétrons centrais se sobrepõem e, devido ao princípio de exclusão, os elétrons são forçados a um estado de energia superior. Não existe separação para a qual tal molécula seja energeticamente favorável.
Ligação em moléculas poliatômicas
Uma molécula poliatômica é uma molécula feita de mais de dois átomos. Os exemplos variam de uma simples molécula de água a uma molécula de proteína complexa. As estruturas dessas moléculas geralmente podem ser entendidas em termos de ligação covalente e hibridização. A hibridização é uma mudança na estrutura de energia de um átomo na qual estados mistos (estados que podem ser escritos como uma superposição linear de outros) participam da ligação.
Para ilustrar a hibridização, considere a ligação em uma molécula de água simples,\(H_2O\). A configuração eletrônica do oxigênio é\(1s^22s^22p^4\). Os elétrons de 1 s e 2 s estão em “camadas fechadas” e não participam da ligação. Os quatro elétrons restantes são os elétrons de valência. Esses elétrons podem preencher seis estados possíveis (\(l = 1, m = 0, \pm 1\)além de girar para cima e para baixo). As energias desses estados são as mesmas, então o átomo de oxigênio pode explorar qualquer combinação linear desses estados em ligação com os átomos de hidrogênio. Essas combinações lineares (sobre as quais você aprendeu no capítulo sobre estrutura atômica) são chamadas de orbitais atômicos e são denotadas por\(p_x\)\(p_y\),\(p_z\) e. As distribuições de carga eletrônica para esses orbitais são dadas na Figura\(\PageIndex{3}\).
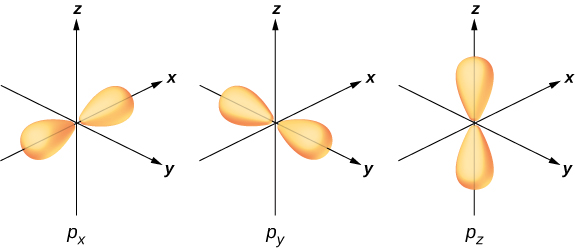
A transformação das funções de onda eletrônica de oxigênio em orbitais e\(p_z\) orbitais na presença dos átomos de hidrogênio é um exemplo de hibridização.\(p_x, p_y\) Dois elétrons são encontrados no\(p_z\) orbital com spins emparelhados (↑ ↓). Um elétron é encontrado em cada um dos\(p_y\) orbitais\(p_x\) e, com spins não pareados. Os últimos orbitais participam da ligação com os átomos de hidrogênio. Com base na Figura\(\PageIndex{3}\), esperamos que o ângulo de aderência para H—O—H seja de 90°. No entanto, se incluirmos os efeitos da repulsão entre átomos, o ângulo de ligação é 104,5°. Os mesmos argumentos podem ser usados para entender a forma tetraédrica do metano (\(CH_4\)) e de outras moléculas.


