29.3: Energias de fótons e o espectro eletromagnético
- Page ID
- 194450
Objetivos de
Ao final desta seção, você poderá:
- Explique a relação entre a energia de um fóton em joules ou elétron-volts e seu comprimento de onda ou frequência.
- Calcule o número de fótons por segundo emitidos por uma fonte monocromática de comprimento de onda e potência específicos.
Radiação ionizante
Um fóton é um quantum da radiação EM. Sua energia é dada por\(E = hf\) e está relacionada à frequência\(f\) e comprimento\(\lambda\) de onda da radiação por
\[\begin{align*} E &= hf \\[4pt] &= \dfrac{hc}{\lambda} \quad \text{(energy of a photon)} \end{align*}\]
onde\(E\) está a energia de um único fóton e\(c\) é a velocidade da luz. Ao trabalhar com sistemas pequenos, a energia em eV geralmente é útil. Observe que a constante de Planck nessas unidades é
\[h = 4.14 \times 10^{-15} \, eV \cdot s.\]
Como muitos comprimentos de onda são declarados em nanômetros (nm), também é útil saber que
\[hc = 1240 \, eV \cdot nm.\]
Isso tornará muitos cálculos um pouco mais fáceis.
Toda radiação EM é composta por fótons. \(\PageIndex{1}\)A figura mostra várias divisões do espectro EM representadas graficamente em relação ao comprimento de onda, frequência e energia do fóton. Anteriormente neste livro, as características dos fótons foram mencionadas na discussão de algumas das características dos raios UV, x e\(\gamma\) raios, a primeira das quais começa com frequências logo acima do violeta no espectro visível. Observou-se que esses tipos de radiação EM têm características muito diferentes da luz visível. Agora podemos ver que essas propriedades surgem porque a energia do fóton é maior em altas frequências.
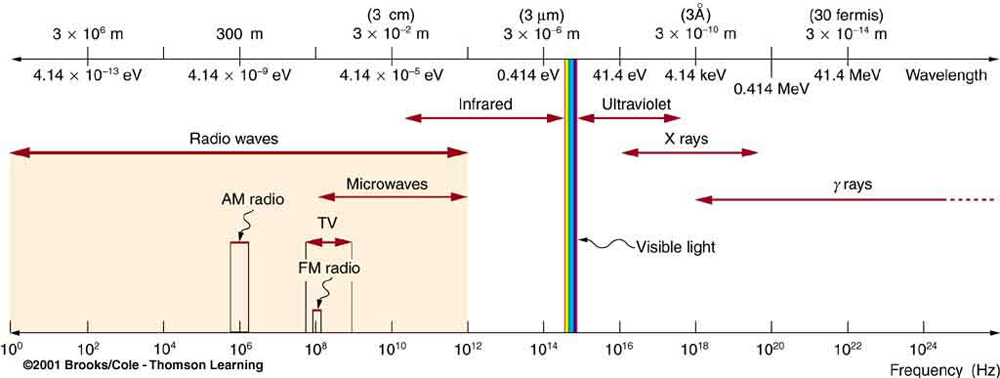
Os fótons agem como quanta individuais e interagem com elétrons, átomos, moléculas individuais e assim por diante. A energia que um fóton carrega é, portanto, crucial para os efeitos que ele tem. A tabela\(\PageIndex{1}\) lista as energias submicroscópicas representativas em eV. Quando comparamos as energias dos fótons do espectro EM na Figura\(\PageIndex{1}\) com as energias na tabela, podemos ver como os efeitos variam com o tipo de radiação EM.
| Energias rotacionais das moléculas | \(10^{-5} \, eV\) |
| Energias vibracionais das moléculas | 0,1 eV |
| Energia entre camadas externas de elétrons em átomos | 1 eV |
| Energia de ligação de uma molécula fracamente ligada | 1 eV |
| Energia da luz vermelha | 2 eV |
| Energia de ligação de uma molécula fortemente ligada | 10 eV |
| Energia para ionizar o átomo ou a molécula | 10 a 1000 eV |
Os raios gama, uma forma de radiação EM nuclear e cósmica, podem ter as frequências mais altas e, portanto, as maiores energias de fótons no espectro EM. Por exemplo, um fóton de\(\gamma\) raios X com\(f = 10^{21} \, Hz\) tem uma energia\(E = hf = 6.63 \times 10^{-13} \, J = 4.14 \, MeV\). Essa energia é suficiente para ionizar milhares de átomos e moléculas, já que são necessários apenas 10 a 1000 eV por ionização. Na verdade,\(\gamma\) os raios X são um tipo de radiação ionizante, assim como os raios X e os UV, porque produzem ionização nos materiais que os absorvem. Como muita ionização pode ser produzida, um único fóton\(\gamma\) de raio X pode causar danos significativos ao tecido biológico, matando as células ou prejudicando sua capacidade de se reproduzir adequadamente. Quando a reprodução celular é interrompida, o resultado pode ser câncer, um dos efeitos conhecidos da exposição à radiação ionizante. Como as células cancerosas estão se reproduzindo rapidamente, elas são excepcionalmente sensíveis à ruptura produzida pela radiação ionizante. Isso significa que a radiação ionizante tem usos positivos no tratamento do câncer, bem como riscos na produção de câncer.
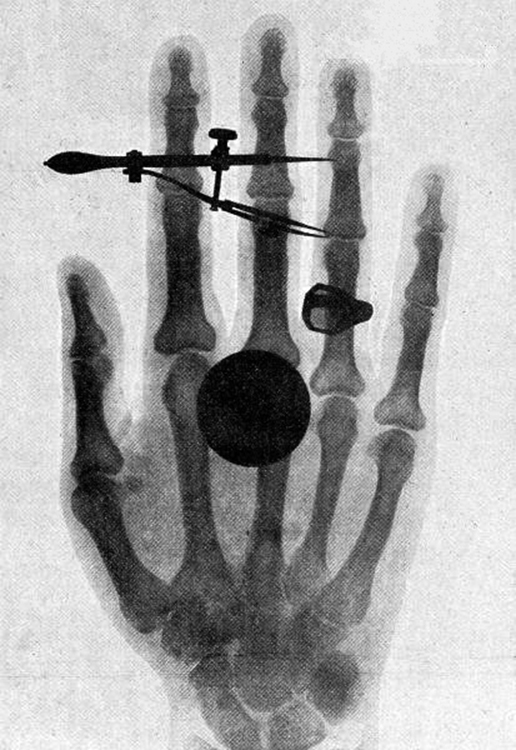
A alta energia de fótons também permite que\(\gamma\) os raios penetrem nos materiais, pois é improvável que uma colisão com um único átomo ou molécula absorva toda a energia do\(\gamma\) raio. Isso pode tornar\(\gamma\) os raios úteis como sonda e, às vezes, são usados em imagens médicas. os raios x, como você pode ver na Figura\(\PageIndex{1}\), se sobrepõem à extremidade de baixa frequência da faixa de\(\gamma\) raios. Como os raios x têm energias de keV ou mais, fótons individuais de raios-X também podem produzir grandes quantidades de ionização. Em energias de fótons mais baixas, os raios x não são tão penetrantes quanto\(\gamma\) os raios e são um pouco menos perigosos. Os raios X são ideais para imagens médicas, seu uso mais comum e um fato que foi reconhecido imediatamente após sua descoberta em 1895 pelo físico alemão W. C. Roentgen (1845-1923). (Veja a Figura\(\PageIndex{2}\).) Dentro de um ano após sua descoberta, os raios X (por uma época chamada de raios Roentgen) foram usados para diagnósticos médicos. Roentgen recebeu o Prêmio Nobel de 1901 pela descoberta dos raios X.
CONEXÕES: CONSERVAÇÃO DE ENERGIA
Mais uma vez, descobrimos que a conservação de energia nos permite considerar as formas inicial e final que a energia assume, sem precisar fazer cálculos detalhados das etapas intermediárias. \(\PageIndex{1}\)O exemplo é resolvido considerando apenas as formas inicial e final de energia.
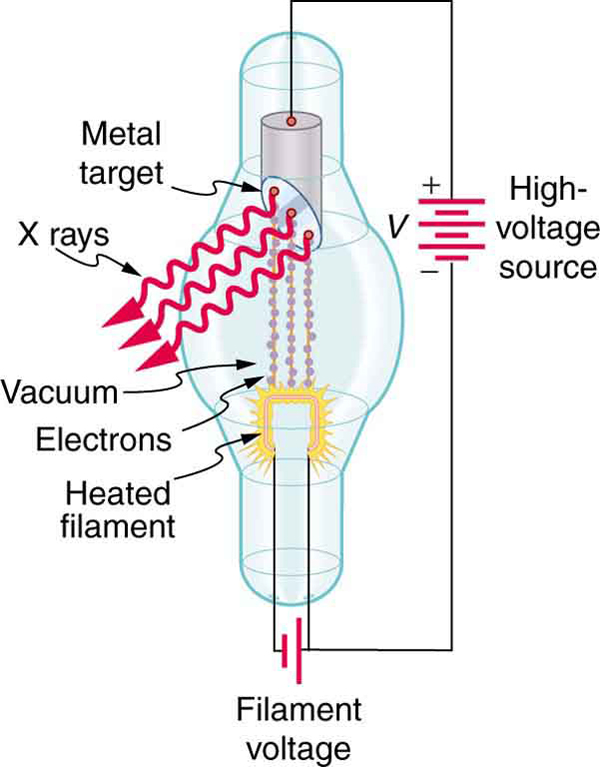
Enquanto\(\gamma\) os raios se originam no decaimento nuclear, os raios x são produzidos pelo processo mostrado na Figura\(\PageIndex{3}\). Os elétrons ejetados por agitação térmica de um filamento quente em um tubo de vácuo são acelerados por meio de uma alta tensão, ganhando energia cinética da energia potencial elétrica. Quando atingem o ânodo, os elétrons convertem sua energia cinética em uma variedade de formas, incluindo energia térmica. Mas como uma carga acelerada irradia ondas EM e, como os elétrons agem individualmente, os fótons também são produzidos. Alguns desses fótons de raio-x obtêm a energia cinética do elétron. Os elétrons acelerados se originam no cátodo, então esse tubo é chamado de tubo de raios catódicos (CRT), e várias versões deles são encontradas em telas antigas de TV e computador, bem como em máquinas de raio-x.
Exemplo\(\PageIndex{1}\): X-ray Photon Energy and X-ray Tube Voltage
Encontre a energia máxima em eV de um fóton de raio-x produzido por elétrons acelerados por meio de uma diferença de potencial de 50,0 kV em um CRT como o da Figura\(\PageIndex{3}\).
Estratégia
Os elétrons podem fornecer toda a sua energia cinética a um único fóton quando atingem o ânodo de um CRT. (Isso é algo como o efeito fotoelétrico ao contrário.) A energia cinética do elétron vem da energia potencial elétrica. Assim, podemos simplesmente igualar a energia máxima do fóton à energia potencial elétrica, ou seja,\(hf = qV\). (Não precisamos calcular cada etapa do começo ao fim se soubermos que toda a energia inicial\(qV\) é convertida na forma final\(hf.\))
Solução
A energia máxima do fóton é\(hf = qV\), onde\(q\) está a carga do elétron e\(V\) é a tensão de aceleração. Assim,
\[hf = (1.60 \times 10^{-19} \, C)(50.0 \times 10^3 \, V). \nonumber\]
A partir da definição do elétron volt\(1 \, eV = 1.60 \times 10^{-19} \, J\), sabemos onde\(1 \, J = 1 \, C \cdot V\). Coletando fatores e convertendo energia em rendimentos de eV
\[hf = (50.0 \times 10^3)(1.60 \times 10^{-19} \, C \cdot V)\left(\dfrac{1 \, eV}{1.60 \times 10^{-19} \, C \cdot V} \right) \nonumber\]
Discussão
Esse exemplo produz um resultado que pode ser aplicado a muitas situações semelhantes. Se você acelerar uma única carga elementar, como a de um elétron, por meio de um potencial dado em volts, sua energia em eV terá o mesmo valor numérico. Assim, um potencial de 50,0 kV gera elétrons de 50,0 keV, que por sua vez podem produzir fótons com uma energia máxima de 50 keV. Da mesma forma, um potencial de 100 kV em um tubo de raios X pode gerar fótons de raio-x de até 100 keV. Muitos tubos de raios X têm voltagens ajustáveis para que vários raios X de energia com energias diferentes e, portanto, diferentes habilidades de penetração possam ser gerados.
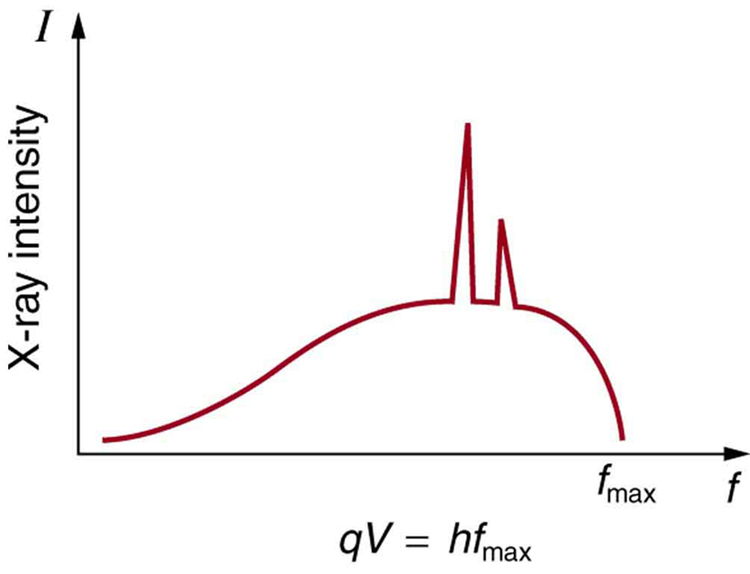
A figura\(\PageIndex{4}\) mostra o espectro dos raios X obtidos de um tubo de raios-X. Há duas características distintas no espectro. Primeiro, a distribuição suave resulta da desaceleração dos elétrons no material do ânodo. Uma curva como essa é obtida pela detecção de muitos fótons, e é evidente que a energia máxima é improvável. Esse processo de desaceleração produz radiação chamada de bremsstrahlung (alemão para radiação de frenagem). A segunda característica é a existência de picos nítidos no espectro; esses são chamados de raios x característicos, pois são característicos do material anódico. Os raios X característicos vêm de excitações atômicas exclusivas de um determinado tipo de material anódico. Eles são semelhantes às linhas nos espectros atômicos, o que implica que os níveis de energia dos átomos são quantizados. Fenômenos como espectros atômicos discretos e raios x característicos são explorados mais detalhadamente na Física Atômica.
A radiação ultravioleta (aproximadamente 4 eV a 300 eV) se sobrepõe à extremidade inferior da faixa de energia dos raios X, mas os raios UV normalmente têm menos energia. O UV vem da desexcitação de átomos que podem fazer parte de um sólido ou gás quente. Esses átomos podem receber energia que posteriormente liberam como UV por vários processos, incluindo descarga elétrica, explosão nuclear, agitação térmica e exposição aos raios X. Um fóton UV tem energia suficiente para ionizar átomos e moléculas, o que torna seus efeitos diferentes dos da luz visível. O UV, portanto, tem alguns dos mesmos efeitos biológicos dos raios e dos raios X. Por exemplo, pode causar câncer de pele e é usado como esterilizador. A principal diferença é que vários fótons UV são necessários para interromper a reprodução celular ou matar uma bactéria, enquanto fótons de\(\gamma\) raio X e raio-X simples podem causar o mesmo dano. Mas como o UV tem energia para alterar as moléculas, ele pode fazer o que a luz visível não pode. Um dos aspectos benéficos do UV é que ele desencadeia a produção de vitamina D na pele, enquanto a luz visível tem energia insuficiente por fóton para alterar as moléculas que desencadeiam essa produção. A icterícia infantil é tratada expondo o bebê aos raios UV (com proteção ocular), chamada fototerapia, cujos efeitos benéficos estão relacionados à sua capacidade de ajudar a prevenir o acúmulo de bilirrubina potencialmente tóxica no sangue.
Exemplo\(\PageIndex{2}\): Photon Energy and Effects for UV
O UV de comprimento de onda curto às vezes é chamado de UV de vácuo, porque é fortemente absorvido pelo ar e deve ser estudado no vácuo. Calcule a energia do fóton em eV para UV de vácuo de 100 nm e estime o número de moléculas que ele poderia ionizar ou se separar.
Estratégia
Usando a equação\(E = hf\)
e constantes apropriadas, podemos encontrar a energia do fóton e compará-la com as informações de energia na Tabela.
Solução
A energia de um fóton é dada por
\[E = hf = \dfrac{hc}{\lambda}. \nonumber\]
Usando\(hc = 1240 \, eV \cdot nm\), descobrimos que
\[E = \dfrac{hc}{\lambda} = \dfrac{1240 \, eV \cdot nm}{100 \, nm} = 12.4 \, eV. \nonumber\]
Discussão
De acordo com a Tabela\(\PageIndex{1}\), essa energia de fótons pode ser capaz de ionizar um átomo ou molécula, e é mais ou menos o que é necessário para quebrar uma molécula fortemente ligada, uma vez que ela está ligada por aproximadamente 10 eV. Essa energia do fóton poderia destruir cerca de uma dúzia de moléculas fracamente ligadas. Devido à sua alta energia de fótons, o UV interrompe os átomos e as moléculas com as quais ele interage. Uma boa consequência é que todos, exceto os raios UV de maior comprimento de onda, são fortemente absorvidos e são facilmente bloqueados por óculos de sol. Na verdade, a maior parte dos raios UV do Sol é absorvida por uma fina camada de ozônio na alta atmosfera, protegendo organismos sensíveis na Terra. Os danos à nossa camada de ozônio pela adição de produtos químicos como os CFCs reduziram essa proteção para nós.
Luz visível
A faixa de energias de fótons para a luz visível do vermelho ao violeta é de 1,63 a 3,26 eV, respectivamente (à esquerda para verificar os Problemas e Exercícios deste capítulo). Essas energias estão na ordem daquelas entre camadas externas de elétrons em átomos e moléculas. Isso significa que esses fótons podem ser absorvidos por átomos e moléculas. Um único fóton pode realmente estimular a retina, por exemplo, alterando uma molécula receptora que então aciona um impulso nervoso. Os fótons podem ser absorvidos ou emitidos somente por átomos e moléculas que tenham exatamente a etapa de energia quantizada correta para fazer isso. Por exemplo, se um fóton vermelho de frequência\(f\) encontrar uma molécula que tem um passo de energia igual a\(\Delta E\)\(hf\), então o fóton pode ser absorvido. As flores violetas absorvem o vermelho e refletem o violeta; isso implica que não há um passo de energia entre os níveis na molécula receptora igual à energia do fóton violeta, mas há uma etapa de energia para o vermelho.
Existem algumas diferenças perceptíveis nas características da luz entre as duas extremidades do espectro visível que são devidas às energias dos fótons. A luz vermelha tem energia fotônica insuficiente para expor a maioria dos filmes em preto e branco e, portanto, é usada para iluminar câmaras escuras onde esse filme é desenvolvido. Como a luz violeta tem uma maior energia de fótons, os corantes que absorvem o violeta tendem a desaparecer mais rapidamente do que aqueles que não absorvem. (Veja a Figura\(\PageIndex{5}\).) Dê uma olhada em alguns pôsteres coloridos desbotados em uma vitrine em algum momento e você notará que os azuis e violetas são os últimos a desaparecer. Isso ocorre porque outros corantes, como os vermelhos e verdes, absorvem fótons azuis e violetas, cujas energias mais altas quebram suas moléculas fracamente ligadas. (Moléculas complexas, como as dos corantes e do DNA, tendem a estar fracamente ligadas.) Os corantes azul e violeta refletem essas cores e, portanto, não absorvem esses fótons mais energéticos, sofrendo menos danos moleculares.

Materiais transparentes, como alguns vidros, não absorvem nenhuma luz visível, porque não há nenhuma etapa de energia nos átomos ou moléculas que possa absorver a luz. Como fótons individuais interagem com átomos individuais, é quase impossível ter dois fótons absorvidos simultaneamente para atingir uma grande etapa de energia. Por causa de sua menor energia de fótons, a luz visível às vezes pode passar por muitos quilômetros de uma substância, enquanto frequências mais altas, como UV, raios X e\(\gamma\) raios, são absorvidas porque têm energia fóton suficiente para ionizar o material.
Exemplo\(\PageIndex{3}\): How Many Photons per Second Does a Typical Light Bulb Produce?
Supondo que 10,0% da produção de energia de uma lâmpada de 100 W esteja na faixa visível (típica para lâmpadas incandescentes) com um comprimento de onda médio de 580 nm, calcule o número de fótons visíveis emitidos por segundo.
Estratégia
Potência é energia por unidade de tempo e, portanto, se pudermos encontrar a energia por fóton, podemos determinar o número de fótons por segundo. Isso será melhor feito em joules, já que a potência é dada em watts, que são joules por segundo.
Solução
A potência na produção de luz visível é 10,0% de 100 W, ou 10,0 J/s. A energia do fóton visível médio é encontrada substituindo o comprimento de onda médio fornecido pela fórmula
\[E = \dfrac{hc}{\lambda}. \nonumber\]
Isso produz
\[E = \dfrac{(6.63 \times 10^{-34} \, J \cdot s)(3.00 \times 10^8 \, m/s}{580 \times 10^{-9}} = 3.43 \times 10^{-19} \, J. \nonumber\]
O número de fótons visíveis por segundo é, portanto,
\[photon/s = \dfrac{10.0 \, J/s}{3.43 \times 10^{-19} \, J/photon} = 2.92 \times 10^{19} \, photon/s \nonumber\]
Discussão
Esse número incrível de fótons por segundo é a verificação de que fótons individuais são insignificantes na experiência humana comum. É também uma verificação do princípio da correspondência — na escala macroscópica, a quantização se torna essencialmente contínua ou clássica. Finalmente, há tantos fótons emitidos por uma lâmpada de 100 W que ela pode ser vista a olho nu a muitos quilômetros de distância.
Fótons de baixa energia
A radiação infravermelha (IR) tem energias de fótons ainda mais baixas do que a luz visível e não pode alterar significativamente átomos e moléculas. O IR pode ser absorvido e emitido por átomos e moléculas, particularmente entre estados bem espaçados. O IR é extremamente fortemente absorvido pela água, por exemplo, porque as moléculas de água têm muitos estados separados por energias na ordem de\(10^{-5} \, eV\) até\(10^{-2} \, eV\) bem dentro das faixas de energia de IR e microondas. É por isso que na faixa de infravermelho, a pele é quase preta como azeviche, com uma emissividade próxima de 1 — há muitos estados nas moléculas de água na pele que podem absorver uma grande variedade de energias de fótons de infravermelho. Nem todas as moléculas têm essa propriedade. O ar, por exemplo, é quase transparente para muitas frequências de infravermelho.
As microondas são as frequências mais altas que podem ser produzidas por circuitos eletrônicos, embora também sejam produzidas naturalmente. Assim, as microondas são semelhantes às infravermelhas, mas não se estendem a frequências tão altas. Existem estados na água e em outras moléculas que têm a mesma frequência e energia que as microondas, normalmente cerca de\(10^{-5} \, eV\). Essa é uma das razões pelas quais os alimentos absorvem as microondas com mais força do que muitos outros materiais, tornando os fornos de microondas uma maneira eficiente de colocar energia diretamente nos alimentos.
As energias de fótons para infravermelho e microondas são tão baixas que um grande número de fótons está envolvido em qualquer transferência significativa de energia por infravermelho ou microondas (como se aquecer com uma lâmpada de calor ou cozinhar pizza no microondas). Luz visível, infravermelho, microondas e todas as frequências mais baixas não podem produzir ionização com fótons únicos e normalmente não apresentam os riscos de frequências mais altas. Quando a radiação visível, infravermelha ou de microondas é perigosa, como a indução de catarata por microondas, o risco se deve ao grande número de fótons agindo juntos (não ao acúmulo de fótons, como a esterilização por UV fraco). Os efeitos negativos da radiação visível, infravermelha ou de microondas podem ser efeitos térmicos, que podem ser produzidos por qualquer fonte de calor. Mas uma diferença é que, em uma intensidade muito alta, campos elétricos e magnéticos fortes podem ser produzidos por fótons agindo juntos. Esses campos eletromagnéticos (EMF) podem realmente ionizar materiais.
ALERTA DE EQUÍVOCO: LINHAS DE ALTA TENSÃO
- Embora algumas pessoas pensem que morar perto de linhas de alta tensão é perigoso para a saúde, estudos contínuos sobre os efeitos de campo transitórios produzidos por essas linhas mostram que seus pontos fortes são insuficientes para causar danos. Os estudos demográficos também não mostram uma correlação significativa de efeitos nocivos com linhas de alta tensão. A American Physical Society publicou um relatório há mais de 10 anos sobre campos de linhas elétricas, que concluiu que a literatura científica e as revisões de painéis não mostram nenhuma ligação consistente e significativa entre os campos de câncer e linhas de energia. Eles também sentiram que o “desvio de recursos para eliminar uma ameaça que não tem base científica persuasiva é perturbador”.
É virtualmente impossível detectar fótons individuais com frequências abaixo das frequências de microondas, devido à sua baixa energia de fótons. Mas os fótons estão lá. Uma onda EM contínua pode ser modelada como fótons. Em baixas frequências, as ondas EM são geralmente tratadas como campos elétricos e magnéticos que variam no tempo e na posição, sem quantização perceptível. Esse é outro exemplo do princípio da correspondência em situações que envolvem um grande número de fótons.
EXPLORAÇÕES DE PHET: VISÃO COLORIDA
Faça um arco-íris inteiro misturando luz vermelha, verde e azul. Altere o comprimento de onda de um feixe monocromático ou filtre a luz branca. Veja a luz como um feixe sólido ou veja os fótons individuais.

Resumo
- A energia do fóton é responsável por muitas características da radiação EM, sendo particularmente perceptível em altas frequências.
- Os fótons têm características de ondas e partículas.
Glossário
- raio gama
- também\(\gamma\) raio X; fóton de maior energia no espectro EM
- radiação ionizante
- radiação que ioniza materiais que a absorvem
- raio-x
- Fóton EM entre\(\gamma\) raios X e UV em energia
- bremsstrahlung
- Alemão para frear a radiação; produzido quando os elétrons são desacelerados
- raios x característicos
- raios x cuja energia depende do material em que foram produzidos
- radiação ultravioleta
- UV; fótons ionizantes ligeiramente mais energéticos que a luz violeta
- luz visível
- a gama de energias de fótons que o olho humano pode detectar
- radiação infravermelha
- fótons com energias ligeiramente menores que a luz vermelha
- microondas
- fótons com comprimentos de onda da ordem de um mícron\((\mu m)0\))


