15.E: Métodos de transferência de calor e calor (exercício)
- Page ID
- 195079
Perguntas conceituais
15.1: A Primeira Lei da Termodinâmica
1. Descreva a foto da chaleira no início desta seção em termos de transferência de calor, trabalho realizado e energia interna. Como o calor está sendo transferido? Qual é o trabalho realizado e o que o está fazendo? Como a chaleira mantém sua energia interna?
2. A primeira lei da termodinâmica e a conservação de energia, conforme discutido em Conservação de Energia, estão claramente relacionadas. Como eles diferem nos tipos de energia considerados?
3. A transferência de calor\(\displaystyle Q\) e o trabalho realizado\(\displaystyle W\) são sempre energia em trânsito, enquanto a energia interna\(\displaystyle U\) é a energia armazenada em um sistema. Dê um exemplo de cada tipo de energia e indique especificamente como ela está em trânsito ou reside em um sistema.
4. Como a transferência de calor e a energia interna diferem? Em particular, quais podem ser armazenados como tal em um sistema e quais não podem?
5. Se você descer algumas escadas e parar, o que acontece com sua energia cinética e sua energia potencial gravitacional inicial?
6. Dê uma explicação de como a energia alimentar (calorias) pode ser vista como energia potencial molecular (consistente com a definição atômica e molecular de energia interna).
7. Identifique o tipo de energia transferida para seu corpo em cada uma das seguintes opções como energia interna, transferência de calor ou trabalho:
(a) aproveitar a luz do sol;
(b) comer alimentos;
(c) andar de elevador até um andar superior.
15.2: A Primeira Lei da Termodinâmica e alguns processos simples
8. Muito esforço, tempo e dinheiro foram gastos na busca pela chamada máquina de movimento perpétuo, que é definida como uma máquina hipotética que opera ou produz trabalho útil indefinidamente e/ou uma máquina hipotética que produz mais trabalho ou energia do que consome. Explique, em termos de motores térmicos e da primeira lei da termodinâmica, por que ou por que não essa máquina provavelmente será construída.
9. Um método de converter a transferência de calor em trabalho é a transferência de calor para um gás, que se expande, trabalhando em um pistão, conforme mostrado na figura abaixo.
(a) A transferência de calor é convertida diretamente para funcionar em um processo isobárico ou passa primeiro por outra forma? Explique sua resposta.
(b) E em um processo isotérmico?
(c) E em um processo adiabático (onde a transferência de calor ocorreu antes do processo adiabático)?
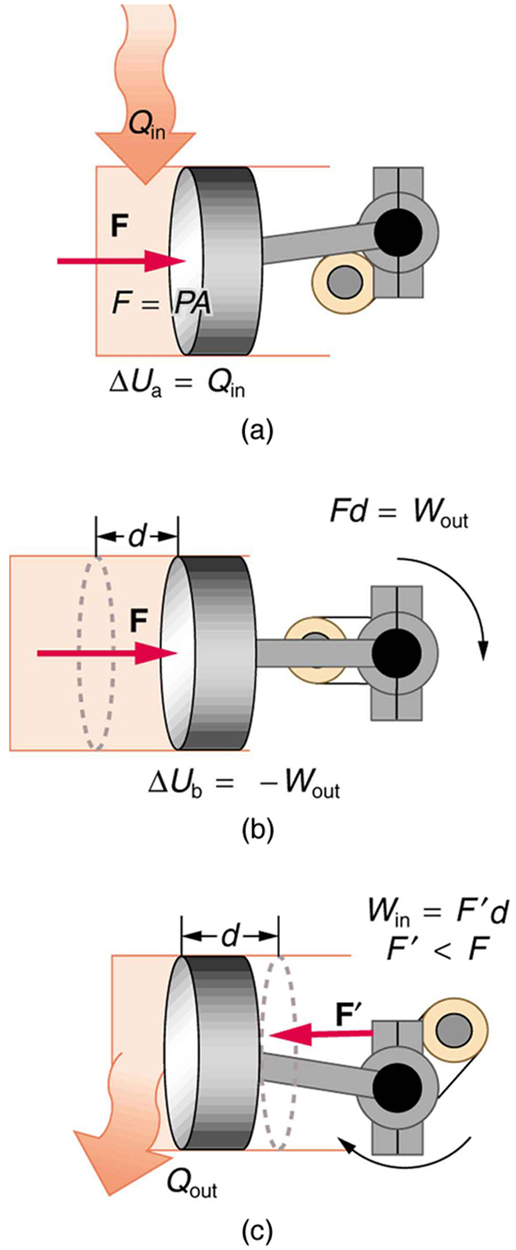
10. A pergunta anterior faria algum sentido para um processo isocórico? Explique sua resposta.
11. Normalmente dizemos isso\(\displaystyle ΔU=0\) para um processo isotérmico. Isso pressupõe que nenhuma mudança de fase ocorra? Explique sua resposta.
12. A temperatura de um gás em rápida expansão diminui. Explique o porquê em termos da primeira lei da termodinâmica. (Dica: considere se o gás funciona e se a transferência de calor ocorre rapidamente para o gás por condução.)
13. Qual processo cíclico representado pelos dois circuitos fechados, ABCFA e ABDEA, no\(\displaystyle PV\) diagrama da figura abaixo produz a maior rede? Esse processo também é aquele com a menor entrada de trabalho necessária para retorná-lo ao ponto A? Explique suas respostas.
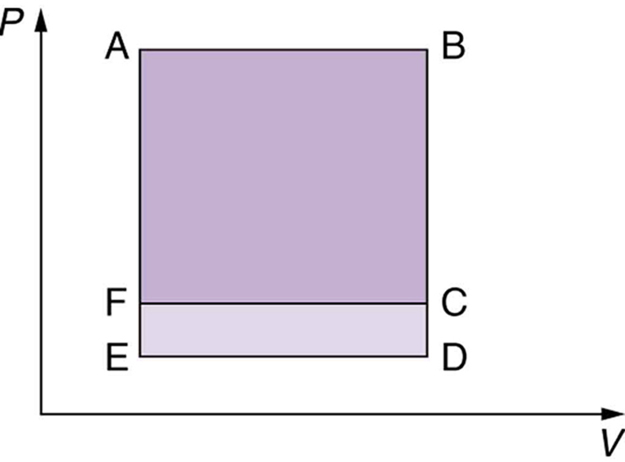
Os dois processos cíclicos mostrados neste\(\displaystyle PV\) diagrama começam com e retornam o sistema às condições no ponto A, mas seguem caminhos diferentes e produzem quantidades diferentes de trabalho.
14. Um processo real pode ser quase adiabático se ocorrer em um tempo muito curto. Como o curto período de tempo ajuda o processo a ser adiabático?
15. É improvável que um processo possa ser isotérmico, a menos que seja um processo muito lento. Explique o porquê. O mesmo vale para os processos isobáricos e isocóricos? Explique sua resposta.
15.3 Introdução à Segunda Lei da Termodinâmica: Motores térmicos e sua eficiência
16. Imagine que você está dirigindo um carro até Pike's Peak, no Colorado. Para levantar um carro pesando 1000 quilos, uma distância de 100 metros exigiria cerca de um milhão de joules. Você poderia levantar um carro de 12,5 quilômetros com a energia de um galão de gasolina. Subir o Pike's Peak (uma subida de apenas 3000 metros) deve consumir um pouco menos de um litro de gasolina. Mas outras considerações devem ser levadas em consideração. Explique, em termos de eficiência, quais fatores podem impedir você de realizar seu uso ideal de energia nesta viagem.
17. É necessária uma diferença de temperatura para operar um motor térmico? Declare por que ou por que não.
18. As definições de eficiência variam dependendo de como a energia está sendo convertida. Compare as definições de eficiência para o corpo humano e os motores térmicos. Como a definição de eficiência em cada um se relaciona com o tipo de energia que está sendo convertida em trabalho?
19. Por que, além do fato de que a segunda lei da termodinâmica diz que os motores reversíveis são os mais eficientes, os motores térmicos que empregam processos reversíveis deveriam ser mais eficientes do que aqueles que empregam processos irreversíveis? Considere que os mecanismos dissipativos são uma das causas da irreversibilidade.
15.4 O motor térmico perfeito de Carnot: a segunda lei da termodinâmica reafirmada
20. Pense no pássaro que bebe no início desta seção (Figura). Embora a ave tenha a máxima eficiência teórica possível, se deixada por conta própria ao longo do tempo, a ave deixará de “beber”. Quais são alguns dos processos dissipativos que podem fazer com que o movimento do pássaro cesse?
21. Engenharia e materiais aprimorados podem ser empregados em motores térmicos para reduzir a transferência de calor para o meio ambiente? Eles podem eliminar totalmente a transferência de calor para o meio ambiente?
22. A segunda lei da termodinâmica altera o princípio da conservação da energia?
15.5: Aplicações da Termodinâmica: Bombas de calor e refrigeradores
23. Explique por que as bombas de calor não funcionam tão bem em climas muito frios quanto em climas mais amenos. O mesmo se aplica aos refrigeradores?
24. Em alguns países do norte da Europa, casas estão sendo construídas sem nenhum tipo de sistema de aquecimento. Eles são muito bem isolados e são mantidos aquecidos pelo calor corporal dos moradores. Porém, quando os moradores não estão em casa, ainda faz calor nessas casas. Qual é a possível explicação?
25. Por que refrigeradores, condicionadores de ar e bombas de calor operam de forma mais econômica para ciclos com uma pequena diferença entre\(\displaystyle T_h\) e\(\displaystyle T_c\)? (Observe que as temperaturas do ciclo empregado são cruciais para sua\(\displaystyle COP\).)
26. Os gerentes de mercearia afirmam que há menos consumo total de energia no verão se a loja for mantida em baixa temperatura. Faça argumentos para apoiar ou refutar essa afirmação, levando em conta que existem vários refrigeradores e freezers na loja.
27. Você pode resfriar uma cozinha deixando a porta da geladeira aberta?
15.6: Entropia e a Segunda Lei da Termodinâmica: Transtorno e Indisponibilidade de Energia
28. Uma mulher fecha sua cabana de verão em setembro e retorna em junho. Enquanto isso, ninguém entrou na cabana. Explique o que ela provavelmente encontrará, em termos da segunda lei da termodinâmica.
29. Considere um sistema com um determinado conteúdo de energia, do qual desejamos extrair o máximo de trabalho possível. A entropia do sistema deve ser alta ou baixa? Isso é ordenado ou desordenado? Estruturado ou uniforme? Explique brevemente.
30. Um gás fica mais ordenado quando se liquefaz? Sua entropia muda? Em caso afirmativo, a entropia aumenta ou diminui? Explique sua resposta.
31. Explique como a entropia da água pode diminuir quando ela congela sem violar a segunda lei da termodinâmica. Especificamente, explique o que acontece com a entropia de seus arredores.
32. Um gás de temperatura uniforme é mais ou menos ordenado do que um com várias temperaturas diferentes? O que é mais estruturado? Em que a transferência de calor pode resultar em trabalho realizado sem transferência de calor de outro sistema?
33. Dê um exemplo de um processo espontâneo em que um sistema se torna menos ordenado e a energia se torna menos disponível para trabalhar. O que acontece com a entropia do sistema nesse processo?
34. Qual é a mudança na entropia em um processo adiabático? Isso implica que os processos adiabáticos são reversíveis? Um processo pode ser precisamente adiabático para um sistema macroscópico?
35. A entropia de uma estrela aumenta ou diminui à medida que ela irradia? A entropia do espaço para o qual ela irradia (que tem uma temperatura de cerca de 3 K) aumenta ou diminui? O que isso faz com a entropia do universo?
36. Explique por que um prédio feito de tijolos tem uma entropia menor do que os mesmos tijolos em uma pilha desorganizada. Faça isso considerando o número de maneiras pelas quais cada um poderia ser formado (o número de microestados em cada macroestado).
15.7: Interpretação estatística da entropia e da segunda lei da termodinâmica: a explicação subjacente
37. Explique por que um prédio feito de tijolos tem uma entropia menor do que os mesmos tijolos em uma pilha desorganizada. Faça isso considerando o número de maneiras pelas quais cada um poderia ser formado (o número de microestados em cada macroestado).
Problemas e exercícios
15.1: A Primeira Lei da Termodinâmica
38. Qual é a mudança na energia interna de um carro se você colocar 12,0 galões de gasolina em seu tanque? O conteúdo energético da gasolina é\(\displaystyle 1.3×10^8J/gal\). Todos os outros fatores, como a temperatura do carro, são constantes.
Solução
\(\displaystyle 1.6×10^9J\)
39. Quanta transferência de calor ocorre de um sistema, se sua energia interna diminuiu em 150 J enquanto ele estava fazendo 30,0 J de trabalho?
40. Um sistema funciona\(\displaystyle 1.80×10^8J\) enquanto a transferência\(\displaystyle 7.50×10^8J\) de calor ocorre para o meio ambiente. Qual é a mudança na energia interna do sistema assumindo que não há outras mudanças (como na temperatura ou pela adição de combustível)?
Solução
\(\displaystyle −9.30×10^8J\)
41. Qual é a mudança na energia interna de um sistema que funciona\(\displaystyle 4.50×10^5J\) enquanto a transferência\(\displaystyle 3.00×10^6J\) de calor ocorre para o sistema e a transferência\(\displaystyle 8.00×10^6J\) de calor ocorre para o meio ambiente?
42. Suponha que uma mulher faça 500 J de trabalho e 9500 J de transferência de calor ocorram no ambiente durante o processo.
(a) Qual é a diminuição de sua energia interna, assumindo que não há mudança na temperatura ou no consumo de alimentos? (Ou seja, não há outra transferência de energia.)
(b) Qual é a eficiência dela?
Solução
(a)\(\displaystyle −1.0×10^4J\) ou\(\displaystyle −2.39 kcal\)
(b) 5,00%
43. (a) Quanta energia alimentar um homem metabolizará no processo de fazer 35,0 kJ de trabalho com uma eficiência de 5,00%?
(b) Quanta transferência de calor ocorre para o ambiente para manter sua temperatura constante? Mostre explicitamente como você segue as etapas da Estratégia de Solução de Problemas para termodinâmica encontrada em Estratégias de Solução de Problemas para Termodinâmica.
44. (a) Qual é a taxa metabólica média em watts de um homem que metaboliza 10.500 kJ de energia alimentar em um dia?
(b) Qual é a quantidade máxima de trabalho em joules que ele pode fazer sem quebrar a gordura, assumindo uma eficiência máxima de 20,0%?
(c) Compare sua produção de trabalho com a potência diária de um motor de 187 W (0,250 cavalos de potência).
Solução
(a) 122 W
(b)\(\displaystyle 2.10×10^6J\)
(c) O trabalho realizado pelo motor é\(\displaystyle 1.61×10^7\); assim, o motor produz 7,67 vezes o trabalho realizado pelo homem
45. (a) Quanto tempo dura a energia em uma xícara de iogurte de 1470 kJ (350 kcal) em uma mulher trabalhando a uma taxa de 150 W com uma eficiência de 20,0% (como em subir escadas sem pressa)?
(b) O tempo encontrado na parte (a) implica que é fácil consumir mais energia alimentar do que você poderia razoavelmente esperar se exercitar com exercícios?
46. (a) Uma mulher escalando o Monumento a Washington metaboliza a energia\(\displaystyle 6.00×10^2kJ\) dos alimentos. Se sua eficiência for de 18,0%, quanta transferência de calor ocorre para o ambiente para manter sua temperatura constante?
(b) Discuta a quantidade de transferência de calor encontrada em (a). É consistente com o fato de você se aquecer rapidamente ao se exercitar?
Solução
(a) 492 kJ
(b) Essa quantidade de calor é consistente com o fato de você aquecer rapidamente durante o exercício. Como o corpo é ineficiente, o excesso de calor produzido deve ser dissipado por meio da transpiração, respiração, etc.
15.2: A Primeira Lei da Termodinâmica e alguns processos simples
47. Um pneu\(\displaystyle 0.0380m^3\) de carro contém ar a uma pressão de\(\displaystyle 2.20×10^5N/m^2\) (cerca de 32 psi). Quanto mais energia interna esse gás tem do que o mesmo volume tem na pressão manométrica zero (que é equivalente à pressão atmosférica normal)?
Solução
\(\displaystyle 6.77×10^3J\)
48. Um balão de brinquedo cheio de hélio tem uma pressão manométrica de 0,200 atm e um volume de 10,0 L. Quanto maior é a energia interna do hélio no balão do que seria na pressão manométrica zero?
49. O vapor para acionar uma locomotiva a vapor antiga é fornecido a uma pressão manométrica constante de\(\displaystyle 1.75×10^6N/m^2\) (cerca de 250 psi) para um pistão com um raio de 0,200 m.
(a) Calculando\(\displaystyle PΔV\), encontre o trabalho realizado pelo vapor quando o pistão se move 0,800 m. Observe que esta é a saída da rede, já que a pressão manométrica é usada.
(b) Agora, determine a quantidade de trabalho calculando a força exercida vezes a distância percorrida. A resposta é a mesma da parte (a)?
Solução
(a)\(\displaystyle W=PΔV=1.76×10^5J\)
(b)\(\displaystyle W=Fd=1.76×10^5J\). Sim, a resposta é a mesma.
50. Uma bomba de pneu acionada manualmente tem um pistão com um diâmetro de 2,50 cm e um curso máximo de 30,0 cm. (a) Quanto trabalho você faz de uma só vez se a pressão manométrica média for\(\displaystyle 2.40×10^5N/m^2\) (cerca de 35 psi)?
(b) Que força média você exerce sobre o pistão, negligenciando o atrito e a força gravitacional?
51. Calcule a potência líquida de um motor térmico seguindo o caminho ABCDA na figura abaixo.
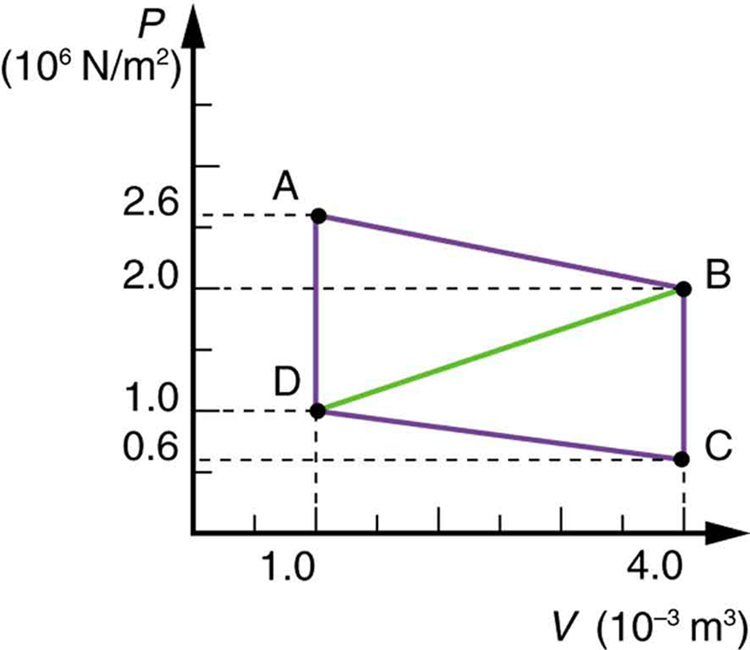
Solução
\(\displaystyle W=4.5×10^3J\)
52. Qual é a potência líquida de um motor térmico que segue o caminho ABDA na figura acima, com uma linha reta de B a D? Por que a produção de trabalho é menor do que a do caminho ABCDA? Mostre explicitamente como você segue as etapas nas Estratégias de resolução de problemas para termodinâmica.
53. Resultados irracionais
O que há de errado com a alegação de que um motor térmico cíclico funciona 4,00 kJ com uma entrada de 24,0 kJ de transferência de calor, enquanto 16,0 kJ de calor é transferido para o meio ambiente?
A solução não
\(\displaystyle W\) é igual à diferença entre a entrada de calor e a saída de calor.
54. (a) Um motor térmico cíclico, operando entre temperaturas de\(\displaystyle 450º C\) e\(\displaystyle 150º C\) produz 4,00 MJ de trabalho com uma transferência de calor de 5,00 MJ para o motor. Quanta transferência de calor ocorre para o meio ambiente?
(b) O que é irracional sobre o motor?
(c) Qual premissa não é razoável?
55. Construa seu próprio problema
Considere o motor a gasolina de um carro. Crie um problema no qual você calcule a máxima eficiência que esse mecanismo pode ter. Entre as coisas a considerar estão as temperaturas efetivas dos reservatórios quentes e frios. Compare sua eficiência calculada com a eficiência real dos motores dos automóveis.
56. Construa seu próprio problema
Considere uma viagem de carro pelas montanhas. Crie um problema no qual você calcule a eficiência geral do carro para a viagem como uma relação entre a energia cinética e potencial obtida e o combustível consumido. Compare essa eficiência com a eficiência termodinâmica cotada para motores a gasolina e discuta por que a eficiência termodinâmica é muito maior. Entre os fatores a serem considerados estão o ganho de altitude e velocidade, a massa do carro, a distância percorrida e a economia típica de combustível.
15.3 Introdução à Segunda Lei da Termodinâmica: Motores térmicos e sua eficiência
57. Um determinado motor térmico faz 10,0 kJ de trabalho e 8,50 kJ de transferência de calor ocorre para o meio ambiente em um processo cíclico.
(a) Qual foi a transferência de calor para este motor?
(b) Qual foi a eficiência do motor?
Solução
(a)\(\displaystyle 18.5kJ\)
(b)\(\displaystyle 54.1%\)
58. Com a transferência\(\displaystyle 2.56×10^6J\) de calor para este motor, um determinado motor térmico cíclico só\(\displaystyle 1.50×10^5J\) pode funcionar.
(a) Qual é a eficiência do motor?
(b) Quanta transferência de calor para o meio ambiente ocorre?
59. (a) Qual é a potência de trabalho de um motor térmico cíclico com uma eficiência de 22,0% e\(\displaystyle 6.00×10^9J\) de transferência de calor para o motor?
(b) Quanta transferência de calor ocorre para o meio ambiente?
Solução
(a)\(\displaystyle 1.32 × 10^9J\)
(b)\(\displaystyle 4.68 × 10^9J\)
60. (a) Qual é a eficiência de um motor térmico cíclico no qual 75,0 kJ de transferência de calor ocorre para o meio ambiente para cada 95,0 kJ de transferência de calor para o motor?
(b) Quanto trabalho ele produz para 100 kJ de transferência de calor para o motor?
61. O motor de um grande navio funciona\(\displaystyle 2.00×10^8J\) com uma eficiência de 5,00%.
(a) Quanta transferência de calor ocorre para o meio ambiente?
(b) Quantos barris de combustível são consumidos, se cada barril produz transferência\(\displaystyle 6.00×10^9J\) de calor quando queimado?
Solução
(a)\(\displaystyle 3.80 × 10^9J\)
(b) 0,667 barris
62. (a) Quanta transferência de calor ocorre para o meio ambiente por uma usina elétrica que usa a transferência\(\displaystyle 1.25×10^{14}J\) de calor para o motor com uma eficiência de 42,0%?
(b) Qual é a relação entre a transferência de calor para o meio ambiente e a produção de trabalho?
(c) Quanto trabalho é feito?
63. Suponha que as turbinas de uma usina movida a carvão tenham sido atualizadas, resultando em uma melhoria na eficiência de 3,32%. Suponha que, antes da atualização, a usina tivesse uma eficiência de 36% e que a transferência de calor para o motor em um dia ainda seja a mesma\(\displaystyle 2.50×10^{14}J\).
(a) Quanto mais energia elétrica é produzida devido à atualização?
(b) Quanto menos transferência de calor ocorre para o meio ambiente devido à atualização?
Solução
(a)\(\displaystyle 8.30 × 10^{12}J\), que é 3,32% do\(\displaystyle 2.50 × 10^{14}J\).
(b)\(\displaystyle –8.30 × 10^{12}J\), onde o sinal negativo indica uma redução na transferência de calor para o meio ambiente.
64. Esse problema compara a produção de energia e a transferência de calor para o meio ambiente por dois tipos diferentes de usinas nucleares — uma com a eficiência normal de 34,0% e outra com uma eficiência aprimorada de 40,0%. Suponha que ambos tenham a mesma transferência de calor para o motor em um dia,\(\displaystyle 2.50×10^{14}J\).
(a) Quanto mais energia elétrica é produzida pela usina mais eficiente?
(b) Quanto menos transferência de calor ocorre para o meio ambiente pela usina mais eficiente? (Um tipo de usina nuclear mais eficiente, o reator refrigerado a gás, não tem sido confiável o suficiente para ser economicamente viável, apesar de sua maior eficiência.)
15.4 O motor térmico perfeito de Carnot: a segunda lei da termodinâmica reafirmada
65. Um determinado motor a gasolina tem uma eficiência de 30,0%. Qual seria a temperatura do reservatório quente para um motor Carnot com essa eficiência, se ele operasse com uma temperatura de reservatório frio de\(\displaystyle 200ºC\)?
Solução
\(\displaystyle 403ºC\)
66. Um reator nuclear refrigerado a gás opera entre as temperaturas do reservatório quente\(\displaystyle 700ºC\) e frio de\(\displaystyle 27.0ºC\) e.
(a) Qual é a eficiência máxima de um motor térmico operando entre essas temperaturas?
(b) Encontre a proporção dessa eficiência com a eficiência de Carnot de um reator nuclear padrão (encontrado no exemplo).
67. (a) Qual é a temperatura do reservatório quente de um motor Carnot que tem uma eficiência de 42,0% e uma temperatura de reservatório frio de\(\displaystyle 27.0ºC\)?
(b) Qual deve ser a temperatura do reservatório quente para um motor térmico real que atinge 0,700 da eficiência máxima, mas ainda tem uma eficiência de 42,0% (e um reservatório frio em\(\displaystyle 27.0ºC\)?
(c) Sua resposta implica limites práticos para a eficiência dos motores a gasolina dos automóveis?
Solução
(a)\(\displaystyle 244ºC\)
(b)\(\displaystyle 477ºC\)
(c) Sim, como os motores dos automóveis não podem ficar muito quentes sem superaquecimento, sua eficiência é limitada.
68. As locomotivas a vapor têm uma eficiência de 17,0% e operam com uma temperatura de vapor quente de\(\displaystyle 425ºC\).
(a) Qual seria a temperatura do reservatório frio se fosse um motor Carnot?
(b) Qual seria a eficiência máxima dessa máquina a vapor se a temperatura do reservatório frio fosse\(\displaystyle 150ºC\)?
69. Motores a vapor práticos utilizam\(\displaystyle 450ºC\) vapor, que mais tarde se esgota em\(\displaystyle 270ºC\).
(a) Qual é a eficiência máxima que um motor térmico desse tipo pode ter?
(b) Como o\(\displaystyle 270ºC\) vapor ainda está muito quente, uma segunda máquina a vapor às vezes é operada usando o escapamento da primeira. Qual é a eficiência máxima do segundo motor se o escapamento tiver uma temperatura de\(\displaystyle 150ºC\)?
(c) Qual é a eficiência geral dos dois motores?
(d) Mostre que esta é a mesma eficiência de um único motor Carnot operando entre\(\displaystyle 450ºC\)\(\displaystyle 150ºC\) e. Mostre explicitamente como você segue as etapas nas Estratégias de resolução de problemas para termodinâmica.
Solução
(a)\(\displaystyle Eff_1=1−\frac{T_{c,1}}{T_{h,1}}=1−\frac{543K}{723K}=0.249\) ou\(\displaystyle 24.9%\)
(b)\(\displaystyle Eff_2=1−\frac{423K}{543K}=0.221\) ou\(\displaystyle 22.1%\)
(c) da\(\displaystyle Eff_1=1−\frac{T_{c,1}}{T_{h,1}}⇒T_{c,1}=T_{h,1}(1,−,eff_1)\) mesma forma,\(\displaystyle T_{c,2}=T_{h,2}(1−Eff_2)\)
usando\(\displaystyle T_{h,2}=T_{c,1} \text{in above equation gives} T_{c,2}=T_{h,1}(1−Eff_1)(1−Eff_2)≡T_{h,1}(1−Eff_{overall})\)
\(\displaystyle ∴(1−Eff_{overall})=(1−Eff_1)(1−Eff_2)\)
\(\displaystyle Eff_{overall}=1−(1−0.249)(1−0.221)=41.5%\)
(d)\(\displaystyle Eff_{overall}=1−\frac{423K}{723K}=0.415\) ou\(\displaystyle 41.5%\)
70. Uma usina elétrica a carvão tem uma eficiência de 38%. A temperatura do vapor que sai da caldeira é\(\displaystyle 550ºC \). Qual porcentagem da eficiência máxima essa estação obtém? (Suponha que a temperatura do ambiente seja\(\displaystyle 20ºC\).)
71. Você estaria disposto a apoiar financeiramente uma inventora que está comercializando um dispositivo que ela afirma ter 25 kJ de transferência de calor a 600 K, tem transferência de calor para o meio ambiente a 300 K e faz 12 kJ de trabalho? Explique sua resposta.
Solução
A transferência de calor para o reservatório frio é\(\displaystyle Q_c=Q_h−W=25kJ−12kJ=13kJ\), portanto, a eficiência é\(\displaystyle Eff=1−\frac{Q_c}{Q_h}=1−\frac{13kJ}{25kJ}=0.48\). A eficiência de Carnot é\(\displaystyle Eff_C=1−\frac{T_c}{T_h}=1−\frac{300K}{600K}=0.50\). A eficiência real é de 96% da eficiência de Carnot, que é muito maior do que a melhor já alcançada, de cerca de 70%, então seu esquema provavelmente será fraudulento.
72. Resultados irracionais
(a) Suponha que você queira projetar uma máquina a vapor que tenha transferência de calor para o meio ambiente a 270ºC e tenha uma eficiência de Carnot de 0,800. Qual temperatura do vapor quente você deve usar?
(b) O que não é razoável sobre a temperatura?
(c) Qual premissa não é razoável?
73. Resultados irracionais
(a) Calcule a temperatura do reservatório frio de uma máquina a vapor que usa vapor quente\(\displaystyle 450ºC\) e tem uma eficiência de Carnot de 0,700.
(b) O que não é razoável sobre a temperatura?
(c) Qual premissa não é razoável?
Solução
(a) —56,3ºC
(b) A temperatura está muito baixa para a saída de uma máquina a vapor (o ambiente local). Está abaixo do ponto de congelamento da água.
(c) A eficiência presumida é muito alta.
15.5: Aplicações da Termodinâmica: Bombas de calor e refrigeradores
74. Qual é o coeficiente de desempenho de uma bomba de calor ideal que tem transferência de calor de uma temperatura fria de\(\displaystyle −25.0ºC\) para uma temperatura quente de\(\displaystyle 40.0ºC\)?
Solução
4.82
75. Suponha que você tenha um refrigerador ideal que resfrie um ambiente\(\displaystyle −20.0ºC\) e tenha transferência de calor para outro ambiente em\(\displaystyle 50.0ºC\). Qual é seu coeficiente de desempenho?
76. Qual é o melhor coeficiente de desempenho possível para um refrigerador hipotético que poderia produzir nitrogênio líquido\(\displaystyle −200ºC\) e ter transferência de calor para o meio ambiente\(\displaystyle 35.0ºC\)?
Solução
0.311
77. Em um clima de inverno muito ameno, uma bomba de calor transfere calor de um ambiente\(\displaystyle 5.00ºC\) para um em\(\displaystyle 35.0ºC\). Qual é o melhor coeficiente de desempenho possível para essas temperaturas? Mostre explicitamente como você segue as etapas nas Estratégias de resolução de problemas para termodinâmica.
78. (a) Qual é o melhor coeficiente de desempenho para uma bomba de calor que tem uma temperatura de reservatório quente\(\displaystyle 50.0ºC\) e uma temperatura de reservatório frio de\(\displaystyle −20.0ºC\)?
(b) Quanta transferência de calor ocorre para o ambiente quente se\(\displaystyle 3.60×10^7J\) o trabalho (10,0kW⋅h) for colocado nele?
(c) Se o custo desse insumo de trabalho for\(\displaystyle 10.0 cents/kW⋅h\), como seu custo se compara com a transferência direta de calor obtida pela queima de gás natural a um custo de 85,0 centavos por termo. (Uma garrafa térmica é uma unidade comum de energia para gás natural e iguais\(\displaystyle 1.055×10^8J\).)
Solução
(a) 4.61
(b)\(\displaystyle 1.66×10^8J\) ou\(\displaystyle 3.97×10^4kcal\)
(c) Para transferir\(\displaystyle 1.66×10^8J\), a bomba de calor custa $1,00, o gás natural custa $1,34.
79. (a) Qual é o melhor coeficiente de desempenho para um refrigerador que resfria um ambiente\(\displaystyle −30.0ºC\) e tem transferência de calor para outro ambiente\(\displaystyle 45.0ºC\)?
(b) Quanto trabalho em joules deve ser feito para uma transferência de calor de 4186 kJ do ambiente frio?
(c) Qual é o custo de fazer isso se o trabalho custa 10,0 centavos por\(\displaystyle 3.60×10^6J\)?
(d) Quantos kJ de transferência de calor ocorrem no ambiente quente?
(e) Discuta que tipo de refrigerador pode operar entre essas temperaturas.
80. Suponha que você queira operar um refrigerador ideal com uma temperatura baixa de\(\displaystyle −10.0ºC\) e queira que ele tenha um coeficiente de desempenho de 7,00. Qual é a temperatura do reservatório quente para esse refrigerador?
Solução
27.6ºC
81. Uma bomba de calor ideal está sendo considerada para uso no aquecimento de um ambiente com uma temperatura de\(\displaystyle 22.0ºC\). Qual é a temperatura do reservatório frio se a bomba tiver um coeficiente de desempenho de 12,0?
82. Um ar condicionado de 4 toneladas remove\(\displaystyle 5.06×10^7J\) (48.000 unidades térmicas britânicas) de um ambiente frio em 1,00 h.
(a) Qual entrada de energia em joules é necessária para fazer isso se o ar condicionado tiver uma classificação de eficiência energética (\(\displaystyle EER\)) de 12,0?
(b) Qual é o custo de fazer isso se o trabalho custa 10,0 centavos por\(\displaystyle 3.60×10^6J \) (um quilowatt-hora)?
(c) Discuta se esse custo parece realista. Observe que a classificação de eficiência energética (\(\displaystyle EER\)) de um ar condicionado ou refrigerador é definida como o número de unidades térmicas britânicas de transferência de calor de um ambiente frio por hora dividido pelos watts de entrada de energia.
Solução
(a)\(\displaystyle 1.44×10^7J\)
(b) 40 centavos
(c) Esse custo parece bastante realista; diz que operar um ar condicionado o dia todo custaria $9,59 (se funcionasse continuamente).
83. Mostre que os coeficientes de desempenho de refrigeradores e bombas de calor estão relacionados por\(\displaystyle COP_{ref}=COP_{hp}−1\).
Comece com as definições de\(\displaystyle COP\) s e a relação de conservação de energia entre\(\displaystyle Q_h, Q_c,\)\(\displaystyle W\) e.
15.6: Entropia e a Segunda Lei da Termodinâmica: Transtorno e Indisponibilidade de Energia
84. (a) Em um dia de inverno, uma certa casa perde calor para o exterior (cerca\(\displaystyle 5.00×10^8J\) de 500.000 Btu). Qual é a mudança total na entropia devido apenas a essa transferência de calor, assumindo uma temperatura interna média de\(\displaystyle 21.0º C\) e uma temperatura externa média de\(\displaystyle 5.00º C\)?
(b) Essa grande mudança na entropia implica que uma grande quantidade de energia se tornou indisponível para trabalhar. Onde encontramos mais energia quando essa energia é perdida para nós?
Solução
(a)\(\displaystyle 9.78×10^4J/K\)
(b) Para obter mais energia, devemos gerá-la a partir de coisas dentro da casa, como uma bomba de calor, corpos humanos e outros aparelhos. Como você sabe, usamos muita energia para manter nossas casas aquecidas no inverno devido à perda de calor para o exterior.
85. Em um dia quente\(\displaystyle 4.00×10^6J\) de verão, ocorre a transferência de calor para um carro estacionado, aumentando sua temperatura de\(\displaystyle 35.0º C\) para\(\displaystyle 45.0º C\). Qual é o aumento da entropia do carro apenas devido a essa transferência de calor?
86. Uma rocha quente ejetada da fonte de lava de um vulcão esfria de\(\displaystyle 1100º C\) para\(\displaystyle 40.0º C\) e sua entropia diminui em 950 J/K. Quanta transferência de calor ocorre da rocha?
Solução
\(\displaystyle 8.01×10^5J\)
87. Quando a transferência\(\displaystyle 1.60×10^5J\) de calor ocorre para uma torta de carne inicialmente às\(\displaystyle 20.0º C\), sua entropia aumenta em 480 J/K. Qual é a temperatura final?
88. O Sol irradia energia na proporção\(\displaystyle 3.80×10^{26}W\) de sua\(\displaystyle 5500º C\) superfície para o espaço vazio escuro (uma fração insignificante irradia para a Terra e os outros planetas). A temperatura efetiva do espaço profundo é\(\displaystyle −270º C\).
(a) Qual é o aumento da entropia em um dia devido a essa transferência de calor?
(b) Quanto trabalho está indisponível?
Solução
(a)\(\displaystyle 1.04×10^{31}J/K\)
(b)\(\displaystyle 3.28×10^{31}J\)
89. (a) Ao atingir o equilíbrio, quanta transferência de calor ocorre a partir de 1,00 kg de água\(\displaystyle 40.0º C\) quando ela é colocada em contato com 1,00 kg de\(\displaystyle 20.0º C\) água para atingir o equilíbrio?
(b) Qual é a mudança na entropia devido a essa transferência de calor?
(c) Quanto trabalho é indisponibilizado, considerando a temperatura mais baixa\(\displaystyle 20.0º C\)? Mostre explicitamente como você segue as etapas nas Estratégias de resolução de problemas para entropia.
90. Qual é a diminuição da entropia de 25,0 g de água que se condensa no espelho de um banheiro a uma temperatura de\(\displaystyle 35.0º C\), assumindo que não há mudança de temperatura e dado que o calor latente de vaporização é de 2450 kJ/kg?
Solução
199 J/K
91. Encontre o aumento na entropia de 1,00 kg de nitrogênio líquido que começa em sua temperatura de ebulição, ferve e aquece\(\displaystyle 20.0º C\) a uma pressão constante.
92. Uma grande usina elétrica gera 1000 MW de eletricidade com uma eficiência de 35,0%.
(a) Calcule a transferência de calor para a central elétrica\(\displaystyle Q_h\),, em um dia.
(b) Quanta transferência de calor\(\displaystyle Q_c\) ocorre para o meio ambiente em um dia?
(c) Se a transferência de calor nas torres de resfriamento for da\(\displaystyle 35.0º C\) água para a massa de ar local, que aumenta a temperatura de\(\displaystyle 18.0º C\) para\(\displaystyle 20.0º C\), qual é o aumento total da entropia devido a essa transferência de calor?
(d) Quanta energia fica indisponível para fazer o trabalho devido a esse aumento na entropia, assumindo uma temperatura\(\displaystyle 18.0º C\) mais baixa? (Parte do\(\displaystyle Q_c\) poderia ser utilizada para operar motores térmicos ou simplesmente para aquecer o ambiente, mas raramente é.)
Solução
(a)\(\displaystyle 2.47×10^{14}J\)
(b)\(\displaystyle 1.60×10^{14}J\)
(c)\(\displaystyle 2.85×10^{10}J/K\)
(d)\(\displaystyle 8.29×10^{12}J\)
93. (a) Quanta transferência de calor ocorre de 20,0 kg de\(\displaystyle 90.0º C\) água colocados em contato com 20,0 kg de\(\displaystyle 10.0º C\) água, produzindo uma temperatura final de\(\displaystyle 50.0º C\)?
(b) Quanto trabalho um motor Carnot poderia fazer com essa transferência de calor, supondo que opere entre dois reservatórios em temperaturas constantes de\(\displaystyle 90.0º C\) e\(\displaystyle 10.0º C\)?
(c) Qual aumento na entropia é produzido pela mistura de 20,0 kg de\(\displaystyle 90.0º C\) água com 20,0 kg de\(\displaystyle 10.0º C\) água?
(d) Calcule a quantidade de trabalho indisponível por esta mistura usando uma temperatura baixa de\(\displaystyle 10.0º C\) e compare-a com o trabalho realizado pelo motor Carnot. Mostre explicitamente como você segue as etapas nas Estratégias de resolução de problemas para entropia.
(e) Discuta como os processos cotidianos tornam cada vez mais energia indisponível para o trabalho, conforme está implícito nesse problema.
15.7: Interpretação estatística da entropia e da segunda lei da termodinâmica: a explicação subjacente
94. Usando a Tabela, verifique a alegação de que, se você jogar 100 moedas por segundo, você pode esperar obter 100 cabeças ou 100 coroas uma vez ao\(\displaystyle 2×10^{22}\) calcular o tempo com precisão de dois dígitos.
Solução
Isso deve acontecer duas vezes em cada\(\displaystyle 1.27×10^{30}s\) ou uma vez em cada\(\displaystyle 6.35×10^{29}s\)
\(\displaystyle (6.35×10^{29}s)(\frac{1 h}{3600 s})=(\frac{1 d}{24 h})(\frac{1 y}{365.25 d})=2.0×10^{22}y\)
95. Em que porcentagem das vezes você obterá algo na faixa de 60 cabeças e 40 caudas a 40 cabeças e 60 caudas ao jogar 100 moedas? O número total de microestados nessa faixa é\(\displaystyle 1.22×10^{30}\). (Consulte a tabela.)
96. (a) Se jogar 100 moedas, quantas maneiras (microestados) existem para obter os três macroestados mais prováveis de 49 cabeças e 51 caudas, 50 cabeças e 50 caudas e 51 cabeças e 49 caudas?
(b) Que porcentagem do total de possibilidades é essa? (Consulte a tabela.)
Solução
(a)\(\displaystyle 3.0×10^{29}\)
(b) 24%
97. (a) Qual é a mudança na entropia se você começar com 100 moedas no macroestado de 45 cabeças e 55 caudas, jogá-las e obter 51 cabeças e 49 caudas?
(b) E se você tiver 75 cabeças e 25 caudas?
(c) Qual é a probabilidade de 51 cabeças e 49 caudas do que 75 cabeças e 25 caudas?
(d) Qualquer um dos resultados viola a segunda lei da termodinâmica?
98. (a) Qual é a mudança na entropia se você começar com 10 moedas no macroestado de 5 cabeças e 5 caudas, jogá-las e obter 2 cabeças e 8 caudas?
(b) Qual a probabilidade de 5 cabeças e 5 caudas do que 2 cabeças e 8 caudas? (Pegue a proporção do número de microestados para descobrir.)
(c) Se você estivesse apostando em 2 cabeças e 8 coroas, você aceitaria probabilidades de 252 a 45? Explique por que ou por que não.
Solução
(a)\(\displaystyle −2.38×10^{–23}J/K\)
(b) 5,6 vezes mais provável
(c) Se você estivesse apostando em duas cabeças e 8 coroas, as chances de empatar são de 252 a 45, então, em média, você empataria. Então, não, você não apostaria em probabilidades de 252 a 45.
99. (a) Se você jogar 10 moedas, em que porcentagem das vezes você obterá os três macroestados mais prováveis (6 cabeças e 4 caudas, 5 cabeças e 5 caudas, 4 cabeças e 6 caudas)?
(b) Você pode jogar 10 moedas de forma realista e contar o número de cabeças e caudas cerca de duas vezes por minuto. Nesse ritmo, quanto tempo demorará em média para obter 10 cabeças e 0 caudas ou 0 cabeças e 10 caudas?
100. (a) Construa uma tabela mostrando os macroestados e todos os microestados individuais para lançar 6 moedas. (Use a tabela como guia.)
(b) Quantos macroestados existem?
(c) Qual é o número total de microestados?
(d) Qual a porcentagem de chance de jogar 5 cabeças e 1 cauda?
(e) Qual é a probabilidade de você jogar 3 cabeças e 3 caudas do que 5 cabeças e 1 cauda? (Pegue a proporção do número de microestados para descobrir.)
Solução
(b) 7
(c) 64
(d) 9,38%
(e) 3,33 vezes mais provável (20 a 6)
101. Em um ar condicionado, 12,65 MJ de transferência de calor ocorrem de um ambiente frio em 1,00 h.
(a) Que massa de gelo derretida envolveria a mesma transferência de calor?
(b) Quantas horas de operação seriam equivalentes a derreter 900 kg de gelo?
(c) Se o gelo custa 20 centavos por kg, você acha que o ar condicionado poderia ser operado de forma mais barata do que simplesmente usando gelo? Descreva detalhadamente como você avalia os custos relativos.

