15.1: A Primeira Lei da Termodinâmica
- Page ID
- 195033
objetivos de aprendizagem
Ao final desta seção, você poderá:
- Defina a primeira lei da termodinâmica.
- Descreva como a conservação de energia se relaciona com a primeira lei da termodinâmica.
- Identifique instâncias da primeira lei da termodinâmica funcionando em situações cotidianas, incluindo o metabolismo biológico.
- Calcule as mudanças na energia interna de um sistema, depois de contabilizar a transferência de calor e o trabalho realizado.
Se estivermos interessados em como a transferência de calor é convertida em trabalho, o princípio da conservação de energia é importante. A primeira lei da termodinâmica aplica o princípio da conservação de energia a sistemas em que a transferência de calor e o trabalho são os métodos de transferência de energia para dentro e para fora do sistema.

A primeira lei da termodinâmica afirma que a mudança na energia interna de um sistema é igual à transferência líquida de calor para o sistema menos o trabalho de rede realizado pelo sistema. Em forma de equação, a primeira lei da termodinâmica é
\[\Delta U = Q - W. \label{first}\]
Aqui\(\Delta U\) está a mudança na energia interna \(U\)do sistema. \(Q\)é o calor líquido transferido para o sistema — ou seja,\(Q\) é a soma de todas as transferências de calor para dentro e para fora do sistema. \(W\)é o trabalho de rede realizado pelo sistema — ou seja,\(W\) é a soma de todo o trabalho realizado no ou pelo sistema. Usamos as seguintes convenções de sinalização: se\(Q\) for positivo, então há uma transferência líquida de calor para o sistema; se\(W\) for positivo, então há trabalho de rede feito pelo sistema. Portanto, o positivo\(Q\) adiciona energia ao sistema e o positivo\(W\) retira energia do sistema. Assim\(\Delta U = Q - W\). Observe também que, se ocorrer mais transferência de calor para o sistema do que o trabalho realizado, a diferença será armazenada como energia interna. Os motores térmicos são um bom exemplo disso: a transferência de calor para eles ocorre para que eles possam funcionar (Figura\(\PageIndex{2}\)). Agora vamos examinar\(Q, \, W\) e\(\Delta U\) aprofundar.

LEI DA TERMODINÂMICA E LEI DE CONSERVAÇÃO DE ENERGIA
A primeira lei da termodinâmica é, na verdade, a lei de conservação de energia declarada da forma mais útil em termodinâmica. A primeira lei estabelece a relação entre a transferência de calor, o trabalho realizado e a mudança na energia interna de um sistema.
Heat Q e Work W
A transferência de calor\(Q\) e o trabalho\(W\) são os dois meios diários de trazer energia para dentro ou para fora de um sistema. Os processos são bem diferentes. A transferência de calor, um processo menos organizado, é impulsionada por diferenças de temperatura. O trabalho, um processo bastante organizado, envolve uma força macroscópica exercida à distância. No entanto, o calor e o trabalho podem produzir resultados idênticos. Por exemplo, ambos podem causar um aumento de temperatura. A transferência de calor para um sistema, como quando o sol aquece o ar de um pneu de bicicleta, pode aumentar sua temperatura, assim como o trabalho realizado no sistema, como quando o ciclista bombeia ar para dentro do pneu. Uma vez que o aumento da temperatura tenha ocorrido, é impossível dizer se foi causado pela transferência de calor ou pelo trabalho. Essa incerteza é um ponto importante. Tanto a transferência de calor quanto o trabalho são energia em trânsito — nenhum deles é armazenado como tal em um sistema. No entanto, ambos podem alterar a energia interna\(U\) de um sistema. A energia interna é uma forma de energia completamente diferente do calor ou do trabalho.
Energia interna U
Podemos pensar na energia interna de um sistema de duas maneiras diferentes, mas consistentes. A primeira é a visão atômica e molecular, que examina o sistema na escala atômica e molecular. A energia interna\(U\) de um sistema é a soma das energias cinética e potencial de seus átomos e moléculas. Lembre-se de que a energia cinética mais a energia potencial é chamada de energia mecânica. Assim, a energia interna é a soma da energia mecânica atômica e molecular. Como é impossível acompanhar todos os átomos e moléculas individuais, devemos lidar com médias e distribuições. Uma segunda forma de ver a energia interna de um sistema é em termos de suas características macroscópicas, que são muito semelhantes aos valores médios atômicos e moleculares.
Macroscopicamente, definimos que a mudança na energia\(\Delta U\) interna é aquela dada pela primeira lei da termodinâmica (Equação\ ref {first}):\[\Delta U = Q - W \nonumber\]
Muitos experimentos detalhados verificaram que\(\Delta U = Q - W\), onde\(\Delta U\) está a mudança na energia cinética total e potencial de todos os átomos e moléculas em um sistema. Também foi determinado experimentalmente que a energia interna\(U\) de um sistema depende apenas do estado do sistema e não de como ele atingiu esse estado. Mais especificamente,\(U\) é considerada uma função de algumas quantidades macroscópicas (pressão, volume e temperatura, por exemplo), independente da história passada, como se houve transferência de calor ou trabalho realizado. Essa independência significa que, se soubermos o estado de um sistema, podemos calcular mudanças em sua energia interna\(U\) a partir de algumas variáveis macroscópicas.
MACROSCÓPICO VERSUS MICROSCÓPICO
Em termodinâmica, costumamos usar a imagem macroscópica ao fazer cálculos de como um sistema se comporta, enquanto a imagem atômica e molecular fornece explicações subjacentes em termos de médias e distribuições. Veremos isso novamente nas seções posteriores deste capítulo. Por exemplo, no tópico de entropia, os cálculos serão feitos usando a visão atômica e molecular.
Para ter uma ideia melhor de como pensar sobre a energia interna de um sistema, vamos examinar um sistema que vai do Estado 1 para o Estado 2. O sistema tem energia interna\(U_1\) no Estado 1 e tem energia interna\(U_2\) no Estado 2, não importa como chegou a qualquer um dos estados. Então, a mudança na energia interna
\[\Delta U = U_2 - U_1\]
é independente do que causou a mudança. Em outras palavras,\(\delta U\) é independente do caminho. Por caminho, queremos dizer o método de ir do ponto inicial ao ponto final. Por que essa independência é importante? Ambos\(Q\) \(W\)dependem do caminho, mas\(\Delta U\) não (Equação\ ref {first}). Essa independência de caminho significa que a energia interna\(U\) é mais fácil de considerar do que a transferência de calor ou o trabalho realizado.
Exemplo\(\PageIndex{1}\): Calculating Change in Internal Energy - The Same Change in \(U\) is Produced by Two Different Processes
- Suponha que haja transferência de calor de 40,00 J para um sistema, enquanto o sistema faz 10,00 J de trabalho. Posteriormente, há uma transferência de calor de 25,00 J para fora do sistema, enquanto 4,00 J de trabalho são feitos no sistema. Qual é a mudança líquida na energia interna do sistema?
- Qual é a mudança na energia interna de um sistema quando um total de 150,00 J de transferência de calor ocorre para fora (do) sistema e 159,00 J de trabalho é feito no sistema (Figura\(\PageIndex{3}\))?
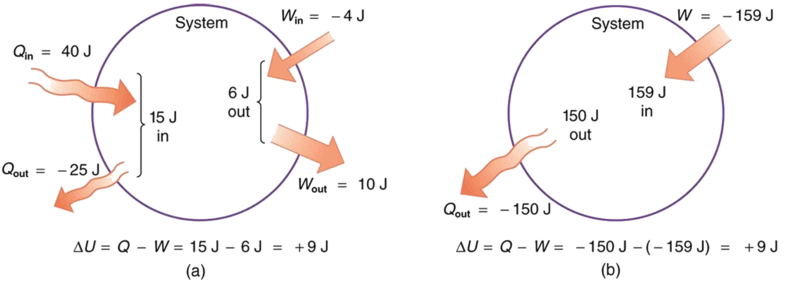
Estratégia
Na parte (a), devemos primeiro encontrar a transferência líquida de calor e o trabalho em rede realizado a partir das informações fornecidas. Em seguida, a primeira lei da termodinâmica (Equação\ ref {first}).
pode ser usado para encontrar a mudança na energia interna. Na parte (b), a transferência líquida de calor e o trabalho realizado são fornecidos, para que a equação possa ser usada diretamente.
Solução para (a)
A transferência térmica líquida é a transferência de calor para o sistema menos a transferência de calor para fora do sistema, ou
\[ \begin{align*} Q &= 40.00 \, J - 25.00 \, J \\[5pt] &= 15.00 \, J \end{align*}\]
Da mesma forma, o trabalho total é o trabalho realizado pelo sistema menos o trabalho realizado no sistema, ou
\[ \begin{align*} W &= 10.00 \, J - 4.00 \, J \\[5pt] &= 6.00 \, J. \end{align*}\]
Discussão sobre (a)
Não importa se você analisa o processo geral ou o divide em etapas, a mudança na energia interna é a mesma.
Solução para (b)
Aqui, a transferência líquida de calor e o trabalho total são fornecidos diretamente a ser\(Q = -150.00 \, J\) e\(W = -159.00 \, J\), de modo que
\[ \begin{align*} \Delta U &= Q - W = -150.00 - (-159.00) \\[5pt] &= 9.00 \, J. \end{align*}\]
Discussão sobre (b)
Um processo muito diferente na parte (b) produz a mesma mudança de 9,00-J na energia interna que na parte (a). Observe que a mudança no sistema em ambas as partes está relacionada\(\Delta U\) e não\(Q\) aos indivíduos envolvidos.\(W\) O sistema acaba no mesmo estado em (a) e (b). As partes (a) e (b) apresentam dois caminhos diferentes para o sistema seguir entre os mesmos pontos inicial e final, e a mudança na energia interna de cada uma é a mesma — ela é independente do caminho.
Metabolismo humano e a Primeira Lei da Termodinâmica
O metabolismo humano é a conversão de alimentos em transferência de calor, trabalho e gordura armazenada. O metabolismo é um exemplo interessante da primeira lei da termodinâmica em ação. Agora, examinamos novamente esses tópicos por meio da primeira lei da termodinâmica. Considerando o corpo como o sistema de interesse, podemos usar a primeira lei para examinar a transferência de calor, o trabalho e a energia interna em atividades que vão do sono aos exercícios pesados. Quais são algumas das principais características da transferência de calor, do trabalho e da energia no corpo? Por um lado, a temperatura corporal normalmente é mantida constante pela transferência de calor para o ambiente. Isso significa que\(Q\) é negativo. Outro fato é que o corpo geralmente funciona no mundo exterior. Isso significa que\(W\) é positivo. Em tais situações, então, o corpo perde energia interna, pois\(\Delta U = Q - W\) é negativo.
Agora, considere os efeitos de comer. Comer aumenta a energia interna do corpo adicionando energia potencial química (essa é uma visão pouco romântica de um bom bife). O corpo metaboliza todos os alimentos que consumimos. Basicamente, o metabolismo é um processo de oxidação no qual a energia potencial química dos alimentos é liberada. Isso implica que a entrada de alimentos está na forma de trabalho. A energia dos alimentos é relatada em uma unidade especial, conhecida como Caloria. Essa energia é medida pela queima de alimentos em um calorímetro, que é como as unidades são determinadas.
Em química e bioquímica, uma caloria (escrita com c minúsculo) é definida como a energia (ou transferência de calor) necessária para elevar a temperatura de um grama de água pura em um grau Celsius. Nutricionistas e vigilantes do peso tendem a usar a caloria da dieta, que é frequentemente chamada de caloria (escrita com C maiúsculo). Uma caloria alimentar é a energia necessária para elevar a temperatura de um quilo de água em um grau Celsius. Isso significa que uma caloria dietética é igual a uma quilocaloria para o químico, e é preciso ter cuidado para evitar confusão entre as duas.
Novamente, considere a energia interna que o corpo perdeu. Há três lugares para onde essa energia interna pode ir: para a transferência de calor, para o trabalho e para a gordura armazenada (uma pequena fração também vai para o reparo e crescimento celular). A transferência de calor e o trabalho retiram a energia interna do corpo e a comida a devolve. Se você comer a quantidade certa de comida, sua energia interna média permanecerá constante. Tudo o que você perde na transferência de calor e no trabalho é substituído por comida, de modo que, a longo prazo,\(\Delta U = 0\). Se você comer demais repetidamente, então\(\Delta U\) é sempre positivo, e seu corpo armazena essa energia interna extra como gordura. O inverso é verdadeiro se você comer muito pouco. Se\(\Delta U\) for negativo por alguns dias, o corpo metaboliza sua própria gordura para manter a temperatura corporal e realizar trabalhos que retiram energia do corpo. Esse processo é como a dieta produz perda de peso.
A vida nem sempre é tão simples, como qualquer pessoa que faz dieta sabe. O corpo armazena gordura ou a metaboliza somente se a ingestão de energia mudar por um período de vários dias. Depois de fazer uma dieta importante, a próxima tem menos sucesso porque seu corpo altera a maneira como responde à baixa ingestão de energia. Sua taxa metabólica basal (BMR) é a taxa na qual os alimentos são convertidos em transferência de calor e o trabalho realizado enquanto o corpo está em repouso completo. O corpo ajusta sua taxa metabólica basal para compensar parcialmente a ingestão excessiva ou insuficiente. O corpo diminuirá a taxa metabólica em vez de eliminar sua própria gordura para substituir a ingestão perdida de alimentos. Você relaxará com mais facilidade e se sentirá menos enérgico como resultado da menor taxa metabólica e não perderá peso tão rápido quanto antes. O exercício ajuda a perder peso, pois produz transferência de calor do corpo e do trabalho e aumenta a taxa metabólica mesmo quando você está em repouso. A perda de peso também é auxiliada pela eficiência bastante baixa do corpo na conversão de energia interna em trabalho, de modo que a perda de energia interna resultante do trabalho é muito maior do que o trabalho realizado. Deve-se notar, no entanto, que os sistemas vivos não estão em equilíbrio térmico.
O corpo nos fornece uma excelente indicação de que muitos processos termodinâmicos são irreversíveis. Um processo irreversível pode ir em uma direção, mas não no contrário, sob um determinado conjunto de condições. Por exemplo, embora a gordura corporal possa ser convertida para trabalhar e produzir transferência de calor, o trabalho realizado no corpo e a transferência de calor para ele não podem ser convertidos em gordura corporal. Caso contrário, poderíamos pular o almoço tomando sol ou descendo escadas. Outro exemplo de processo termodinâmico irreversível é a fotossíntese. Esse processo é a ingestão de uma forma de energia — a luz — pelas plantas e sua conversão em energia potencial química. Ambas as aplicações da primeira lei da termodinâmica são ilustradas na Figura\(\PageIndex{4}\). Uma grande vantagem das leis de conservação, como a primeira lei da termodinâmica, é que elas descrevem com precisão os pontos inicial e final de processos complexos, como metabolismo e fotossíntese, sem levar em conta as complicações intermediárias.

Resumo
A tabela apresenta um resumo dos termos relevantes para a primeira lei da termodinâmica.
| Prazo | Definição |
|---|---|
| \(U\) | Energia interna — a soma das energias cinética e potencial dos átomos e moléculas de um sistema. Pode ser dividido em várias subcategorias, como energia térmica e química. Depende apenas do estado de um sistema (como o\(P\) dele)\(V\) e\(T\) não de como a energia entrou no sistema. A mudança na energia interna é independente do caminho. |
| \(Q\) | Calor—energia transferida devido a uma diferença de temperatura. Caracterizado por movimento molecular aleatório. Altamente dependente do caminho. \(Q\)entrar em um sistema é positivo. |
| \(W\) | Trabalho — energia transferida por uma força que se move à distância. Um processo organizado e ordenado. Depende do caminho. \(W\)feito por um sistema (seja contra uma força externa ou para aumentar o volume do sistema) é positivo. |
- A primeira lei da termodinâmica é dada como\(\Delta U = Q - W\), onde\(\Delta U\) está a mudança na energia interna de um sistema,\(Q\) é a transferência líquida de calor (a soma de todas as transferências de calor para dentro e para fora do sistema) e\(W\) é o trabalho em rede realizado (a soma de todo o trabalho realizado no ou pelo sistema).
- Ambos\(Q\) e\(W\) são energia em trânsito;\(\Delta U\) representam apenas uma quantidade independente capaz de ser armazenada.
- A energia interna\(U\) de um sistema depende apenas do estado do sistema e não de como ele atingiu esse estado.
- O metabolismo dos organismos vivos e a fotossíntese das plantas são tipos especializados de transferência de calor, trabalho e energia interna dos sistemas.
Glossário
- primeira lei da termodinâmica
- afirma que a mudança na energia interna de um sistema é igual à transferência líquida de calor para o sistema menos o trabalho de rede realizado pelo sistema
- energia interna
- a soma das energias cinética e potencial dos átomos e moléculas de um sistema
- metabolismo humano
- conversão de alimentos em transferência de calor, trabalho e gordura armazenada


