13.E: Trabalho, energia e recursos energéticos (exercício)
- Page ID
- 194308
Perguntas conceituais
13.1: Temperatura
1. O que significa dizer que dois sistemas estão em equilíbrio térmico?
2. Dê um exemplo de uma propriedade física que varia com a temperatura e descreva como ela é usada para medir a temperatura.
3. Quando um termômetro de álcool frio é colocado em um líquido quente, a coluna de álcool desce um pouco antes de subir. Explique o porquê.
4. Se você adicionar água fervente a uma xícara em temperatura ambiente, qual seria a temperatura final de equilíbrio da unidade? Você precisará incluir os arredores como parte do sistema. Considere a lei zero da termodinâmica.
13.2: Expansão térmica de sólidos e líquidos
5. As tensões térmicas causadas pelo resfriamento irregular podem facilmente quebrar panelas de vidro. Explique por que o Pyrex®, um vidro com um pequeno coeficiente de expansão linear, é menos suscetível.
6. A água se expande significativamente quando congela: ocorre um aumento de volume de cerca de 9%. Como resultado dessa expansão e devido à formação e crescimento de cristais à medida que a água congela, cerca de 10% a 30% das células biológicas explodem quando o material animal ou vegetal é congelado. Discuta as implicações desse dano celular na perspectiva de preservar corpos humanos por meio do congelamento, para que possam ser descongelados em alguma data futura, quando se espera que todas as doenças sejam curáveis.
7. Um método para obter um encaixe firme, digamos, de um pino de metal em um orifício em um bloco de metal, é fabricar o pino um pouco maior que o orifício. O pino é então inserido quando está em uma temperatura diferente da do bloco. O bloco deve estar mais quente ou mais frio do que o pino durante a inserção? Explique sua resposta.
8. Realmente ajuda passar água quente sobre uma tampa de metal bem fechada em uma jarra de vidro antes de tentar abri-la? Explique sua resposta.
9. Líquidos e sólidos se expandem com o aumento da temperatura, porque a energia cinética dos átomos e moléculas de um corpo aumenta. Explique por que alguns materiais encolhem com o aumento da temperatura.
13.3: A Lei do Gás Ideal
10. Descubra a população humana da Terra. Existe uma toupeira de pessoas habitando a Terra? Se a massa média de uma pessoa for de 60 kg, calcule a massa de uma toupeira de pessoas. Como a massa de uma toupeira de pessoas se compara à massa da Terra?
11. Em que circunstâncias você esperaria que um gás se comportasse de forma significativamente diferente do previsto pela lei do gás ideal?
12. Um termômetro de gás de volume constante contém uma quantidade fixa de gás. Qual propriedade do gás é medida para indicar sua temperatura?
13.4: Teoria Cinética: Explicação Atômica e Molecular da Pressão e Temperatura
13. Como o momentum está relacionado à pressão exercida por um gás? Explique no nível atômico e molecular, considerando o comportamento dos átomos e moléculas.
13.5: Mudanças de fase
14. Uma panela de pressão contém água e vapor em equilíbrio a uma pressão maior que a pressão atmosférica. Como essa pressão maior aumenta a velocidade de cozimento?
15. Por que a condensação se forma mais rapidamente no objeto mais frio de uma sala — por exemplo, em um copo de água gelada?
16. Qual é a pressão de vapor do dióxido de carbono sólido (gelo seco) em\(\displaystyle –78.5ºC\)?
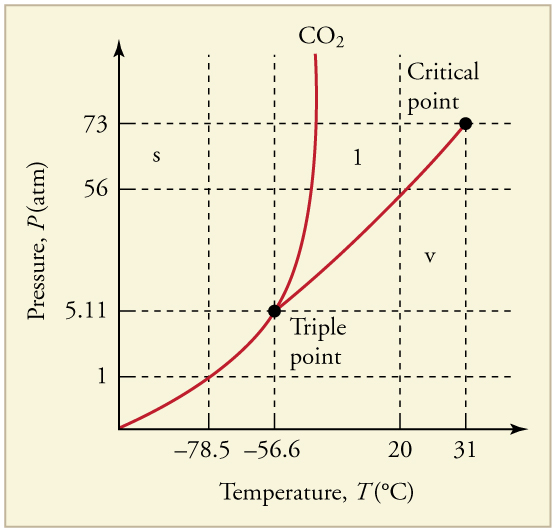
O diagrama de fases do dióxido de carbono. Os eixos não são lineares e o gráfico não está em escala. O gelo seco é dióxido de carbono sólido e tem uma temperatura de sublimação de\(\displaystyle –78.5ºC\).
17. O dióxido de carbono pode ser liquefeito à temperatura ambiente (\(\displaystyle 20ºC\))? Em caso afirmativo, como? Se não, por que não? (Veja a Figura.)
18. O oxigênio não pode ser liquefeito à temperatura ambiente colocando-o sob uma pressão grande o suficiente para unir suas moléculas. Explique por que isso acontece.
19. Qual é a diferença entre gás e vapor?
13.6: Umidade, evaporação e ebulição
20. Como a umidade depende apenas da pressão e da temperatura do vapor da água, as densidades de vapor de saturação listadas na Tabela são válidas em uma atmosfera de hélio a uma pressão de\(\displaystyle 1.01×10^5N/m^2\), em vez de ar? Esses valores são afetados pela altitude na Terra?
21. Por que um copo de\(\displaystyle 40.0ºC\) água colocado em uma câmara de vácuo começa a ferver quando a câmara é evacuada (o ar é bombeado para fora da câmara)? A que pressão começa a ebulição? A comida cozinharia mais rápido em um copo assim?
22. Por que o álcool isopropílico evapora muito mais rapidamente do que a água no STP (temperatura e pressão padrão)?
Problemas e exercícios
13.1: Temperatura
23. Qual é a temperatura Fahrenheit de uma pessoa com\(\displaystyle 39.0ºC\) febre?
Solução
\(\displaystyle 102ºF\)
24. Os danos causados pela geada na maioria das plantas ocorrem em temperaturas iguais\(\displaystyle 28.0ºF\) ou inferiores. Qual é essa temperatura na escala Kelvin?
25. Para economizar energia, a temperatura ambiente é mantida\(\displaystyle 68.0ºF\) no inverno e\(\displaystyle 78.0ºF\) no verão. Quais são essas temperaturas na escala Celsius?
Solução
\(\displaystyle 20.0ºC\) e\(\displaystyle 25.6ºC\)
26. Um filamento de lâmpada de tungstênio pode operar a 2900 K. Qual é a temperatura Fahrenheit? O que é isso na escala Celsius?
27. A temperatura da superfície do Sol é de cerca de 5750 K. Qual é essa temperatura na escala Fahrenheit?
Solução
\(\displaystyle 9890ºF\)
28. Uma das temperaturas mais altas já registradas na superfície da Terra foi\(\displaystyle 134ºF\) no Vale da Morte, Califórnia. Qual é essa temperatura em graus Celsius? Qual é essa temperatura em Kelvin?
29. (a) Suponha que uma frente fria entre em seu local e diminua a temperatura em 40,0 graus Fahrenheit. Em quantos graus Celsius a temperatura diminui quando há uma\(\displaystyle 40.0ºF\) diminuição na temperatura?
(b) Mostre que qualquer mudança na temperatura em graus Fahrenheit é nove quintos da mudança em graus Celsius.
Solução
(a)\(\displaystyle 22.2ºC\)
(b)\(\displaystyle ΔT(ºF)=T_2(ºF)−T_1(ºF)\)
\(\displaystyle =\frac{9}{5}T_2(ºC)+32.0º−(\frac{9}{5}T_1(ºC)+32.0º)\)
\(\displaystyle =\frac{9}{5}(T_2(ºC)−T_1(ºC))=\frac{9}{5}ΔT(ºC)\)
30. (a) Em que temperatura as escalas Fahrenheit e Celsius têm o mesmo valor numérico?
(b) Em que temperatura as escalas Fahrenheit e Kelvin têm o mesmo valor numérico?
13.2: Expansão térmica de sólidos e líquidos
31. A altura do Monumento a Washington é medida em 170 m em um dia em que a temperatura está\(\displaystyle 35.0ºC\). Qual será sua altura em um dia em que a temperatura cair\(\displaystyle -10.0ºC\)? Embora o monumento seja feito de calcário, suponha que seu coeficiente de expansão térmica seja o mesmo do mármore.
Solução
169,95 m
32. Quanto mais alta fica a Torre Eiffel no final de um dia quando a temperatura aumenta\(\displaystyle 15ºC\)? Sua altura original é de 321 m e você pode assumir que é feito de aço.
33. Qual é a mudança no comprimento de uma coluna de mercúrio de 3,00 cm de comprimento se sua temperatura mudar de\(\displaystyle 37.0ºC\) para\(\displaystyle 40.0ºC\), supondo que o mercúrio seja irrestrito?
Solução
\(\displaystyle 5.4×10^{−6}m\)
34. Qual o tamanho da lacuna de expansão entre os trilhos ferroviários de aço se eles atingirem uma temperatura máxima\(\displaystyle 35.0ºC\) maior do que quando foram colocados? Seu comprimento original é de 10,0 m.
35. Você está pensando em comprar um pequeno pedaço de terra em Hong Kong. O preço é “apenas” $60.000 por metro quadrado! O título do terreno diz que as dimensões são\(\displaystyle 20m×30m\). Em quanto o preço total mudaria se você medisse o pacote com uma fita métrica de aço em um dia em que a temperatura estivesse\(\displaystyle 20ºC\) acima do normal?
Solução
Como a área fica menor, o preço da terra diminui em\(\displaystyle ~$17,000.\)
36. O aquecimento global produzirá aumento do nível do mar, em parte devido ao derretimento das calotas polares, mas também devido à expansão da água à medida que a temperatura média dos oceanos aumenta. Para ter uma ideia do tamanho desse efeito, calcule a mudança no comprimento de uma coluna de água de 1,00 km de altura para um aumento de temperatura de\(\displaystyle 1.00ºC\). Observe que esse cálculo é apenas aproximado porque o aquecimento do oceano não é uniforme com a profundidade.
37. Mostre que 60,0 L de gasolina originalmente a 15,0ºC tamanho 12 {"15" “.” 0°C} {} se expandirá para 61,1 L quando aquecer até 35,0ºC, tamanho 12 {"35" “.” 0°"C, "} {} conforme afirmado no exemplo.
Solução
\(\displaystyle V=V_0+ΔV=V_0(1+βΔT)\)
\(\displaystyle =(60.00 L)[1+(950×10^{−6}/ºC)(35.0ºC−15.0ºC)]\)
\(\displaystyle =61.1L\)
38. (a) Suponha que um medidor feito de aço e outro feito de invar (uma liga de ferro e níquel) tenham o mesmo comprimento em\(\displaystyle 0ºC\). Qual é a diferença de comprimento deles\(\displaystyle 22.0ºC\)?
(b) Repita o cálculo para duas fitas de inspeção de 30,0 m de comprimento.
39. (a) Se um copo de vidro de 500 ml for enchido até a borda com álcool etílico a uma temperatura de\(\displaystyle 5.00ºC\), quanto transbordará quando a temperatura atingir\(\displaystyle 22.0ºC\)?
(b) Quanto menos água transbordaria nas mesmas condições?
Solução
(a) 9,35 mL
(b) 7,56 mL
40. A maioria dos automóveis tem um reservatório de refrigerante para capturar o fluido do radiador que pode transbordar quando o motor está quente. Um radiador é feito de cobre e é preenchido até sua capacidade de 16,0 L quando está em\(\displaystyle 10.0ºC\). Qual volume de fluido do radiador transbordará quando o radiador e o fluido atingirem a temperatura\(\displaystyle 95.0ºC\) operacional, considerando que o coeficiente de expansão do volume do fluido é\(\displaystyle β=400×10^{–6}/ºC\)? Observe que esse coeficiente é aproximado, porque a maioria dos radiadores de automóveis tem temperaturas operacionais superiores\(\displaystyle 95.0ºC\) a.
41. Um físico faz uma xícara de café instantâneo e percebe que, à medida que o café esfria, seu nível cai 3,00 mm na xícara de vidro. Mostre que essa diminuição não pode ser devida à contração térmica calculando a diminuição\(\displaystyle 350cm^3\) do nível se o café estiver em uma xícara de 7,00 cm de diâmetro e diminuir a temperatura de\(\displaystyle 95.0ºC\) para\(\displaystyle 45.0ºC\). (A maior parte da queda de nível é, na verdade, devido à fuga de bolhas de ar.)
Solução
0,832 mm
42. (a) A densidade da água\(\displaystyle 0ºC\) é muito próxima\(\displaystyle 1000kg/m^3\) (na verdade é\(\displaystyle 999.84 kg/m^3\)), enquanto a densidade do gelo\(\displaystyle 0ºC\) é\(\displaystyle 917 kg/m^3\). Calcule a pressão necessária para evitar que o gelo se expanda ao congelar, negligenciando o efeito que uma pressão tão grande teria na temperatura de congelamento. (Esse problema fornece apenas uma indicação do tamanho das forças associadas ao congelamento da água.)
(b) Quais são as implicações desse resultado para as células biológicas que estão congeladas?
43. Mostre isso\(\displaystyle β≈3α\), calculando a variação no volume\(\displaystyle ΔV\) de um cubo com lados de comprimento\(\displaystyle L\).
Solução
Sabemos como o comprimento muda com a temperatura:\(\displaystyle ΔL=αL_0ΔT\). Também sabemos que o volume de um cubo está relacionado ao seu comprimento por\(\displaystyle V=L^3\), então o volume final é então\(\displaystyle V=V_0+ΔV=(L_0+ΔL)^3\). Substituindo\(\displaystyle ΔL\) doações
\(\displaystyle V=(L_0+αL_0ΔT)^3=L^3_0(1+αΔT)^3\).
Agora, por\(\displaystyle αΔT\) ser pequeno, podemos usar a expansão binomial:
\(\displaystyle V≈L^3_0(1+3αΔT)=L^3_0+3αL^3_0ΔT.\)
Então, escrever os termos de comprimento em termos de volumes dá\(\displaystyle V=V_0+ΔV≈V_0+3αV_0ΔT\), e assim
\(\displaystyle ΔV=βV_0ΔT≈3αV_0ΔT,\)ou\(\displaystyle β≈3α\).
13.3: A Lei do Gás Ideal
44. A pressão manométrica nos pneus do seu carro está\(\displaystyle 2.50×10^5N/m^2\) em uma temperatura de\(\displaystyle 35.0ºC\) quando você os dirige em uma balsa para o Alasca. Qual é a pressão manométrica deles mais tarde, quando a temperatura cai para\(\displaystyle –40.0ºC\)?
Solução
1.623 atm
45. Converta uma pressão absoluta\(\displaystyle 7.00×10^5N/m^2\) de em pressão manométrica em\(\displaystyle lb/in^2\). (Esse valor foi declarado como sendo um pouco menor do que\(\displaystyle 90.0 lb/in^2\) no Exemplo. É isso?)
46. Suponha que uma lâmpada incandescente cheia de gás seja fabricada de forma que o gás dentro da lâmpada esteja na pressão atmosférica quando a lâmpada tiver uma temperatura de\(\displaystyle 20.0ºC\).
(a) Encontre a pressão manométrica dentro dessa lâmpada quando ela estiver quente, assumindo que sua temperatura média seja\(\displaystyle 60.0ºC\) (uma aproximação) e negligenciando qualquer alteração no volume devido à expansão térmica ou vazamentos de gás.
(b) A pressão final real da lâmpada será menor do que a calculada na parte (a) porque a lâmpada de vidro se expandirá. Qual será a pressão final real, levando isso em consideração? Essa é uma diferença insignificante?
Solução
(a) 0,136 atm
(b) 0,135 atm. A diferença entre esse valor e o valor da parte (a) é insignificante.
47. Grandes balões cheios de hélio são usados para elevar equipamentos científicos a grandes altitudes.
(a) Qual é a pressão dentro de um balão desse tipo se ele começa no nível do mar com uma temperatura de\(\displaystyle 10.0ºC\) e sobe para uma altitude onde seu volume é vinte vezes o volume original e sua temperatura é\(\displaystyle –50.0ºC\)?
(b) Qual é a pressão manométrica? (Suponha que a pressão atmosférica seja constante.)
48. Confirme se as unidades de\(\displaystyle nRT\) são as de energia para cada valor de\(\displaystyle R\):
(a)\(\displaystyle 8.31J/mol⋅K\),
(b)\(\displaystyle 1.99 cal/mol⋅K\) e
(c)\(\displaystyle 0.0821 L⋅atm/mol⋅K\).
Solução
(a)\(\displaystyle nRT=(mol)(J/mol⋅K)(K)=J\)
(b)\(\displaystyle nRT=(mol)(cal/mol⋅K)(K)=cal\)
(c)\(\displaystyle nRT=(mol)(L⋅atm/mol⋅K)(K)\)
\(\displaystyle =L⋅atm=(m^3)(N/m^2)\)
\(\displaystyle =N⋅m=J\)
49. No texto, foi mostrado que\(\displaystyle N/V=2.68×10^{25}m^{−3}\) para o gás no STP.
(a) Mostre que essa quantidade é equivalente a\(\displaystyle N/V=2.68×10^{19}cm^{−3}\), conforme indicado.
(b) Sobre quantos átomos existem em um\(\displaystyle μm^3\) (um micrômetro cúbico) no STP?
(c) O que sua resposta à parte (b) implica sobre a separação de átomos e moléculas?
50. Calcule o número de toupeiras no volume de ar de 2,00 L nos pulmões de uma pessoa média. Observe que o ar está em\(\displaystyle 37.0ºC\) (temperatura corporal).
Solução
\(\displaystyle 7.86×10^{−2}mol\)
51. Um passageiro\(\displaystyle 100cm^3\) de avião tem ar no estômago pouco antes de decolar de um aeroporto no nível do mar. Qual volume o ar terá na altitude de cruzeiro se a pressão da cabine cair para\(\displaystyle 7.50×10^4N/m^2\)?
52. (a) Qual é o volume (in\(\displaystyle km^3\)) do número de grãos de areia da Avogadro se cada grão for um cubo e tiver lados com 1,0 mm de comprimento? (b) Quantos quilômetros de praias de comprimento isso cobriria se a praia tivesse uma média de 100 m de largura e 10,0 m de profundidade? Negligencie os espaços de ar entre os grãos.
Solução
(a)\(\displaystyle 6.02×10^5km^3\)
(b)\(\displaystyle 6.02×10^8km\)
53. Um sistema de vácuo caro pode atingir uma pressão tão baixa quanto\(\displaystyle 1.00×10^{–7}N/m^2\) a de\(\displaystyle 20ºC\). Quantos átomos existem em um centímetro cúbico nessa pressão e temperatura?
54. A densidade numérica dos átomos de gás em um determinado local no espaço acima do nosso planeta é de aproximadamente\(\displaystyle 1.00×10^{11}m^{−3}\), e a pressão está\(\displaystyle 2.75×10^{–10}N/m^2\) nesse espaço. Qual é a temperatura lá?
Solução
\(\displaystyle −73.9ºC\)
55. Um pneu de bicicleta tem uma pressão de a uma\(\displaystyle 7.00×10^5N/m^2\) temperatura de\(\displaystyle 18.0ºC\) e contém 2,00 L de gás. Qual será sua pressão se você soltar uma quantidade de ar com um volume de\(\displaystyle 100cm^3\) pressão atmosférica? Suponha que a temperatura e o volume do pneu perman
56. Um cilindro de gás de alta pressão contém 50,0 L de gás tóxico a uma pressão de\(\displaystyle 1.40×10^7N/m^2\) e uma temperatura de\(\displaystyle 25.0ºC\). Sua válvula vaza depois que o cilindro cai. O cilindro é resfriado até a temperatura do gelo seco (\(\displaystyle –78.5ºC\)) para reduzir a taxa de vazamento e a pressão para que possa ser reparado com segurança.
(a) Qual é a pressão final no tanque, assumindo uma quantidade insignificante de vazamentos de gás durante o resfriamento e que não há mudança de fase?
(b) Qual é a pressão final se um décimo do gás escapar?
(c) A que temperatura o tanque deve ser resfriado para reduzir a pressão para 1,00 atm (supondo que o gás não mude de fase e que não haja vazamento durante o resfriamento)?
(d) O resfriamento do tanque parece ser uma solução prática?
Solução
(a)\(\displaystyle 9.14×10^6N/m^2\)
(b)\(\displaystyle 8.23×10^6N/m^2\)
(c) 2,16 K
(d) No. A temperatura final necessária é muito baixa para ser facilmente alcançada em um objeto grande.
57. Encontre o número de moles em 2,00 L de gás à pressão\(\displaystyle 35.0ºC\) e abaixo\(\displaystyle 7.41×10^7N/m^2\) dela.
58. Calcule a profundidade na qual o número de bolas de tênis de mesa de Avogadro cobriria a Terra. Cada bola tem um diâmetro de 3,75 cm. Suponha que o espaço entre as bolas acrescente 25,0% extras ao seu volume e suponha que elas não sejam esmagadas por seu próprio peso.
Solução
41 km
59. (a) Qual é a pressão manométrica em um pneu de\(\displaystyle 25.0ºC\) carro contendo 3,60 mol de gasolina em um volume de 30,0 L?
(b) Qual será sua pressão manométrica se você adicionar 1,00 L de gás originalmente à pressão atmosférica e\(\displaystyle 25.0ºC\)? Suponha que a temperatura retorne\(\displaystyle 25.0ºC\) e o volume permaneça constante.
60. (a) No espaço profundo entre as galáxias, a densidade dos átomos é tão baixa quanto\(\displaystyle 10^6atoms/m^3\), e a temperatura é de 2,7 K. Qual é a pressão?
(b) Qual volume (in\(\displaystyle m^3\)) é ocupado por 1 mol de gás?
(c) Se esse volume for um cubo, qual é o comprimento de seus lados em quilômetros?
Solução
(a)\(\displaystyle 3.7×10^{−17}Pa\)
(b)\(\displaystyle 6.0×10^{17}m^3\)
(c)\(\displaystyle 8.4×10^2km\)
13.4: Teoria Cinética: Explicação Atômica e Molecular da Pressão e Temperatura
61. Algumas lâmpadas incandescentes são preenchidas com gás argônio. O que é\(\displaystyle v_{rms}\) para átomos de argônio próximos ao filamento, supondo que sua temperatura seja de 2500 K?
Solução
\(\displaystyle 1.25×10^3m/s\)
62. As velocidades atômicas e moleculares médias (\(\displaystyle v_{rms}\)) são grandes, mesmo em baixas temperaturas. O que é\(\displaystyle v_{rms}\) para átomos de hélio a 5,00 K, apenas um grau acima da temperatura de liquefação do hélio?
63. (a) Qual é a energia cinética média em joules de átomos de hidrogênio na\(\displaystyle 5500ºC\) superfície do Sol?
(b) Qual é a energia cinética média dos átomos de hélio em uma região da coroa solar onde está a temperatura\(\displaystyle 6.00×10^5K\)?
Solução
(a)\(\displaystyle 1.20×10^{−19}J\)
(b)\(\displaystyle 1.24×10^{−17}J\)
64. A velocidade de escape de qualquer objeto da Terra é de 11,2 km/s.
(a) Expresse essa velocidade em m/s e km/h.
(b) A que temperatura as moléculas de oxigênio (a massa molecular é igual a 32,0 g/mol) teriam uma velocidade média\(\displaystyle v_{rms}\) igual à velocidade de escape da Terra de 11,1 km/s?
65. A velocidade de escape da Lua é muito menor do que da Terra e é de apenas 2,38 km/s. A que temperatura as moléculas de hidrogênio (massa molecular é igual a 2,016 g/mol) teriam uma velocidade média\(\displaystyle v_{rms}\) igual à velocidade de escape da Lua?
Solução
\(\displaystyle 458K\)
66. A fusão nuclear, a fonte de energia do Sol, bombas de hidrogênio e reatores de fusão, ocorre muito mais facilmente quando a energia cinética média dos átomos é alta, ou seja, em altas temperaturas. Suponha que você queira que os átomos em seu experimento de fusão tenham energias cinéticas médias de\(\displaystyle 6.40×10^{–14}J\). Qual temperatura é necessária?
67. Suponha que a velocidade média (\(\displaystyle v_{rms}\)) das moléculas de dióxido de carbono (massa molecular é igual a 44,0 g/mol) em uma chama seja encontrada\(\displaystyle 1.05×10^5m/s\). Que temperatura isso representa?
Solução
\(\displaystyle 1.95×10^7K\)
68. As moléculas de hidrogênio (massa molecular é igual a 2,016 g/mol) têm uma velocidade média\(\displaystyle v_{rms}\) igual a 193 m/s. Qual é a temperatura?
69. Grande parte do gás próximo ao Sol é hidrogênio atômico. Sua temperatura teria que ser\(\displaystyle 1.5×10^7K\) para que a velocidade média fosse igual\(\displaystyle v_{rms}\) à velocidade de escape do Sol. O que é essa velocidade?
Solução
\(\displaystyle 6.09×10^5m/s\)
70. Existem dois isótopos importantes de urânio -\(\displaystyle ^{235}U\) e\(\displaystyle ^{238}U\); esses isótopos são quase idênticos quimicamente, mas têm massas atômicas diferentes. Só\(\displaystyle ^{235}U\) é muito útil em reatores nucleares. Uma das técnicas para separá-los (difusão de gás) é baseada nas diferentes velocidades médias\(\displaystyle v_{rms}\) do gás hexafluoreto de urânio,\(\displaystyle UF_6\).
(a) As massas moleculares para\(\displaystyle ^{235}U\)\(\displaystyle UF_6\) e\(\displaystyle ^{238}U\)\(\displaystyle UF_6\) são 349,0 g/mol e 352,0 g/mol, respectivamente. Qual é a proporção de suas velocidades médias?
(b) Em que temperatura suas velocidades médias difeririam em 1,00 m/s?
(c) Suas respostas a esse problema implicam que essa técnica pode ser difícil?
13.6: Umidade, evaporação e ebulição
71. O ar seco é 78,1% de nitrogênio. Qual é a pressão parcial do nitrogênio quando a pressão atmosférica é\(\displaystyle 1.01×10^5N/m^2\)?
Solução
\(\displaystyle 7.89×10^4Pa\)
72. (a) Em que está a pressão de vapor da água\(\displaystyle 20.0ºC\)?
(b) A que porcentagem de pressão atmosférica isso corresponde?
(c) Qual porcentagem do\(\displaystyle 20.0ºC\) ar é vapor de água se tiver 100% de umidade relativa? (A densidade do ar seco em\(\displaystyle 20.0ºC\) é\(\displaystyle 1.20kg/m^3\).)
73. As panelas de pressão aumentam a velocidade de cozimento elevando a temperatura de ebulição da água acima de seu valor à pressão atmosférica.
(a) Qual pressão é necessária para elevar o ponto de ebulição\(\displaystyle 120.0ºC\)?
(b) A que pressão manométrica isso corresponde?
Solução
(a)\(\displaystyle 1.99×10^5Pa\)
(b) 0,97 atm
74. (a) Em que temperatura a água ferve a uma altitude de 1500 m (cerca de 5000 pés) em um dia em que a pressão atmosférica está\(\displaystyle 8.59×10^4N/m^2\)?
(b) E a uma altitude de 3000 m (cerca de 10.000 pés) quando a pressão atmosférica é\(\displaystyle 7.00×10^4N/m^2\)?
75. Qual é a pressão atmosférica no topo do Monte. Everest em um dia em que a água ferve lá a uma temperatura de\(\displaystyle 70.0ºC\)?
Solução
\(\displaystyle 3.12×10^4Pa\)
76. Em um ponto nos altos Andes, a água ferve\(\displaystyle 80.0ºC\), reduzindo muito a velocidade de cozimento das batatas, por exemplo. O que é pressão atmosférica nesse local?
77. Qual é a umidade relativa em um\(\displaystyle 25.0ºC\) dia em que o ar contém\(\displaystyle 18.0g/m^3\) vapor d'água?
Solução
78,3%
78. Qual é a densidade do vapor de água\(\displaystyle g/m^3\) em um dia quente e seco no deserto quando a temperatura é\(\displaystyle 40.0ºC\) e a umidade relativa é de 6,00%?
79. Um mergulhador de alto mar deve respirar uma mistura gasosa que tenha a mesma pressão parcial de oxigênio do nível do mar, onde o ar seco contém 20,9% de oxigênio e tem uma pressão total de\(\displaystyle 1.01×10^5N/m^2\).
(a) Qual é a pressão parcial do oxigênio ao nível do mar?
(b) Se o mergulhador respirar uma mistura de gases a uma pressão de\(\displaystyle 2.00×10^6N/m^2\), qual porcentagem de oxigênio deveria ter a mesma pressão parcial de oxigênio do nível do mar?
Solução
(a)\(\displaystyle 2.12×10^4Pa\)
(b)\(\displaystyle 1.06%\)
80. A pressão de vapor da água em\(\displaystyle 40.0ºC\) é\(\displaystyle 7.34×10^3N/m^2\). Usando a lei do gás ideal, calcule a densidade do vapor de água\(\displaystyle g/m^3\) que cria uma pressão parcial igual a essa pressão de vapor. O resultado deve ser o mesmo que a densidade do vapor de saturação nessa temperatura (\(\displaystyle 51.1 g/m^3\)).
81. O ar nos pulmões humanos tem uma temperatura\(\displaystyle 37.0ºC\) e uma densidade de vapor de saturação de\(\displaystyle 44.0 g/m^3\).
(a) Se 2,00 L de ar forem expirados e ar muito seco inalado, qual é a perda máxima de vapor d'água pela pessoa?
(b) Calcule a pressão parcial do vapor de água com essa densidade e compare-a com a pressão de vapor de\(\displaystyle 6.31×10^3N/m^2\).
Solução
(a)\(\displaystyle 8.80×10^{−2}g\)
(b)\(\displaystyle 6.30×10^3Pa\); os dois valores são quase idênticos.
82. Se a umidade relativa for de 90,0% em uma manhã abafada de verão, quando a temperatura estiver\(\displaystyle 20.0ºC\), o que será no final do dia em que a temperatura estiver\(\displaystyle 30.0ºC\), supondo que a densidade do vapor d'água permaneça constante?
83. No final de um dia de outono, a umidade relativa é de 45,0% e a temperatura é\(\displaystyle 20.0ºC\). Qual será a umidade relativa naquela noite, quando a temperatura cair para\(\displaystyle 10.0ºC\), assumindo uma densidade constante do vapor de água?
Solução
82.3%
84. Pressão atmosférica no topo do Monte. O Everest é\(\displaystyle .30×10^4N/m^2\).
(a) Qual é a pressão parcial de oxigênio se for 20,9% do ar?
(b) Qual a porcentagem de oxigênio que um alpinista deve respirar para que sua pressão parcial seja a mesma do nível do mar, onde está a pressão atmosférica\(\displaystyle 1.01×10^5N/m^2\)?
(c) Um dos problemas mais graves para quem escala montanhas muito altas é a secagem extrema das passagens respiratórias. Por que essa secagem ocorre?
85. Qual é o ponto de orvalho (a temperatura na qual 100% de umidade relativa ocorreria) em um dia em que a umidade relativa do ar é de 39,0% a uma temperatura de\(\displaystyle 20.0ºC\)?
Solução
\(\displaystyle 4.77ºC\)
86. Em um determinado dia, a temperatura é\(\displaystyle 25.0ºC \) e a umidade relativa do ar é de 90,0%. Quantos gramas de água devem se condensar em cada metro cúbico de ar se a temperatura cair para\(\displaystyle 15.0ºC\)? Essa queda de temperatura pode, portanto, produzir forte orvalho ou neblina.
87. Conceitos integrados
O ponto de ebulição da água aumenta com a profundidade porque a pressão aumenta com a profundidade. Em que profundidade a água doce terá um ponto de ebulição de\(\displaystyle 150ºC\), se a superfície da água estiver ao nível do mar?
Solução
\(\displaystyle 38.3m\)
88. Conceitos integrados
(a) Em que profundidade na água doce é atingida a pressão crítica da água, uma vez que a superfície está ao nível do mar?
(b) A que temperatura essa água ferverá?
(c) É necessária uma temperatura significativamente mais alta para ferver a água em uma profundidade maior?
89. Conceitos integrados
Para ter uma ideia do pequeno efeito que a temperatura tem no princípio de Arquimedes, calcule a fração do peso de um bloco de cobre que é suportada pela força de empuxo na\(\displaystyle 0ºC\) água e compare essa fração com a fração suportada na\(\displaystyle 95.0ºC\) água.
Solução
\(\displaystyle \frac{(F_B/w_{Cu})}{(F_B/w_{Cu})′}=1.02\). A força de empuxo suporta quase exatamente a mesma quantidade de força no bloco de cobre em ambas as circunstâncias.
90. Conceitos integrados
Se você quiser cozinhar na água\(\displaystyle 150ºC\), precisará de uma panela de pressão que possa suportar a pressão necessária.
(a) Que pressão é necessária para que o ponto de ebulição da água seja tão alto?
(b) Se a tampa da panela de pressão tiver um disco de 25,0 cm de diâmetro, que força ela deve ser capaz de suportar nessa pressão?
91. Resultados irracionais
(a) Quantos moles por metro cúbico de um gás ideal existem a uma pressão de\(\displaystyle 1.00×10^{14}N/m^2\) e a\(\displaystyle 0ºC\)?
(b) O que não é razoável nesse resultado?
(c) Qual premissa ou suposição é responsável?
Solução
(a)\(\displaystyle 4.41×10^{10}mol/m^3\)
(b) É excessivamente grande.
(c) Em altas pressões como essas, a lei do gás ideal não pode mais ser aplicada. Como resultado, respostas irracionais surgem quando elas são usadas.
92. Resultados irracionais
(a) Um mecânico de automóveis afirma que uma haste de alumínio se encaixa frouxamente em seu orifício em um bloco de motor de alumínio porque o motor está quente e a haste está fria. Se o furo for 10,0% maior em diâmetro do que a\(\displaystyle 22.0ºC\) haste, em que temperatura a haste terá o mesmo tamanho do furo?
(b) O que não é razoável nessa temperatura? (c) Qual premissa é responsável?
93. Resultados irracionais
Diz-se que a temperatura dentro de uma explosão de supernova é\(\displaystyle 2.00×10^{13}K\).
(a) Qual seria a velocidade média\(\displaystyle v_{rms}\) dos átomos de hidrogênio?
(b) O que não é razoável nessa velocidade?
(c) Qual premissa ou suposição é responsável?
Solução
(a)\(\displaystyle 7.03×10^8m/s\) tamanho 12 {tamanho 11 {7 “.” “03" vezes “10" RSup {tamanho 8 {8}} `"m/s"}} {}
(b) A velocidade é muito alta - é maior que a velocidade da luz
(c) A suposição de que o hidrogênio dentro de uma supernova se comporta como uma ideia de gás é responsável, por causa da grande temperatura e densidade no núcleo de uma estrela. Além disso, quando uma velocidade maior que a velocidade da luz é obtida, a física clássica deve ser substituída pela relatividade, um assunto ainda não abordado.
94. Resultados irracionais
Suponha que a umidade relativa seja de 80% em um dia em que a temperatura esteja\(\displaystyle 30.0ºC\).
(a) Qual será a umidade relativa se o ar esfriar\(\displaystyle 25.0ºC\) e a densidade do vapor permanecer constante?
(b) O que não é razoável nesse resultado?
(c) Qual premissa é responsável?

