13.6: Umidade, evaporação e ebulição
- Page ID
- 194307
Objetivos de
Ao final desta seção, você poderá:
- Explique a relação entre a pressão de vapor da água e a capacidade do ar de reter o vapor de água.
- Explique a relação entre umidade relativa e pressão parcial do vapor de água no ar.
- Calcule a densidade do vapor usando pressão de vapor.
- Calcule a umidade e o ponto de orvalho.
A expressão “não é o calor, é a umidade” é um argumento válido. Nós nos refrescamos em climas quentes, evaporando o suor de nossa pele e a água de nossas vias respiratórias. Como a evaporação é inibida pela alta umidade, sentimos mais calor em uma determinada temperatura quando a umidade é alta. A baixa umidade, por outro lado, pode causar desconforto devido ao ressecamento excessivo das membranas mucosas e pode aumentar o risco de infecções respiratórias.

Figura\(\PageIndex{1}\): Gotas de orvalho como essas, em uma folha de bananeira fotografada logo após o nascer do sol, se formam quando a temperatura do ar cai para ou abaixo do ponto de orvalho. No ponto de orvalho, a taxa na qual as moléculas de água se unem é maior do que a taxa na qual elas se separam, e parte da água se condensa para formar gotículas. (crédito: Aaron Escobar, Flickr)
Quando dizemos umidade, na verdade queremos dizer umidade relativa. A umidade relativa nos diz quanto vapor de água está no ar em comparação com o máximo possível. No máximo, denotado como saturação, a umidade relativa é de 100% e a evaporação é inibida. A quantidade de vapor de água no ar depende da temperatura. Por exemplo, a umidade relativa aumenta à noite, à medida que a temperatura do ar diminui, às vezes atingindo o ponto de orvalho. Na temperatura do ponto de orvalho, a umidade relativa é de 100% e a neblina pode resultar da condensação das gotículas de água se elas forem pequenas o suficiente para permanecerem em suspensão. Por outro lado, se você deseja secar algo (talvez seu cabelo), é mais eficaz soprar ar quente sobre ele do que ar frio, porque, entre outras coisas, o aumento da temperatura aumenta a energia das moléculas, então a taxa de evaporação aumenta.
A quantidade de vapor de água no ar depende da pressão do vapor da água. As fases líquida e sólida estão continuamente liberando vapor porque algumas das moléculas têm velocidades altas o suficiente para entrar na fase gasosa; veja a Figura (a). Se uma tampa for colocada sobre o recipiente, como na Figura (b), a evaporação continua, aumentando a pressão, até que se acumule vapor suficiente para que a condensação equilibre a evaporação. Em seguida, o equilíbrio foi alcançado e a pressão de vapor é igual à pressão parcial da água no recipiente. A pressão do vapor aumenta com a temperatura porque as velocidades moleculares são mais altas à medida que a temperatura aumenta. A tabela fornece valores representativos da pressão do vapor de água em uma faixa de temperaturas.

A umidade relativa está relacionada à pressão parcial do vapor de água no ar. Com 100% de umidade, a pressão parcial é igual à pressão do vapor e nenhuma água pode entrar na fase de vapor. Se a pressão parcial for menor que a pressão do vapor, a evaporação ocorrerá, pois a umidade é inferior a 100%. Se a pressão parcial for maior que a pressão de vapor, ocorre condensação. Na linguagem cotidiana, as pessoas às vezes se referem à capacidade do ar de “reter” o vapor d'água, mas isso não é realmente o que acontece. O vapor de água não é retido pelo ar. A quantidade de água no ar é determinada pela pressão do vapor da água e não tem nada a ver com as propriedades do ar.
| Temperatura\(^oC\) | Pressão de vapor\((Pa)\) | Densidade do vapor de saturação\(g/m^3\) |
| −50 | 4.0 | 0,039 |
| -20 | \(1.04 \times 10^2\) | 0,89 |
| -10 | \(2.60 \times 10^2\) | 2,36 |
| 0 | \(6.10 \times 10^2\) | 4,84 |
| 5 | \(8.68 \times 10^2\) | 6,80 |
| 10 | \(1.19 \times 10^3\) | 9,40 |
| 15 | \(1.69 \times 10^3\) | 12,8 |
| 20 | \(2.33 \times 10^3\) | 17.2 |
| 25 | \(3.17 \times 10^3\) | 23,0 |
| 30 | \(4.24 \times 10^3\) | 30,4 |
| 37 | \(6.31 \times 10^3\) | 4,0 |
| 40 | \(7.34 \times 10^3\) | 51.1 |
| 50 | \(1.23 \times 10^4\) | 82.4 |
| 60 | \(1.99 \times 10^4\) | 130 |
| 70 | \(3.12 \times 10^4\) | 197 |
| 80 | \(4.73 \times 10^4\) | 294 |
| 90 | \(7.01 \times 10^4\) | 418 |
| 95 | \(8.59 \times 10^4\) | 505 |
| 100 | \(1.01 \times 10^5\) | 598 |
| 120 | \(1.99 \times 10^5\) | 1095 |
| 150 | \(4.76 \times 10^5\) | 2430 |
| 200 | \(1.55 \times 10^6\) | 7090 |
| 220 | \(2.32 \times 10^6\) | 10.200 |
Densidade do vapor de saturação da água
Exemplo\(\PageIndex{1}\): Calculating Density Using Vapor Pressure
A tabela fornece a pressão de vapor da água em. \(20.0^oC\)como\(2.33 \times 10^3 \, Pa\). Use a lei do gás ideal para calcular a densidade do vapor de água\(g/m^3\) que criaria uma pressão parcial igual a essa pressão de vapor. Compare o resultado com a densidade do vapor de saturação dada na tabela.
Estratégia
Para resolver esse problema, precisamos dividi-lo em duas etapas. A pressão parcial segue a lei do gás ideal,
\[PV = nRT,\]
onde\(n\) está o número de toupeiras. Se resolvermos essa equação para\(n/V\)
para calcular o número de moles por metro cúbico, podemos então converter essa quantidade em gramas por metro cúbico, conforme solicitado. Para fazer isso, precisamos usar a massa molecular da água, que é dada na tabela periódica.
Solução
1. Identifique os conhecidos e converta-os nas unidades adequadas:
- temperatura\(T = 20^oC = 203 \, K\)
- pressão\(P\) de vapor da água em\(20^oC\) é\(2.33 \times 10^3 \, Pa\)
- a massa molecular da água é\(18.0 \, g/m\)
2. Resolva a lei do gás ideal para\(n?V\).
\[\dfrac{n}{V} = \dfrac{P}{RT}\]
3. Substitua valores conhecidos na equação e resolva\(n/V\).
\[\dfrac{n}{V} = \dfrac{P}{RT} = \dfrac{2.33 \times 10^3 \, Pa}{(8.31 \, J/mol \cdot K)(293 \, K)} = 0.957 \, mol/m^3\]
4. Converta a densidade em moles por metro cúbico em gramas por metro cúbico.
\[\rho = \left(0.957\dfrac{mol}{m^3}\right)\left(\dfrac{18.0 \, g}{mol}\right) = 17.2 \, g/m^3\]
Discussão
A densidade é obtida assumindo uma pressão igual à pressão de vapor da água em\(20.0^oC\). A densidade encontrada é idêntica ao valor na Tabela, o que significa que uma densidade de vapor de\(17.2 \, g/m^3\) em\(20.9^oC\) cria uma pressão parcial de\(2.33 \times 10^3 \, Pa\), igual à pressão de vapor da água nessa temperatura. Se a pressão parcial for igual à pressão do vapor, as fases líquida e de vapor estarão em equilíbrio e a umidade relativa será de 100%. Assim, não pode haver mais do que 17,2 g de vapor de água por\(m^3\) at\(20.0^oC\), de modo que esse valor seja a densidade do vapor de saturação nessa temperatura. Este exemplo ilustra como o vapor de água se comporta como um gás ideal: a pressão e a densidade são consistentes com a lei do gás ideal (supondo que a densidade na tabela esteja correta). As densidades de vapor de saturação listadas na Tabela são as quantidades máximas de vapor de água que o ar pode reter em várias temperaturas.
Porcentagem de umidade relativa
Definimos a porcentagem de umidade relativa como a razão entre a densidade do vapor e a densidade do vapor de saturação, ou
\[percent \, relative \, humidity = \dfrac{vapor \, density}{saturation \, vapor \, density} \times 100\]
Podemos usar isso e os dados da Tabela para fazer uma variedade de cálculos interessantes, tendo em mente que a umidade relativa é baseada na comparação da pressão parcial do vapor de água no ar e no gelo.
Podemos usar isso e os dados da Tabela para fazer uma variedade de cálculos interessantes, tendo em mente que a umidade relativa é baseada na comparação da pressão parcial do vapor de água no ar e no gelo.
Exemplo\(\PageIndex{2}\): Calculating Humidity and Dew Point
(a) Calcule a porcentagem de umidade relativa em um dia em que a temperatura está\(25.0^oC\) e o ar contém 9,40 g de vapor por\(m^3\). (b) Em que temperatura esse ar atingirá 100% de umidade relativa (a densidade de saturação)? Essa temperatura é o ponto de orvalho. (c) Qual é a umidade quando a temperatura do ar é\(25.0^oC\) e o ponto de orvalho é\(-10.0^oC\)?
Estratégia e solução
(a) A porcentagem de umidade relativa é definida como a razão entre a densidade do vapor e a densidade do vapor de saturação.
\[percent \, relative \, humidity = \dfrac{vapor \, density}{saturation \, vapor \, density} \times 100\]
O primeiro é dado como sendo\(9.40 \, g/m^3\), e o segundo é encontrado na Tabela a ser\(23.0 \, g/m^3\). Assim,
\[percent \, relative \, humidity = \dfrac{9.40 \, g/m^3}{23.0 \, g/m^3} \times 100 = 40.9 \%\]
(b) O ar contém vapor\(9.40 \, g/m^3\) de água. A umidade relativa será de 100% em uma temperatura onde\(9.40 \, g/m^3\) está a densidade de saturação. A inspeção da Tabela revela que este é o caso em\(10.0^oC\),
onde a umidade relativa será de 100%. Essa temperatura é chamada de ponto de orvalho do ar com essa concentração de vapor de água.
(c) Aqui, a temperatura do ponto de orvalho é dada como sendo\(10.0^oC\). Usando a Tabela, vemos que a densidade do vapor é\(2.36 \, g/m^3\), porque esse valor é a densidade do vapor de saturação em\(-10.0^oC\). A densidade do vapor de saturação em\(25.0^oC\) é vista como sendo\(23.0 \, g/m^3\). Assim, a umidade relativa em\(25.0^oC\) é
\[percent \, relative \, humidity = \dfrac{2.36 \, g/m^3}{23.0 \, g/m^3} \times 100 = 10.3 \%\]
Discussão
A importância do ponto de orvalho é que a temperatura do ar não pode cair abaixo\(10.0^oC\) da parte (b) ou\(-10.0^oC\) da parte (c), sem que o vapor de água se condense do ar. Se ocorrer condensação, ocorre uma transferência considerável de calor (discutida em Métodos de transferência de calor e calor), o que evita que a temperatura caia ainda mais. Quando os pontos de orvalho estão abaixo\(0^oC\), as temperaturas de congelamento são uma possibilidade maior, o que explica por que os agricultores acompanham o ponto de orvalho. A baixa umidade nos desertos significa baixas temperaturas do ponto de orvalho. Portanto, a condensação é improvável. Se a temperatura cair, o vapor não se condensa em gotas líquidas. Como nenhum calor é liberado no ar, a temperatura do ar cai mais rapidamente em comparação com o ar com maior umidade. Da mesma forma, em altas temperaturas, as gotículas de líquido não evaporam, de modo que nenhum calor é removido do gás para a fase líquida. Isso explica a grande faixa de temperatura nas regiões áridas.
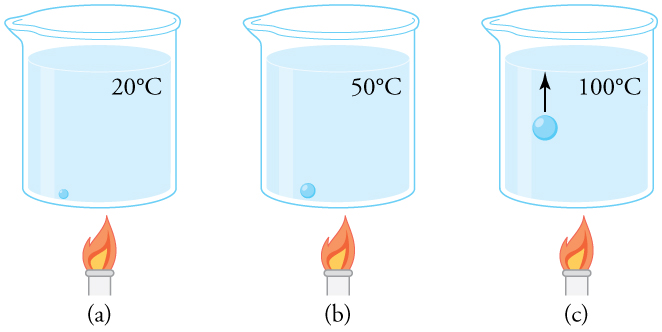
Por que a água ferve\(100^oC\)? Você notará na Tabela que a pressão de vapor da água\(100^oC\) é de\(1.01 \times 10^5 \, Pa\), ou 1,00 atm. Assim, ele pode evaporar sem limite nessa temperatura e pressão. Mas por que ela forma bolhas quando ferve? Isso ocorre porque a água normalmente contém quantidades significativas de ar dissolvido e outras impurezas, que são observadas como pequenas bolhas de ar em um copo de água. Se uma bolha começar no fundo do recipiente em\(20^oC\), ela contém vapor de água (cerca de 2,30%). A pressão dentro da bolha é fixada em 1,00 atm (ignoramos a leve pressão exercida pela água ao redor). Conforme a temperatura aumenta, a quantidade de ar na bolha permanece a mesma, mas o vapor de água aumenta; a bolha se expande para manter a pressão em 1,00 atm. Em\(100^oC\), o vapor de água entra na bolha continuamente, pois a pressão parcial da água é igual a 1,00 atm em equilíbrio. No entanto, ela não pode atingir essa pressão, pois a bolha também contém ar e a pressão total é de 1,00 atm. A bolha cresce em tamanho e, assim, aumenta a força de empuxo. A bolha se rompe e sobe rapidamente até a superfície — chamamos isso de ebulição! (Veja a Figura.)
Verifique sua compreensão
- A liofilização é um processo no qual substâncias, como alimentos, são secas colocando-as em uma câmara de vácuo e diminuindo a pressão atmosférica ao redor delas. Como a baixa pressão atmosférica acelera o processo de secagem e por que isso faz com que a temperatura dos alimentos caia?
[Ocultar solução]
A diminuição da pressão atmosférica resulta na diminuição da pressão parcial da água, daí uma menor umidade. Assim, a evaporação da água dos alimentos, por exemplo, será aprimorada. As moléculas de água com maior probabilidade de se separarem dos alimentos serão aquelas com as maiores velocidades. Os restantes, portanto, têm uma velocidade média mais baixa e uma temperatura mais baixa. Isso pode (e resulta) no congelamento e secagem dos alimentos; portanto, o processo é apropriadamente chamado de liofilização.
EXPLORAÇÕES DE PHET: ESTADOS DA MATÉRIA
Observe diferentes tipos de moléculas formarem um sólido, líquido ou gás. Adicione ou remova o calor e observe a mudança de fase. Altere a temperatura ou o volume de um recipiente e veja um diagrama de pressão-temperatura responder em tempo real. Relacione o potencial de interação com as forças entre as moléculas.

Resumo
- A umidade relativa é a fração do vapor de água em um gás em comparação com o valor de saturação.
- A densidade do vapor de saturação pode ser determinada a partir da pressão do vapor para uma determinada temperatura.
- A porcentagem de umidade relativa é definida como\[percent \, relative \, humidity = \dfrac{vapor \, density}{saturation \, vapor \, density} \times 100\%\]
- O ponto de orvalho é a temperatura na qual o ar atinge 100% de umidade relativa.
Glossário
- ponto de condensação
- a temperatura na qual a umidade relativa é de 100%; a temperatura na qual a água começa a se condensar para fora do ar
- saturação
- a condição de 100% de umidade relativa
- porcentagem de umidade relativa
- a relação entre a densidade do vapor e a densidade do vapor de saturação
- umidade relativa
- a quantidade de água no ar em relação à quantidade máxima que o ar pode reter


