11.8: Coesão e adesão em líquidos - tensão superficial e ação capilar
- Page ID
- 195271
Objetivos de
Ao final desta seção, você poderá:
- Entenda as forças coesivas e adesivas.
- Defina a tensão superficial.
- Entenda a ação capilar.
As crianças sopram bolhas de sabão e brincam com o spray de um aspersor em um dia quente de verão (Figura\(\PageIndex{1}\)). Uma aranha subaquática mantém seu suprimento de ar em uma bolha brilhante que ele carrega enrolada em volta dele. Um técnico retira sangue para um tubo de pequeno diâmetro apenas tocando-o até uma gota em um dedo picado. Um bebê prematuro luta para inflar seus pulmões. Qual é o fio condutor? Todas essas atividades são dominadas pelas forças de atração entre átomos e moléculas em líquidos — tanto dentro de um líquido quanto entre o líquido e seu entorno.

Forças de atração entre moléculas do mesmo tipo são chamadas de forças coesivas. Os líquidos podem, por exemplo, ser mantidos em recipientes abertos porque as forças coesivas mantêm as moléculas unidas. Forças de atração entre moléculas de diferentes tipos são chamadas de forças adesivas. Essas forças fazem com que gotas de líquido grudem nas vidraças das janelas, por exemplo. Nesta seção, examinamos os efeitos diretamente atribuíveis às forças coesivas e adesivas em líquidos.
Definição: Forças coesivas
Forças de atração entre moléculas do mesmo tipo são chamadas de forças coesivas.
Definição: Forças adesivas
Forças de atração entre moléculas de diferentes tipos são chamadas de forças adesivas.
Tensão superficial
As forças coesivas entre as moléculas fazem com que a superfície de um líquido se contraia até a menor área de superfície possível. Esse efeito geral é chamado de tensão superficial. As moléculas na superfície são puxadas para dentro por forças coesivas, reduzindo a área da superfície. As moléculas dentro do líquido experimentam força líquida zero, pois têm vizinhas em todos os lados.
Definição: Tensão superficial
As forças coesivas entre as moléculas fazem com que a superfície de um líquido se contraia até a menor área de superfície possível. Esse efeito geral é chamado de tensão superficial.
Tensão superficial
As forças entre átomos e moléculas estão por trás do efeito macroscópico chamado tensão superficial. Essas forças atrativas aproximam as moléculas e tendem a minimizar a área da superfície. Esse é outro exemplo de explicação submicroscópica para um fenômeno macroscópico.
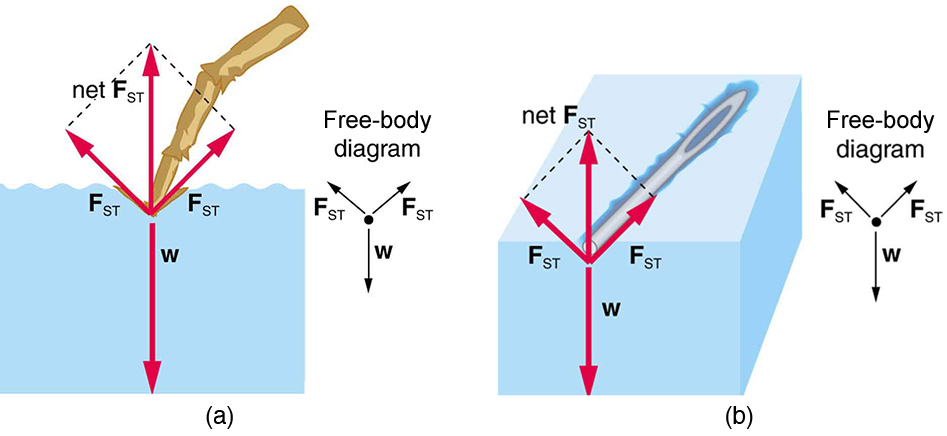
O modelo de uma superfície líquida agindo como uma folha elástica esticada pode explicar efetivamente os efeitos da tensão superficial. Por exemplo, alguns insetos podem andar sobre a água (em vez de flutuar nela) como nós andaríamos em um trampolim — eles amassam a superfície, conforme mostrado na Figura\(\PageIndex{2a}\). A figura\(\PageIndex{2b}\) mostra outro exemplo, em que uma agulha repousa sobre a superfície da água. A agulha de ferro não pode e não flutua, porque sua densidade é maior que a da água. Em vez disso, seu peso é suportado por forças na superfície esticada que tentam torná-la menor ou mais plana. Se a agulha fosse colocada apontada para baixo na superfície, seu peso atuando em uma área menor quebraria a superfície e ela afundaria.
A tensão superficial é proporcional à força da força coesiva, que varia com o tipo de líquido. A tensão superficial\(\overline{\gamma}\) é definida como a força F por unidade de comprimento\(L\) exercida por uma membrana líquida esticada:
\[\gamma = \dfrac{F}{L}.\]
A tabela\(\PageIndex{1}\) lista os valores de\(\overline{\gamma}\) para alguns líquidos.
| Líquido | Tensão superficial γ (N/m) |
|---|---|
| Água em\(0^oC\) | 0,0756 |
| Água em\(20^oC\) | 0,0728 |
| Água em\(100^OC\) | 0,0589 |
| Água com sabão (típica) | 0,0370 |
| Álcool etílico | 0,0223 |
| Glicerina | 0,0631 |
| Mercúrio | 0,465 |
| Azeite | 0,032 |
| Fluidos de tecido (típicos) | 0,050 |
| Sangue, gordura inteira\(37^oC\) | 0,058 |
| Plasma sanguíneo em\(37^oC\) | 0,073 |
| Ouro em\(1070^oC\) | 1.000 |
| Oxigênio em\(-193^oC\) | 0,0157 |
| Hélio em\(-269^oC\) | 0,00012 |
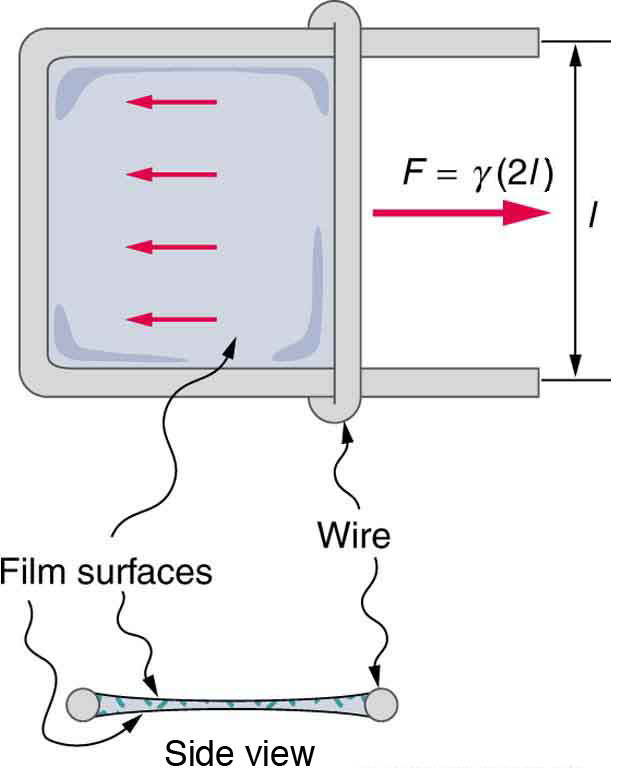
Para o inseto da Figura Figura\(\PageIndex{1a}\), seu peso\(w\) é suportado pelos componentes ascendentes da força de tensão superficial:\(w = \gamma L \sin \theta\), onde\(L\) está a circunferência do pé do inseto em contato com a água. A figura\(\PageIndex{3}\) mostra uma maneira de medir a tensão superficial. O filme líquido exerce uma força sobre o fio móvel na tentativa de reduzir sua área de superfície. A magnitude dessa força depende da tensão superficial do líquido e pode ser medida com precisão.
A tensão superficial é a razão pela qual os líquidos formam bolhas e gotículas. A força de tensão da superfície interna faz com que as bolhas sejam aproximadamente esféricas e eleva a pressão do gás preso no interior em relação à pressão atmosférica externa. Pode-se mostrar que a pressão manométrica\(P \) dentro de uma bolha esférica é dada por
\[P = \dfrac{4\gamma}{r},\]
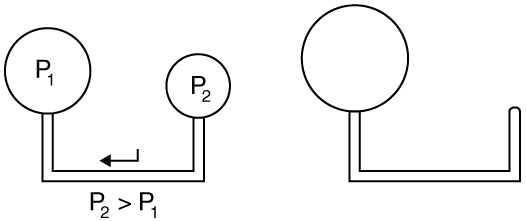
onde\(r\) está o raio da bolha. Assim, a pressão dentro de uma bolha é maior quando a bolha é menor. Outra evidência disso é ilustrada na Figura\(\PageIndex{4}\). Quando é permitido que o ar flua entre dois balões de tamanho desigual, o balão menor tende a entrar em colapso, enchendo o balão maior.
Exemplo\(\PageIndex{1}\): Surface Tension: Pressure Inside a Bubble
Calcule a pressão manométrica dentro de uma bolha de sabão\(2.00 \times 10^{-4} m\) em raio usando a tensão superficial da água com sabão na tabela. Converta essa pressão em mm Hg.
Estratégia
O raio é dado e a tensão superficial pode ser encontrada na Tabela, e assim\(P\) pode ser encontrada diretamente na equação\(P = \frac{4\gamma}{r}\).
Solução
\(\gamma\)Substituindo\(r\) e nesta equação\(P = \frac{4\gamma}{r}\), obtemos
\[P = \dfrac{4\gamma}{r} = \dfrac{4(0.037 \, N/m)}{2.00 \times 10^{-4}m} = 740 \, N/m^2 = 740 \, Pa.\]
Usamos um fator de conversão para obter isso em unidades de mm Hg:
\[P = (740 \, N/m^2)\dfrac{1.00 \, mm \, Hg}{133 \, N/m^2} = 5.56 \, mm \, Hg.\]
Discussão
Observe que, se um furo fosse feito na bolha, o ar seria forçado a sair, a bolha diminuiria em raio e a pressão manométrica reduziria para zero, e a pressão absoluta interna diminuiria para a pressão atmosférica (760 mm Hg).
Nossos pulmões contêm centenas de milhões de sacos revestidos de muco chamados alvéolos, que são muito semelhantes em tamanho e cerca de 0,1 mm de diâmetro. (Veja a Figura.) Você pode expirar sem ação muscular, permitindo que a tensão superficial contraia esses sacos. Pacientes médicos cuja respiração é auxiliada por um respirador de pressão positiva têm ar soprado para os pulmões, mas geralmente podem expirar sozinhos. Mesmo que haja paralisia, a tensão superficial nos alvéolos expelirá o ar dos pulmões. Como a pressão aumenta à medida que os raios dos alvéolos diminuem, uma respiração de limpeza profunda ocasional é necessária para reinflar completamente os alvéolos. Os respiradores são programados para fazer isso e achamos natural, assim como nossos cães e gatos de companhia, respirar bem antes de dormir.
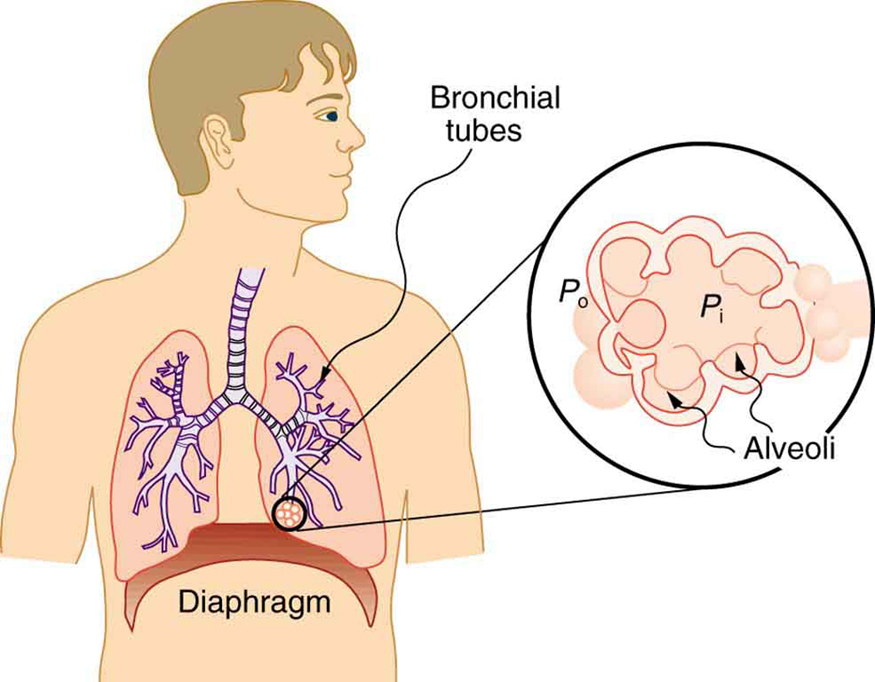
A tensão nas paredes dos alvéolos resulta do tecido da membrana e de um líquido nas paredes dos alvéolos contendo uma lipoproteína longa que atua como um surfactante (uma substância redutora da tensão superficial). A necessidade do surfactante resulta da tendência de pequenos alvéolos entrarem em colapso e de o ar penetrar nos alvéolos maiores, tornando-os ainda maiores (conforme demonstrado na Figura). Durante a inalação, as moléculas de lipoproteína são separadas e a tensão da parede aumenta à medida que o raio aumenta (aumento da tensão superficial). Durante a expiração, as moléculas voltam a se unir e a tensão superficial diminui, ajudando a evitar o colapso dos alvéolos. O surfactante, portanto, serve para alterar a tensão da parede para que pequenos alvéolos não colapsem e alvéolos grandes sejam impedidos de se expandir demais. Essa mudança de tensão é uma propriedade exclusiva desses surfactantes e não é compartilhada pelos detergentes (que simplesmente diminuem a tensão superficial). (Veja a Figura.)
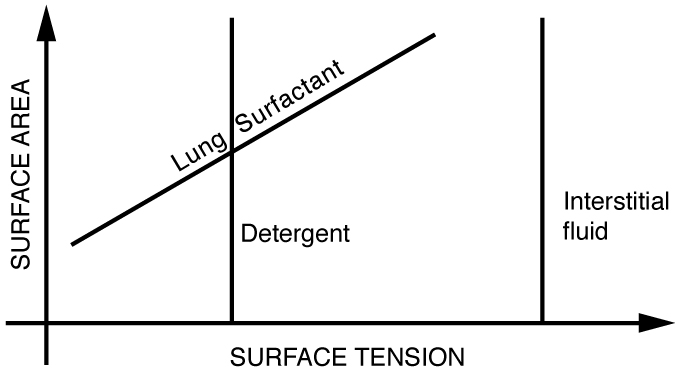
Se a água entrar nos pulmões, a tensão superficial é muito grande e você não pode inalar. Esse é um problema grave na ressuscitação de vítimas de afogamento. Um problema semelhante ocorre em recém-nascidos que nascem sem esse surfactante — seus pulmões são muito difíceis de inflar. Essa condição é conhecida como doença da membrana hialina e é a principal causa de morte de bebês, particularmente em partos prematuros. Algum sucesso foi alcançado no tratamento da doença da membrana hialina por meio da pulverização de um surfactante nas vias respiratórias do bebê. O enfisema produz o problema oposto com os alvéolos. As paredes alveolares das vítimas de enfisema se deterioram e os sacos se combinam para formar sacos maiores. Como a pressão produzida pela tensão superficial diminui com o aumento do raio, esses sacos maiores produzem pressão menor, reduzindo a capacidade das vítimas do enfisema de expirar. Um teste comum para o enfisema é medir a pressão e o volume de ar que pode ser expirado.
Fazendo conexões: investigação para levar para casa
- Experimente colocar uma agulha de costura na água. Para que essa atividade funcione, a agulha precisa estar bem limpa, pois até mesmo o óleo dos dedos pode ser suficiente para afetar as propriedades da superfície da agulha.
- Coloque as cerdas de um pincel na água. Puxe a escova para fora e observe que, por um curto período, as cerdas ficarão grudadas. A tensão superficial da água ao redor das cerdas é suficiente para mantê-las unidas. À medida que as cerdas secam, o efeito da tensão superficial se dissipa.
- Coloque um laço de linha na superfície da água sem gás de forma que toda a linha entre em contato com a água. Observe a forma do laço. Agora coloque uma gota de detergente no meio do laço. O que acontece com o formato do laço? Por quê?
- Polvilhe pimenta na superfície da água. Adicione uma gota de detergente. O que acontece? Por quê?
- Flutue dois fósforos paralelamente um ao outro e adicione uma gota de detergente entre eles. O que acontece? Nota: Para cada novo experimento, a água precisa ser substituída e a tigela lavada para liberá-la de qualquer detergente residual.
Adesão e ação capilar
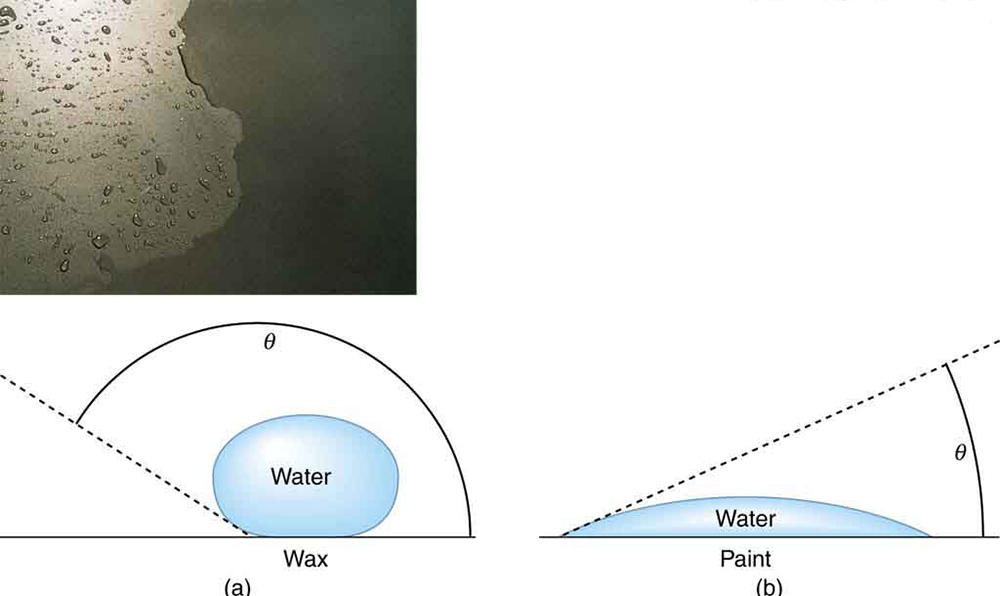
Por que a água se espalha em um carro encerado, mas não na tinta nua? A resposta é que as forças adesivas entre a água e a cera são muito menores do que as entre a água e a tinta. A competição entre as forças de adesão e coesão é importante no comportamento macroscópico dos líquidos. Um fator importante no estudo das funções dessas duas forças é o ângulo\(\theta\) entre a tangente à superfície do líquido e a superfície (Figura\(\PageIndex{7}\)). O ângulo de contato\(\theta\) está diretamente relacionado à força relativa das forças coesivas e adesivas. Quanto maior a força da força coesiva em relação à força adesiva, maior\(\theta\) é e mais o líquido tende a formar uma gotícula. Quanto menor\(\theta\) for, menor será a resistência relativa, de modo que a força adesiva seja capaz de nivelar a queda. A tabela lista os ângulos de contato para várias combinações de líquidos e sólidos.
Definição: Ângulo de contato
O ângulo\(\theta\) entre a tangente à superfície do líquido e a superfície é chamado de ângulo de contato.
Um fenômeno importante relacionado à força relativa das forças coesivas e adesivas é a ação capilar — a tendência de um fluido ser elevado ou suprimido em um tubo estreito ou tubo capilar. Essa ação faz com que o sangue seja aspirado para um tubo de pequeno diâmetro quando o tubo toca uma gota.
Ação capilar
A tendência de um fluido ser elevado ou suprimido em um tubo estreito, ou tubo capilar, é chamada de ação capilar.
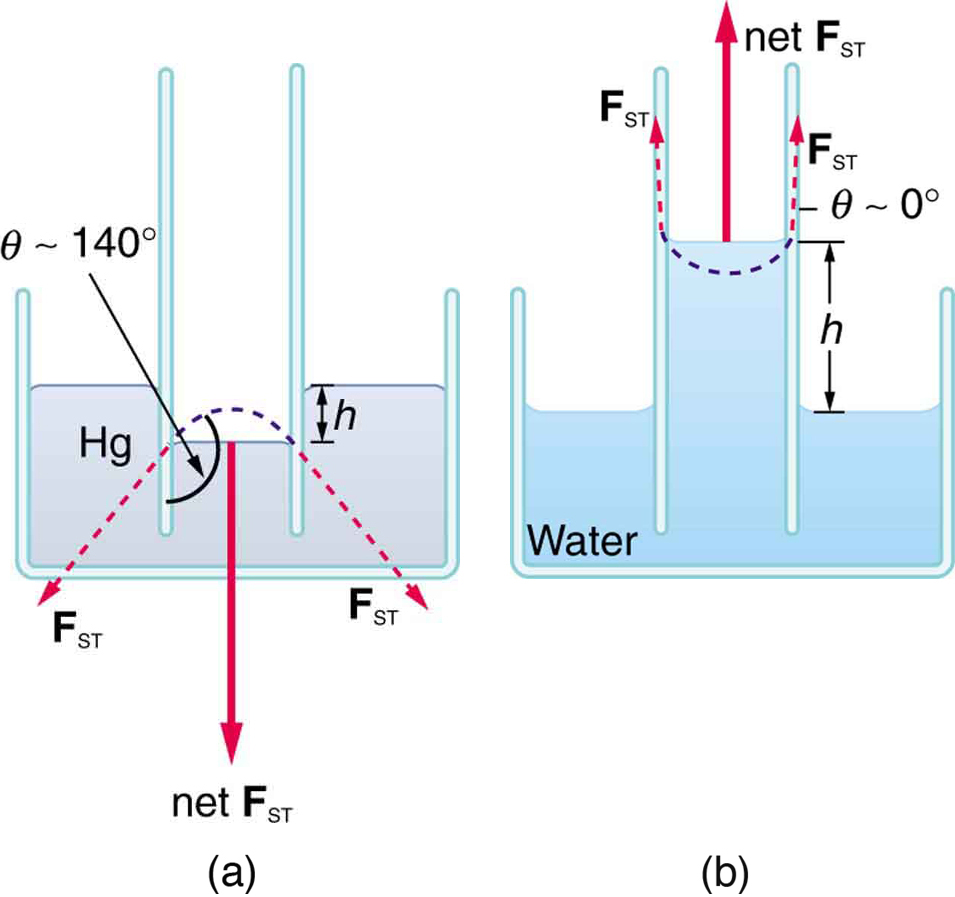
Se um tubo capilar for colocado verticalmente em um líquido, conforme mostrado na Figura, a ação capilar aumentará ou suprimirá o líquido dentro do tubo, dependendo da combinação de substâncias. O efeito real depende da força relativa das forças coesivas e adesivas e, portanto, do ângulo de contato\(\theta\) dado na tabela. Se\(\theta\) for menor\(90^o\), então o fluido será elevado; se\(\theta\) for maior do que\(90^o\), será suprimido. O mercúrio, por exemplo, tem uma tensão superficial muito grande e um grande ângulo de contato com o vidro. Quando colocada em um tubo, a superfície de uma coluna de mercúrio se curva para baixo, como uma gota. A superfície curva de um fluido em um tubo é chamada de menisco. A tendência da tensão superficial é sempre reduzir a área da superfície. A tensão superficial, portanto, achata a superfície curva do líquido em um tubo capilar. Isso resulta em uma força descendente no mercúrio e uma força ascendente na água, como visto na Figura.
| Interface | Ângulo de contato\(\phi\) |
|---|---|
| Vidro de mercúrio | \ (\ phi\)” style="text-align:center; ">\(140^o\) |
| Copo de água | \ (\ phi\)” style="text-align:center; ">\(0^o\) |
| Água e parafina | \ (\ phi\)” style="text-align:center; ">\(107^o\) |
| Prata aquática | \ (\ phi\)” style="text-align:center; ">\(90^o\) |
| Líquidos orgânicos (a maioria) - vidro | \ (\ phi\)” style="text-align:center; ">\(0^o\) |
| Álcool etílico em vidro | \ (\ phi\)” style="text-align:center; ">\(0^o\) |
| Vidro de querosene | \ (\ phi\)” style="text-align:center; ">\(26^o\) |
A ação capilar pode mover líquidos horizontalmente por distâncias muito grandes, mas a altura até a qual ele pode elevar ou suprimir um líquido em um tubo é limitada por seu peso. Pode-se mostrar que essa altura\(h\) é dada por
\[h = \dfrac{2\gamma \cos \theta}{\rho gr}.\]
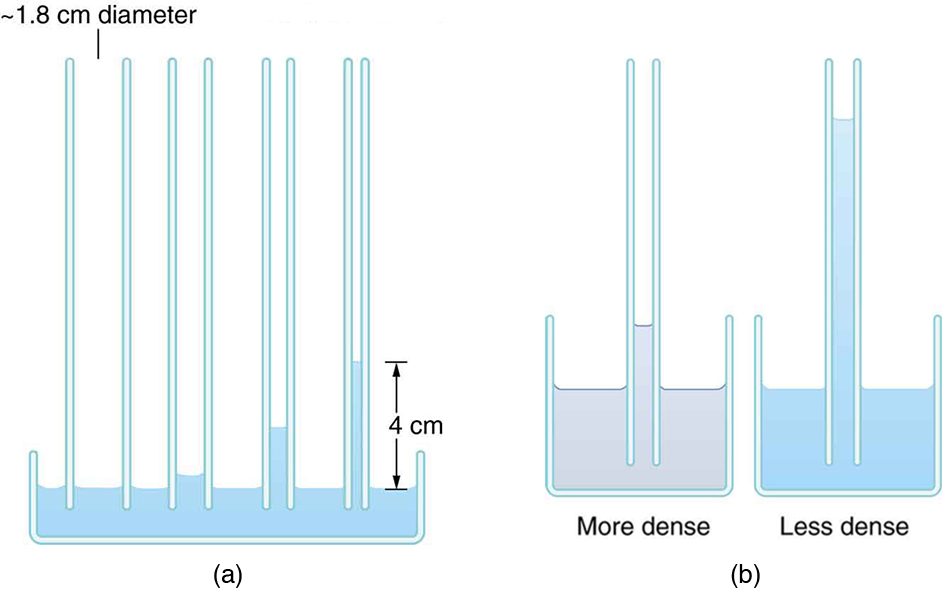
Se observarmos os diferentes fatores dessa expressão, poderemos ver como isso faz sentido. A altura é diretamente proporcional à tensão superficial\(\gamma\), que é sua causa direta. Além disso, a altura é inversamente proporcional ao raio do tubo — quanto menor o raio, maior o fluido pode ser elevado, já que um tubo menor retém menos massa. A altura também é inversamente proporcional à densidade do fluido, pois uma densidade maior significa uma massa maior no mesmo volume. (Veja a Figura.)
Exemplo\(\PageIndex{2}\): Calculating Radius of a Capillary Tube: Capillary Action: Tree Sap
A ação capilar pode ser a única responsável pelo crescimento da seiva nas árvores? Para responder a essa pergunta, calcule o raio de um tubo capilar que elevaria a seiva 100 m até o topo de uma sequóia gigante, assumindo que a densidade da seiva é\(1050 \, kg/m^3\), seu ângulo de contato é zero e sua tensão superficial é a mesma da água em\(20.0^oC\).
Estratégia
A altura até a qual um líquido subirá como resultado da ação capilar é dada por\(h = \frac{2\gamma \cos \theta}{\rho gr}\), e cada quantidade é conhecida, exceto por\(r\).
Solução
Resolver\(r\) e substituir valores conhecidos produz
\[r = \dfrac{2\gamma \cos \theta}{\rho gh} = \dfrac{2(0.0728 \, N/m)cos(0^o)}{(1050 \, kg/m^3)(9.80 \, m/s^2)(100 \, m)}\]
\[= 1.41 \times 10^{-7} \, m.\]
Discussão
Esse resultado não é razoável. A seiva nas árvores se move através do xilema, que forma tubos com raios tão pequenos quanto\(2.5 \times 10^{-7} \, m.\) Esse valor é cerca de 180 vezes maior que o raio encontrado aqui, necessário para elevar a seiva\(100 m\). Isso significa que a ação capilar por si só não pode ser a única responsável pela seiva chegar ao topo das árvores.
Como a seiva chega ao topo das árvores altas? (Lembre-se de que uma coluna de água só pode atingir uma altura de 10 m quando há vácuo na parte superior — veja [link].) A questão não foi completamente resolvida, mas parece que é puxada para cima como uma corrente unida por forças coesas. À medida que cada molécula de seiva entra em uma folha e evapora (um processo chamado transpiração), toda a cadeia é puxada um pouco para cima. Portanto, uma pressão negativa criada pela evaporação da água deve estar presente para puxar a seiva pelos vasos do xilema. Na maioria das situações, os fluidos podem empurrar, mas podem exercer apenas uma tração insignificante, porque as forças coesivas parecem ser muito pequenas para manter as moléculas firmemente unidas. Mas neste caso, a força coesiva das moléculas de água fornece uma força muito forte. A figura mostra um dispositivo para estudar a pressão negativa. Alguns experimentos demonstraram que pressões negativas suficientes para puxar a seiva até o topo das árvores mais altas podem ser alcançadas.
Resumo
- Forças de atração entre moléculas do mesmo tipo são chamadas de forças coesivas.
- Forças de atração entre moléculas de diferentes tipos são chamadas de forças adesivas.
- As forças coesivas entre as moléculas fazem com que a superfície de um líquido se contraia até a menor área de superfície possível. Esse efeito geral é chamado de tensão superficial.
- A ação capilar é a tendência de um fluido ser levantado ou suprimido em um tubo estreito, ou tubo capilar, devido à força relativa das forças coesivas e adesivas.
Glossário
- forças adesivas
- as forças de atração entre moléculas de diferentes tipos
- ação capilar
- a tendência de um fluido ser levantado ou abaixado em um tubo estreito
- forças coesas
- as forças de atração entre moléculas do mesmo tipo
- ângulo de contato
- o ângulo\(θ\) entre a tangente à superfície do líquido e a superfície
- tensão superficial
- as forças de coesão entre as moléculas que fazem com que a superfície de um líquido se contraia até a menor área de superfície possível


