7.2: Matéria
- Page ID
- 172330
A matéria é a “coisa” encontrada nos ecossistemas. Tecnicamente, matéria é definida como qualquer coisa que ocupe espaço ou tenha massa. Massa é resistência à aceleração. Simplificando, a massa é semelhante ao peso, mas o peso é responsável pela aceleração devido à gravidade. A matéria se move entre os componentes bióticos e abióticos do ecossistema por meio de ciclos biogeoquímicos. A compreensão completa desses ciclos requer um pano de fundo nas partículas que compõem a matéria, os átomos.
Átomos e moléculas
Elementos são substâncias que não podem ser decompostas ou transformadas quimicamente em outras substâncias (figura\(\PageIndex{a}\)). Um total de 118 elementos foram definidos; no entanto, apenas 92 ocorrem naturalmente e menos de 30 são encontrados em organismos. Os 26 elementos restantes são instáveis e, portanto, não existem por muito tempo ou são teóricos e ainda não foram detectados. Cada elemento é designado por seu símbolo químico (como H, N, O, C e Na) e possui propriedades únicas. Essas propriedades exclusivas permitem que os elementos se combinem e se unam entre si de maneiras específicas.
Um átomo é o menor componente de um elemento que retém todas as propriedades químicas desse elemento. Por exemplo, um átomo de hidrogênio tem todas as propriedades do elemento hidrogênio, como ele existe como um gás à temperatura ambiente e se liga ao oxigênio para criar uma molécula de água. Os átomos de hidrogênio não podem ser divididos em nada menor, mantendo as propriedades do hidrogênio. Se um átomo de hidrogênio fosse dividido em partículas menores, ele não teria mais as propriedades do hidrogênio. No nível mais básico, todos os organismos são feitos de uma combinação de elementos. Eles contêm átomos que se combinam para formar moléculas. As moléculas podem interagir para formar células, as unidades estruturais e funcionais da vida. Em organismos multicelulares, como animais, essas células se combinam para formar tecidos, que compõem os órgãos. Essas combinações continuam até que organismos multicelulares inteiros sejam formados.
Os átomos se combinam para formar moléculas. As moléculas são substâncias químicas feitas de dois ou mais átomos unidos. Algumas moléculas são muito simples, como O 2, que é composto por apenas dois átomos de oxigênio. Algumas moléculas usadas pelos organismos, como o DNA, são feitas de muitos milhões de átomos. Todos os átomos contêm prótons, elétrons e nêutrons (figura\(\PageIndex{b}\)). A única exceção é o hidrogênio (H), que normalmente é feito apenas de um próton e um elétron. Um próton é uma partícula carregada positivamente que reside no núcleo (o núcleo do átomo) de um átomo e tem uma massa de 1 e uma carga de +1. Um elétron é uma partícula carregada negativamente que viaja no espaço ao redor do núcleo. Em outras palavras, ele reside fora do núcleo. Tem uma massa insignificante e uma carga de -1. Os nêutrons, como os prótons, residem no núcleo de um átomo. Eles têm uma massa de 1 e nenhuma carga. As cargas positivas (prótons) e negativas (elétrons) se equilibram em um átomo neutro, que tem uma carga líquida zero.
Cada elemento contém um número diferente de prótons e nêutrons, dando a ele seu próprio número atômico e número de massa. O número atômico de um elemento é igual ao número de prótons que esse elemento contém. O número de massa é o número de prótons mais o número de nêutrons desse elemento. Portanto, é possível determinar o número de nêutrons subtraindo o número atômico do número de massa.
Ligações químicas
A forma como os elementos interagem uns com os outros depende do número de elétrons e de como eles estão dispostos. Quando um átomo não contém números iguais de prótons e elétrons, ele é chamado de íon. Como o número de elétrons não é igual ao número de prótons, cada íon tem uma carga líquida. Por exemplo, se o sódio perder um elétron, agora ele tem 11 prótons e apenas 10 elétrons, deixando-o com uma carga geral de +1. Os íons positivos são formados pela perda de elétrons e são chamados de cátions. Os íons negativos são formados pelo ganho de elétrons e são chamados de ânions. Os nomes aniônicos elementares são alterados para terminar em -ide. Por exemplo, quando o cloro se torna um íon, é chamado de cloreto.
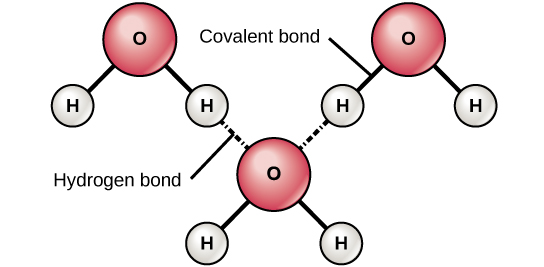
Ligações iônicas e covalentes são fortes ligações formadas entre dois átomos. Essas ligações mantêm os átomos juntos em um estado relativamente estável. Ligações iônicas são formadas entre dois íons de carga oposta (um ânion e um cátion). Como as cargas positivas e negativas se atraem, esses íons são mantidos juntos da mesma forma que dois ímãs de carga oposta ficariam juntos. Ligações covalentes se formam quando os elétrons são compartilhados entre dois átomos. Cada átomo compartilha um de seus elétrons, que então orbita os núcleos de ambos os átomos, mantendo os dois átomos juntos. As ligações covalentes são a forma mais forte e comum de ligação química nos organismos. Ao contrário da maioria das ligações iônicas, as ligações covalentes não se dissociam na água. As ligações de hidrogênio se formam quando as moléculas têm uma distribuição desigual de elétrons e, portanto, têm extremidades parcialmente positivas e parcialmente negativas. Eles são, portanto, atraídos um pelo outro (figura\(\PageIndex{c}\)). Tecnicamente, as ligações de hidrogênio ocorrem apenas entre hidrogênio e oxigênio (O), nitrogênio (N) ou flúor (F). Às vezes, ligações de hidrogênio conectam diferentes partes ou moléculas grandes, como é o caso do DNA e das proteínas. As ligações de hidrogênio são mais fracas do que as ligações iônicas e covalentes e podem se romper facilmente. (Observe que as ligações de hidrogênio estão entre as forças intermoleculares mais fortes, aquelas que ocorrem entre as moléculas, no entanto.)
Macromoléculas biológicas
Os organismos contêm moléculas orgânicas grandes chamadas macromoléculas biológicas. As moléculas orgânicas são aquelas que contêm carbono ligado covalentemente ao hidrogênio. (Em contraste, as moléculas inorgânicas não têm carbono ligado ao hidrogênio e geralmente são mais simples do que as orgânicas.) Além disso, eles podem conter oxigênio, nitrogênio, fósforo, enxofre e elementos adicionais. Existem quatro classes principais de macromoléculas biológicas: carboidratos, lipídios, proteínas e ácidos nucléicos. Cada um é um componente importante da célula e executa uma ampla variedade de funções.
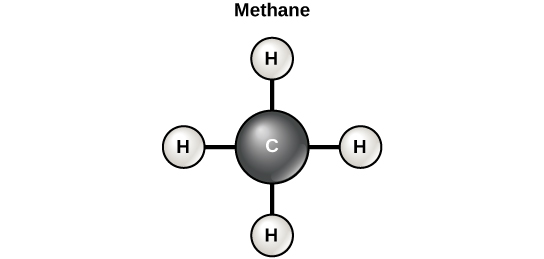
Costuma-se dizer que a vida é “baseada em carbono”. Isso significa que os átomos de carbono, ligados a outros átomos de carbono ou outros elementos, formam os componentes fundamentais de muitas das moléculas encontradas exclusivamente nos seres vivos. Outros elementos desempenham papéis importantes nas moléculas biológicas, mas o carbono certamente se qualifica como o elemento “fundamental” das moléculas nos seres vivos. São as propriedades de ligação dos átomos de carbono que são responsáveis por seu importante papel. O carbono pode formar quatro ligações covalentes com outros átomos ou moléculas. A molécula de carbono orgânico mais simples é o metano (CH 4), no qual quatro átomos de hidrogênio se ligam a um átomo de carbono (figura\(\PageIndex{d}\)).
Os carboidratos incluem o que é comumente chamado de açúcares simples, como glicose, e carboidratos complexos, como o amido. Embora muitos tipos de carboidratos sejam usados como energia, alguns são usados como estrutura pela maioria dos organismos, incluindo plantas e animais. Por exemplo, a celulose é um carboidrato complexo que adiciona rigidez e força à camada externa das células vegetais (as paredes celulares).
Os lipídios incluem um grupo diversificado de compostos que são unidos por uma característica comum: os lipídios são insolúveis em água. Os lipídios desempenham muitas funções diferentes em uma célula. As células armazenam energia para uso a longo prazo na forma de lipídios chamados gorduras. Os lipídios também fornecem isolamento do meio ambiente para plantas e animais. Por exemplo, eles ajudam a manter os pássaros e mamíferos aquáticos secos devido à sua natureza que repele a água. Os lipídios também são os blocos de construção de muitos hormônios e são um componente importante das membranas que envolvem as células e formam muitas de suas estruturas internas.
As proteínas são uma das moléculas orgânicas mais abundantes nos sistemas vivos e têm a mais diversa gama de funções de todas as macromoléculas. Eles são todos polímeros de aminoácidos. As funções das proteínas são muito diversas porque existem 20 aminoácidos quimicamente distintos diferentes que formam cadeias longas, e os aminoácidos podem estar em qualquer ordem. As proteínas podem funcionar em reações químicas facilitadas nos organismos, como a fotossíntese, transmitindo mensagens como hormônios, fazendo com que os músculos se contraiam e muito mais.
Os ácidos nucléicos são moléculas muito grandes que são importantes para a continuidade da vida. Eles carregam o projeto genético de uma célula e, portanto, as instruções para sua funcionalidade. Os dois principais tipos de ácidos nucléicos são o ácido desoxirribonucléico (DNA) e o ácido ribonucléico (RNA). O DNA é o material genético encontrado em todos os organismos, desde bactérias unicelulares até mamíferos multicelulares. O outro tipo de ácido nucléico, o RNA, está envolvido principalmente na síntese de proteínas. O DNA e o RNA são compostos de pequenos blocos de construção conhecidos como nucleotídeos. O DNA tem uma bela estrutura de dupla hélice (Figura\(\PageIndex{e}\)).


