7.4: 蛋白质
- Page ID
- 200276
学习目标
- 描述氨基酸的基本结构
- 描述蛋白质的化学结构
- 总结蛋白质的独特特征
在本章开头,描述了一项著名的实验,在该实验中,科学家们在模拟我们所知道的生命进化之前很久就存在于地球上的氨基酸的条件下合成了氨基酸。 这些化合物基本上能够以任意数量结合在一起,产生基本上任何大小的分子,这些分子具有广泛的物理和化学特性,并具有对所有生物至关重要的许多功能。 源自氨基酸的分子可以充当细胞和亚细胞实体的结构成分、营养来源、原子和能量储存库,以及激素、酶、受体和转运分子等功能物种。
氨基酸和肽键
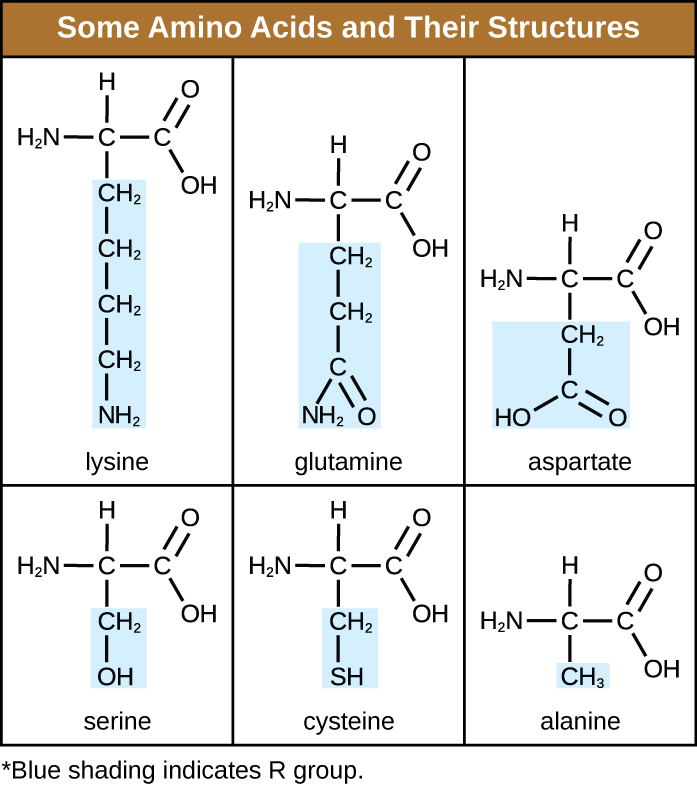
氨基酸是一种有机分子,其中氢原子、羧基(—COOH)和氨基(—NH 2)都与同一个碳原子(即所谓的α碳)结合。 与α碳结合的第四组因不同的氨基酸而异,被称为残基或侧链,在结构公式中用字母 R 表示。 残留物是两个或多个氨基酸结合并去除水分子时产生的单体。 蛋白质的主要结构,即肽链,由氨基酸残基组成。 官能团和 R 基团的独特特征允许氨基酸的这些成分形成氢键、离子键和二硫键,以及形成二级、三级和四元蛋白结构所需的极性/非极性相互作用。 这些基团主要由碳、氢、氧、氮和硫组成,其形式为碳氢化合物、酸、酰胺、醇和胺。 图中提供了一些说明这些可能性的示例\(\PageIndex{1}\)。
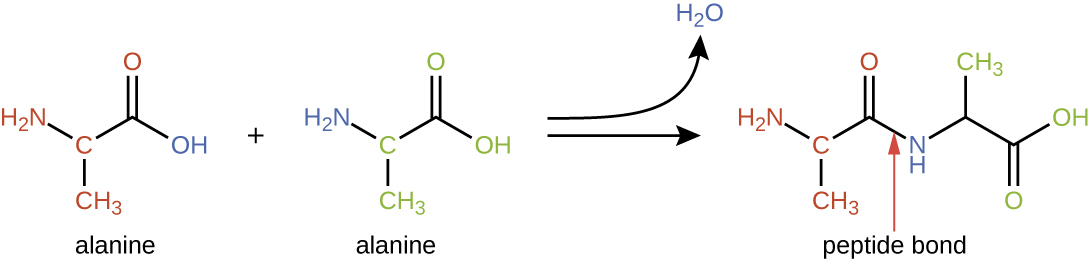
氨基酸可以通过一个分子的羧酸基团与另一个分子的胺基团发生反应而化学结合在一起。 这种反应形成肽键和水分子,是脱水合成的又一个例子(图\(\PageIndex{2}\))。 通过化学连接相对较少数量的氨基酸(大约 50 个或更少)而形成的分子被称为肽,前缀通常用于指定这些数字:二肽(两个氨基酸)、三肽(三个氨基酸)等。 更笼统地说,氨基酸的大致数量是指定的:寡肽是通过结合多达约20个氨基酸形成的,而多肽则由多达大约50个氨基酸合成。 当连接在一起的氨基酸数量变得非常多,或者当使用多个多肽作为建筑亚基时,由此产生的大分子称为蛋白质。 这些生物聚合物的长度是连续可变的(单体数量),加上每种氨基酸上可能存在各种各样的 R 基团,使得可能形成的蛋白质类型具有几乎无限的多样性。
练习\(\PageIndex{1}\)
多肽中有多少氨基酸?
蛋白质结构
蛋白质的大小(长度)和特定的氨基酸序列是其形状的主要决定因素,蛋白质的形状对其功能至关重要。 例如,在生物固氮过程中(参见 Bi ogeochem ical Cycles),统称为根瘤菌的土壤微生物与大豆、花生或豆类等豆类植物的根部共生相互作用,在植物根部形成一种称为结节的新结构。 然后,该植物会产生一种叫做 leghemoglobin 的载体蛋白,一种携带氮气或氧气的蛋白质。 Leghemoglobin 在形状和氨基酸序列合适的蛋白质特定区域(活性位点)与其底物氧气具有很高的亲和力。 如果活性位点的形状或化学环境发生变化,即使是轻微的改变,底物也可能无法那么强地结合,或者根本无法结合。 因此,要使蛋白质完全活跃,它必须具有与其功能相适应的形状。
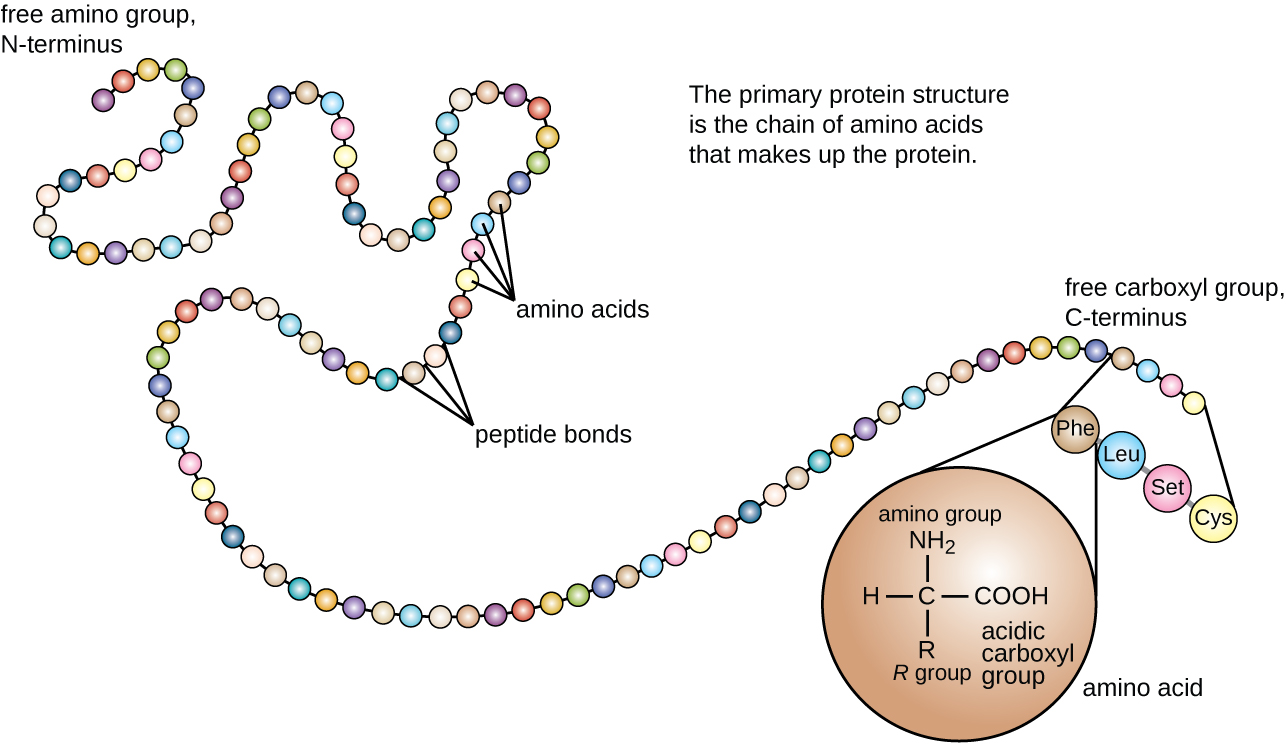
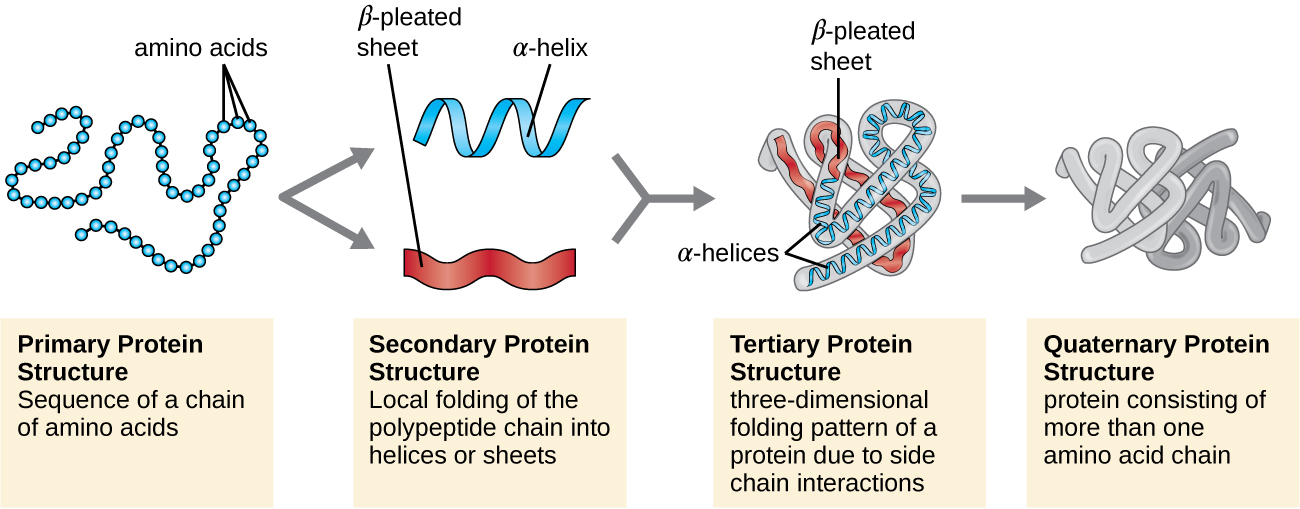
蛋白质结构分为四个级别:初级、二级、三级和四级。 初级结构就是构成多肽链的氨基酸序列。 该图\(\PageIndex{3}\)描绘了蛋白质的主要结构。
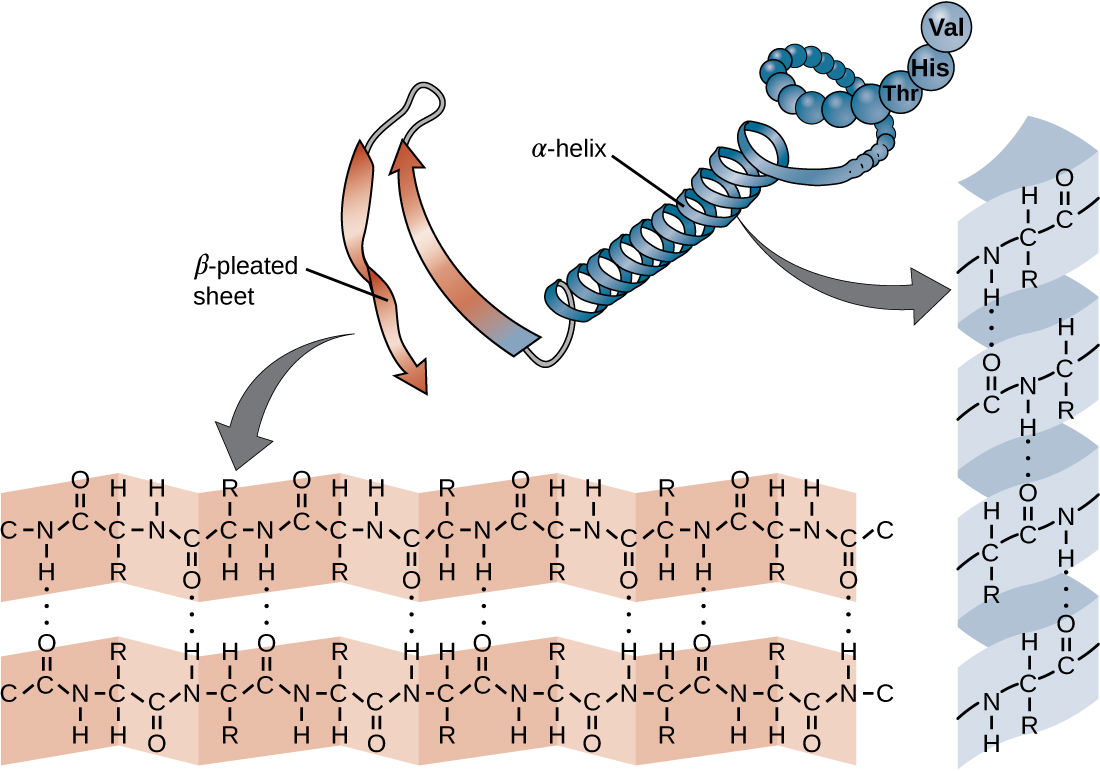
定义蛋白质初级结构的氨基酸链不是刚性的,而是灵活的,因为将氨基酸结合在一起的键的性质。 当链足够长时,肽骨架内的胺和羰基官能团(不包括 R 侧基团)之间可能发生氢键,从而导致多肽链局部折叠成螺旋和片状。 这些形状构成了蛋白质的二级结构。 最常见的二级结构是 α-Helix 和 β 褶板。 在 α-螺旋结构中,螺旋由一个氨基酸的羰基中的氧原子与链上只有四个氨基酸单位的氨基的氢原子之间的氢键保持。 在 β 褶片中,褶皱由连续的羰基和氨基序列之间的相似氢键形成,这些序列在多肽链的骨干上进一步分离(图\(\PageIndex{4}\))。
蛋白质组织的下一个层次是三级结构,即单个多肽链的大规模三维形状。 三级结构由链中相距较远的氨基酸残基之间的相互作用决定。 多种相互作用产生蛋白质三级结构,例如二硫化物桥,它们是氨基酸侧基上磺酰基 (—SH) 官能团之间的键;氢键;离子键;以及非极性侧链之间的疏水相互作用。 所有这些相互作用,无论是弱的还是强的,共同决定了蛋白质的最终三维形状及其功能(图\(\PageIndex{5}\))。
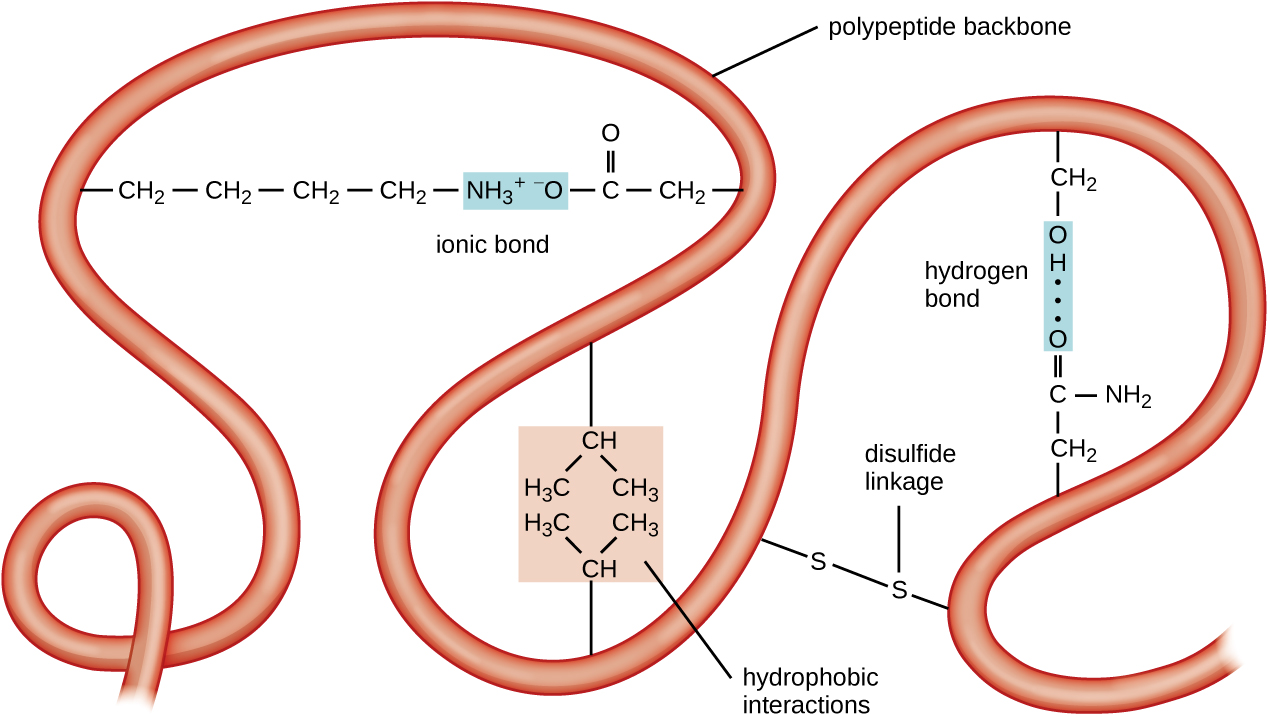
多肽链呈现大规模、三维形状的过程称为蛋白质折叠。 据说在正常生物学作用中完全起作用的折叠蛋白具有天然结构。 当蛋白质失去其三维形状时,它可能不再起作用。 这些展开的蛋白质是变性的。 变性意味着二级结构和三级结构(如果存在的话,还有第四纪结构)的丧失,而初级结构的丧失。
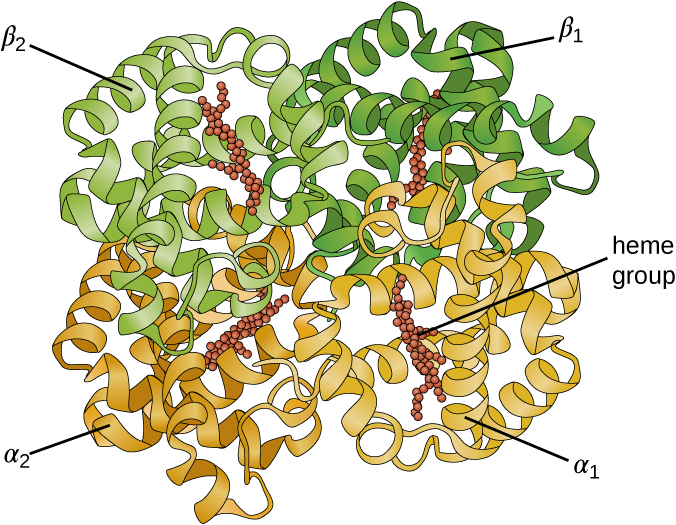
有些蛋白质是几种独立多肽的组合,也称为蛋白质亚单位。 只有当所有亚基都存在且配置得当时,这些蛋白质才能充分发挥作用。 将这些亚单位凝聚在一起的相互作用构成了蛋白质的第四纪结构。 相对较弱的相互作用稳定了整个四元结构。 例如,血红蛋白具有四个球状蛋白亚基的四元结构:两个 α 和两个 β 多肽,每个都含有铁基血红素(图\(\PageIndex{6}\))。
另一类重要的蛋白质是具有非蛋白质部分的共轭蛋白。 如果共轭蛋白附有碳水化合物,则称为糖蛋白。 如果它附有脂质,则称为脂蛋白。 这些蛋白质是膜的重要成分。 图中\(\PageIndex{7}\)总结了蛋白质结构的四个级别。
练习\(\PageIndex{2}\)
如果蛋白质的一级、二级、三级或四级结构发生变化,会发生什么?
初级结构、功能失调的蛋白质和囊性纤维化
与生物膜相关的蛋白质分为外在的或内在的。 外在蛋白,也称为外周蛋白,与膜的一侧松散地相关。 内在蛋白质或整体蛋白质嵌入膜中,通常作为跨膜蛋白作为转运系统的一部分发挥作用。 囊性纤维化(CF)是一种由跨膜蛋白变化引起的人类遗传疾病。 它主要影响肺部,但也可能影响胰腺、肝脏、肾脏和肠道。 CF 是由囊性纤维化跨膜蛋白(CFTR)中氨基酸苯丙氨酸的流失引起的。 一种氨基酸的流失会改变蛋白质的初级结构,这种蛋白质通常有助于将盐和水输送进和运出细胞(图\(\PageIndex{8}\))。
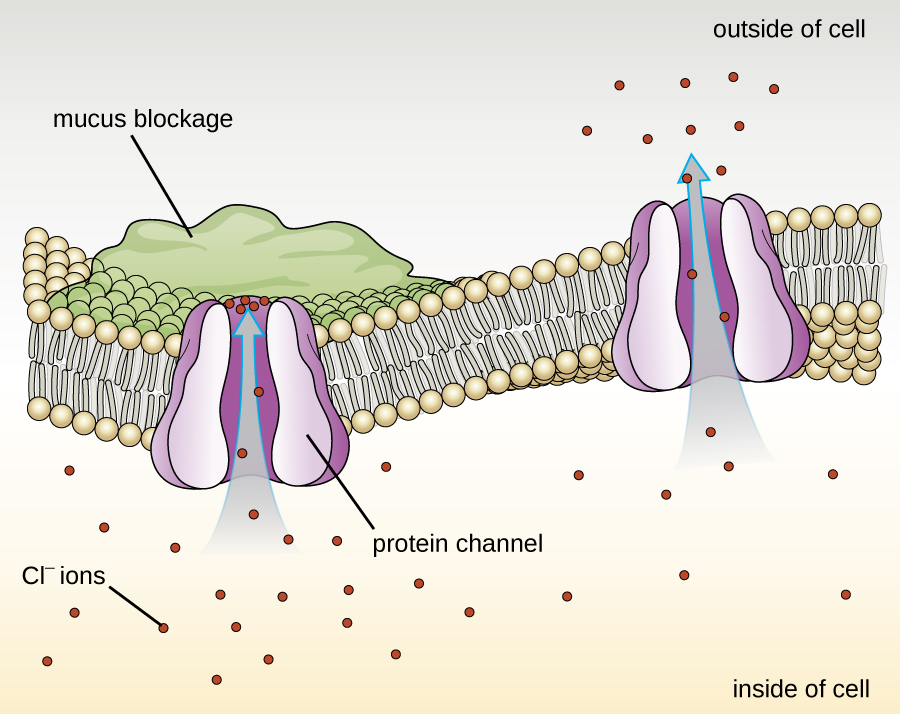
初级结构的变化使蛋白质无法正常运作,这会导致人体产生异常浓稠的粘液,阻塞肺部并导致粘稠粘液的积聚。 粘液阻塞胰腺,阻止天然酶帮助人体分解食物和吸收重要营养。
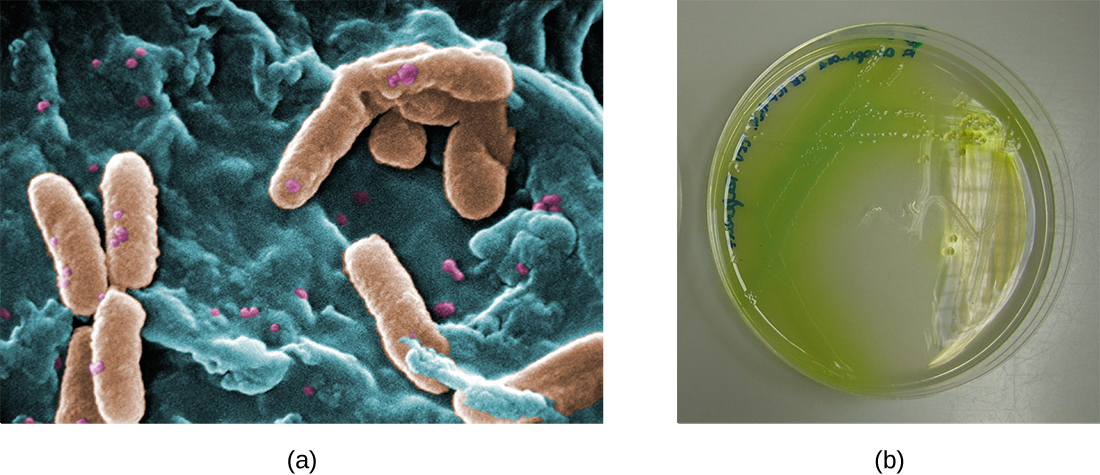
在囊性纤维化患者的肺部,改变的粘液为细菌提供了繁殖的环境。 这种定植导致肺部小气道中生物膜的形成。 囊性纤维化患者肺部最常见的病原体是铜绿假单胞菌(图\(\PageIndex{9}\))和洋葱伯克霍尔德菌。 假单胞菌在肺部的生物膜内分化并形成大型菌落,称为 “粘液样假单胞菌”。 菌落具有独特的色素沉着,可在实验室检查中出现(图\(\PageIndex{9}\)),为医生提供了患者患有 CF 的第一条线索(这种菌落在健康个体中很少见)。
有关囊性纤维化的更多信息,请访问囊性纤维化基金会网站。
关键概念和摘要
- 氨基酸是所有生命必需的小分子。 每种都有一个 α 碳,氢原子、羧基和胺基与之结合。 以 R 表示的第四个键基团在不同氨基酸的化学成分、大小、极性和电荷方面各不相同,从而提供了不同的性质。
- 肽是由氨基酸通过脱水合成连接形成的聚合物。 连接的氨基酸之间的键称为肽键。 连接在一起的氨基酸的数量可能从几个到多个不等。
- 蛋白质是由大量氨基酸连接形成的聚合物。 它们在细胞中发挥许多重要功能,充当营养素和酶;储存碳、氮和能量的分子;以及结构成分。
- 蛋白质的结构是其功能的关键决定因素,通过分级分类来描述:初级、次级、三级和四级。 蛋白质的原生结构可能会被变性所破坏,导致其高阶结构和生物学功能丧失。
- 有些蛋白质是由几个单独的蛋白质亚单位形成的,这些亚单位的相互作用构成了蛋白质复合物的第四级结构。
- 共轭蛋白具有非多肽部分,该部分可以是碳水化合物(形成糖蛋白)或脂质部分(形成脂蛋白)。 这些蛋白质是膜的重要成分。


