3.E : La première loi de la thermodynamique (exercice)
- Page ID
- 190997
Questions conceptuelles
3.2 Systèmes thermodynamiques
1. Examinez ces scénarios et déterminez si le travail est effectué par le système sur l'environnement (SE) ou par l'environnement sur le système (ES) :
a) ouvrir une boisson gazeuse ;
b) le remplissage d'un pneu crevé ;
c) un bidon de gaz vide scellé se dilate par temps chaud et s'incline contre les murs.
3.3 Travail, chaleur et énergie interne
2. Est-il possible de déterminer si une modification de l'énergie interne est causée par la chaleur transférée, par le travail effectué ou par une combinaison des deux ?
3. Lorsqu'un liquide est vaporisé, sa variation d'énergie interne n'est pas égale à la chaleur ajoutée. Pourquoi ?
4. Pourquoi une pompe à vélo est-elle chaude lorsque vous gonflez votre pneu ?
5. Est-il possible que la température d'un système reste constante lorsque de la chaleur entre ou sort de celui-ci ? Dans l'affirmative, donnez des exemples.
3.4 Première loi de la thermodynamique
6. Que nous apprend la première loi de la thermodynamique sur l'énergie de l'univers ?
7. L'ajout de chaleur à un système augmente-t-il toujours son énergie interne ?
8. Beaucoup d'efforts, de temps et d'argent ont été consacrés à la recherche d'une machine dite à mouvement perpétuel, définie comme une machine hypothétique qui fonctionne ou produit un travail utile indéfiniment et/ou une machine hypothétique qui produit plus de travail ou d'énergie qu'elle n'en consomme. Expliquez, en fonction de la première loi de la thermodynamique, pourquoi ou pourquoi une telle machine est susceptible d'être construite.
3.5 Processus thermodynamiques
9. Lorsqu'un gaz se dilate de manière isotherme, il fonctionne. Quelle est la source d'énergie nécessaire pour effectuer ce travail ?
10. Si la pression et le volume d'un système sont donnés, la température est-elle toujours déterminée de manière unique ?
11. Il est peu probable qu'un procédé puisse être isotherme à moins qu'il ne s'agisse d'un processus très lent. Expliquez pourquoi. Est-ce qu'il en va de même pour les processus isobariques et isochoriques ? Expliquez votre réponse.
3.6 Capacités thermiques d'un gaz idéal
12. Comment un objet peut-il transférer de la chaleur s'il ne possède pas une quantité discrète de chaleur ?
13. La plupart des matériaux se dilatent lorsqu'ils Une exception notable est l'eau entre 0 °C et 4 °C, dont le volume diminue en fait avec l'augmentation de la température. Qu'est-ce qui est le plus élevé pour l'eau dans cette région de température,\(\displaystyle C_p\) ou\(\displaystyle C_V\) ?
14. Pourquoi existe-t-il deux chaleurs spécifiques pour les gaz\(\displaystyle C_p\) et\(\displaystyle C_V\) une seule pour les solides ?
3.7 Procédés adiabatiques pour un gaz idéal
15. Est-il possible que γ soit inférieur à l'unité ?
16. Vous attendriez-vous à ce que γ soit plus grand pour un gaz ou un solide ? Expliquez.
17. Il n'y a aucun changement dans l'énergie interne d'un gaz idéal soumis à un processus isotherme puisque l'énergie interne dépend uniquement de la température. Est-il donc exact de dire qu'un processus isotherme est identique à un processus adiabatique pour un gaz idéal ? Expliquez votre réponse.
18. Un gaz fonctionne-t-il lorsqu'il se dilate adiabatiquement ? Dans l'affirmative, quelle est la source d'énergie nécessaire pour effectuer ces travaux ?
Des problèmes
3.2 Systèmes thermodynamiques
19. Un gaz suit\(\displaystyle pV=bp+c_T\) une courbe isotherme, où p est la pression, V est le volume, b est une constante et c est une fonction de la température. Montrez qu'une échelle de température selon un processus isochore peut être établie avec ce gaz et qu'elle est identique à celle d'un gaz idéal.
20. Une mole de gaz possède un coefficient de dilatation isobare\(\displaystyle dV/dT=R/p\) et un coefficient pression-température isochore\(\displaystyle dp/dT=p/T\). Trouvez l'équation de l'état du gaz.
21. Déterminez l'équation d'état d'un solide qui possède un coefficient de dilatation isobare\(\displaystyle dV/dT=2cT−bp\) et un coefficient pression/volume isotherme\(\displaystyle dV/dp=−bT\).
3.3 Travail, chaleur et énergie interne
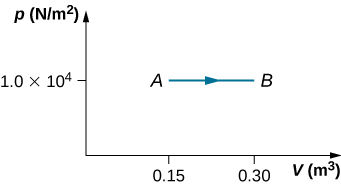
22. Un gaz à une pression de 2,00 atm subit une expansion isobare quasi statique de 3,00 à 5,00 L. Combien de travail est effectué par le gaz ?
23. Il faut 500 J de travail pour comprimer de manière quasi statique 0,50 mol d'un gaz idéal jusqu'à un cinquième de son volume initial. Calculez la température du gaz en supposant qu'elle reste constante pendant la compression.
24. On constate que lorsqu'un gaz dilué se dilate de façon quasi statique de 0,50 à 4,0 L, il fait 250 J de travail. En supposant que la température du gaz reste constante à 300 K, combien de moles de gaz sont présentes ?
25. Dans une expansion isobare quasi statique, 500 J de travail sont effectués par le gaz. Si la pression du gaz est de 0,80 atm, quelle est la fraction de l'augmentation du volume du gaz, en supposant qu'il était initialement de 20,0 L ?
26. Lorsqu'un gaz subit un changement de volume isobare quasi statique de 10,0 à 2,0 L, 15 J de travail à partir d'une source externe sont nécessaires. Quelle est la pression du gaz ?
27. Un gaz idéal se dilate de manière quasi-statique et isotherme d'un état de pression p et de volume V à un état de volume 4V. Montrez que le travail effectué par le gaz dans l'expansion est pV (ln 4).
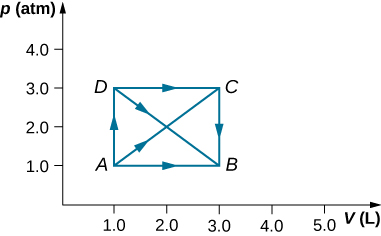
28. Comme indiqué ci-dessous, calculez le travail effectué par le gaz dans les processus quasi-statiques représentés par les chemins
a) AB ; b) BAD ; c) ACB ; et d) ADCB
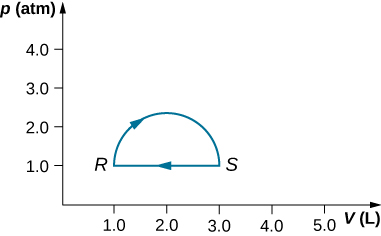
29. (a) Calculez le travail effectué sur le gaz le long du trajet fermé indiqué ci-dessous. La section incurvée entre R et S est semi-circulaire.
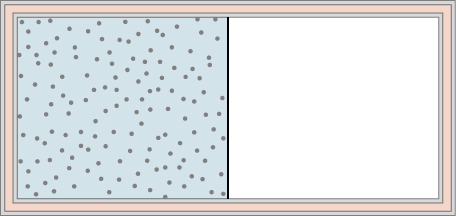
b) Si le procédé est effectué dans la direction opposée, quel est le travail effectué sur le gaz ?
30. Un gaz idéal se dilate de manière quasi statique jusqu'à trois fois son volume initial. Quel procédé nécessite plus de travail à partir du gaz, qu'il s'agisse d'un procédé isotherme ou isobare ? Déterminez le ratio du travail effectué dans ces processus.
31. Un gaz dilué à une pression de 2,0 atm et à un volume de 4,0 L est amené par les étapes quasi-statiques suivantes : (a) une expansion isobare jusqu'à un volume de 10,0 L, (b) un changement isochore jusqu'à une pression de 0,50 atm, (c) une compression isobare jusqu'à un volume de 4,0 L, et (d) un changement isochore jusqu'à une pression de 2,0 guichet automatique. Montrez ces étapes sur un diagramme pV et déterminez à partir de votre graphique le réseau réalisé par le gaz.
32. Quelle est l'énergie mécanique moyenne des atomes d'un gaz monatomique idéal à 300 K ?
33. Quelle est l'énergie interne de 6,00 mol d'un gaz monatomique idéal à 200 °C ?
34. Calculez l'énergie interne de 15 mg d'hélium à une température de 0 °C.
35. Deux gaz idéaux monatomiques A et B sont à la même température. Si 1,0 g de gaz A a la même énergie interne que 0,10 g de gaz B, quelles sont
a) le rapport entre le nombre de moles de chaque gaz et
(b) le rapport des masses atomiques des deux gaz ?
36. Les coefficients de Van der Waals pour l'oxygène sont\(\displaystyle a=0.138J⋅m^3/mol^2\) et\(\displaystyle b=3.18×10^{−5}m^3/mol\). Utilisez ces valeurs pour dessiner une isotherme d'oxygène de Van der Waals à 100 K. Sur le même graphique, tracez les isothermes d'une mole d'un gaz idéal.
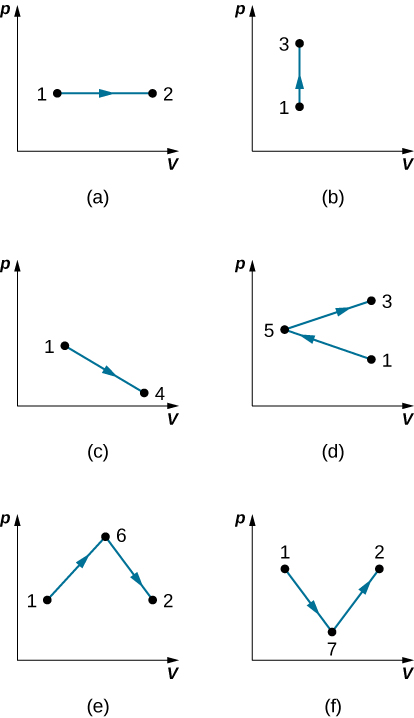
37. Découvrez le travail effectué dans le cadre des processus quasi-statiques présentés ci-dessous. Les états sont donnés sous forme de valeurs (p, V) pour les points du plan pV : 1 (3 atm, 4 L), 2 (3 atm, 6 L), 3 (5 atm, 4 L), 4 (2 atm, 6 L), 5 (4 atm, 2 L), 6 (5 atm, 5 L) et 7 (2 atm, 5 L).
3.4 Première loi de la thermodynamique
38. Lorsqu'un gaz dilué se dilate de façon quasi statique de 0,50 à 4,0 L, il fait 250 J de travail. En supposant que la température du gaz reste constante à 300 K,
a) Quelle est la variation de l'énergie interne du gaz ?
(b) Quelle quantité de chaleur est absorbée par le gaz au cours de ce processus ?
39. Lors d'une expansion, 500 J de travail sont effectués par le gaz. Si l'énergie interne du gaz a augmenté de 80 J lors de l'expansion, quelle quantité de chaleur le gaz absorbe-t-il ?
40. Un gaz idéal se dilate de manière quasi-statique et isotherme d'un état de pression p et de volume V à un état de volume 4V. Quelle quantité de chaleur est ajoutée au gaz en expansion ?
41. Comme indiqué ci-dessous, si la chaleur absorbée par le gaz le long de AB est de 400 J, déterminez les quantités de chaleur absorbées le long de
(a) BAD ; (b) ACB ; et (c) ADCB.

42. Lors de l'expansion isobare de A à B représentée ci-dessous, 3 100 J de chaleur sont ajoutés au gaz. Quelle est l'évolution de son énergie interne ?
43. (a) Quelle est la variation de l'énergie interne pour le processus représenté par la trajectoire fermée illustrée ci-dessous ? (b) Quelle quantité de chaleur est échangée ? (c) Si le chemin est parcouru dans la direction opposée, quelle quantité de chaleur est échangée ?

44. Lorsqu'un gaz se dilate le long du trajet AC illustré ci-dessous, il effectue 400 J de travail et absorbe 200 ou 400 J de chaleur.
(a) Supposons qu'on vous dise que le long de la trajectoire ABC, le gaz absorbe 200 ou 400 J de chaleur. Laquelle de ces valeurs est correcte ?
(b) Donnez la bonne réponse tirée de la partie (a), quelle quantité de travail est effectuée par le gaz le long de l'ABC ?
(c) Le long du CD, l'énergie interne du gaz diminue de 50 J. Quelle est la quantité de chaleur échangée par le gaz le long de ce trajet ?
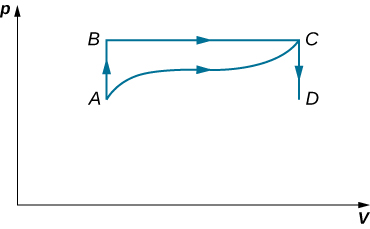
45. Lorsqu'un gaz se dilate le long de AB (voir ci-dessous), il effectue 500 J de travail et absorbe 250 J de chaleur. Lorsque le gaz se dilate le long du courant alternatif, il effectue 400 J de travail et absorbe 300 J de chaleur.
a) Quelle quantité de chaleur le gaz échange-t-il le long de la Colombie-Britannique ?
(b) Lorsque le gaz passe de C à A le long de la CDA, 800 J de travail sont effectués sur ce gaz de C à D. Quelle quantité de chaleur échange-t-il le long du CDA ?
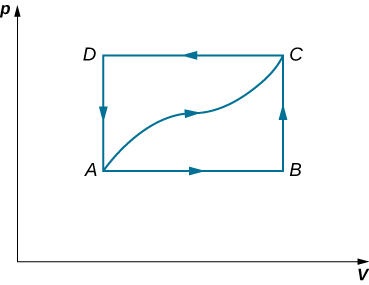
46. Un gaz dilué est stocké dans la chambre gauche d'un récipient dont les parois sont parfaitement isolantes (voir ci-dessous), et la chambre droite est évacuée. Lorsque la cloison est retirée, le gaz se dilate et remplit tout le récipient. Calculez le travail effectué par le gaz. L'énergie interne du gaz change-t-elle au cours de ce processus ?
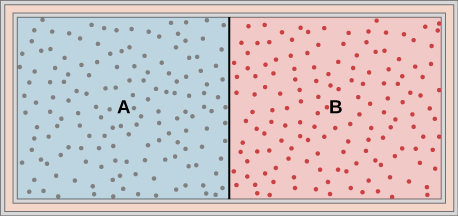
47. Les gaz idéaux A et B sont stockés dans les chambres gauche et droite d'un contenant isotherme, comme indiqué ci-dessous. La cloison est retirée et les gaz se mélangent. Des travaux ont-ils été effectués dans le cadre de ce processus ? Si les températures de A et B sont initialement égales, qu'advient-il de leur température commune après leur mélange ?
48. Un gaz monatomique idéal à une pression\(\displaystyle .0×10^5N/m^2\) et à une température de 300 K subit une expansion isobare quasi statique de\(\displaystyle 2.0×10^3\) à\(\displaystyle 4.0×10^3cm^3.\)
a) Quel est le travail effectué par le gaz ?
(b) Quelle est la température du gaz après la détente ?
c) Combien de moles de gaz y a-t-il ?
d) Quelle est la variation de l'énergie interne du gaz ?
e) Quelle quantité de chaleur est ajoutée au gaz ?
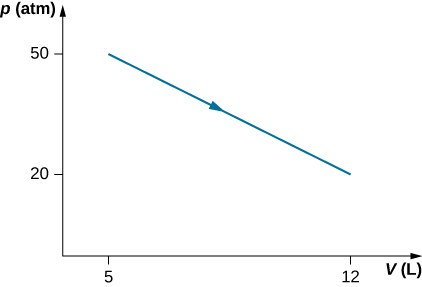
49. Examinez le processus pour la vapeur dans un cylindre illustré ci-dessous. Supposons que la variation de l'énergie interne dans ce processus soit de 30 kJ. Trouvez la chaleur qui entre dans le système.
50. L'état de 30 moles de vapeur dans un cylindre est modifié de manière cyclique depuis a-b-c-a, où la pression et le volume des états sont les suivants : a (30 atm, 20 L), b (50 atm, 20 L) et c (50 atm, 45 L). Supposons que chaque changement se produise le long de la ligne reliant les états initial et final dans le plan pV.
(a) Afficher le cycle dans le plan pV.
(b) Trouvez le réseau réalisé par la vapeur en un cycle.
(c) Déterminer la quantité nette de flux de chaleur dans la vapeur au cours d'un cycle.
51. Un gaz idéal monatomique subit un processus quasi-statique qui est décrit par la fonction\(\displaystyle p(V)=p_1+3(V−V_1)\), où l'état de départ est (\(\displaystyle p_1,V_1\)) et l'état final\(\displaystyle (p_2,V_2)\). Supposons que le système se compose de n moles de gaz dans un récipient capable d'échanger de la chaleur avec l'environnement et dont le volume peut changer librement.
a) Évaluer le travail effectué par le gaz lors du changement d'état.
(b) Déterminer la variation de l'énergie interne du gaz.
(c) Déterminez l'apport de chaleur au gaz pendant le changement.
d) Quelles sont les températures initiale et finale ?
52. Un récipient métallique de volume fixe\(\displaystyle 2.5×10^{−3}m^3\) immergé dans un grand réservoir à une température de 27 °C contient deux compartiments séparés par une paroi librement mobile. Dans un premier temps, la paroi est maintenue en place par un bouchon de telle sorte qu'il y ait 0,02 mol d'azote gazeux d'un côté et 0,03 mole d'oxygène gazeux de l'autre côté, chacune occupant la moitié du volume. Lorsque le bouchon est retiré, la paroi se déplace et prend une position finale. Le mouvement du mur est contrôlé de telle sorte que le mur se déplace par pas quasi statiques infinitésimaux.
(a) Déterminer les volumes finaux des deux côtés en supposant le comportement idéal des gaz pour les deux gaz.
(b) Combien de travail chaque gaz effectue-t-il sur l'autre ?
c) Quelle est la variation de l'énergie interne de chaque gaz ?
(d) Déterminez la quantité de chaleur qui entre ou sort de chaque gaz.
53. Un gaz contenu dans un récipient cylindrique fermé est détendu de manière adiabatique et quasi-statique d'un état A (3 MPa, 2 L) à un état B avec un volume de 6 L le long du trajet\(\displaystyle 1.8pV=constant.\)
(a) Tracez la trajectoire dans le plan pV.
(b) Déterminer la quantité de travail effectuée par le gaz et la variation de l'énergie interne du gaz au cours du processus.
3.5 Processus thermodynamiques
54. Deux moles d'un gaz idéal monatomique à (5 MPa, 5 L) sont détendues de manière isotherme jusqu'à ce que le volume soit doublé (étape 1). Il est ensuite refroidi de manière isochore jusqu'à ce que la pression soit de 1 MPa (étape 2). La température baisse au cours de ce processus. Le gaz est maintenant comprimé de manière isotherme jusqu'à ce que son volume revienne à 5 L, mais sa pression est maintenant de 2 MPa (étape 3). Enfin, le gaz est chauffé de manière isochore pour revenir à l'état initial (étape 4).
(a) Dessinez les quatre processus dans le plan pV.
(b) Déterminez le travail total effectué par le gaz.
55. Envisagez une transformation d'un point A à un point B dans un processus en deux étapes. Tout d'abord, la pression est abaissée de 3 MPa au point A à une pression de 1 MPa, tout en maintenant le volume à 2 L en refroidissant le système. L'état atteint est marqué C. Ensuite, le système est chauffé à pression constante pour atteindre un volume de 6 L à l'état B.
(a) Déterminez la quantité de travail effectuée sur la trajectoire ACB.
(b) Déterminez la quantité de chaleur échangée par le système lorsqu'il passe de A à B sur le trajet ACB.
(c) Comparer la variation de l'énergie interne lorsque le processus AB se produit de façon adiabatique avec la variation AB par le biais du processus en deux étapes sur la trajectoire ACB.
56. Prenons l'exemple d'un cylindre à piston mobile contenant n moles d'un gaz idéal. L'ensemble de l'appareil est immergé dans un bain à température constante de température T kelvin. Le piston est ensuite poussé lentement de sorte que la pression du gaz change de manière quasi statique de p1p1 à p2p2 à température constante T. Trouvez le travail effectué par le gaz en termes de n, R\(\displaystyle p_1\), T et\(\displaystyle p_2\).
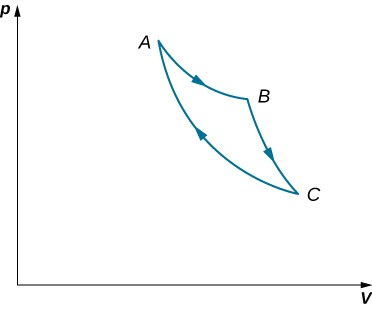
57. Un gaz idéal se dilate de manière isotherme le long de l'AB et effectue 700 J de travail (voir ci-dessous).
a) Quelle quantité de chaleur le gaz échange-t-il le long de l'AB ?
(b) Le gaz se dilate ensuite adiabatiquement le long de la Colombie-Britannique et effectue 400 J de travail. Lorsque le gaz retourne à A le long de CA, il évacue 100 J de chaleur vers son environnement. Combien de travail est effectué sur le gaz le long de ce trajet ?
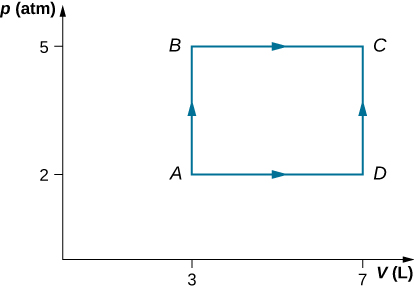
58. Considérez les processus présentés ci-dessous pour un gaz monatomique.
(a) Trouvez le travail effectué dans chacun des processus AB, BC, AD et DC.
(b) Déterminer le changement d'énergie interne dans les processus AB et BC.
(c) Déterminer la différence d'énergie interne entre les états C et A.
(d) Déterminez la chaleur totale ajoutée lors du processus ADC.
(e) À partir des informations fournies, pouvez-vous trouver la chaleur ajoutée au cours du procédé AD ? Pourquoi ou pourquoi pas ?
59. Deux moles d'hélium gazeux sont placées dans un récipient cylindrique muni d'un piston. Le gaz est à température ambiante de 25 °C et sous une pression de\(\displaystyle 3.0×10^5Pa\). Lorsque la pression provenant de l'extérieur diminue tout en maintenant la température au même niveau que la température ambiante, le volume du gaz double.
(a) Déterminez le travail effectué par l'agent externe sur le gaz du procédé.
b) Déterminez la chaleur échangée par le gaz et indiquez si le gaz absorbe ou cède de la chaleur. Supposons un comportement de gaz idéal.
60. Une quantité de n moles d'un gaz idéal monatomique dans un récipient conducteur doté d'un piston mobile est placée dans un grand bain de chaleur thermique à température\(\displaystyle T_1\) et le gaz est laissé à l'équilibre. Une fois l'équilibre atteint, la pression sur le piston est abaissée afin que le gaz se dilate à température constante. Le processus se poursuit de manière quasi statique jusqu'à ce que la pression finale soit égale aux 4/3 de la pression initiale\(\displaystyle p_1\).
(a) Déterminer la variation de l'énergie interne du gaz.
(b) Trouvez le travail effectué par le gaz.
(c) Trouvez la chaleur échangée par le gaz et indiquez si le gaz absorbe ou cède de la chaleur.
3.6 Capacités thermiques d'un gaz idéal
61. La température d'un gaz monatomique idéal augmente de 8,0 K. Quelle est la variation de l'énergie interne d'une mole de gaz à volume constant ?
62. Pour une augmentation de température de 10 °C à volume constant, quelle est la chaleur absorbée par a) 3,0 mol d'un gaz monatomique dilué ; b) 0,50 mol d'un gaz diatomique dilué ; et c) 15 moles d'un gaz polyatomique dilué ?
63. Si les gaz du problème précédent sont initialement à 300 K, quelles sont leurs énergies internes après absorption de la chaleur ?
64. Considérons 0,40 mol de dioxyde de carbone dilué à une pression de 0,50 atm et un volume de 50 L. Quelle est l'énergie interne du gaz ?
65. Lorsque 400 J de chaleur sont ajoutés lentement à 10 mol d'un gaz monatomique idéal, sa température augmente de 10 °C. Quel est le travail effectué sur le gaz ?
66. Une mole de gaz diatomique dilué occupant un volume de 10,00 L se détend à une pression constante de 2 000 atm lorsqu'elle est chauffée lentement. Si la température du gaz augmente de 10,00 K et que 400,0 J de chaleur sont ajoutés au cours du processus, quel est son volume final ?
3.7 Procédés adiabatiques pour un gaz idéal
67. Un gaz idéal monatomique subit une expansion adiabatique quasi statique au cours de laquelle son volume est doublé. Comment est modifiée la pression du gaz ?
68. Un gaz idéal a une pression de 0,50 atm et un volume de 10 L. Il est comprimé de façon adiabatique et quasi statique jusqu'à ce que sa pression soit de 3,0 atm et son volume de 2,8 L. Le gaz est-il monatomique, diatomique ou polyatomique ?
69. Les mesures de pression et de volume d'un gaz dilué soumis à une expansion adiabatique quasi statique sont présentées ci-dessous. Tracez ln p par rapport à V et déterminez γ pour ce gaz à partir de votre graphique.
| (ATM) | V (L) |
| 20,0 | 1,0 |
| 17,0 | 1.1 |
| 14,0 | 1.3 |
| 11,0 | 1,5 |
| 8,0 | 2,0 |
| 5,0 | 2.6 |
| 2,0 | 5.2 |
| 1,0 | 8.4 |
70. Un gaz monatomique idéal à 300 K se dilate de manière adiabatique et réversible jusqu'à deux fois son volume. Quelle est sa température finale ?
71. Un gaz diatomique idéal à 80 K est comprimé lentement de façon adiabatique et réversible jusqu'à la moitié de son volume. Quelle est sa température finale ?
72. Un gaz diatomique idéal à 80 K est comprimé lentement de façon adiabatique jusqu'à un tiers de son volume initial. Quelle est sa température finale ?
73. Comparez la charge en énergie interne d'un gaz idéal pour une expansion adiabatique quasi-statique à celle d'un gaz isotherme quasi-statique. Qu'arrive-t-il à la température d'un gaz idéal lors d'une expansion adiabatique ?
74. La température de n moles d'un gaz idéal passe de\(\displaystyle T_1\)\(\displaystyle T_2\) à lors d'une transition adiabatique quasi statique. Montrez que le travail effectué par le gaz est donné par\(\displaystyle W=\frac{nR}{γ−1}(T_1−T_2)\).
75. Un gaz dilué se dilate de manière quasi statique jusqu'à trois fois son volume initial. La pression finale du gaz est-elle supérieure pour une expansion isotherme ou adiabatique ? Votre réponse dépend-elle du fait que le gaz est monatomique, diatomique ou polyatomique ?
76. (a) Un gaz idéal se dilate adiabatiquement d'un volume de\(\displaystyle 2.0×10^{−3}m^3\) à\(\displaystyle 2.5×10^{−3}m^3\). Si la pression et la température initiales étaient respectivement de\(\displaystyle 5.0×10^5Pa\) et 300 K, quelles sont la pression et la température finales du gaz ? Utilisez γ = 5/3 pour le gaz.
(b) Dans un procédé isotherme, un gaz idéal se dilate d'un volume de\(\displaystyle 2.0×10^{−3}m^3\) à\(\displaystyle 2.5×10^{−3}m^3\). Si la pression et la température initiales étaient respectivement de\(\displaystyle .0×10^5Pa\) et 300 K, quelles sont la pression et la température finales du gaz ?
77. Sur un processus adiabatique caractérisé par une variation idéale de la pression, du volume et de la température du gaz, telle qu'elle\(\displaystyle pV^γ\) soit constante avec γ = 5/3 pour un gaz monatomique tel que l'hélium et γ = 7/5 pour un gaz diatomique tel que l'hydrogène à température ambiante. Utilisez des valeurs numériques pour tracer deux isothermes de 1 mol d'hélium gazeux en utilisant la loi des gaz idéaux et deux processus adiabatiques intermédiaires. À utiliser\(\displaystyle T_1=500K,V_1=1L,\) et\(\displaystyle T_2=300K\) pour votre terrain.
78. Deux moles d'un gaz idéal monatomique tel que l'hélium sont comprimées de manière adiabatique et réversible d'un état (3 atm, 5 L) à un état de pression de 4 atm. (a) Déterminez le volume et la température de l'état final. (b) Déterminer la température de l'état initial du gaz. (c) Trouvez le travail effectué par le gaz dans le processus. (d) Déterminer la variation de l'énergie interne du gaz au cours du processus.
Problèmes supplémentaires
79. Envisagez le processus illustré ci-dessous. Au cours des étapes AB et BC, 3 600 J et 2 400 J de chaleur, respectivement, sont ajoutés au système.
(a) Trouvez le travail effectué dans chacun des processus AB, BC, AD et DC.
(b) Déterminer le changement d'énergie interne dans les processus AB et BC.
(c) Déterminer la différence d'énergie interne entre les états C et A.
(d) Déterminez la chaleur totale ajoutée dans le procédé ADC.
(e) À partir des informations fournies, pouvez-vous trouver la chaleur ajoutée au cours du procédé AD ? Pourquoi ou pourquoi pas ?

80. Un pneu de voiture contient\(\displaystyle 0.0380m^3\) de l'air à une pression de\(\displaystyle 2.20×10^5Pa\) (environ 32 psi). Quelle est la quantité d'énergie interne supérieure à celle du même volume à une pression manométrique nulle (ce qui équivaut à la pression atmosphérique normale) ?
81. Un ballon jouet rempli d'hélium a une pression manométrique de 0,200 atm et un volume de 10,0 L. Dans quelle mesure l'énergie interne de l'hélium dans le ballon est-elle supérieure à ce qu'elle serait à une pression manométrique nulle ?
82. La vapeur nécessaire à l'entraînement d'une ancienne locomotive à vapeur est fournie à une pression manométrique constante\(\displaystyle 1.75×10^6N/m^2\) (environ 250 psi) à un piston d'un rayon de 0,200 m.
a) En calculant\(\displaystyle pΔV\), trouvez le travail effectué par la vapeur lorsque le piston se déplace de 0,800 m. Notez qu'il s'agit du débit net, étant donné que la pression manométrique est utilisée.
(b) Déterminez maintenant la quantité de travail en calculant la force exercée multipliée par la distance parcourue. La réponse est-elle la même que dans la partie (a) ?
83. Une pompe à pneus à commande manuelle possède un piston d'un diamètre de 2,50 cm et d'une course maximale de 30,0 cm.
(a) Combien de travail effectuez-vous en une seule course si la pression manométrique moyenne est de\(\displaystyle 2.4×10^5N/m^2\) (environ 35 psi) ?
(b) Quelle force moyenne exercez-vous sur le piston, en négligeant le frottement et la force gravitationnelle ?
84. Calculez la puissance nette d'un moteur thermique en suivant la trajectoire ABCDA comme indiqué ci-dessous.
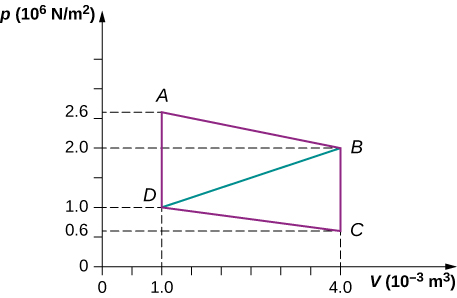
85. Quelle est la puissance nette d'un moteur thermique qui suit la trajectoire ABDA dans le problème précédent avec une ligne droite allant de B à D ? Pourquoi le résultat du travail est-il inférieur à celui du chemin ABCDA ?
86. Cinq moles d'un gaz idéal monatomique dans une bouteille à 27 °C sont détendues de manière isotherme d'un volume de 5 L à 10 L.
a) Quelle est l'évolution de l'énergie interne ?
(b) Combien de travail a été effectué sur le gaz utilisé dans le processus ? c) Quelle quantité de chaleur a été transférée au gaz ?
87. Quatre moles d'un gaz idéal monatomique dans une bouteille à 27 °C sont détendues à une pression constante égale à 1 atm jusqu'à ce que son volume double.
a) Quelle est l'évolution de l'énergie interne ?
(b) Quelle quantité de travail a été réalisée par le gaz au cours du procédé ?
c) Quelle quantité de chaleur a été transférée au gaz ?
88. L'hélium gazeux est refroidi de 20 °C à 10 °C en le dilatant de 40 atm à 1 atm. S'il y a 1,4 mol d'hélium,
a) Quel est le volume final d'hélium ?
(b) Quelle est l'évolution de l'énergie interne ?
89. Dans un processus adiabatique, l'oxygène gazeux dans un récipient est comprimé selon un trajet qui peut être décrit par la pression suivante en atm en fonction du volume V, avec\(\displaystyle V_0=1L: p=(3.0atm)(V/V_0)^{−1.2}\). Les volumes initial et final au cours du processus étaient de 2 L et 1,5 L, respectivement. Déterminez la quantité de travail effectuée sur le gaz.
90. Une bouteille contenant trois moles d'un gaz idéal monatomique est chauffée à une pression constante de 2 atm. La température du gaz passe de 300 K à 350 K sous l'effet de la dilatation. Trouvez le travail effectué
a) sur le gaz ; et
b) par le gaz.
91. Une bouteille contenant trois moles d'azote gazeux est chauffée à une pression constante de 2 atm. La température du gaz passe de 300 K à 350 K sous l'effet de la dilatation. Trouvez le travail effectué
a) sur le gaz, et
(b) par le gaz en utilisant l'équation d'état de Van der Waals au lieu de la loi du gaz idéal.
92. Deux moles d'un gaz idéal monatomique tel que l'hélium sont comprimées de manière adiabatique et réversible d'un état (3 atm, 5 L) à un état de pression de 4 atm.
(a) Déterminez le volume et la température de l'état final.
(b) Détermine la température de l'état initial.
(c) Trouvez le travail effectué par le gaz dans le processus.
(d) Déterminer la variation de l'énergie interne au cours du processus. Supposons\(\displaystyle C_V=5R\) et\(\displaystyle C_p=C_V+R\) pour le gaz diatomique idéal dans les conditions données.
93. Un récipient isolé contient 1,5 mole d'argon à 2 atm. Le gaz occupe initialement un volume de 5 L. En raison de la détente adiabatique, la pression du gaz est réduite à 1 atm.
(a) Déterminez le volume et la température de l'état final.
(b) Déterminer la température du gaz à l'état initial.
(c) Trouvez le travail effectué par le gaz dans le processus.
(d) Déterminer la variation de l'énergie interne du gaz au cours du processus.
Problèmes liés au défi
94. Une mole d'un gaz monatomique idéal occupe un volume de\(\displaystyle 1.0×10^{−2}m^3\) à une pression de\(\displaystyle 2.0×10^5N/m^2\).
a) Quelle est la température du gaz ?
(b) Le gaz subit une compression adiabatique quasi statique jusqu'à ce que son volume soit réduit à\(\displaystyle 5.0×10^{−3}m^3\). Quelle est la nouvelle température du gaz ?
(c) Combien de travail est effectué sur le gaz pendant la compression ?
d) Quelle est la variation de l'énergie interne du gaz ?
95. Une mole d'un gaz idéal se trouve initialement dans une chambre de volume\(\displaystyle 1.0×10^{−2}m^3\) et à une température de 27 °C.
a) Quelle quantité de chaleur est absorbée par le gaz lorsqu'il se dilate lentement de manière isotherme pour atteindre le double de son volume initial ?
(b) Supposons que le gaz soit lentement transformé vers le même état final en diminuant d'abord la pression à volume constant, puis en le dilatant de manière isobare. Quelle est la chaleur transférée pour cette coque ?
(c) Calculez la chaleur transférée lorsque le gaz est transformé de manière quasi statique jusqu'au même état final en le dilatant de manière isobare, puis en diminuant sa pression à volume constant.
96. Une balle d'une masse de 10 g se déplace horizontalement à 200 m/s lorsqu'elle frappe et s'intègre dans un balancier d'une masse de 2,0 kg.
a) Quelle quantité d'énergie mécanique est dissipée lors de la collision ?
(b) En supposant que\(\displaystyle C_v\) pour le bob plus bullet est 3R, calculez l'augmentation de température du système due à la collision. Supposons que la masse moléculaire du système soit de 200 g/mol.
97. Le cylindre isolé illustré ci-dessous est fermé aux deux extrémités et contient un piston isolant qui peut se déplacer librement sur des roulements sans friction. Le piston divise la chambre en deux compartiments contenant les gaz A et B. À l'origine, chaque compartiment a un volume\(\displaystyle 5.0×10^{−2}m^3\) et contient un gaz idéal monatomique à une température de 0 °C et une pression de 1,0 atm.
a) Combien de moles de gaz se trouvent dans chaque compartiment ?
(b) La chaleur Q est lentement ajoutée à A pour qu'elle se dilate et B est comprimée jusqu'à ce que la pression des deux gaz soit de 3,0 atm. Utilisez le fait que la compression de B est adiabatique pour déterminer le volume final des deux gaz.
(c) Quelles sont leurs températures finales ?
(d) Quelle est la valeur de Q ?
98. Dans un moteur diesel, le carburant est allumé sans bougie d'allumage. Au lieu de cela, l'air contenu dans un cylindre est comprimé adiabatiquement à une température supérieure à la température d'inflammation du carburant ; au point de compression maximale, le carburant est injecté dans le cylindre. Supposons que de l'air à 20 °C soit introduit dans le cylindre à un certain volume,\(\displaystyle V_1\) puis comprimé de façon adiabatique et quasi statique jusqu'à une température de 600 °C et un volume\(\displaystyle V_2\). Si γ = 1,4, quel est le ratio\(\displaystyle V_1/V_2\) ? (Remarque : dans un moteur diesel en fonctionnement, la compression n'est pas quasi-statique.)


