3.A : La première loi de la thermodynamique (réponse)
- Page ID
- 190987
Vérifiez votre compréhension
3.1. \(\displaystyle p_2(V_2−V_1)\)
3.2. Ligne 1,\(\displaystyle ΔE_{int}=40J\) ;
ligne 2,\(\displaystyle W=50J\) et\(\displaystyle ΔE_{int}=40J\)
ligne 3,\(\displaystyle Q=80J\) et\(\displaystyle ΔE_{int}=40J\) ; et
ligne 4,\(\displaystyle Q=0\) et\(\displaystyle ΔE_{int}=40J\)
3.3. Pour que le processus soit représenté par la courbe\(\displaystyle p=nRT/V\) sur le diagramme pV pour l'évaluation du travail.
3.4. \(\displaystyle 1.26×10-^3J\).
Questions conceptuelles
1. a. SE ; b. ES ; c. ES
3. Une partie de l'énergie sert à transformer la phase du liquide en gaz.
5. Oui, tant que le travail effectué est égal à la chaleur ajoutée, il n'y aura aucun changement d'énergie interne et donc aucun changement de température. Lorsque l'eau gèle ou lorsque la glace fond en retirant ou en ajoutant de la chaleur, respectivement, la température reste constante.
7. Si plus de travail est effectué sur le système que la chaleur ajoutée, l'énergie interne du système diminuera en fait.
9. Le système doit être en contact avec une source de chaleur qui permet à la chaleur de pénétrer dans le système.
11. Les processus isothermes doivent être lents pour garantir que la température ne change pas lors du transfert de chaleur. Même pour les processus isobariques et isochoriques, le système doit être en équilibre thermique avec de lentes variations des variables thermodynamiques.
13. \(\displaystyle C_p\)Est généralement plus important que\(\displaystyle C_V\) parce que lorsque l'expansion se produit sous pression constante, elle agit sur l'environnement. Par conséquent, la chaleur peut entrer dans l'énergie interne et fonctionner. À volume constant, toute la chaleur est convertie en énergie interne. Dans cet exemple, l'eau se contracte lors du chauffage, donc si nous ajoutons de la chaleur à pression constante, le travail sur l'eau est effectué par l'environnement et\(\displaystyle C_p\) est donc inférieur à\(\displaystyle C_V\).
15. Non, il est toujours supérieur à 1.
17. Un processus adiabatique entraîne un changement de température mais aucun flux de chaleur. Le processus isotherme n'entraîne aucun changement de température mais un flux de chaleur.
Problèmes
19. \(\displaystyle p(V−b)=−c_T\)est l'échelle de température souhaitée et reflète le gaz idéal à volume constant.
21. \(\displaystyle V−bpT+cT^2=0\)
23. 74 K
25. 1,4 fois
27. PvLN (4)
29. a. 160 J ; b. —160 J
31. \(\displaystyle W=900J\)
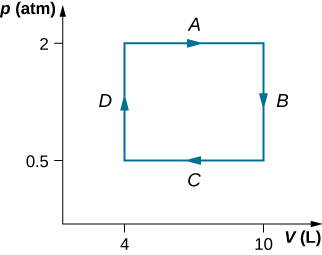
33. \(\displaystyle 3.53×10^4J\)
35. a. 1:1 ;
Avant 10:1
37. environ 600 J ;
b. 0 ;
environ 500 J ;
d. 200 J ;
e. 800 J ;
environ 500 J
39. 580 J
41. environ 600 J ;
b. 600 J ;
environ 800 J
43. a. 0 ;
b. 160 J ;
environ —160 J
45. a. 150 J ;
b. 700 J
47. Aucun travail n'est effectué et ils atteignent la même température commune.
49. 54 500 J
51. un\(\displaystyle (p_1+3V^2_1)(V_2−V_1)−3V_1(V^2_2−V^2_1)+(V^3_2−V^3_1)\) ;.
b.\(\displaystyle \frac{3}{2}(p_2V_2−p_1V_1)\) ;
c. la somme des parties (a) et (b) ; d.\(\displaystyle T_1=\frac{p_1V_1}{nR}\) et\(\displaystyle T_2=\frac{p_2V_2}{nR}\)
53. un.
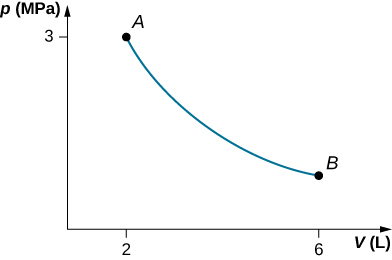
b.\(\displaystyle W=4.39kJ,ΔE_{int}=−4.39kJ\)
55. a. 1660 J ;
b. -2730 J ;
c. Cela ne dépend pas du processus.
57. environ 700 J ;
b. 500 J
59. a. -3 400 J ;
b. 3400 J entre dans le gaz
61. 100 J
63. a. 370 J ;
b. 100 J ;
environ 500 J
65. 850 J
67. pression diminuée de 0,31 fois la pression initiale
69. \(\displaystyle γ=0.713\)
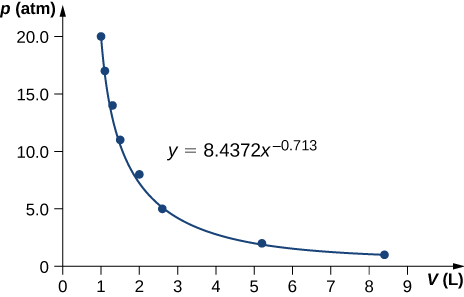
71. 84 K
73. Une expansion adiabatique nécessite moins de travail et aucun flux de chaleur, ce qui réduit l'énergie interne par rapport à une expansion isotherme qui implique à la fois un flux de chaleur et un travail effectué. La température diminue lors de l'expansion adiabatique.
75. L'isotherme a une pression finale plus élevée et ne dépend pas du type de gaz.
77.
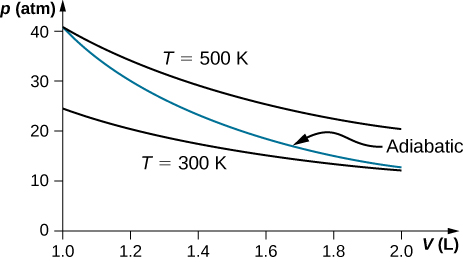
Problèmes supplémentaires
79. un.\(\displaystyle W_{AB}=0,W_{BC}=2026J,W_{AD}=810.4J,W_{DC}=0;\)
b.\(\displaystyle ΔE_{AB}=3600J,ΔE_{BC}=374J\) ;
c.\(\displaystyle ΔE_{AC}=3974J\) ;
d\(\displaystyle Q_{ADC}=4784J\) ;.
e. Non, car de la chaleur a été ajoutée pour les deux parties AD et DC. Il n'y a pas assez d'informations pour déterminer la quantité provenant de chaque segment du chemin.
81. 300 J
83. a. 59,5 J ;
b. 170 N
85. \(\displaystyle 2.4×10^3J\)
87. a. 15 000 J ;
b. 10 000 J ;
Environ 25 000 J
89. 78 J
91. Une bouteille contenant trois moles d'azote gazeux est chauffée à une pression constante de 2 atm. a. −1220 J ; b. +1220 J
93. a. 7,6 L, 61,6 K ;
b. 81,3 K ;
c.\(\displaystyle 3.63L⋅atm=367J\) ;
d. −367 J
Problèmes liés au défi
95. a. 1700 J ; b. 1200 J ; environ 2400 J
97. a. 2,2 mol ;
b.\(\displaystyle V_A=6.7×10^{−2}m^3, V_B=3.3×10^{−2}m^3\) ;
c.\(\displaystyle T_A=2400K,T_B=397K\) ; d. 26 000 J


