1.2 : Température et équilibre thermique
- Page ID
- 191021
À la fin de cette section, vous serez en mesure de :
- Définissez la température et décrivez-la de manière qualitative
- Expliquer l'équilibre thermique
- Expliquer la loi zéro de la thermodynamique
La chaleur nous est familière à tous. Nous pouvons sentir la chaleur pénétrer dans notre corps par le soleil d'été ou par le café ou le thé chauds après une promenade hivernale. Nous pouvons également sentir la chaleur quitter notre corps lorsque nous ressentons le froid de la nuit ou l'effet rafraîchissant de la transpiration après l'exercice.
Qu'est-ce que la chaleur ? Comment le définissons-nous et comment est-il lié à la température ? Quels sont les effets de la chaleur et comment s'écoule-t-elle d'un endroit à l'autre ? Nous constaterons que, malgré la richesse des phénomènes, un petit ensemble de principes physiques sous-jacents unit ces sujets et les relie à d'autres domaines. Nous commençons par examiner la température et la manière de la définir et de la mesurer.
Température
Le concept de température a évolué à partir des concepts courants de chaud et de froid. La définition scientifique de la température explique bien plus que notre sens du chaud et du froid. Comme vous l'avez peut-être déjà appris, de nombreuses grandeurs physiques sont définies uniquement en fonction de la manière dont elles sont observées ou mesurées, c'est-à-dire qu'elles sont définies de manière opérationnelle. La température est définie opérationnellement comme la quantité de ce que nous mesurons à l'aide d'un thermomètre. Comme nous le verrons en détail dans un chapitre ultérieur sur la théorie cinétique des gaz, la température est proportionnelle à l'énergie cinétique moyenne de translation, ce qui fournit une définition plus physique. Les différences de température maintiennent le transfert de chaleur, ou transfert de chaleur, dans tout l'univers. Le transfert de chaleur est le mouvement de l'énergie d'un endroit ou d'un matériau à un autre en raison d'une différence de température. (Vous en apprendrez plus sur le transfert de chaleur plus loin dans ce chapitre.)
Équilibre thermique
L'équilibre thermique est un concept important lié à la température. Deux objets sont en équilibre thermique s'ils sont en contact étroit, ce qui permet à l'un ou l'autre de gagner de l'énergie de l'autre, mais aucune énergie nette n'est transférée entre eux. Même lorsqu'ils ne sont pas en contact, ils sont en équilibre thermique si, lors de leur mise en contact, aucune énergie nette n'est transférée entre eux. Si deux objets restent en contact pendant une longue période, ils s'équilibrent généralement. En d'autres termes, deux objets en équilibre thermique n'échangent pas d'énergie.
Expérimentalement, si l'objet A est en équilibre avec l'objet B et que l'objet B est en équilibre avec l'objet C, alors (comme vous l'avez peut-être déjà deviné) l'objet A est en équilibre avec l'objet C. Cette déclaration de transitivité s'appelle la loi zéro de la thermodynamique. (Le chiffre « zéro » a été suggéré par le physicien britannique Ralph Fowler dans les années 1930. Les première, deuxième et troisième lois de la thermodynamique étaient déjà nommées et numérotées à l'époque. La loi zéro avait rarement été énoncée, mais elle doit être discutée avant les autres, donc Fowler lui a donné un chiffre plus petit.) Prenons le cas où A est un thermomètre. La loi zéro nous indique que si A lit une certaine température lorsqu'il est en équilibre avec B, et qu'il est ensuite placé en contact avec C, il n'échangera pas d'énergie avec C ; par conséquent, sa lecture de température restera la même (Figure\(\PageIndex{1}\)). En d'autres termes, si deux objets sont en équilibre thermique, ils ont la même température.
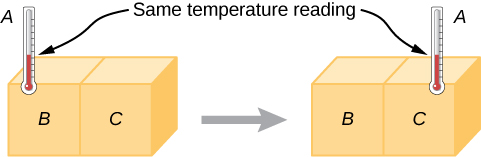
A thermometer measures its own temperature. It is through the concepts of thermal equilibrium and the zeroth law of thermodynamics that we can say that a thermometer measures the temperature of something else, and to make sense of the statement that two objects are at the same temperature.
In the rest of this chapter, we will often refer to “systems” instead of “objects.” As in the chapter on linear momentum and collisions, a system consists of one or more objects—but in thermodynamics, we require a system to be macroscopic, that is, to consist of a huge number (such as \(10^{23}\)) of molecules. Then we can say that a system is in thermal equilibrium with itself if all parts of it are at the same temperature. (We will return to the definition of a thermodynamic system in the chapter on the first law of thermodynamics.)


