9.2 : Types de liaisons moléculaires
- Page ID
- 189536
À la fin de cette section, vous serez en mesure de :
- Distinguer les différents types de liaisons moléculaires
- Déterminer l'énergie de dissociation d'une molécule à l'aide des concepts d'énergie d'ionisation, d'affinité électronique et de force de Coulomb
- Décrire la liaison covalente en termes de symétrie d'échange
- Expliquer la structure physique d'une molécule en termes de concept d'hybridation
La mécanique quantique a connu un succès extraordinaire pour expliquer la structure et la liaison des molécules, et constitue donc le fondement de toute la chimie. La chimie quantique, comme on l'appelle parfois, explique des questions fondamentales telles que la raison pour laquelle les\(H_2O\) molécules existent, pourquoi l'angle de liaison entre les atomes d'hydrogène de cette molécule est précisément de 104,5° et pourquoi ces molécules se lient entre elles pour former de l'eau liquide à température ambiante. L'application de la mécanique quantique aux molécules peut s'avérer très difficile mathématiquement. Notre discussion sera donc uniquement qualitative.
Lorsque nous étudierons les molécules, puis les solides, nous utiliserons de nombreux modèles scientifiques différents. Dans certains cas, nous considérons une molécule ou un cristal comme un ensemble de noyaux ponctuels dont les électrons circulent autour de l'extérieur selon des trajectoires bien définies, comme dans le modèle de Bohr. Dans d'autres cas, nous utilisons nos connaissances complètes de la mécanique quantique pour étudier ces systèmes en utilisant les fonctions des ondes et le concept de spin des électrons. Il est important de se rappeler que nous étudions la physique moderne à l'aide de modèles et que différents modèles sont utiles à des fins différentes. Nous n'utilisons pas toujours le modèle le plus puissant, alors qu'un modèle moins puissant et plus facile à utiliser fera l'affaire.
Types d'obligations
Les unités chimiques se forment par de nombreux types de liaisons chimiques. Une liaison ionique se forme lorsqu'un électron passe d'un atome à un autre. Une liaison covalente se produit lorsque deux atomes ou plus partagent des électrons. Une liaison de Van der Waals se produit en raison de l'attraction de molécules polarisées en charge et est considérablement plus faible que les liaisons ioniques ou covalentes. De nombreux autres types de collage existent également. Souvent, la liaison se fait par l'intermédiaire de plusieurs mécanismes. Cette section se concentre sur les liaisons ioniques et covalentes.
Liaisons ioniques
La liaison ionique est peut-être le type de liaison le plus simple à comprendre. Il explique la formation de composés salins, tels que le chlorure de sodium\(\ce{NaCl}\). L'atome de sodium (symbole Na) possède la même disposition électronique qu'un atome de néon plus un électron en 3 s. Seulement 5,14 eV d'énergie d'ionisation sont nécessaires pour éliminer cet électron de l'atome de sodium. Par conséquent, Na peut facilement céder ou donner cet électron à un atome adjacent (proche), obtenant ainsi un arrangement d'électrons plus stable. Le chlore (symbole Cl) n'a besoin que d'un seul électron pour compléter sa couche de valence. Il accepte donc facilement cet électron s'il se trouve à proximité de l'atome de sodium. Nous disons donc que le chlore possède une grande affinité électronique, qui est l'énergie associée à un électron accepté. L'énergie fournie par l'atome de chlore dans ce processus est de 3,62 eV. Après le transfert de l'électron de l'atome de sodium à l'atome de chlore, l'atome de sodium devient un ion positif et l'atome de chlore devient un ion négatif.
Cette réaction ressemble à ceci
\[\ce{Na(g) + Cl(g) -> Na^{+}(g) + Cl^{-}(g)} \label{rx1} \]
et l'énergie totale requise pour ce transfert est donnée par
\[E_{transfer} = 5.14 \,\text{eV} - 3.62 \,\text{eV} = 1.52 \,\text{eV}. \label{9.1} \]
L'ion sodium positif et l'ion chlorure négatif subissent une force de Coulomb attrayante. L'énergie potentielle associée à cette force est donnée par
\[U_{coul} = -\dfrac{ke^2}{r_0}, \nonumber \]
où\(ke^2 = 1.440\, \text{eV-nm}\) et\(r_0\) est la distance entre les ions.
Au fur et à mesure que les ions sodium et chlorure se déplacent ensemble (« descendent la colline énergétique potentielle »), la force d'attraction entre les ions devient plus forte. Cependant, si les ions se rapprochent trop, les fonctions d'ondes des électrons du cœur des deux ions commencent à se chevaucher. En raison du principe d'exclusion, cette action fait passer les électrons du noyau, et donc l'ensemble de la molécule, à un état énergétique supérieur.
\[\ce{ Na^{+}(g) + Cl^{-}(g) -> NaCl(g)} \label{rx2} \]
La distance de séparation d'équilibre (ou longueur de liaison) entre les ions se produit lorsque la molécule est dans son état énergétique le plus bas. Pour la diatomique\(\ce{NaCl}\), cette distance est de 0,236 nm. La figure\(\PageIndex{1}\) montre l'énergie totale de\(\ce{NaCl}\) en fonction de la distance de séparation entre les ions.
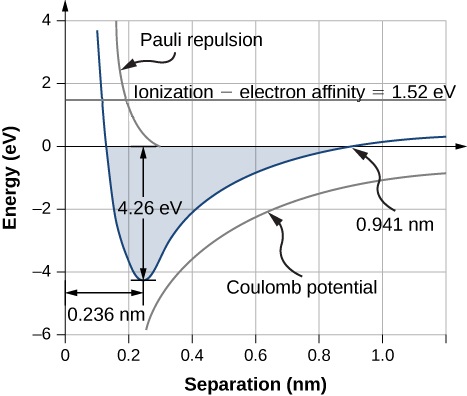
L'énergie totale requise pour former une seule unité saline à partir du neutre\(\ce{Na}\) et des\(\ce{Cl}\) atomes est la somme des énergies associées au transfert d'électrons (équation \ ref {rx1}) et à la combinaison d'ions (équation \ ref {rx2}) :
\[U_{form} = E_{transfer} + U_{coul} + U_{ex}, \nonumber \]
où\(U_{ex}\) est l'énergie associée à la répulsion entre les électrons du noyau en raison du principe d'exclusion de Pauli. La valeur de\(U_{form}\) doit être négative pour que la liaison se forme spontanément (sinon, les espèces séparées sont moins énergivores). L'énergie de dissociation est définie comme l'énergie requise pour séparer l'unité en ses ions constitutifs, écrite
\[U_{diss} = -U_{form} \nonumber \]
Chaque unité de formule diatomique possède sa propre énergie de dissociation caractéristique et sa propre longueur de séparation à l'équilibre. Les valeurs d'échantillon sont données dans le tableau\(\PageIndex{1}\).
Les liaisons peuvent être rompues de manière symétrique ou asymétrique. La première est appelée homolyse et constitue la base de l'énergie habituelle de dissociation des liaisons (homolytiques). Pour l'unité de formule saline (\(\ce{NaCl}\)), la réaction homolytique associée serait
\[\ce{NaCl(g) -> Na (g) + Cl(g)} \label{homo} \]
La scission asymétrique d'une liaison est appelée hétérolyse (c'est-à-dire énergie de dissociation de la liaison hétérolytique). La réaction hétérolytique associée pour\(\ce{ NaCl}\) serait
\[\ce{NaCl(g) -> Na^{+} (g) + Cl^{-}(g)} \label{hetero} \]
La différence entre les énergies de dissociation des liaisons homolytiques et hétérolytiques est simplement\(E_{transfer}\) donnée par l'équation \ ref {9.1}.
| molécule | Énergie de dissociation (eV) | Séparation à l'équilibre (nm) (longueur de liaison) |
|---|---|---|
| NaCl | 4.26 | 0,236 |
| NaF | 4,99 | 0,193 |
| NABR | 3.8 | 0,250 |
| NAI | 3.1 | 0,271 |
| Ah | 2,08 | 0,189 |
| LiCl | 4,86 | 0,202 |
| LiH | 2,47 | 0,239 |
| II | 3,67 | 0,238 |
| KCl | 4,43 | 0,267 |
| KBr | 3,97 | 0,282 |
| RBF | 5.12 | 0,227 |
| RBCL | 4,64 | 0,279 |
| CSi | 3,57 | 0,337 |
| H-H | 4,5 | 0,075 |
| N-N | 9,8 | 0,11 |
| O-O | 5.2 | 0,12 |
| F-F | 1,6 | 0,14 |
| Cl-Cl | 2,5 | 0,20 |
Quelle est l'énergie de dissociation d'une unité de formule saline (NaCl) ?
Stratégie
Le chlorure de sodium (\(\ce{NaCl}\)) est un sel formé par des liaisons ioniques. Le changement d'énergie associé à cette liaison dépend de trois processus principaux :
- l'ionisation du Na et l'acceptation de l'électron d'un atome de Na par un atome de Cl ; et
- Attraction coulombienne des ions résultants (\(\ce{Na^{+}}\)et\(\ce{Cl^{-}}\)).
- Si les ions s'approchent trop, ils se repoussent grâce au principe d'exclusion (0,32 eV).
La distance de séparation d'équilibre est\(r_0 = 0.236 \text{nm}\).
Solution
Le changement d'énergie associé au transfert d'un électron de Na à Cl est de 1,52 eV (Équation \ ref {9.1}). Lors de la séparation à l'équilibre, les atomes sont\(r_0 = 0.236 \text{nm}\) séparés. L'énergie potentielle électrostatique des atomes est
\[\begin{align*} U_{could} &= -\dfrac{ke^2}{r_0} \\[5pt] &= - \dfrac{1.44 \, \text{eV} \cdot nm}{0.236 \,nm} \\[5pt] &= - 6.10 \, \text{eV} . \end{align*} \nonumber \]
La différence d'énergie totale associée à la formation d'une unité de formule NaCl est
\[\begin{align*}E_{form} &= E_{transfer} + U_{coul} + U_{ex} \\[5pt] &= 1.52 \, \text{eV} + (−6.10 eV) + 0.32\, \text{eV} \\[5pt] &= -4.26 eV \end{align*} \nonumber \]
Par conséquent, l'énergie de dissociation homolytique de\(\ce{NaCl}\) est de 4,26 eV.
L'importance
La formation d'une unité de formule NaCl par liaison ionique est énergétiquement favorable. L'énergie de dissociation, ou énergie requise pour séparer l'unité NaCl en\(Cl\) atomes\(Na\) et, est de 4,26 eV, conformément à la Figure\(\PageIndex{1}\).
Pourquoi l'énergie potentielle associée au principe d'exclusion est-elle positive dans l'exemple\(\PageIndex{1}\) ?
- Réponse
-
Elle correspond à une force de répulsion entre les électrons du noyau des ions.
À quelle\(\ce{Na}\)\(\ce{Cl}\) distance est-il énergétiquement favorable à ce que cette réaction se produise ?
\[\ce{Na(g) + Cl(g) -> Na^{+}(g) + Cl^{-}(g)} \nonumber \]
- Réponse
-
Cela se produit lorsque l'énergie potentielle électrique (\(U_{coul}\)) et l'énergie de répulsion de Pauli (\(U_{ex}\)) égalent l'énergie du transfert d'électrons (\(E_{transfer}\)), qui est de 0,941 nm comme indiqué sur la Figure\(\PageIndex{1}\). Notez qu'\(U_{ex} \approx 0\)à cette distance.
Pour un ion sodium dans un cristal ionique de NaCl, l'expression de l'énergie potentielle de Coulomb\(U_{could}\) doit être modifiée par un facteur connu sous le nom de constante de Madelung. Ce facteur prend en compte l'interaction de l'ion sodium avec tous les ions chlorure et sodium voisins. La constante de Madelung pour un cristal de NaCl est d'environ 1,75. Cette valeur implique une distance de séparation d'équilibre entre les\(Cl^-\) ions\(Na^+\) et de 0,280 nm, soit légèrement plus grande que pour le NaCl diatomique. Nous reviendrons sur ce point plus tard.
Liaisons covalentes
Dans une liaison ionique, un électron passe d'un atome à un autre. Cependant, dans une liaison covalente, un électron est partagé entre deux atomes. Le mécanisme de liaison ionique ne peut pas expliquer l'existence de molécules telles que\(H_2\)\(O_2\), et CO, car il n'existe aucune distance de séparation pour laquelle l'énergie potentielle négative d'attraction est supérieure à l'énergie nécessaire pour créer des ions. La compréhension précise de la manière dont ces molécules sont liées par covalence repose sur une compréhension plus approfondie de la mécanique quantique qui va au-delà de la couverture de ce livre, mais nous décrirons qualitativement les mécanismes dans la section suivante.
Les liaisons covalentes peuvent être comprises à l'aide de l'exemple simple d'une\(\ce{H_2^{+}}\) molécule, qui consiste en un électron dans le champ électrique de deux protons. Ce système peut être modélisé par un électron dans un puits double carré (Figure\(\PageIndex{2}\)). L'électron est également susceptible de se trouver dans chaque puits, de sorte que la fonction d'onde est symétrique ou antisymétrique autour d'un point situé à mi-chemin entre les puits.
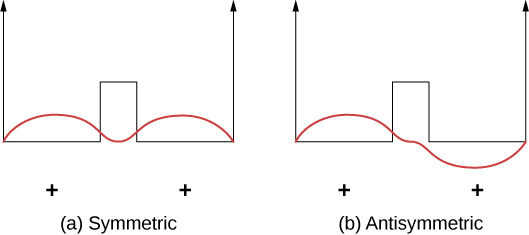
Imaginez maintenant que les deux puits soient séparés par une grande distance. À l'état fondamental, la fonction d'onde existe dans l'un des deux états possibles : soit un pic positif unique (une « bosse » semblable à une onde sinusoïdale) dans les deux puits (cas symétrique), soit un pic positif dans un puits et un pic négatif dans l'autre (cas antisymétrique). Ces états ont la même énergie. Cependant, lorsque les puits sont réunis, la fonction d'onde symétrique devient l'état fondamental et l'état antisymétrique devient le premier état excité, c'est-à-dire que le niveau d'énergie de l'électron est divisé. Remarquez que l'état de symétrie spatiale devient l'état énergétiquement favorable (énergie inférieure).
La même analyse est appropriée pour un électron lié à deux atomes d'hydrogène. Ici, les formes des fonctions d'ondes de l'état fondamental ont la\(e^{(-|x|/a_0)}\) forme\(e^{-r/a_0}\) ou une dimension. L'état de symétrie spatiale, favorable sur le plan énergétique, implique une densité de charge élevée à mi-chemin entre les protons, où les électrons sont susceptibles de rassembler les protons chargés positivement.
Si un deuxième électron est ajouté à ce système pour former une\(H_2\) molécule, la fonction d'onde doit décrire les deux particules, y compris leur relation spatiale et leurs spins relatifs. Cette fonction d'onde doit également respecter l'indiscernabilité des électrons. (« Si vous avez vu un électron, vous les avez tous vus. ») En particulier, la commutation ou l'échange d'électrons ne doit pas produire d'effet observable, une propriété appelée symétrie d'échange. La symétrie d'échange peut être symétrique, ne produisant aucun changement dans la fonction d'onde, ou antisymétrique, produisant une modification globale du signe de la fonction d'onde, aucun de ces changements n'étant observable.
Comme nous le verrons plus loin, la fonction d'onde totale de deux électrons doit être antisymétrique lors de l'échange. Par exemple, deux électrons liés à une molécule d'hydrogène peuvent être dans un état spatio-symétrique avec des spins antiparallèles (↑ ↓) ou dans un état antisymétrique spatial avec des spins parallèles (↑). L'état à spins antiparallèles est énergétiquement favorable et est donc utilisé dans la liaison covalente. Cependant, si les protons sont trop rapprochés les uns des autres, la répulsion entre les protons devient importante. (Dans d'autres molécules, cet effet est fourni par le principe d'exclusion.) En conséquence,\(H_2\) atteint une séparation d'équilibre d'environ 0,074 nm avec une énergie de liaison de 4,52 eV.
Consultez ce didacticiel et cette simulation interactive de PBS Learning Media pour explorer les forces d'attraction et de répulsion qui agissent sur les particules atomiques et les liaisons covalentes d'une\(H_2\) molécule.
La mécanique quantique exclut de nombreux types de molécules. Par exemple, la molécule\(H_3\) ne se forme pas, car si un troisième atome H s'approche de l'hydrogène diatomique, la fonction d'onde de l'électron de cet atome chevauche les électrons des deux autres atomes. Si les trois électrons se trouvent dans l'état fondamental de leurs atomes respectifs, une paire d'électrons partage les mêmes nombres quantiques, ce qui est interdit par le principe d'exclusion. Au lieu de cela, l'un des électrons est forcé à passer à un état d'énergie plus élevé. Il n'existe aucune séparation entre trois protons pour laquelle le changement d'énergie total de ce processus est négatif, c'est-à-dire lorsque la liaison se produit spontanément. De même,\(He_2\) il n'est pas lié par covalence dans des conditions normales, car ces atomes n'ont aucun électron de valence à partager. Au fur et à mesure que les atomes sont réunis, les fonctions d'onde des électrons du noyau se chevauchent et, en raison du principe d'exclusion, les électrons sont forcés à passer à un état énergétique plus élevé. Il n'existe aucune séparation pour laquelle une telle molécule est énergétiquement favorable.
Liaison dans les molécules polyatomiques
Une molécule polyatomique est une molécule composée de plus de deux atomes. Les exemples vont d'une simple molécule d'eau à une molécule de protéine complexe. Les structures de ces molécules peuvent souvent être comprises en termes de liaison covalente et d'hybridation. L'hybridation est une modification de la structure énergétique d'un atome dans laquelle des états mixtes (états qui peuvent être écrits comme une superposition linéaire d'autres états) participent à la liaison.
Pour illustrer l'hybridation, considérez la liaison dans une simple molécule d'eau,\(H_2O\). La configuration électronique de l'oxygène est\(1s^22s^22p^4\). Les électrons 1 s et 2 s se trouvent dans des « couches fermées » et ne participent pas à la liaison. Les quatre électrons restants sont des électrons de valence. Ces électrons peuvent remplir six états possibles (\(l = 1, m = 0, \pm 1\), plus une rotation ascendante et descendante). Les énergies de ces états étant les mêmes, l'atome d'oxygène peut exploiter n'importe quelle combinaison linéaire de ces états pour se lier aux atomes d'hydrogène. Ces combinaisons linéaires (que vous avez apprises dans le chapitre sur la structure atomique) sont appelées orbitales atomiques, et elles sont désignées par\(p_x\)\(p_y\), et\(p_z\). Les distributions de charge électronique pour ces orbitales sont données dans la figure\(\PageIndex{3}\).
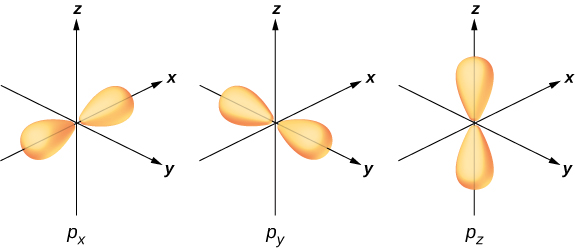
La transformation des fonctions des ondes électroniques de l'oxygène en\(p_x, p_y\) atomes d'hydrogène et\(p_z\) des orbitales en présence d'atomes d'hydrogène est un exemple d'hybridation. Deux électrons se trouvent dans l'\(p_z\)orbite avec des spins appariés (↑ ↓). Un électron se trouve dans chacune des\(p_y\) orbitales\(p_x\) et, avec des spins non appariés. Ces dernières orbitales participent à la liaison avec les atomes d'hydrogène. Sur la base de la figure\(\PageIndex{3}\), nous nous attendons à ce que l'angle de liaison pour H—O—H soit de 90°. Cependant, si l'on inclut les effets de la répulsion entre les atomes, l'angle de liaison est de 104,5°. Les mêmes arguments peuvent être utilisés pour comprendre la forme tétraédrique du méthane (\(CH_4\)) et d'autres molécules.


