8.5 : Le principe d'exclusion et le tableau périodique
- Page ID
- 189783
À la fin de cette section, vous serez en mesure de :
- Expliquer l'importance du principe d'exclusion de Pauli pour comprendre la structure atomique et les liaisons moléculaires
- Expliquer la structure du tableau périodique en termes d'énergie totale, de moment cinétique orbital et de spin des électrons individuels d'un atome
- Décrire la configuration électronique des atomes dans le tableau périodique
Jusqu'à présent, nous n'avons étudié que l'hydrogène, l'élément chimique le plus simple. Nous avons découvert qu'un électron de l'atome d'hydrogène peut être complètement spécifié par cinq nombres quantiques :
- \(n\):nombre quantique principal
- \(l\): nombre quantique de moment cinétique
- \(m\): nombre quantique de projection du moment cinétique
- \(s\): nombre quantique de spin
- \(m_s\): nombre quantique de projection de spin
Pour construire l'état fondamental d'un atome neutre à plusieurs électrons, imaginez de commencer par un noyau de charge Ze (c'est-à-dire un noyau de numéro atomique Z), puis d'ajouter des électrons Z un par un. Supposons que chaque électron se déplace dans un champ électrique sphérique symétrique produit par le noyau et tous les autres électrons de l'atome. L'hypothèse est valide car les électrons sont répartis de manière aléatoire autour du noyau et produisent un champ électrique moyen (et un potentiel) sphériquement symétrique. Le potentiel électrique U (r) de chaque électron ne suit pas la\(-1/r\) forme simple en raison des interactions entre les électrons, mais il s'avère que nous pouvons toujours étiqueter chaque état électronique individuel par des nombres quantiques, (\(n,l,m,s,m_s\)). (Le nombre quantique de spin\(s\) est le même pour tous les électrons, il ne sera donc pas utilisé dans cette section.)
La structure et les propriétés chimiques des atomes s'expliquent en partie par le principe d'exclusion de Pauli : deux électrons d'un atome ne peuvent pas avoir les mêmes valeurs pour les quatre nombres quantiques (\(n,l,m,m_s\)). Ce principe est lié à deux propriétés des électrons : tous les électrons sont identiques (« quand vous avez vu un électron, vous les avez tous vus ») et ils ont un spin semi-intégral (\(s = 1/2\)). Des ensembles d'échantillons de nombres quantiques pour les électrons d'un atome sont donnés dans le tableau\(\PageIndex{1}\). Conformément au principe d'exclusion de Pauli, aucune ligne du tableau ne contient exactement le même ensemble de nombres quantiques.
| \(n\) | \(l\) | \(m\) | \(m_s\) | Symbole sous-shell | Nombre d'électrons : sous-couche | Nombre d'électrons : coque |
|---|---|---|---|---|---|---|
| \ (n \) » style="vertical-align:middle ; « >1 | \ (l \) » style="vertical-align:middle ; « >0 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >½ | 1 s | 2 | 2 |
| \ (n \) » style="vertical-align:middle ; « >1 | \ (l \) » style="vertical-align:middle ; « >0 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >2 | \ (l \) » style="vertical-align:middle ; « >0 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >½ | 2 s | 2 | 8 |
| \ (n \) » style="vertical-align:middle ; « >2 | \ (l \) » style="vertical-align:middle ; « >0 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >2 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >—1 | \ (m_s \) » style="vertical-align:middle ; « >½ | 2 p. | 6 | |
| \ (n \) » style="vertical-align:middle ; « >2 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >—1 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >2 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >½ | |||
| \ (n \) » style="vertical-align:middle ; « >2 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >2 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >1 | \ (m_s \) » style="vertical-align:middle ; « >½ | |||
| \ (n \) » style="vertical-align:middle ; « >2 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >1 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >0 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >½ | 3 s | 2 | 18 |
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >0 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >—1 | \ (m_s \) » style="vertical-align:middle ; « >½ | 3 p. | 6 | |
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >—1 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >1 | \ (m_s \) » style="vertical-align:middle ; « >½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >1 | \ (m \) » style="vertical-align:middle ; « >1 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >—2 | \ (m_s \) » style="vertical-align:middle ; « >½ | 3 d | 10 | |
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >—2 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >—1 | \ (m_s \) » style="vertical-align:middle ; « >½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >—1 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >0 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >1 | \ (m_s \) » style="vertical-align:middle ; « >½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >1 | \ (m_s \) » style="vertical-align:middle ; « >—½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >2 | \ (m_s \) » style="vertical-align:middle ; « >½ | |||
| \ (n \) » style="vertical-align:middle ; « >3 | \ (l \) » style="vertical-align:middle ; « >2 | \ (m \) » style="vertical-align:middle ; « >2 | \ (m_s \) » style="vertical-align:middle ; « >—½ |
On dit que les électrons ayant le même nombre quantique principal n se trouvent dans la même couche, et ceux qui ont la même valeur de l occupent la même sous-couche. Un électron à l'\(n = 1\)état d'atome d'hydrogène est noté 1 s, où le premier chiffre indique la coque (\(n = 1\)) et la lettre indique la sous-couche (\(s,p,d,f,...\)correspond à\(l = 0,1,2,3,...\)). Deux électrons dans\(n = 1\) cet état sont désignés par\(1s^2\), où l'exposant indique le nombre d'électrons. Un électron à l'\(n = 2\)état avec\(l = 1\) est noté 2 p. La combinaison de deux électrons à l'\(l = 0\)état\(n = 2\) et et de trois électrons à l'\(l = 1\)état\(n = 2\) et s'écrit\(2s^22p^3\), et ainsi de suite. Cette représentation de l'état électronique est appelée configuration électronique de l'atome. Les configurations électroniques de plusieurs atomes sont données dans le tableau\(\PageIndex{2}\). Les électrons de la couche externe d'un atome sont appelés électrons de valence. Les liaisons chimiques entre les atomes d'une molécule s'expliquent par le transfert et le partage d'électrons de valence.
| Elément | Configuration électronique | Alignement rotatif |
|---|---|---|
| H | \(1s^1\) | (↑) |
| Il | \(1s^2\) | (↑ ↓) |
| Li | \(1s^22s^1\) | (↑) |
| Être | \(1s^22s^2\) | (↑ ↓) |
| B | \(1s^22s^22p^1\) | (↑ ↓) (↑) |
| C | \(1s^22s^22p^2\) | (↑ ↓) (↑) (↑) |
| N | \(1s^22s^22p^3\) | (↑ ↓) (↑) (↑) (↑) |
| O | \(1s^22s^22p^4\) | (↑ ↓) (↑) (↑) (↑) |
| F | \(1s^22s^22p^5\) | (↑ ↓) (↑ ↓) (↑) (↑) |
| Nouveau | \(1s^22s^22p^6\) | (↑ ↓) (↑ ↓) (↑ ↓) (↑ ↓) |
| Na | \(1s^22s^22p^63s^1\) | (↑) |
| Mg | \(1s^22s^22p^63s^2\) | (↑ ↓) |
| Al | \(1s^22s^22p^63s^13p^1\) | (↑ ↓) (↑) |
Le nombre maximum d'électrons dans une sous-couche dépend de la valeur du nombre quantique du moment cinétique, l. Pour une valeur l donnée, il existe des états de moment cinétique\(2l + 1\) orbitaux. Cependant, chacun de ces états peut être rempli par deux électrons (spin up et down, ↑ ↓). Ainsi, le nombre maximum d'électrons dans une sous-couche est
\[N = 2(2l + 1) = 4l + 2. \nonumber \]
Dans la sous-couche 2 s (\(l = 0\)), le nombre maximum d'électrons est de 2. Dans la sous-couche 2 p (\(l = 1\)), le nombre maximum d'électrons est de 6. Par conséquent, le nombre maximum total d'électrons dans la\(n = 2\) coque (y compris les sous-couches\(l = 0\) et 1) est\(2 + 6\) de 8. En général, le nombre maximum d'électrons dans la n ème couche est de\(2n^2\).
Combien de sous-coques se trouvent dans la\(n = 3\) coque ? Identifiez chaque sous-couche et calculez le nombre maximum d'électrons qui la rempliront. Montrez que le nombre maximum d'électrons qui remplissent un atome est de\(2n^2\).
Stratégie
Les sous-couches sont déterminées par la valeur de l ; ainsi, nous déterminons d'abord quelles valeurs de l sont autorisées, puis nous appliquons l'équation « nombre maximum d'électrons pouvant se trouver dans a\(subshell = 2(2l + 1\)) » pour trouver le nombre d'électrons dans chaque sous-couche.
Solution
Parce\(n = 3\) que nous savons que l peut être égal à 0, 1 ou 2 ; il y a donc trois sous-couches possibles. En notation standard, ils sont étiquetés comme les sous-couches 3 s, 3 p et 3 d. Nous avons déjà vu que deux électrons peuvent être dans un état s et six dans un état p, mais utilisons l'équation « nombre maximum d'électrons qui peuvent être dans un
subshell\(= 2(2l + 1)\) » pour calculer le nombre maximum dans chaque :
\(3s\)a\(l = 0\) ; ainsi,\(2(2l + 1) = 2(0 + 1) = 2\)
\(3p\)a\(l = 1\) ; ainsi,\(2(2l + 1) = 2(2 + 1) = 6\)
\(3d\)a\(l = 2\) ; ainsi,\(2(2l + 1) = 2(4 + 1) = 10\)
\(Total = 18\)
(dans la\(n = 3\) coque).
L'équation « nombre maximum d'électrons pouvant se trouver dans une couche =\(2n^2\) » donne que le nombre maximum d'électrons dans\(n = 3\) la couche est
Nombre maximum d'électrons\(= 2n^2 = 2(3)^2 = 2(9) = 18\).
L'importance
Le nombre total d'électrons dans les trois sous-couches possibles est donc le même que celui de la formule\(2n^2\). En notation standard (spectroscopique), une\(n = 3\) coque pleine est désignée par\(3s^23p^63d^{10}\). Les coquilles ne se remplissent pas d'une manière simple. Avant que la\(n = 3\) coque ne soit complètement remplie, par exemple, nous commençons à trouver des électrons dans la\(n = 4\) coque.
La structure du tableau périodique (Figure\(\PageIndex{1}\)) peut être comprise en termes de couches et de sous-couches et, en fin de compte, en termes d'énergie totale, de moment cinétique orbital et de spin des électrons de l'atome. Une discussion détaillée du tableau périodique est confiée à un cours de chimie ; nous n'en esquissons ici que les caractéristiques de base. Dans cette discussion, nous supposons que les atomes sont électriquement neutres, c'est-à-dire qu'ils ont le même nombre d'électrons et de protons. (Rappelons que le nombre total de protons dans un noyau atomique est appelé numéro atomique, Z.)
Tout d'abord, le tableau périodique est organisé en colonnes et en rangées. Le tableau se lit de gauche à droite et de haut en bas dans l'ordre croissant du numéro atomique\(Z\). Les atomes qui appartiennent à la même colonne ou au même groupe chimique partagent bon nombre des mêmes propriétés chimiques. Par exemple, les atomes de Li et de Na (dans la première colonne) se lient aux autres atomes de la même manière. La première ligne du tableau correspond à la couche 1 s (\(l = 0\)) d'un atome.
Considérez la procédure hypothétique qui consiste à ajouter des électrons, un par un, à un atome. Pour l'hydrogène (H) (en haut à gauche), la couche de 1 s est remplie d'un électron de spin ascendant ou descendant (↑ ou ↓). Cet électron isolé est facilement partagé avec d'autres atomes, de sorte que l'hydrogène est chimiquement actif. Pour l'hélium (He) (en haut à droite), la coque de 1 s est remplie à la fois d'un électron de spin ascendant et d'un électron de spin descendant (↑ ↓). Cela « remplit » la couche 1 s, de sorte qu'un atome d'hélium a tendance à ne pas partager d'électrons avec d'autres atomes. L'atome d'hélium est dit chimiquement inactif, inerte ou noble ; de même, l'hélium gazeux est dit être un gaz inerte ou un gaz noble.
Construisez un atome en ajoutant et en soustrayant des protons, des neutrons et des électrons. Comment évoluent l'élément, la charge et la masse ? Consultez PhET Explorations : Build an Atom pour découvrir les réponses à ces questions.
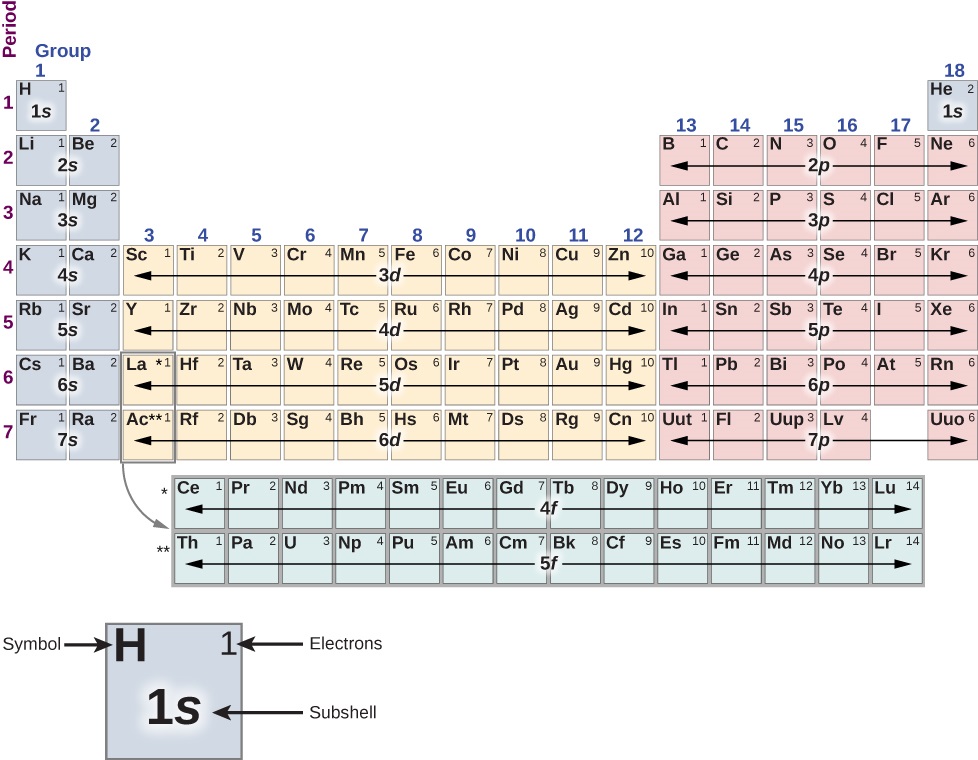
La deuxième ligne correspond aux sous-couches 2 s et 2 p. Pour le lithium (Li) (en haut à gauche), la coque de 1 s est remplie d'un électron de spin up et de spin down (↑ ↓) et la coque 2 s est remplie d'un électron de spin up ou de spin down (↑ ou↓). Sa configuration électronique est donc de\(1s^22s^1\) ou [He] 2 s, où [He] indique un noyau d'hélium. Comme l'hydrogène, le seul électron de la couche la plus externe est facilement partagé avec d'autres atomes. Pour le béryllium (Be), l'enveloppe en 2 s est remplie d'un électron de rotation ascendante et descendante (↑ ↓) et a la configuration électronique [He]\(2s^2\).
Ensuite, nous regardons le côté droit de la table. Pour le bore (B), les couches 1 s et 2 s sont remplies et la couche 2 p (\(l = 1\)) contient un électron de spin ascendant ou descendant (↑ ou↓). Du carbone (C) au néon (N), on remplit ensuite la coque de 2 p. Le nombre maximum d'électrons dans les couches 2 p est de\(4l + 2 = 4(2) + 2 = 6\). Pour le néon (Ne), la couche de 1 s est remplie d'un électron de spin up et de spin-down (↑ ↓), et la coque 2 p est remplie de six électrons (↑ ↓ ↓). Cela « remplit » les sous-couches 1 s, 2 s et 2 p, donc comme l'hélium, l'atome de néon a tendance à ne pas partager d'électrons avec les autres atomes.
Le processus de remplissage d'électrons se répète dans la troisième rangée. Cependant, à partir de la quatrième rangée, le schéma est rompu. L'ordre réel de remplissage des électrons est donné par
1 s, 2 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p, 6 s, 4 f, 5 d, 6 p, 7 s,...
Notez que les sous-couches 3 d, 4 d, 4 f et 5 d (en gras) sont remplies dans le désordre ; cela se produit en raison des interactions entre les électrons de l'atome, que nous avons négligées jusqu'à présent. Les métaux de transition sont des éléments situés dans l'espace entre les deux premières colonnes et les six dernières colonnes qui contiennent des électrons qui remplissent la sous-couche d (\(l = 1\)). Comme prévu, ces atomes sont disposés en\(4l + 2 = 4(2) + 2 = 10\) colonnes. La structure du tableau périodique peut être comprise en termes de quantification de l'énergie totale (n), du moment cinétique orbital (l) et du spin (s). Les deux premières colonnes correspondent à la sous-coque s (\(l = 0\)), les six colonnes suivantes correspondent à la sous-coque p (\(l = 1\)) et l'espace entre ces colonnes correspond à la sous-coque d (\(l = 2\)).
Le tableau périodique fournit également des informations sur les liaisons moléculaires. Pour ce faire, considérez les atomes dans la colonne la plus à gauche (les métaux dits alcalins, notamment Li, Na et K). Ces atomes contiennent un seul électron dans la sous-couche 2 s, qui est facilement transmis à d'autres atomes. En revanche, les atomes de la colonne située de l'avant vers la droite (les halogènes, par exemple, Cl, F et Br) sont relativement peu enclins à partager les électrons. Ces atomes préféreraient de loin accepter un électron, car ils ne sont qu'à un électron d'une couche pleine (« d'être nobles »).
Par conséquent, si un atome de Na est placé à proximité d'un atome de Cl, l'atome de Na donne librement son électron 2 s et l'atome de Cl l'accepte avec empressement. Au cours du processus, l'atome de Na (initialement une charge neutre) se charge positivement et le Cl (initialement une charge neutre) se charge négativement. Les atomes chargés sont appelés ions. Dans ce cas, les ions sont\(Na^+\) et\(Cl^-\), où l'exposant indique la charge de l'ion. L'attraction électrique (Coulomb) entre ces atomes forme une molécule de NaCl (sel). Une liaison chimique entre deux ions est appelée liaison ionique. Il existe de nombreux types de liaisons chimiques. Par exemple, dans une molécule d'oxygène, les\(O_2\) électrons sont répartis de manière égale entre les atomes. La liaison d'atomes d'oxygène est un exemple de liaison covalente.


